Alonso Herreros JM1, Escudero Galindo DM2, Bernal Montañes JM3
1 Especialista en Farmacia Hospitalaria. Especialista en Farmacia Industrial y Galénica.
Hospital General Universitario Los Arcos. Mar Menor. Murcia (España)
2 Licenciada en Farmacia. Universidad Miguel Hernández. Elche. Alicante (España)
3 Especialista en Farmacia Hospitalaria. Hospital Reina Sofía de Murcia (España)
Este trabajo ha sido presentado parcialmente en el 18th Congreso of European Association of Hospital Pharmacy. March 2013, París
____
Rev. OFIL 2016, 26;2:123-126
Fecha de recepción: 01/06/2015 – Fecha de aceptación: 14/03/2016
____
Resumen
Introducción: La dronedarona se comercializó en 2010, apareciendo rápidamente varias alertas de seguridad que obligaron a las autoridades sanitarias a reducir su uso, (Alerta-SGMUH (FV) 16/2011).
Objetivo: Evaluar el grado de cumplimiento por parte de los prescriptores de los controles requeridos por la autoridad sanitaria en los pacientes que tomaban dronedarona (pruebas hepáticas y renales) en un área sanitaria de 210.000 habitantes.
Materiales y métodos: Estudio retrospectivo, descriptivo y observacional. Se seleccionaron los pacientes a quienes se prescribió dronedarona durante el último semestre de 2011. Fueron clasificados en tres grupos: los que comenzaron el tratamiento después de la publicación de la alerta (GRUPO-A), los que iniciaron el tratamiento antes de la alerta (GRUPO-B), y finalmente los pacientes que lo interrumpieron durante ese semestre (GRUPO-C). En todos los grupos se comprobó que los controles se hicieron de la forma y tiempos indicados por la alerta.
Resultados: Se examinaron 72 historias clínicas. Grupo-A de 17 pacientes, sólo 1 tenía pruebas de función hepática y renal como era requerido por la alerta. En el grupo B (48), 15 no tenía ninguno de los controles requeridos. En el Grupo C con 5 pacientes (dos muertes), 3 no tenían ningún control.
Conclusiones: El grado de cumplimiento de las pruebas renales y hepáticas requeridas por la autoridad sanitaria en pacientes que tomaban dronedarona fue muy baja. Parece necesario revisar el sistema de alertas y control de medicamentos prescritos en atención primaria.
Palabras clave: Dronedarona, seguridad de medicamentos, atención farmacéutica.
Monitoring kidney and liver function in patients treated with dronedarone
____
Correspondencia:
José Mª Alonso Herreros
Hospital General Universitario Los Arcos – Mar Menor
Paraje Torre Octavio, 54
30739 San Javier (Murcia)
Correo electrónico: josem.alonso@carm.es
____
Introducción
La dronedarona es un principio activo que se comercializó con indicación de fibrilación auricular paroxística1,2. A los pocos meses de su comercialización, a raíz de los resultados del ensayo clínico PALLAS3-7 la Agencia Española del Medicamento y Productos Sanitarios (AEMPS) publicó una alerta sobre este fármaco, donde se introdujeron restricciones de uso, contraindicaciones y recomendaciones de monitorización de las funciones hepática, renal, cardiovascular y pulmonar, tanto al inicio como en la continuación del tratamiento8. Con posterioridad, se clasificó como Medicación de Diagnóstico Hospitalario (DH), por lo que –según la normativa española– tenía que ser prescrito por un especialista hospitalario, y pasar por una inspección previa para su dispensación en oficinas de farmacia.
En este estudio se plantea analizar el cumplimiento de las indicaciones de la Alerta de Seguridad de la AEMPS, y los controles específicos que se indican en la ficha técnica de la dronedarona tras su comercialización y la publicación de la primera alerta, así como proponer sistemas de monitorización de medicamentos en atención primaria en situaciones similares.
Estos objetivos se llevaron a cabo:
- Analizando si se cumplen con la monitorización de la función renal y hepática en los pacientes que iniciaron su tratamiento con dronedarona después de que la AEMPS publicara la alerta.
- Comprobando si los controles que exigía la AEMPS para pacientes con continuación de tratamiento, se estaban llevando a cabo.
- En los pacientes a los que se les suspendía el tratamiento, en el periodo descrito, verificando si esta interrupción estaba relacionada con alguna reacción adversa o contraindicación de las que se detallan en la alerta.
- Proponiendo mecanismos de mejora en la aplicación de los controles específicos que aparecen en la ficha técnica de la medicación destinada mayoritariamente a pacientes de atención primaria.
MATERIAL Y MÉTODOS
Se realizó un estudio retrospectivo, observacional y descriptivo. Para extraer la muestra a analizar de la población de estudio se incluyó a todo paciente que tenía al menos una receta retirada de dronedarona en el periodo julio-diciembre 2011 de un Área de Salud de la Región de Murcia (España) con 210.000 habitantes. Se usó el programa ADN –MicroStrategy Analytic Enterprise, 2011– de explotación de datos de recetas médicas facturadas para obtener los pacientes.
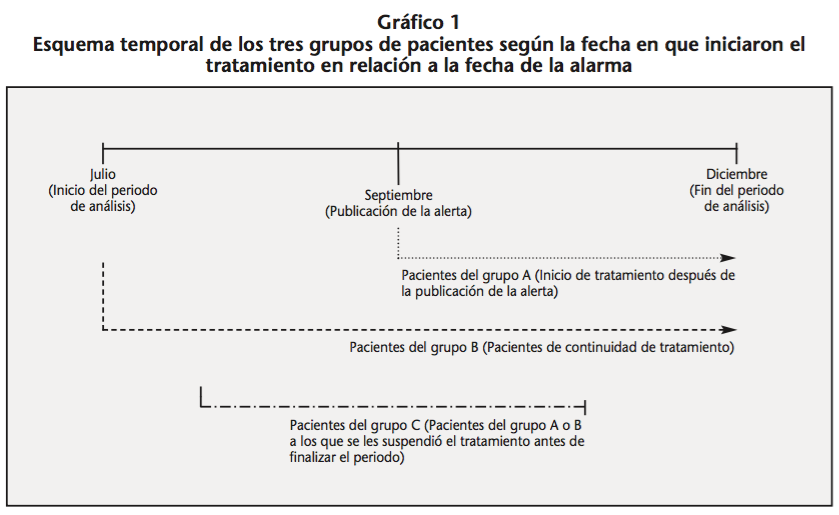
Una vez obtenida la población a monitorizar, se dividió en tres grupos (Gráfico 1):
- Grupo A, pacientes que habían iniciado el tratamiento con dronedarona tras la publicación de la alerta. Por tanto a estos pacientes se les debería haber realizado una monitorización hepática antes de iniciar el tratamiento, tras una semana, mensualmente durante 6 meses, en los meses 9 y 12, y posteriormente de forma periódica. A su vez, se les tendría que haber monitorizado la función renal, mediante analítica antes de iniciar el tratamiento y una semana después de iniciar el mismo.
- El grupo B, fueron todos aquellos pacientes que estaban en tratamiento antes de la publicación de la alerta. En estos pacientes la alerta indicaba que era necesario valorar si cumplían los criterios de uso del medicamento, incluyendo lógicamente los controles analíticos de función renal y hepática.
- El grupo C, fueron los pacientes que abandonaron el tratamiento antes de finalizar el periodo de estudio. Se comprobó si se les había realizado alguna de las analíticas anteriores, se investigó la causa de abandono del tratamiento con dronedarona, y si éste se había sustituido por amiodarona u otro tratamiento antiarrítmico. También se comprobó si el abandono del tratamiento se debía a alguna reacción adversa (RAM) al medicamento en cuestión.
Una vez distribuidos los pacientes en los citados grupos, se procedió a la comprobación de las analíticas realizadas. Para ello se usó el programa Selene© versión 5.3.1 de gestión de historias clínicas (SIEMENS).
Para el análisis de la función hepática se revisó que en la analítica aparecieran control de las enzimas hepáticas transaminasas (GOT, GTP, fosfatasa alcalina, γ-glutamiltransferasa y lactactato deshidrogenasa). De forma parecida, se revisó la concentración de creatinina plasmática para monitorizar la función renal.
A los pacientes del grupo C, además de comprobar que poseían la monitorización adecuada, se revisó la historia clínica (HC), mediante el programa corporativo de desarrollo propio del Servicio Murciano de Salud Ágora Plus© de gestión de historias clínicas integradas atención primaria-especializada.
RESULTADOS
Se analizaron los controles analíticos de 72 pacientes, estos fueron distribuidos en los tres grupos (Gráfico 2):
- Grupo A, 17 pacientes.
- Grupo B, 48 pacientes.
- Grupo C, 5 pacientes.
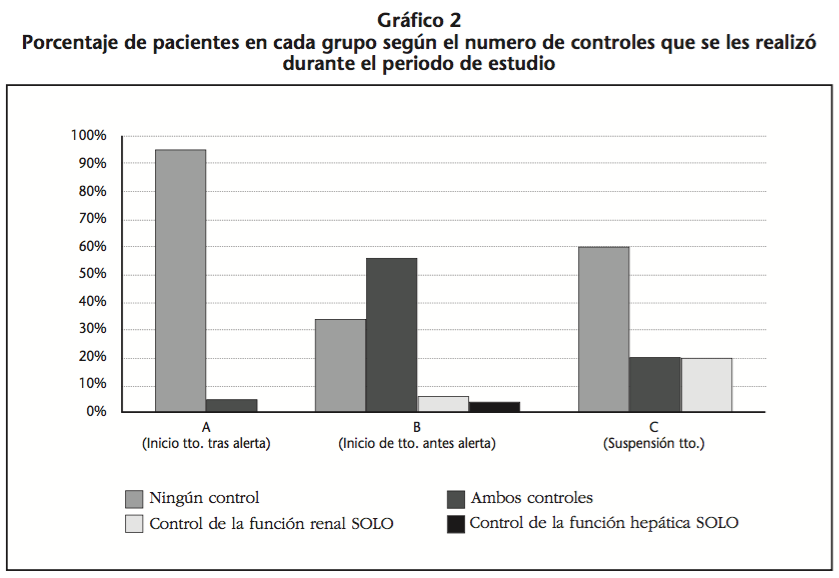
De los 17 pacientes del grupo A, tan solo se le realizó los controles analíticos exigidos por la AEMPS a uno de ellos (5,8% de los pacientes de este grupo).
El grupo B estaba formado por 48 pacientes. A 16 de ellos (33,3%) no se le realizó ningún control analítico; a 3 (6,25%) sólo se le realizó la monitorización de la función renal y a 2 (4,2%) sólo se le monitorizó la función hepática.
Por último el grupo C estaba compuesto por 5 pacientes (dos exitus). A 3 de ellos (el 60%) no se le realizó ningún control analítico de los descritos; sólo a uno (el 20%) se le monitorizó la función renal, y sólo al otro (el 20% restante de pacientes) se les realizó ambos controles, hepáticos y renales.
De los dos exitus, uno falleció por cáncer de pulmón. No se le hizo ni control hepático ni control renal. Estuvo en tratamiento con dronedarona durante seis meses. En el mes de julio y tras un ingreso hospitalario por insuficiencia respiratoria, se le cambio el fármaco por amiodarona.
El segundo exitus estuvo tres meses en tratamiento con dronedarona, se le realizó los controles analíticos de la función renal, pero no así de la hepática. Según la alerta, su uso estaba claramente contraindicado pues el paciente sufría enfermedad pulmonar intersticial asociado amiodarona. El fallecimiento fue por insuficiencia cardiaca y pulmonar, no se pudo comprobar su relación con el fármaco.
Al paciente número tres, sí se le realizó la monitorización de la función renal y hepática. Estuvo diez meses en tratamiento con dronedarona hasta que fue suspendida por aumento de la creatinina plasmática. Se le cambió el tratamiento a amiodarona, normalizándose la creatinina a la semana del cambio.
El cuarto y quinto paciente del Grupo C no poseían ningún control analítico de los necesarios. Tras la revisión de ambas historias clínicas no se pudo encontrar ningún indicio de porqué se suspendió la medicación ni de si ésta fue sustituida por otra.
DISCUSIÓN
Los resultados de este estudio indican que el grado de cumplimiento de controles analíticos exigidos por la AEMPS, en pacientes en tratamiento con dronedarona es muy bajo, tanto si lo consideramos como una exigencia de las autoridades sanitarias, como un indicador de calidad asistencial, en los que debería estar próximo al 100%9,10. También son bajos si los comparamos con los resultados obtenidos por otros autores en otros ámbitos11, que encuentran entre el 72% y 76% de pacientes con controles analíticos renales y hepáticos entre el total de la población tratada con dronedarona.
Como limitación del estudio hemos de tener en cuenta el carácter local y retrospectivo del mismo. La duración del mismo –tres meses antes y después de la fecha de la alerta– es menor que la empleada por los autores citados anteriormente11 lo que podría influir en la obtención de unos porcentajes menores. Sin embargo, dado el carácter de la alerta y de los pacientes que debieran estar tratados con dronedarona, tres meses deberían haber sido suficientes para la revisión de un porcentaje importante de tratamientos, y de cumplir con exactitud los requisitos para el inicio del tratamiento, por lo que este aspecto no puede invalidar los resultados globales del estudio.
Se podría pensar que la causa de unos resultados tan pobres fue una incorrecta difusión de la alerta, y plantear una revisión y mejora del circuito de comunicación a los facultativos. Sin embargo, durante el periodo estudiado ya se incorporaban las alertas de la AEMPS al sistema de prescripción electrónica de primaria. Por tanto, todo parece indicar la ausencia de un seguimiento farmacoterapéutico efectivo en los pacientes atendidos en este ámbito, tanto por los propios facultativos prescriptores, como por los farmacéuticos dispensadores o los farmacéuticos de la administración responsables de atención primaria.
No existe motivo para pensar que otros controles recogidos en ficha técnica de otros fármacos sean realizados con más eficacia que en el caso de la dronedarona. Si además, tenemos en cuenta que, al ser éste, un fármaco de reciente comercialización (fase IV de los ensayos clínicos), los controles deberían de haberse realizado con mayor exigencia que con uno más conocido, los resultados globales podrían ser alarmantes.
Si este fármaco no hubiese pasado a ser clasificado como DH, desde el servicio de Farmacia Hospitalaria responsable del área, se hubiese procedido a informar a los facultativos responsables de los pacientes en tratamiento con dronedarona de la situación en la que se encontraban, y de los controles que se tenían que realizar sobre ellos. Al pasar a DH estas funciones las asumió la inspección médica responsable de autorizar las recetas previamente a la dispensación. Sin embargo, los resultados muestran la posibilidad que no se esté realizando en atención primaria, con la frecuencia necesaria, los diversos controles analíticos exigidos en las fichas técnicas de diversos medicamentos. Una solución óptima pasaría por incorporar un sistema de alertas en los programas de prescripción de primaria que verificase la realización de estos controles en el espacio temporal adecuado, así como que los valores obtenidos estén en los intervalos prefijados. Mientras este tipo de avances se desarrollan e implantan, deberían ser los farmacéuticos responsables de la atención farmacéutica en primaria los que identificasen los medicamentos que precisan controles específicos más usados en sus respectivas áreas, identificar a los pacientes, y monitorizar la realización de los controles necesarios.
CONCLUSIONES
El grado de realización de controles analíticos exigidos por la AEMPS, en pacientes en tratamiento con dronedarona es especialmente bajo.
No existe motivo para pensar que este problema sea algo particular de este medicamento, por lo que el seguimiento de las analíticas y demás controles específicos exigidos en las fichas técnicas de los medicamentos, debería ser objetivo a estudiar en cualquier plan de atención farmacéutica sobre pacientes de atención primaria.
Conflicto de intereses: Los autores declaran no tener conflictos de intereses.
Bibliografía
- Clem JR, Farver DK, Fischer JR, Johnson TJ. Dronedarone: a safety comparison to amiodarone. Curr Drug Saf. 2010 Jul 2;5(3):251-6.
- Kozlowski D, Budrejko S, Lip GY, Mikhailidis DP, Rysz J, Raczak G, Banach M. Dronedarone: an overview. Ann Med. 2012 Feb;44(1):60-72.
- Connolly SJ, Camm AJ, Halperin JL, Joyner C, Alings M, et al. PALLAS Investigators. Dronedarone in high-risk permanent atrial fibrillation. N Engl J Med. 2011 Dec 15;365(24):2268-76.
- Overbeck P. Atrial fibrillation. PALLAS study: when dronedarone becomes a risk. MMW Fortschr Med. 2011 Dec 1;153(48):18.
- Naccarelli GV, Wolbrette DL, Levin V, Samii S, Banchs JE, Penny-Peterson E, Gonzalez MD. Safety and efficacy of dronedarone in the treatment of atrial fibrillation/flutter. Clin Med Insights Cardiol. 2011;5:103-19.
- Shantsila A, Lip GY. Highlights of the American Heart Association Scientific Sessions 2011: a focus on ATLAS-TIMI 51, TRACER and PALLAS. Expert Rev Cardiovasc Ther. 2012 Mar;10(3):305-7.
- Doggrell SA, Hancox JC. PALLAS: limiting indications for dronedarone treatment of atrial fibrillation? Expert Opin Pharmacother. 2012 Apr;13(6):867-71.
- Agencia Española del Medicamento y Productos Sanitarios (AEMPS). Dronedarona (Multaq®): Conclusiones de la revaluación de su relación beneficio-riesgo. Nota Informativa referencia (SGMUH (FV), 16/2011). Disponible en (30 de enero 2015) http://www.aemps. gob.es/informa/notasInformativas/medicamentosUsoHumano/seguridad/2011/NI-MUH_16-2011.htm.
- Friberg L. Safety of dronedarone in routine clinical care. J Am Coll Cardiol. 2014;63(22):2376-2384.
- Goette A, Benninger G, Pittrow D, Paar WD, von Stritzky B, Bosch RF. One-year safety and quality of life outcomes in patients with atrial fibrillation on dronedarone: prospective, non-interventional study in German ambulatory care.Herzschrittmacherther Elektrophysiol. 2015 Jun;26(2):148-54.
- Arif SA, Drury R, Ader P. Impact of Food and Drug Administration hepatotoxicity warning on prescribing and monitoring of dronedarone in a tertiary teaching hospital. Int J Pharm Pract. 2015 Dec;23(6):456-60.
____
Descargar PDF: Monitorización de la funcion renal y hepática en pacientes tratados con dronedarona
Perteneciente al: VOL. 26 – Nº2 – 2016
