Sangrador Pelluz C1, Maiques Llácer FJ1, Soler Company E1, Taberner Bonastre P1, Flores Cid J2.
Servicio de Farmacia1. Unidad de Enfermedades Infecciosas2. Hospital Arnau de Vilanova
Resumen
Objetivo: Comparar la seguridad de peginterferon, ribavirina y telaprevir frente a la biterapia con boceprevir en la práctica clínica.
Material y método: Estudio observacional retrospectivo (01-01-2012 a 30-06-2014) de pacientes con hepatitis C genotipo-1 que hubieran finalizado el tratamiento con telaprevir o boceprevir. La toxicidad se clasificó según criterios de la División del SIDA v.1.0.
Resultados: Mayor neutropenia para boceprevir (77,2% vs 45,8% p<0,001) y mayor hiperbilirrubinemia (35,5% vs 8,8% p<0,001) e hiperuricemia (48,6% vs 8,8% p<0,001) para telaprevir. Toxicidad por grados: mayor neutropenia G1-G2 (47,4% vs 30,8% p=0,028) para boceprevir. Con telaprevir mayor hiperurcemia G1-G2 (43,9% vs 8,8% p<0,001) y mayor hiperbilirrubinemia tanto G1-G2 (22,4% vs 8,8% p=0,021) como G3-G4 (13,1% vs 0% p=0,002). Con boceprevir mayor ajuste de dosis de ribavirina (73,7% vs 46,7% p=0,001) e ingresos hospitalarios (21,1% vs 8,4% p=0,021).
Conclusiones: Mayor ajuste de dosis de ribavirina, ingresos hospitalarios, neutropenia y disgeusia con boceprevir, mientras que la toxicodermia, hiperuricemia y prurito anal resultó superior con telaprevir.
Palabras clave: telaprevir, boceprevir, hepatitis C crónica, seguridad, reacciones adversas
Comparative analysis of the safety in clinical practice of Boceprevir and Telaprevir in the treatment of Hepatitis c
Abstract
Objective: To compare the safety of peginterferon, ribavirin and telaprevir against boceprevir combination therapy in clinical practice.
Methods: Retrospective observational study (01-01-2012 to 01-06-2014) of patients with HCV genotype-1 who had completed the combined treatment with telaprevir or boceprevir. Toxicity was graded according to criteria of the Division of SIDA v.1.0.
Results: Increased neutropenia for boceprevir (77.2% vs 45.8% p <0.001) and greater hyperbilirubinemia (35.5% vs 8.8% p <0.001) and hyperuricemia (48.6% vs 8.8% p <0.001) for telaprevir. Toxicity grades: G1-G2 greater neutropenia (47.4% vs 30.8% p = 0.028) for boceprevir. With more hiperurcemia telaprevir G1-G2 (43.9% vs 8.8% p <0.001) and greater hyperbilirubinemia both G1-G2 (22.4% vs 8.8% p = 0.021) and G3-G4 (13.1 % vs 0%, p = 0.002). Further adjustment of ribavirin dose with boceprevir (73.7% vs 46.7% p = 0.001) and hospital admissions (21.1% vs 8.4% p = 0.021).
Conclusions: Higher dose adjustment of ribavirin, hospitalization, neutropenia and dysgeusia with boceprevir, while toxicodermia, hyperuricemia and anal pruritus was higher with telaprevir.
Keywords: telaprevir, boceprevir, hepatitis C chronic, safety, adverse drug events
____
Dentro del Número: VOL. 25 – Nº1 – 2015
Descargar PDF: Análisis comparativo de la seguridad en la práctica clínica de Boceprevir y Telaprevir en el tratamiento de la Hepatitis c
____
Introducción
La infección por el virus de la hepatitis C (VHC) es un problema de salud mundial, y actualmente es la primera causa de hepatopatía crónica y de trasplante hepático en los países occidentales1. La prevalencia de esta infección en Europa varía entre un 1,5% y un 3%, afectando a más de 180 millones de personas en el mundo1,2.
Los antivirales de acción directa telaprevir y boceprevir han revolucionado el tratamiento de la hepatitis C crónica, dado que permiten obtener respuestas virales sostenidas en el 75% de los pacientes no tratados previamente (naive) y cercana al 50% en pacientes sin respuesta a tratamientos previos3-6. La incorporación de estos fármacos consigue incrementar la eficacia y acortar la duración del tratamiento, pero también aumentan notablemente los efectos adversos del mismo como señalan los ensayos clínicos3-6 y estudios observacionales de práctica clínica7-12.
En la actualidad ya se encuentran disponibles nuevos fármacos cuyos estudios señalan tasas de eficacia más elevadas. No obstante, es en el momento actual cuando empezamos a disponer de datos en práctica clínica referentes a la efectividad y seguridad del tratamiento completo con telaprevir y boceprevir. La realización de una comparación directa de la seguridad entre ambos fármacos nos permitirá un mejor conocimiento del perfil de toxicidad de los mismos.
El objetivo del estudio es comparar la seguridad del tratamiento combinado de peginterferon, ribavirina y telaprevir frente a la biterapia en combinación con boceprevir en el tratamiento de la hepatitis C crónica en la práctica clínica.
Material y método
Estudio observacional retrospectivo de 2 años y medio de duración (Enero 2012- Junio 2014) realizado en nuestro Departamento de Salud.
Se incluyeron todos los pacientes adultos infectados por VHC genotipo 1, tanto monoinfectados como coinfectados por VIH, que hubieran finalizado el tratamiento con telaprevir o boceprevir en combinación con peginterferon y ribavirina durante el periodo de estudio.
A partir de los programas informáticos empleados en el Servicio de Farmacia para la atención a pacientes externos, Farmasyst® y Orion Clinic®, se recogieron las siguientes variables: edad, sexo, genotipo, grado de fibrosis, tipo de paciente (naive o pretratados), coinfección con VIH, fármacos, reacciones adversas (RAM) recogidas en la historia clínica, necesidad de transfusión, de eritropoyetina exógena, o de factores estimuladores de colonias de granulocitos (G-CSF), reducciones de dosis de ribavirina, suspensiones de tratamiento e ingresos hospitalarios.
La seguridad se valoró identificando el tipo y la gravedad de los eventos adversos. La clasificación de las RAM se realizó siguiendo los criterios de la División del SIDA (DAIDS, versión 1.0)13. En la comparación de la toxicidad por grados, se agruparon los grados 1 y 2 definiéndose como toxicidad leve-moderada, y los grados 3 y 4 como toxicidad grave.
Todas las RAM clasificadas como graves fueron notificadas por el Servicio de Farmacia al Sistema Español de Farmacovigilancia mediante la tarjeta amarilla.
Los datos se analizaron mediante el programa estadístico SPSS® versión 15.0. Se realizó un análisis descriptivo con medidas de tendencia central y dispersión así como frecuencias absolutas y relativas. Para el análisis comparativo, se empleó el T-test para variables continuas, y el test Chi-cuadrado para comparar en función de una variable categórica.
Resultados
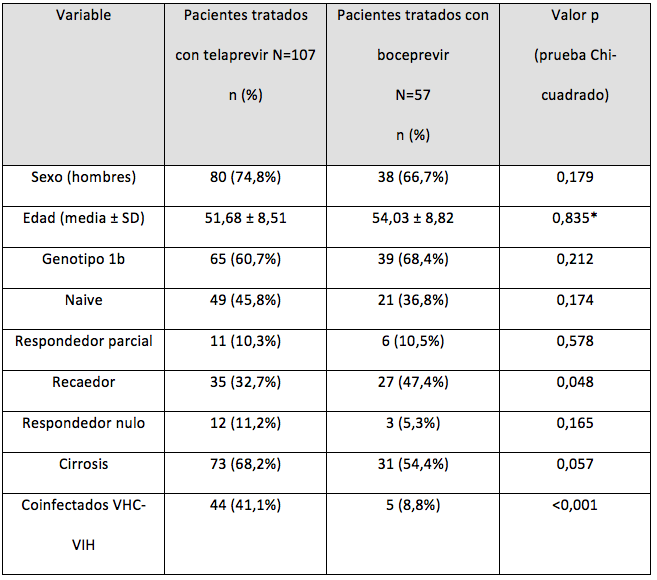
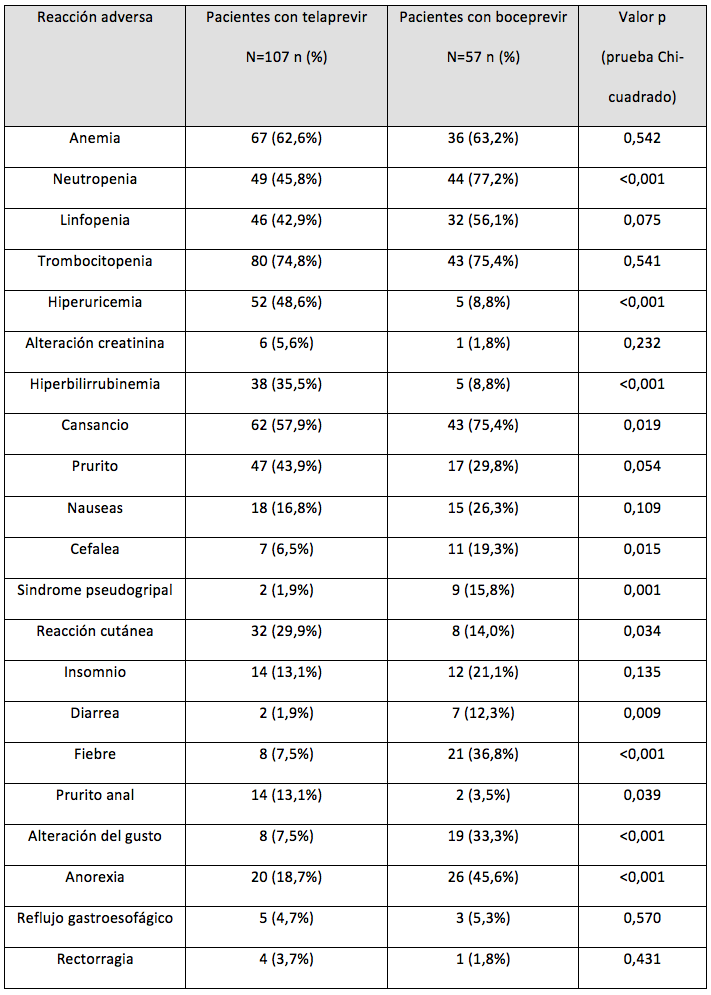
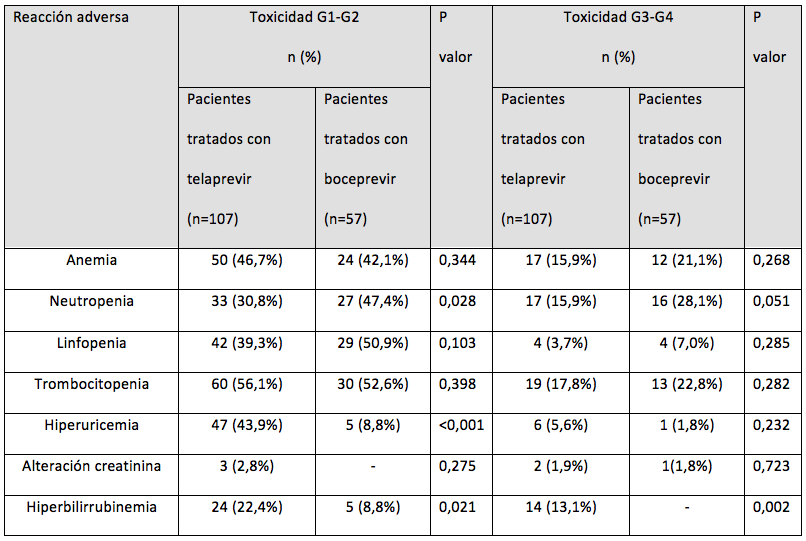
Se incluyeron 164 pacientes, 65,2% (107/164) tratados con telaprevir y 34,8% (57/164) con boceprevir. Las características generales de ambos grupos de tratamiento se resumen en la tabla 1. La comparación de la seguridad entre ambos grupos se refleja en la tabla 2. El análisis de la toxicidad clasificada se recoge en la tabla 3.
El ajuste de dosis de ribavirina se realizó en el 46,7% de los pacientes con telaprevir frente al 73,7% con boceprevir (p=0,001). La suspensión del tratamiento por toxicidad con telaprevir tuvo lugar en el 7,4% de los pacientes, frente a 8,7% de los tratados con boceprevir (p=0,369). Los ingresos hospitalarios derivados de la toxicidad del tratamiento se observaron en el 8,4% de los pacientes con telaprevir y en el 21,1% de los que recibieron boceprevir (p=0,021).
Las transfusiones sanguíneas se realizaron en el 16,8% de los pacientes tratados con telaprevir y en el 15,8% con boceprevir (p=0,526). El empleo de eritropoyetina exógena tuvo lugar en el 29,9% de los tratados con telaprevir y en el 42,1% de los de boceprevir (p=0,082). La utilización de G-CSF fue del 0,9% en los pacientes con telaprevir y del 8,8% en los de boceprevir (p=0,020).
Discusión
El estudio de las diferencias en el perfil de seguridad entre ambos fármacos puede resultar de especial utilidad a la hora de seleccionar el fármaco más adecuado para cada paciente o bien para mejorar el manejo y seguimiento de la posible toxicidad ocasionada.
Referente a la comparación de las RAM de tipo analítico se observa una mayor aparición de hiperbilirrubinemia e hiperuricemia en el tratamiento con telaprevir, siendo mayor la neutropenia en el caso de boceprevir. La mayor incidencia de hiperbilirrubinemia con telaprevir puede explicarse debido a la elevada tasa de pacientes coinfectados que en numerosas ocasiones son tratados con atazanavir, cuyo uso concomitante con telaprevir puede incrementar los valores de bilirrubina9,14. Las diferencias entre ambos fármacos en cuanto a la aparición de hiperbilirrubinemia se confirmó tanto para el grado leve-moderado como para la toxicidad grave.
Se evidencia una mayor toxicidad cutánea y prurito anal con telaprevir, y de disgeusia con boceprevir, tal y como señalan los ensayos clínicos3-6. También se observaron otras diferencias en cuanto a RAM más inespecíficas como anorexia, cansancio, cefalea, diarrea y síndrome pseudogripal, sin embargo estas diferencias pueden ser debidas a la subnotificación, en algunos casos, de este tipo de RAM por parte de los médicos responsables que, en ocasiones, no le otorgan la suficiente gravedad para ser registradas.
Respecto a los datos obtenidos en estudio de cohorte CUPIC con pacientes monoinfectados cirróticos8, nuestro estudio señala un mayor empleo de G-CSF en el tratamiento con boceprevir (8,8% vs 6,8%). Su mayor utilización en el tratamiento combinado con boceprevir respecto a telaprevir se corresponde bien con la mayor incidencia de neutropenia observada para este fármaco.
Se evidenció un mayor ajuste de dosis de ribavirina para ambos fármacos respecto al estudio CUPIC8 (telaprevir 46,7% vs 17,1%, boceprevir 73,7% vs 14,6%), mientras que las suspensiones de tratamiento por toxicidad resultan inferiores a las señaladas por dicho estudio8 para telaprevir (7,4% vs 21,3%) y boceprevir (8,7% vs 14,2%).
En una publicación reciente en la que se realiza una comparación directa de la seguridad entre ambos fármacos12, se observa un mayor ajuste de ribavirina y de empleo de G-CSF con boceprevir de forma significativa, hecho que coincide con lo señalado en nuestro estudio. Además, el empleo de eritropoyetina exógena fue mayor con boceprevir y el de transfusiones con telaprevir, sin embargo las diferencias no fueron significativas al igual que ocurre en nuestro estudio12.
Como limitaciones de nuestro estudio decir que se trata de un estudio retrospectivo con datos obtenidos de las historias clínicas.
En cuanto a la comparación de nuestros resultados frente a los señalados en otras publicaciones, es conveniente tener en cuenta que nuestra población difiere principalmente de las de los ensayos clínicos y estudios de práctica clínica en que no es homogenea, ya que incluye a diferente tipo de pacientes (naive y pretratados), con un número considerable de pacientes cirróticos y coinfectados con VIH.
En conclusión, los resultados comparados señalan un perfil de toxicidad en el que prevalece un mayor ajuste de dosis de ribavirina, ingresos hospitalarios, neutropenia y disgeusia con boceprevir, y mayor aparición de toxicodermia, hiperuricemia y prurito anal con telaprevir.
Bibliografia
- Resolución del Secretario Autonómico de la Agencia Valenciana de Salud de declaración como MAISE de Telaprevir y Boceprevir y establecimiento de directrices y criterios clínicos de utilización en pacientes con hepatitis crónica C. Versión 3 (actualización 10/06/2013) (Consulta 01/10/2014). Disponible en: http://www. san.gva.es/web/dgfps/programa-paise
- Alter MJ. Epidemiology of viral hepatitis C infection. World J Gastroenterol. 2007;13:2436-41.
- Poordad F, McCone J Jr, Bacon BR, Bruno S, Manns MP, Sulkowski MS, et al. Boceprevir for untreated chronic HCV genotype 1 infection. N Engl J Med.2011;364:1195-206.
- Bacon BR, Gordon SC, Lawitz E, Marcellin P, Vierling JM, Zeuzem S, et al. Boceprevir for previously treated chronic HCV genotype 1 infection. N Engl J Med.2011;364:1207-17.
- Jacobson IM, McHutchison JG, Dusheiko GM, Bisceglie AM, Reddy KR, Bzowej NH, et al. Telaprevir for previously untreated chronic hepatitis C virus infection. N Engl J Med. 2011;364:2405–16.
- Zeuzem S, Andreone P, Pol S, Lawitz E, Diago M, Roberts S, et al. Telaprevir for retreatment of HCV infection. N Engl J Med. 2011;364:2417–28.
- Sangrador Pelluz C, Maiques Llácer FJ, Soler Company E. Seguridad en la práctica clínica de la triple terapia con telaprevir en la hepatitis C crónica. Farm Hosp. 2013;37:489-93
- Fontaine H, Hezode C, Dorival C, Larrey D, Zoulim F, de Ledinghen F, et al. SVR12 rates and safety of triple therapy including telaprevir or boceprevir in 485 cirrhotic non responders treated in the French Early Access Program (ANRS CO20-CUPIC). EASL 48th Annual Meeting (Consulta 03/10/2014). Disponible en: http://www.natap.org/2013/EASL/EASL_16.htm
- Sangrador Pelluz C, Maiques Llácer FJ, Soler Company E. Análisis comparativo de la seguridad de la triple terapia con telaprevir entre pacientes monoinfectados por VHC y coinfectados por VIH. Farm Hosp. 2014;38:25-9
- Belpeiro PS, Hwang EW, Thomas IC, Mole LA, Cheung RC, Backus LI. Early virologic responses and hematologic safety of direct-acting antiviral therapies in veterans with chronic hepatitis C. Clin Gastroenterol and Hepatol. 2013;11:1021-7.
- López-Sepúlveda R, Fernández-López C, García Collado C, Jiménez Morales A, Valencia Soto C, Calleja Hernández A.Á. Seguridad boceprevir y telaprevir en la práctica clínica habitual. Farm Hosp. 2014;38:44-9
- Backus LI, Belperio PS, Shahoumian TA, Cheung R, Mole LA. Comparative effectiveness of the Hepatitis C virus protease inhibitors boceprevir and telaprevir in a large US cohort. Aliment Pharmacol Ther.2014;39:93-103
- Criterios de la División del SIDA (DAIDS, versión 1.0). (consulta 5/10/2014) Disponible en: http://www.hptn.org/web%20documents/ hptn046/ssp/appendices/appendixetoxicitytablesdaidsaegradingtablefinaldec004.pdf
- Ficha técnica de Incivo (Consulta 01/010/2014). Disponible en: http://www.ema.europa.eu/docs/es_ES/document_library/EPAR__Product_Information/human/002313/WC500115529.pdf
Tablas
Tabla 1. Diferencias entre ambos grupos en cuanto a características demográficas y del tipo de paciente
*Obtenida con prueba T de student
Tabla 2. Comparación de las RAM entre ambos grupos de tratamiento.
Tabla 3. Comparación de la toxicidad clasificada por grados entre ambos tratamientos.