Fecha de recepción: 26/09/2023 Fecha de aceptación: 20/10/2023
Juan Ignacio Alcaraz López1, Carla Lozano Llano1, Laura Delgado Tellez de Cepeda1, Marina Calvo Salvador1, Ana Royuela Vicente2, Amelia Sánchez Guerrero1
Departamento(s) e institucione(s)
1. Servicio de Farmacia Hospitalaria, Hospital Universitario Puerta de Hierro Majadahonda, Majadahonda, España.
2. Biostatistics Unit; Hospital Universitario Puerta de Hierro Majadahonda, IDIPHISA. CIBERESP, ISCIII. Madrid, España.
Correspondencia: juanignacio.alcaraz@salud.madrid.org
____
Resumen
Objetivos:
Evaluar el perfil de seguridad de voriconazol e isavuconazol, identificar interacciones farmacológicas que imposibilitan el tratamiento con alguno de los dos fármacos en pacientes con aspergilosis invasiva y establecer criterios de eficiencia.
Métodos:
Se ha evaluado el número y gravedad de interacciones farmacológicas presentadas por el uso de voriconazol o isavuconazol concomitante con su tratamiento durante el ingreso. En los pacientes tratados con isavuconazol se realizó una simulación de las potenciales interacciones que hubieran sufrido estos pacientes en caso de ser tratados con voriconazol.
Resultados:
El estudio cuenta con 76 pacientes, tratados con isavuconazol el 47,4% y voriconazol el 52,6%. Los pacientes con isavuconazol recibieron una mediana de 15 fármacos (RIQ: 12,25 – 17,25) concomitantes, siendo en el caso de los pacientes con voriconazol una mediana de 10 fármacos (RIQ 6,25 – 17). No se encontraron diferencias estadísticamente significativas en la toxicidad hepática medida por elevación de transaminasas (p=0,264).
En los pacientes tratados con voriconazol encontramos 106 interacciones de moderadas-graves relacionados con 34 fármacos, de ellas 43 de grado D o X (40,5%) mientras que para el tratamiento con isavuconazol encontramos 69 interacciones moderadas-graves siendo 4 de grado D o X (5,8%).
Conclusiones:
En nuestro estudio no encontramos diferencias en relación a la hepatotoxicidad derivadas del tratamiento, pero sí una menor incidencia de interacciones farmacológicas a favor del isavuconazol, verificado con la simulación realizada si se hubiera hecho el cambio de tratamiento. Consideramos que el mayor coste de tratamiento de isavuconazol estaría justificado en aquellos pacientes con tratamientos concomitantes que supongan interacciones graves con voriconazol.
Palabras claves: isavuconazol, voriconazol, interacciones, azoles.
Comparative analysis of the real-life interaction profile of isavuconazole and voriconazole
Abstract
Objectives:
To evaluate the safety profile of voriconazole and isavuconazole, as well as to identify drug interactions that preclude treatment with either drug in patients with invasive aspergillosis. Also, to establish efficiency criteria.
Methods:
Retrospective study, analysing the incidence of interactions and adverse reactions in patients who received voriconazole or isavuconazole as prophylaxis or treatment of fungal infections during their hospital stay. The number and severity of drug-drug interactions arising from concomitant use of isavuconazole or voriconazole with their treatment during admission have been evaluated. In patients treated with isavuconazole, a simulation of the potential interactions that these patients would have experienced if treated with voriconazole was performed.
Results:
The study has a population of 76 patients, treated with isavuconazole in 47.4% of patients and voriconazole in 52.6%. Isavuconazole patients received a median of 15 drugs (IQR 12.25 – 17.25) concomitantly with isavuconazole, with voriconazole patients receiving a median of 10 drugs (IQR 6.25 – 17). No statistically significant differences were found in liver toxicity as measured by elevated transaminases (7% in isavuconazole-treated patients and 6% in voriconazole, p=0.264.
In patients treated with voriconazole we found 106 moderate-severe interactions related to 34 drugs, of which 43 were grade D or X (40.5%) while for isavuconazole treatment we found 69 moderate-severe interactions of which 4 were grade D or X (5.8%).
Conclusions:
Voriconazole and isavuconazole are the antifungals of choice in the treatment of invasive Aspergillosis with no evidence of differences in efficacy according to published studies, but with a better toxicity and interaction profile. In our study, we found no differences in treatment-related hepatotoxicity, but we did find a lower incidence of drug interactions in favour of isavuconazole, as verified by simulation if the treatment had been switched. In this regard, we believe that the higher treatment cost of isavuconazole would be justified in patients with concomitant treatments that involve serious drug interactions with voriconazole.
Key words: isavuconazole, voriconazole, interactions, azol.
____
Introducción
Una de las principales causas de morbilidad y mortalidad en los pacientes inmunodeprimidos son las infecciones fúngicas invasivas (IFIs). La infección por Candida es la primera causa de IFIs, pero en el caso de los pacientes inmunodeprimidos, la infección por hongos filamentosos oportunistas, principalmente aspergilosis y mucormicosis, cobra gran importancia (1). Así la prevalencia de aspergilosis invasiva en pacientes tratados con trasplante alogénico de progenitores hematopoyéticos (TPH-Alo) es superior al 8-10%, siendo la principal causa de IFI en esta población(2).
La especie infectante más común es el complejo Aspergillus fumigatus (0,35% del total de infecciones en España en 2021), pero otras especies que también producen esta enfermedad incluyen A. flavus (0,04%), A. niger (0,03%) y A. terreus (0,01%). (3)
El manejo óptimo implica un diagnóstico temprano, así como el inicio precoz de una terapia antifúngica. En el arsenal terapéutico existen varias familias de antifúngicos disponibles para el tratamiento de la aspergilosis destacando hasta la fecha los polienos, azoles y equinocandinas. Como primera opción, las guías de clínicas de tratamiento de la Sociedad Americana de Infecciones (IDSA) y Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica (SEIMC) recomiendan el uso de azoles, en concreto, del voriconazol. (1,4)
Isavuconazol es una alternativa terapéutica a voriconazol, con similar mecanismo de acción que ha demostrado no inferioridad de eficacia a voriconazol en el tratamiento de la aspergilosis invasiva. En cuanto al perfil de seguridad, isavuconazol ha demostrado una menor toxicidad hepato-biliar, ocular y cutánea, así como un potencial menor perfil de interacciones farmacológicas frente a voriconazol según los datos obtenidos en el estudio SECURE 5.
El objetivo de este estudio es evaluar en vida real el perfil de seguridad de ambos fármacos y compararlos con el perfil de seguridad obtenido en el ensayo clínico, así como identificar aquellas interacciones farmacológicas que imposibilitan el tratamiento con alguno de los dos fármacos. Con los datos obtenidos, se pretende establecer criterios de eficiencia en el tratamiento de la aspergilosis invasiva en nuestros pacientes.
Nuestro objetivo principal fue evaluar el número y gravedad de interacciones farmacológicas presentadas por el uso concomitante de isavuconazol o voriconazol con su tratamiento durante el ingreso. En los pacientes tratados con isavuconazol se realizó una simulación de las potenciales interacciones que hubieran sufrido estos pacientes en caso de ser tratados con voriconazol.
Métodos
Estudio observacional retrospectivo. Se pretende analizar la incidencia de interacciones y reacciones adversas de los pacientes que han recibido voriconazol o isavuconazol como profilaxis o tratamiento de infecciones fúngicas durante su estancia hospitalaria. El periodo de estudio estuvo comprendido entre 01 de enero y 31 de diciembre del año 2019 en un hospital de tercer nivel, que atiende a un elevado número de pacientes inmunodeprimidos, se seleccionaron todos los pacientes ingresados que habían recibido tratamiento con voriconazol e isavuconazol durante el periodo de estudio, dicha información se obtuvo del programa de prescripción electrónica y la historia clínica del paciente, una vez recogidas las variables de estudio dichos datos fueron anonimizados.
El análisis de las interacciones se efectuó mediante la plataforma Lexicomp® Drug Interactions, tomando como escala de gravedad de las mismas el Lexicomp® Risk Ratings que clasifica las interacciones en las siguientes categorías: X: evitar combinación; D: considerar modificación de la farmacoterapia; C: monitorización de la farmacoterapia; B: no son necesarias modificaciones; A: no existen interacciones conocidas.
Los objetivos secundarios fueron estudiar las reacciones adversas que se presentaron durante el tratamiento recogidas de la historia clínica electrónica, así como describir el coste del mismo teniendo en cuenta el precio notificado recogido en botplus®.
Como variables demográficas se recogieron el sexo y edad. Se obtuvieron además las siguientes variables analíticas de los pacientes: creatinina, enzimas hepáticas, fármaco empleado, días de tratamiento, vía de administración, indicación de uso, fármacos concomitantes.
Para el análisis estadístico de las variables cualitativas se realizó la prueba χ² de Pearson. El análisis de las variables cuantitativas se efectuó mediante la prueba U de Mann-Whitney, y se describen mediante la mediana y los percentiles 25 y 75 (p25-p75). En ambos casos se consideraron estadísticamente significativas las diferencias con un valor p inferior a 0,05. Para comprobar si la existencia de diferencias estadísticamente significativas en el número de interacciones farmacológicas en los pacientes tratados con isavuconazol y las potenciales si hubieran estado en tratamiento con voriconazol, así como de la gravedad de las mismas se realizó la prueba de rangos apareados de Wilcoxon. El software utilizado fue Stata v17 (StataCorp. 2021. Stata Statistical Software: Release 17. College Station, TX: StataCorp LLC.)
Resultados
Demográficos
El presente estudio cuenta con una población de 76 pacientes, siendo el 58% (44) varones, con una mediada de edad de 61,5 años [p25-p75: 55-66,25].
El tratamiento recibido fue isavuconazol en 36 (47,4%) pacientes y voriconazol en 40 (52,6%).
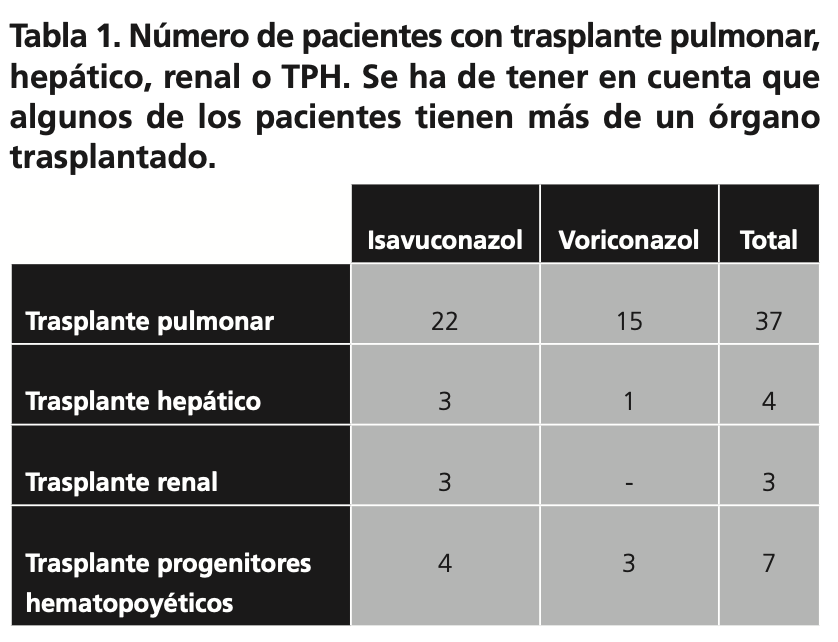
De los 76 pacientes, 51 eran pacientes trasplantados. La distribución de los mismos viene descrita en la Tabla 1.
Analíticos
En el grupo de tratamiento con isavuconazol se recogieron niveles de creatinina en 32 (89%) pacientes, con una mediana de 0,92 mg/dL (0,64 – 1,32), siendo la mediana de aclaramiento de creatinina (ClCr) de 66,26 mL/min [RIQ 44,35-109,06] calculada por CDK-EPI. Se ha de tener en cuenta que 12/32 pacientes (37,5%) presentaban un CLCR < 50 mL/min.
Por otro lado, en los 39 (98%) pacientes con valores de creatinina en el grupo de tratamiento con voriconazol la mediana fue de 0,65 mg/dL (0,51– 1) y de aclaramiento de 104,74 mL/min [RIQ 60,63-134,73]. De estos pacientes, 4/39 (10%) presentaban un aclaramiento menor de 50 mL/min.
Los pacientes tratados con voriconazol presentaron una mejor función renal estadísticamente significativa frente a isavuconzaol (p=0,035).
Tratamiento
Las dosis utilizadas en ambos grupos de tratamiento fueron acordes con las recomendaciones recogidas en ficha.
La mediana de tiempo en tratamiento fue de 30 días (8,50- 84) con isavuconazol, diferenciando aquellos utilizados para el tratamiento de infección activa con una mediana de duración de 28 días (6 – 72,5) y profilaxis con una duración de 71 días (20 – 304).
De forma paralela sucede en el grupo de tratamiento con voriconazol, con una mediana de uso de 30 días (11 – 86). Grupo de tratamiento de una infección activa: 14,5 días (3 –37,5) y profilaxis 61,5 días (3 – 281,5).
Indicación
De 76 pacientes analizados 33 (43,42%) fueron tratados por aspergilosis invasiva, 38,16% fue tratamiento empírico, 10,53% profilaxis de TPH de alto riesgo, 5,26% candidemia en pacientes no neutropénicos y 2,63% infecciones invasivas graves por Candida (incluyendo C. krusei) resistentes a fluconazol.
Si analizamos estas indicaciones según el fármaco recibido, de los pacientes tratados con isavuconazol el 52,78% presentaban aspergilosis invasiva y el 47,22% se empleó como tratamiento empírico.
En cuanto a los pacientes que recibieron voriconazol, en el 35% se empleó como tratamiento de aspergilosis invasiva, 30% tratamiento empírico, 20% como profilaxis de TPH de alto riesgo, 10% candidemia en pacientes no neutropénicos y 5% infecciones invasivas graves por Candida (incluyendo C. krusei) resistentes a fluconazol.
En relación a la vía de administración, el 41,67% de los pacientes con isavuconazol recibió el tratamiento iv, y el 58,23% por vía oral.
El 25% recibió voriconazol por vía intravenosa, 42,5% por vía oral, 25% por vía inhalatoria y 2,5% por vía intrapleural. En dos pacientes no se disponía de los datos de vía de administración.
En cuanto a seguridad, no se encontraron diferencias estadísticamente significativas en la toxicidad hepática, medida por: elevación de transaminasas presente en un 17% (13) de los pacientes (ISA: 7 vs. VORI: 6; p=0.264) y fallo hepático en el 13,15% (10) (ISA: 4 vs. VORI: 6; p=0.616)
Interacciones farmacológicas
Los pacientes con isavuconazol recibieron una mediana de 15 fármacos (12,25 – 17,25) concomitantemente con este, siendo en el caso de los pacientes con voriconazol una mediana de 10 fármacos (6,25 – 17), existiendo una diferencia estadísticamente significativa entre ambos grupos (p=0,048).
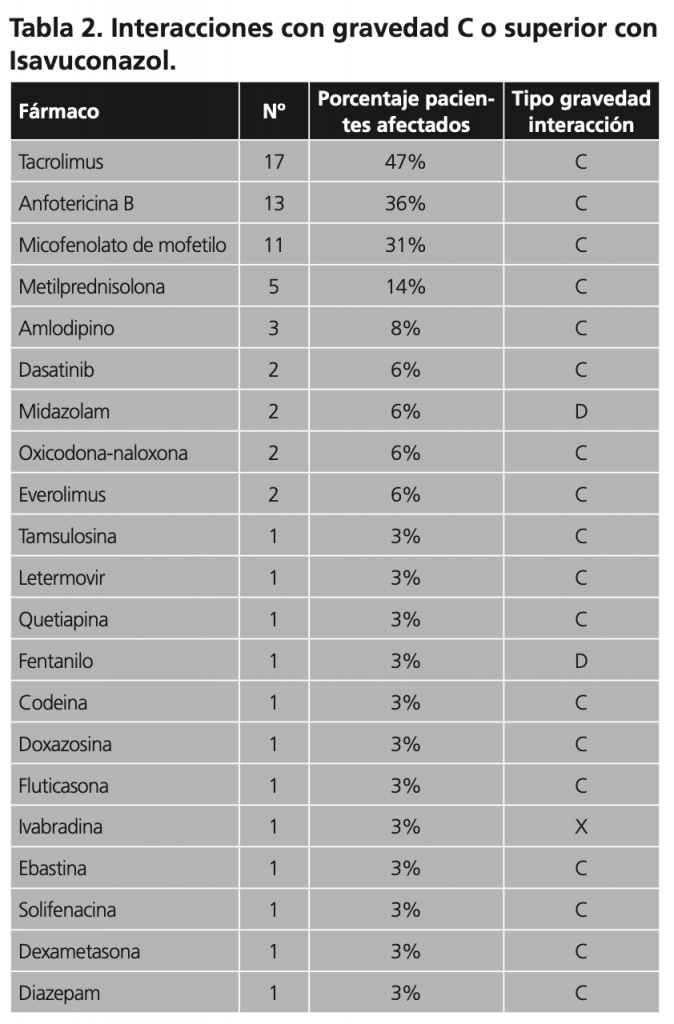
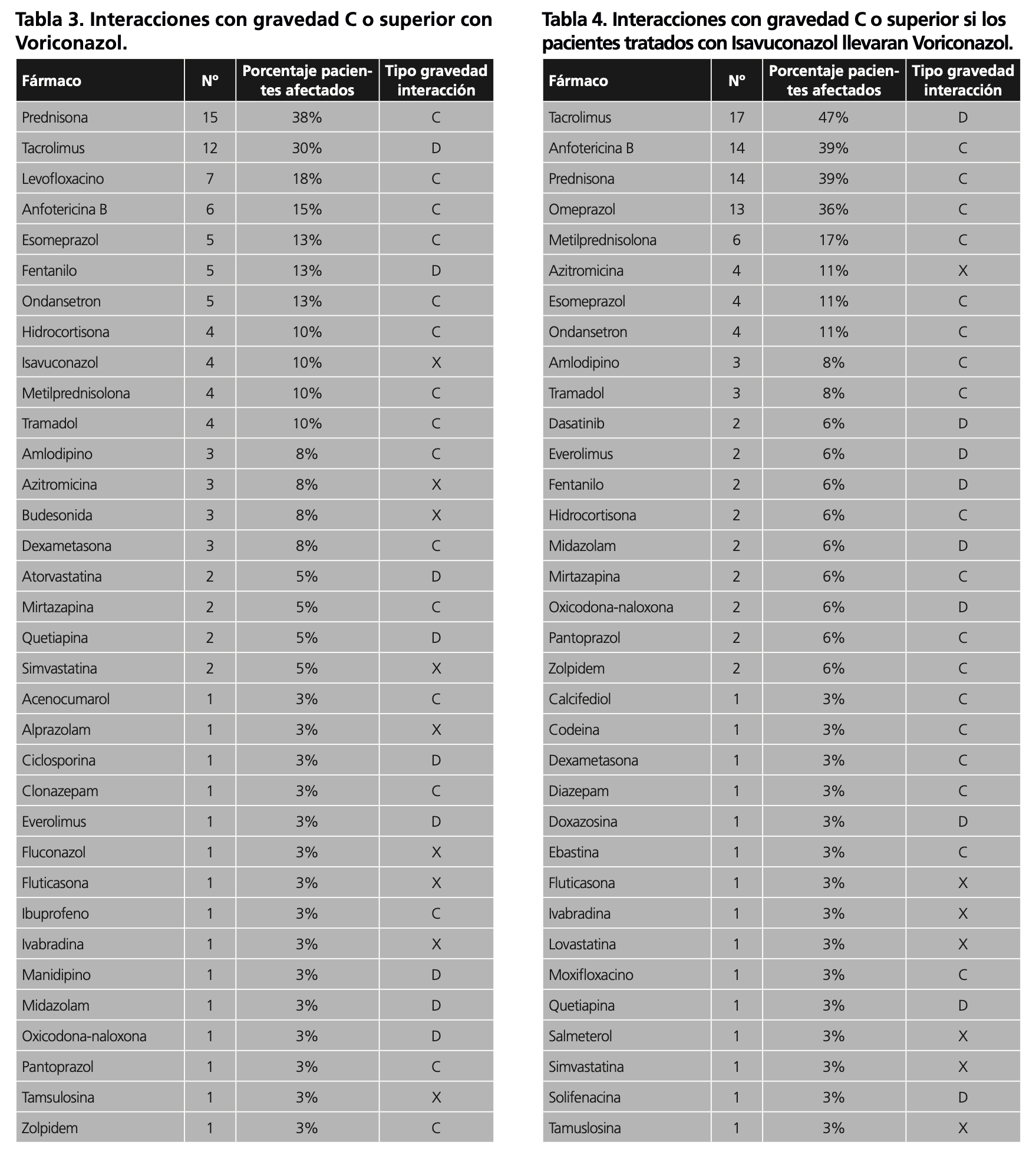
A continuación, se describen los fármacos que interaccionan con el tratamiento antifúngico, así como la gravedad de dicha interacción (Tabla 2, 3 y 4).
El coste del tratamiento de mantenimiento intravenoso al día de voriconazol fue de 350 € y de isavuconazol de 469 € ,mientras que por vía oral el coste de tratamiento era de 112 € para isavuconaol y de 36 € para voriconazol, según los precios actualizados a junio de 2023 en BOTPlus®. Si hubieran sido tratados todos los pacientes con voriconazol en lugar de isavuconazol, esto hubiera supuesto una disminución de 231.151 €.
Discusión
El tratamiento de elección en las infecciones de aspergilosis invasivas recomendado son los antifúngicos triazólicos voriconazol e isavuconazol. Así se muestra en las diferentes guías donde se posicionan de manera similar ambos fármacos como tratamientos preferentes de primera elección (1,4).
Isavuconazol obtuvo la aprobación en el tratamiento de la aspergilosis invasiva tras un estudio comparado con voriconazol demostrando no inferioridad en eficacia. En relación a la seguridad, ambos fármacos presentaron similar porcentaje de efectos adversos, pero con diferencias significativas en las alteraciones hepaticobiliares, oculares y cutáneas. Isavuconazol también presenta un perfil de interacciones farmacológicas más favorable, debido a su menor potencia en la inhibición del complejo enzimático (5).
En la toxicidad hepática medida en nuestro estudio, no encontramos diferencias estadísticamente significativas entre los pacientes tratados con voriconazol e isavuconazol, con una aparición de elevación de niveles de transaminasas en el 19% de pacientes tratados con isavuconazol y del 15% de voriconazol. En el estudio de Samanta(6) en pacientes en tratamiento con ambos fármacos, si encontraron diferencias estadísticamente significativas en la toxicidad que llevó a la discontinuación del tratamiento, destacando la hepatotoxicidad en el 5% de los pacientes tratados con isavuconazol frente al 18% tratados con voriconazol. Este hecho está en línea a los datos encontrados en el estudio secure en el perfil de hepatotoxicidad donde se encontró una diferencia del 9% frente al 16%.
Donde sí hemos encontrado diferencias es en el perfil de las interacciones farmacológicas. En los pacientes tratados con voriconazol encontramos 106 interacciones de moderadas-graves relacionados con 34 fármacos, siendo de ellas 43 de grado D o X (40,5%) mientras que para el tratamiento con isavuconazol encontramos 69 interacciones moderadas-graves siendo 4 de grado D o X (5,8%). En el estudio reportado por Canales Sigueiro y col.(7) que analizaban el perfil de interacciones de isavuconazol, encontraron un porcentaje del 8,1% de interacciones grave (D o X) siendo moderadas el 84,7% (grado C), dato similar al nuestro para este fármaco.
El tacrólimus fue el fármaco más relacionado con interacciones al igual que encontraron Canales y col. encontrando nosotros una diferencia de gravedad según el tratamiento antifúngico concomitante siendo moderada para isavuconazol y grave para voriconazol.
En este sentido realizamos una simulación de las potenciales interacciones que aparecerían si los pacientes tratados con isavuconazol hubieran recibido voriconazol. En dicha simulación nos encontramos que se hubieran producido 115 interacciones farmacológicas moderadas graves que suponen un aumento del 67%, siendo 40 graves (30 categoría D y 10 categoría X).
El isavuconazol supone un mayor coste de tratamiento frente a voriconazol que en nuestros pacientes hubiera supuesto una disminución de 231.151 € en el periodo estudiado en caso de no haber sido utilizado dicho fármaco, pero el perfil de interacciones muestra que dicho cambio no podría haberse realizado en 5 pacientes por el mayor número de interacciones graves de voriconazol.
No hemos encontrado ningún estudio que hubiera realizado dicha simulación si se hubiera realizado el cambio de tratamiento, pero nuestros datos muestran el peor perfil de interacción que justifica en aquellos pacientes que presenten tratamientos concomitantes con ciertos fármacos la imposibilidad de utilizar voriconazol como tratamiento de las infecciones invasivas por Aspergillus sp.
Dentro de las limitaciones de nuestro estudio destacamos el diseño retrospectivo del mismo, el pequeño tamaño muestral así como el estudio de otras toxicidades más allá de la toxicidad hepatobiliar. Otra de las limitaciones importantes del estudio es el no poder demostrar la repercusión clínica que tendrían las interacciones farmacológicas o los daños evitados al no utilizar como tratamiento el voriconazol.
Conclusiones
Voriconazol e isavuconazol son los antifúngicos de elección en el tratamiento de la aspergilosis invasiva sin evidencia de diferencias en eficacia, pero con un mejor perfil de toxicidad e interacciones. En nuestro estudio no hemos encontrado diferencias en relación a la seguridad hepatotóxica derivadas del tratamiento, pero sí una clara menor incidencia de interacciones farmacológicas a favor del isavuconazol, verificado con la simulación realizada si se hubiera hecho el cambio de tratamiento antifúngico. En este sentido, el mayor coste de tratamiento de isavuconazol estaría justificado en aquellos pacientes que presenten tratamientos concomitantes que supongan interacciones graves farmacológicas con el voriconazol.
Bibliografía
(1) Garcia-Vidal C, Alastruey-Izquierdo A, Aguilar-Guisado M, Carratalà J, Castro C, Fernández-Ruiz M, et al. Executive summary of clinical practice guideline for the management of invasive diseases caused by Aspergillus: 2018 Update by the GEMICOMED-SEIMC/REIPI. Enferm Infecc Microbiol Clin (Engl Ed). 2019 Oct;37(8):535-541. doi: 10.1016/j.eimc.2018.03.018. Epub 2018 Jun 28. PMID: 29960829.
(2) Solano C, Vázquez L. Aspergilosis invasora en el paciente con enfermedad oncohematológica [Invasive aspergillosis in the patient with oncohematologic disease]. Rev Iberoam Micol. 2018 Oct-Dec;35(4):198-205. Spanish. doi:10.1016/j.riam.2018.10.001.
(3) Estudio de prevalencia de Infecciones Nosocomiales en España. 2021 EPINE Informe España 27122021. Disponible en: https://epine.es/api/documento-publico/2021%20EPINE%20Informe%20Espa%C3%B1a%2027122021.pdf/reports-esp
(4) Patterson TF, Thompson GR , Denning DW, Fishman JA, Hadley S, Herbrecht R, et al. Practice Guidelines for the Diagnosis and Management of Aspergillosis: 2016 Update by the Infectious Diseases Society of America. Clin Infect Dis. 2016 Aug 15;63(4):e1-e60. doi: 10.1093/cid/ciw326. Epub 2016 Jun 29. PMID: 27365388; PMCID: PMC4967602.
(5) Maertens JA, Raad II, Marr KA, Patterson TF, Kontoyiannis DP, Cornely OA, et al. Isavuconazole versus voriconazole for primary treatment of invasive mould disease caused by Aspergillus and other filamentous fungi (SECURE): a phase 3, randomised-controlled, non-inferiority trial. Lancet. 2016 Feb 20;387(10020):760-9. doi: 10.1016/S0140-6736(15)01159-9. Epub 2015 Dec 10. PMID: 26684607.
(6) Samanta P, Clancy CJ, Marini RV, Rivosecchi RM, McCreary EK, Shields RK,et al.. Isavuconazole Is as Effective as and Better Tolerated Than Voriconazole for Antifungal Prophylaxis in Lung Transplant Recipients. Clin Infect Dis. 2021 Aug 2;73(3):416-426. doi: 10.1093/cid/ciaa652. PMID: 32463873; PMCID: PMC8326536.
(7) Canales-Siguero, D; Caro-Teller JM; Martinez-De La Torre F y Ferrari-Piquero JM. Análisis de las interacciones farmacológicas y recomendaciones terapéuticas asociadas a la utilización de isavuconazol.Rev. OFIL·ILAPHAR [online]. 2022, vol.32, n.2, pp.183-188. Epub 13-Feb-2023. ISSN 1699-714X. https://dx.doi.org/10.4321/s1699-714×2022000200011.
____