Rev. OFIL 2017, 27;3:280-284
Fecha de recepción: 04/08/2016 – Fecha de aceptación: 20/12/2016
González de la Fuente GA, Gutiérrez Nicolás F, Nazco Casariego GJ, González García J, García Gil S, González Perera I
Servicio de Farmacia. Complejo Hospitalario Universitario de Canarias. Tenerife (España)
____
Correspondencia:
Guillermo A. González de la Fuente
Complejo Hospitalario Universitario de Canarias
(Servicio de Farmacia)
Carretera Ofra, s/n
38320 San Cristóbal de La Laguna, Santa Cruz de Tenerife
Correo electrónico: ggonzalezdlf@gmail.com
____
RESUMEN
Objetivo: Comparar los resultados de efectividad y seguridad de infliximab marca de referencia (PR) y de infliximab biosimilar (CT-P13).
Material y métodos: Estudio descriptivo, retrospectivo, de 2 años de duración en el que se incluyeron todos los pacientes mayores de edad a los que se les prescribió PR o CT-P13. Para evaluar la efectividad se registraron los índices de actividad de la enfermedad correspondientes para cada una de las patologías antes de entrar en el estudio y en el momento de salir del mismo. Para evaluar la seguridad, se registró la aparición de reacciones infusionales y/o de efectos secundarios debidos al fármaco.
Resultados: En el estudio se incluyeron un total de 39 pacientes:
– 21 en el grupo PR: 66,67% hombres, edad media: 46 años [24-64].
– 18 en el grupo CT-P13: 61,1% hombres, edad media: 41 años [19-66].
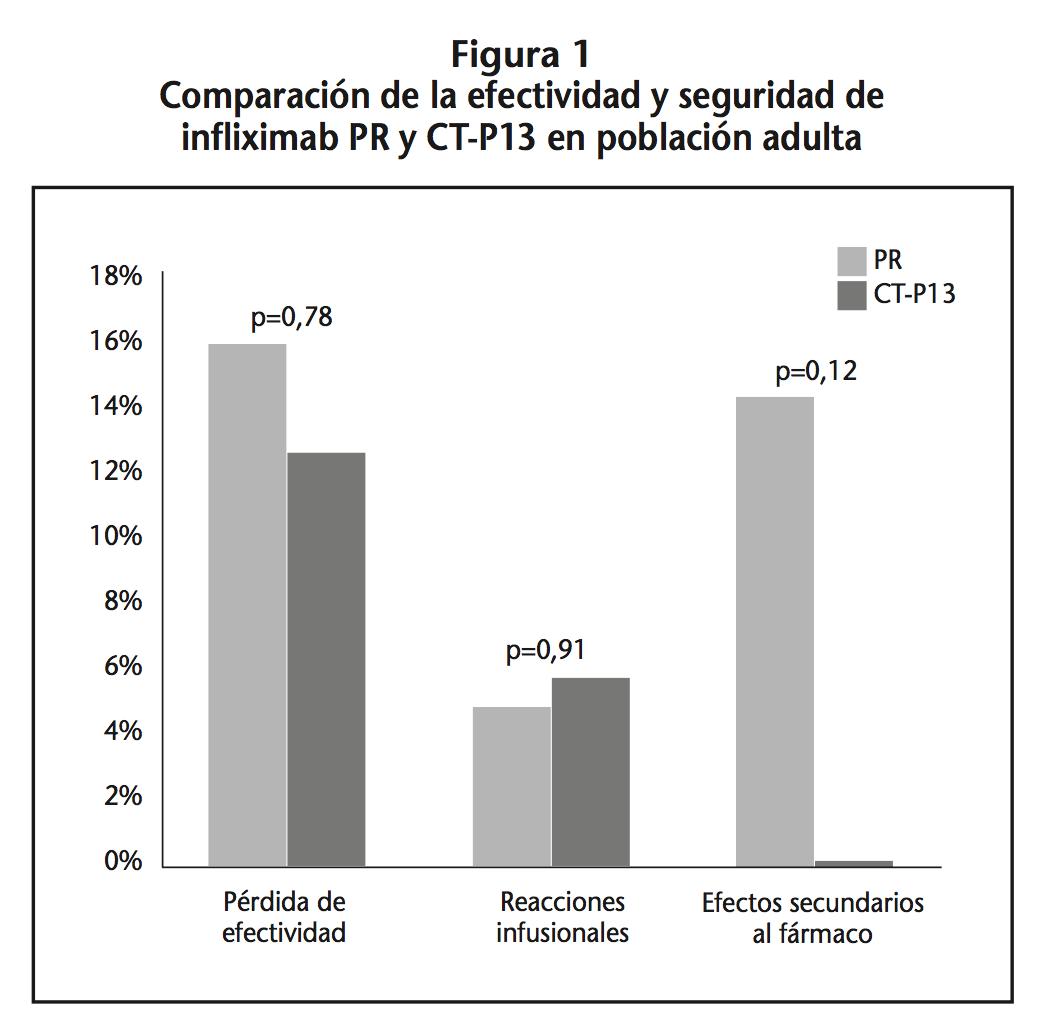
Globalmente, se observó pérdida de efectividad en 3 pacientes del grupo PR y en 2 pacientes del grupo CT-P13 (p=0,78). En ambos grupos, se produjo una reacción infusional. En lo que se refiere a interrupciones del tratamiento debido a efectos secundarios del fármaco, 3 pacientes (14,3%) del grupo PR debieron suspender el tratamiento. No se observó ninguna interrupción por este motivo en el grupo de CT-P13 (p=0,116).
Conclusiones: Según nuestros datos, PR y CT-P13 no muestran diferencias relevantes en efectividad y seguridad tanto en población adulta como en pediátrica.
Palabras clave: Infliximab, biosimilar, efectividad, seguridad.
____
INTRODUCCIÓN
En los últimos años el uso de anticuerpos monoclonales con actividad inmunosupresora, como los anticuerpos contra el factor de necrosis tumoral (antiTNF), han supuesto un punto de inflexión en el manejo de las enfermedades autoinmunes, con resultados muy esperanzadores1. Entre los diferentes anti-TNF que existen en el mercado, el infliximab (IFX) fue el primero en mostrar su eficacia en el control de este tipo de enfermedades2. A pesar de los resultados obtenidos, su elevado coste hace que su uso se limite a las segundas líneas, tras fracaso de los fármacos modificadores de la enfermedad (FAME), como por ejemplo metotrexato, azatioprina, etc3. Sin embargo, la expiración de la patente del IFX producto de referencia (de ahora en adelante PR)(Remicade®) ha permitido el desarrollo de biosimilares (producto bioterapéutico que es similar en términos de calidad, seguridad y eficacia al medicamento de referencia)4, con una considerable reducción del gasto farmacéutico, lo que permitiría un mayor acceso a estos medicamentos desde los Sistemas Públicos de Salud5,6. El primero de estos biosimilares en llegar al mercado ha sido el CT-P13 (Remsima®, Inflectra®) que es un biosimilar de PR producido en la misma línea celular de hibridoma murino, aprobado en Europa para las mismas indicaciones que PR7, gracias a diversos ensayos clínicos (EC) en fase III, que establecieron la equivalencia en seguridad y eficacia de ambos fármacos8,9. Al igual que todos los biosimilares, presentan la misma secuencia de aminoácidos, forma farmacéutica, potencia y composición10,4. Además, diversos ensayos in vitro han demostrado también la similitud de CT-P13 y PR en su capacidad de inducir apoptosis, la citotoxicidad dependiente del complemento y la citotoxicidad celular dependiente de anticuerpo4,10. En lo único que se pueden encontrar ligeras diferencias es en sus estructuras 2ª y 3ª, generalmente debidas a cambios en las longitudes de los oligosacáridos unidos por enlaces N-glucosídicos a la proteína4,7.
A pesar de toda esta evidencia, existe un porcentaje de la comunidad científica que desconfía que esos resultados sean extrapolables al “real-world”11. De tal forma que el objetivo de nuestro estudio ha sido comparar los resultados de efectividad y seguridad de IFX PR y de CT-P13 en la práctica clínica diaria de un hospital de tercer nivel.
MATERIAL Y MÉTODOS
Estudio descriptivo, retrospectivo, de 2 años de duración (abril de 2014 – marzo de 2016) en el que se analizaron todos los pacientes mayores de edad a los que se les prescribió desde el inicio del tratamiento IFX PR (abril de 2014 – marzo 2015) o CT-P13 (I) (abril de 2015 – marzo de 2016), a las dosis indicadas en ficha técnica (3-5 mg/Kg cada 6/8 semanas, con una inducción en las semanas 0, 2 y 6). El seguimiento de los pacientes se realizó a lo largo del año de reclutamiento. Así, el seguimiento de los pacientes del grupo de PR finalizó el 1 de abril de 2015 y el del grupo de CT-P13 el 1 de abril de 2016. Las variables registradas fueron la edad y el sexo de los pacientes, así como la patología, tratamientos previos con terapias biológicas y la tasa de persistencia del tratamiento una vez se cierra el estudio. Se permitió el empleo concomitante de ácido fólico, corticoesteroides orales y/o antiinflamatorios no esteroideos (AINE).
El estudio se realizó en conformidad con los principios de la Declaración de Helsinki adoptada por la 18ª Asamblea Médica Mundial (Helsinki, Finlandia) en 1964 y enmendada en Fortaleza, Brasil (2013), y las Leyes y Reglamentos vigentes en Europa y España.
Para evaluar la efectividad, se registraron los correspondientes índices de actividad de la enfermedad validados para cada una de las patologías, antes de entrar en el estudio y en el momento de salir del mismo: Crohn Disease Activity Index (CDAI), para enfermedad de Crohn (CD); Ulcerative Colitis Disease Activity Index (UCDAI), para colitis ulcerosa, Bath Ankylosing Spondylitis Disease Activity Index (BASDAI), para espondilitis anquilosante (EA) y espondiloartropatías; Disease Activity Score (DAS28), para artritis reumatoide; American College of Rheumatology (ACR50) para artropatía psoriásica. En pacientes con CD, se consideró respuesta al tratamiento una disminución de al menos 100 puntos en el CDAI, mientras que se consideró remisión de la enfermedad un valor de CDAI ≤150. De igual forma, en CU se consideró respuesta una mejora de al menos 3 puntos en la escala UCDAI, mientras que se consideró remisión un UCDAI ≤2. En EA y espondiloartropatía, se aceptó como respuesta una reducción de al menos 1 punto en el índice BASDAI. Por último, la efectividad en artropatía psoriásica se midió analizando la proporción de pacientes que alcanzaron ACR50 en el momento de salir del estudio.
Para evaluar la seguridad, se registró la aparición de reacciones infusionales y/o de efectos secundarios debidos al fármaco, que afectaran al régimen de tratamiento (modificaciones de dosis y/o suspensiones temporales o definitivas del tratamiento).
Los datos fueron registrados a partir del aplicativo informático OncoWin® y de la historia clínica electrónica almacenada en SAP®.
Análisis estadístico
Los resultados de las variables categóricas se expresan en frecuencias y porcentajes. Las variables cuantitativas con medias y desviaciones estándar (SD). Los resultados de efectividad se muestran con las medianas y el rango intercuartílico (IQR), separado por patología. Se consideraron significativos los valores de probabilidad (p) menores a 0,05. Los análisis estadísticos se realizaron con el programa SPSS v. 17.0 (Chicago, IL).
RESULTADOS
Durante el periodo de estudio se incluyeron un total de 39 pacientes:
·21 en el grupo PR: 61,9% hombres, edad media: 44,0 años [24-65].
·18 en el grupo CT-P13: 66,7% hombres, edad media: 43,2 años [19-66].
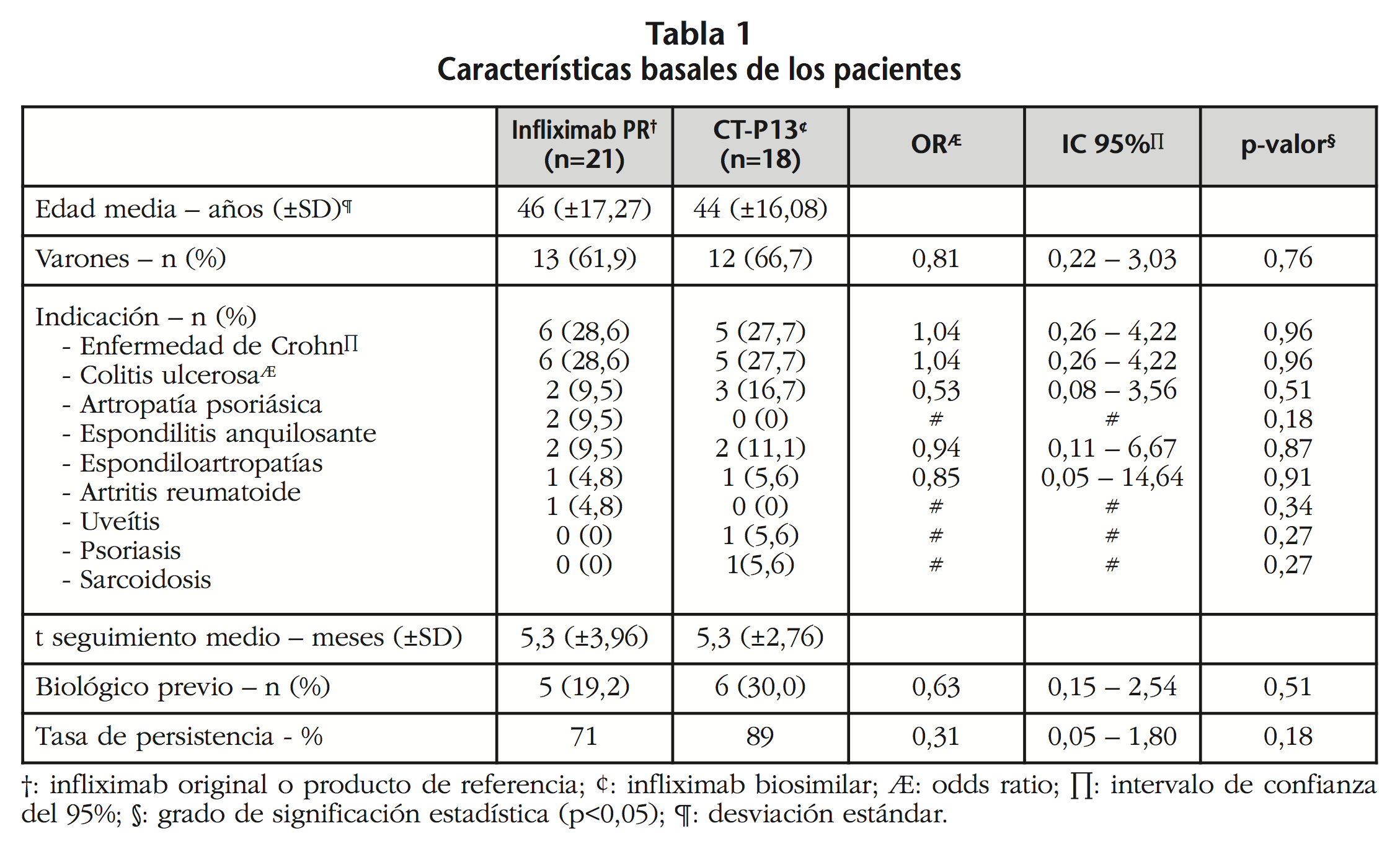
Las características basales de ambos grupos se muestran en la tabla 1. Una paciente diagnosticada de psoriasis del grupo de CT-P13 se puso una única dosis porque se negó a ponerse más el tratamiento. Ambos grupos resultaron ser homogéneos en todas las variables analizadas.
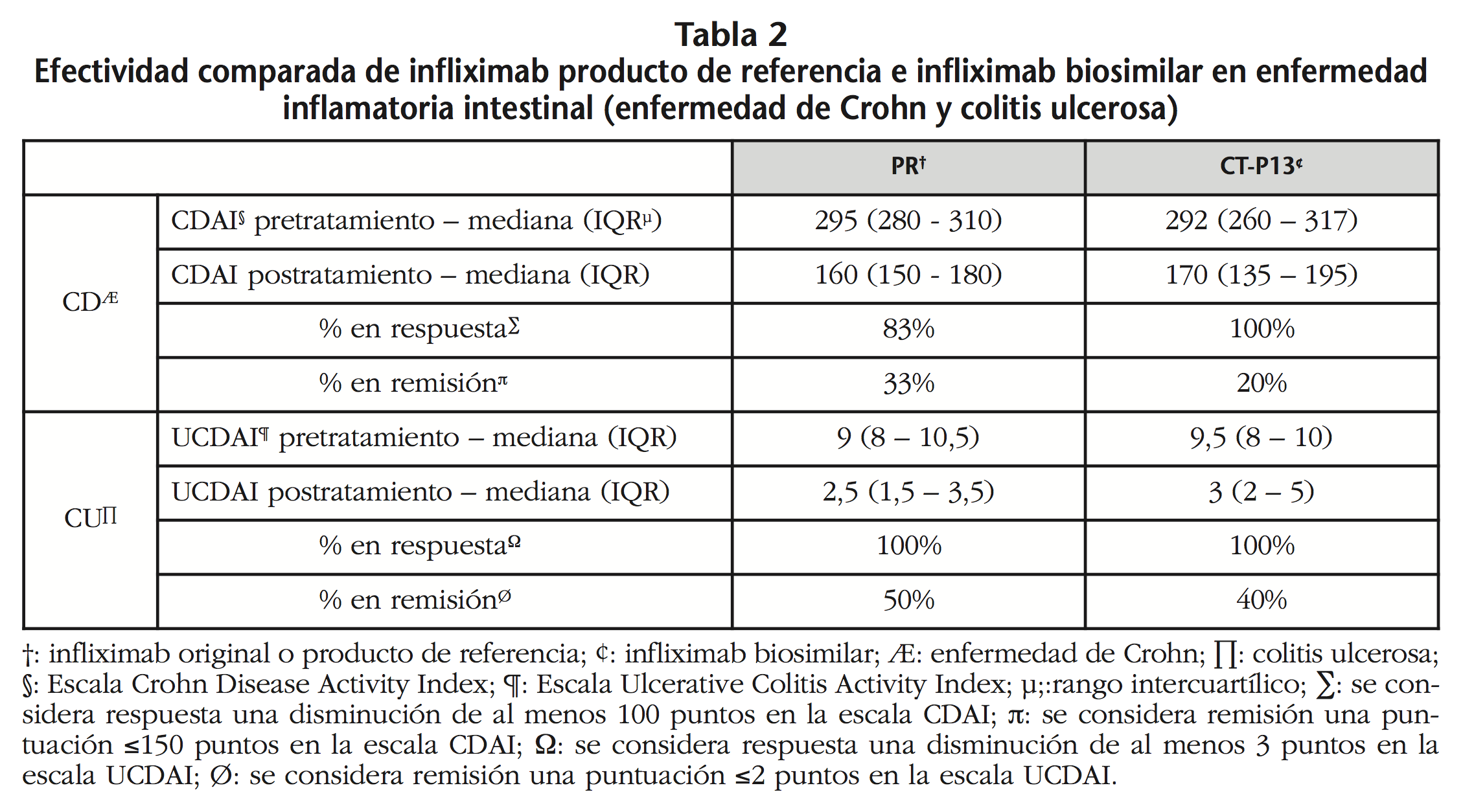
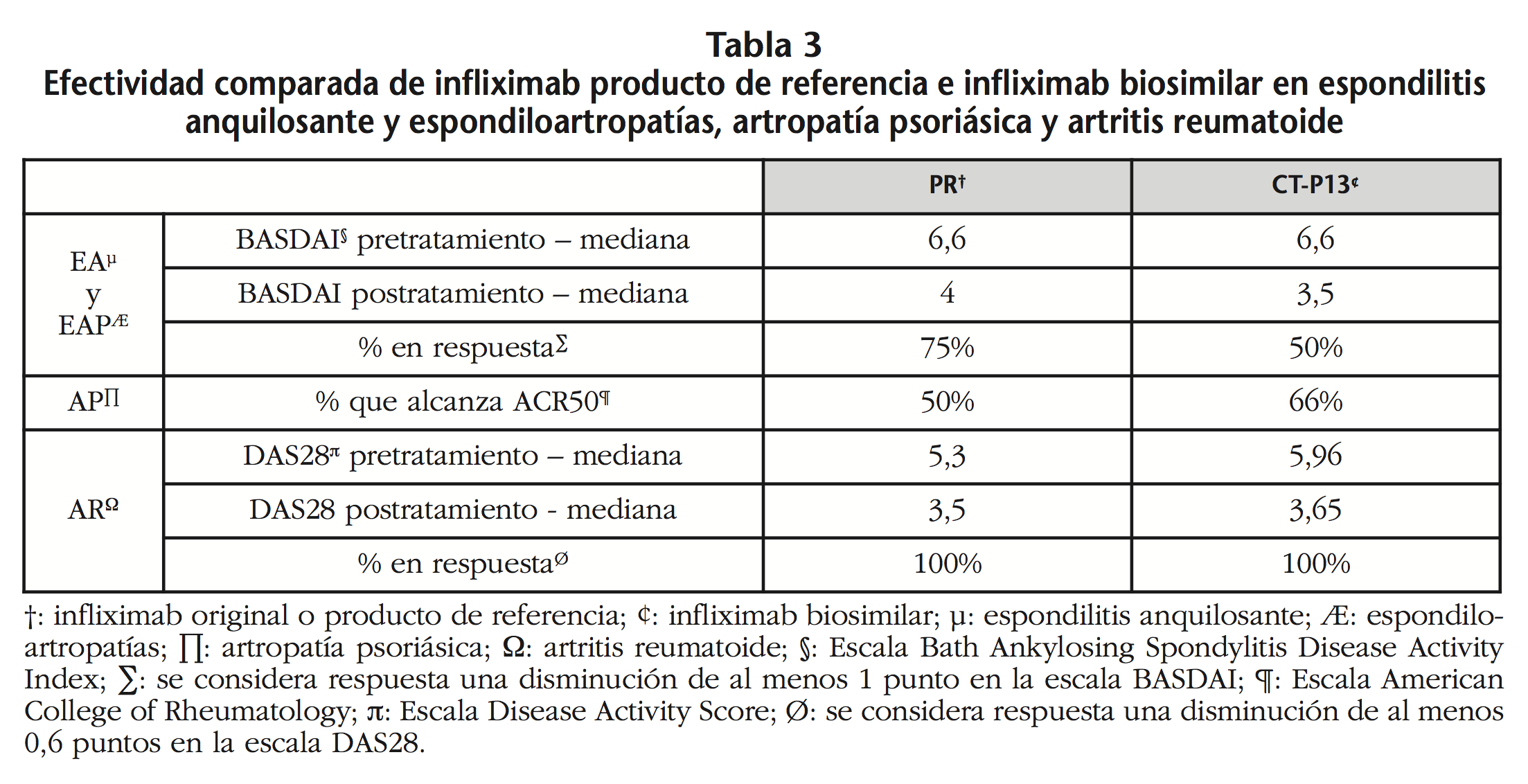
En relación a la efectividad, globalmente no se observaron diferencias entre ambos grupos: en el grupo PR, en el 15,8% de los pacientes se objetivó pérdida de efectividad, mientras que en el grupo de CT-P13, se observó dicha falta de efectividad en el 12,5% (OR=1,31; IC95% 0,19 – 9,02; p=0,78). No se pudo evaluar la efectividad en 4 pacientes: 2 en el grupo PR, diagnosticados de coroidopatía y uveítis, por no disponer de información; y dos en el grupo de CT-P13, diagnosticados de psoriasis y sarcoidosis, por haber aceptado recibir una única infusión del fármaco y por no disponer de información, respectivamente. Los resultados de efectividad desglosados por patología se muestran en las tablas 2 y 3. No se observaron diferencias significativas entre ambos brazos de tratamiento en las patologías estudiadas.
En cuanto a seguridad, los resultados fueron muy similares: en ambos grupos, se produjo una reacción infusional (en el grupo PR tras la administración de la primera dosis y en el grupo CT-P13 tras la cuarta dosis; ninguno había estado en tratamiento con biológicos previamente). En el grupo PR se registraron 3 interrupciones al tratamiento (14,3%) debido a efectos secundarios del fármaco: toxicodermia, episodios eméticos y hemoptisis respectivamente. Ninguno de los 3 pacientes que desarrollaron toxicidad al tratamiento había estado en tratamiento previamente con otro biológico. No se observó ninguna interrupción por este motivo en el grupo de CT-P13 (0%) (p=0,116) (Figura 1).
DISCUSIÓN
Diversos estudios han mostrado la equivalencia en eficacia y seguridad del PR y el CT-P13: el PLANETAS es un EC multinacional, randomizado, doble ciego, en el que se compararon CT-P13 y PR durante 54 semanas en pacientes con espondilitis anquilosante (EA), sin encontrar diferencias entre ambos tratamientos12. El mismo resultado fue observado en el ensayo PLANETRA, con idéntico diseño al PLANETAS, pero en pacientes diagnosticados de AR activa13. Sin embargo y hasta la fecha, escasos son los datos sobre esta equivalencia en la práctica clínica diaria de los hospitales. Con el presente trabajo hemos querido aportar mayor información sobre la efectividad y seguridad del CT-P13 en comparación con el PR, mostrando como presentan datos similares en ambos aspectos.
Por supuesto es un estudio que no está exento de limitaciones. El período de seguimiento en ambos brazos de tratamiento es muy corto (tiempo de seguimiento medio de 5,3 meses) para evaluar a largo plazo los resultados obtenidos, tanto en efectividad como en seguridad. Un factor importante que podría limitar la efectividad de este tipo de tratamientos es el desarrollo de anticuerpos anti-fármaco contra el IFX (AAF). La inmunogenicidad del PR a largo plazo ha sido evaluada en múltiples estudios14. Pero poco se sabe de la inmunogenicidad de CT-P13 a largo plazo. Y mucho menos de la inmunogenicidad de ambos comparada de forma directa y a largo plazo. Numerosos autores reconocen la similitud entre original y biosimilar, pero también que la inmunogenicidad a largo plazo de CT-P13 es todavía una incógnita y son necesarios estudios post-autorización prospectivos en los que se estudie esto15,16. Un estudio reciente de Schulze et al.17, revela que no existen diferencias entre original y biosimilar en concentraciones plasmáticas (Cp) ni en la aparición de AAF. No obstante, el diseño del estudio (unicéntrico, con un tiempo de seguimiento de 38 semanas) hace que no se puedan sacar conclusiones definitivas en este aspecto. Nuestro estudio también tiene la limitación del diseño y el tamaño de la población estudiada (1 año de estudio, según incidencia de la enfermedad en nuestro entorno). Sin embargo, creemos que el hecho de estar realizado sobre pacientes “reales” y según práctica clínica habitual, fuera del entorno “óptimo” que ofrecen los EC, es un punto a favor y que por ello nuestro estudio puede aportar más evidencia sobre el tema.
CONCLUSIONES
Nuestros datos indican que, tras un año de uso en el hospital del CT-P13, éste es al menos igual de efectivo y seguro que PR en población adulta.
Conflicto de intereses: Los autores declaran no tener conflicto de intereses.
BIBLIOGRAFÍA
1. Kuek A, Hazleman BL, Ostör AJ. Immune-mediated inflammatory diseases (IMIDs) and biologic therapy: a medical revolution. Postgrad Med J. 2007 Apr;83(978):251-60.
2. Maini R, St Clair EW, Breedveld F, Furst D, Kalden J, Weisman M, et al. Infliximab (chimeric anti-tumour necrosis factor alpha monoclonal antibody) versus placebo in rheumatoid arthritis patients receiving concomitant methotrexate: a randomised phase III trial. ATTRACT Study Group. Lancet. 1999 Dec 4;354(9194):1932-9.
3. Ficha técnica Infliximab (Remicade). Base de datos de medicamentos de la Agencia Europea del Medicamento [base de datos en Internet]. Agencia Europea del Medicamento. Disponible en: http://www.ema.europa.eu/docs/es_ES/document_library/EPAR_-_Product_Information/human/000240/WC500050888.pd. Acceso junio 2016.
4. Guidelines on evaluation of similar biotherapeutic products (SBPs). World Health Organization. Expert Committee on Biological Standardization. Disponible en: http://www.who.int/biologicals/areas/biological_therapeutics/BIOTHERAPEUTICS_FOR_WEB_22APRIL201.pdf. Acceso junio 2016.
5. Putrik P, Ramiro S, Kvien TK, Sokka T, Pavlova M, Uhlig T, et al. Working Group ‘Equity in access to treatment of rheumatoid arthritis in Europe’. Inequities in access to biologic and synthetic DMARDs across 46 European countries. Ann Rheum Dis. 2014 Jan;73(1):198-206.
6. Nast A, Mrowietz U, Kragballe K, de Jong EM, Puig L, Reich K, et al. Barriers to the prescription of systemic therapies for moderate-to-severe psoriasis–a multinational cross-sectional study. Arch Dermatol Res. 2013 Dec;305(10):899-907.
7. European Medicines Agency. Committee for Medicinal Products for Human Use (CHMP). Assessment report: Remsima (infliximab). 2013. Available at: http:// www.ema.europa.eu/docs/en_GB/document_library/ EPAR_-_Public_assessment_report/human/00 2576/WC500151486.pdf. Accessed Jun 2016.
8. Park W, Hrycaj P, Jeka S, Kovalenko V, Lysenko G, Miranda P, et al. A randomised, double-blind, multicentre, parallel-group, prospective study comparing the pharmacokinetics, safety, and efficacy of CT-P13 and innovator infliximab in patients with ankylosing spondylitis: the PLANETAS study. Ann Rheum Dis. 2013 Oct;72(10):1605-12.
9. Yoo DH, Hrycaj P, Miranda P, Ramiterre E, Piotrowski M, Shevchuk S, et al. A randomised, double-blind, parallel-group study to demonstrate equivalence in efficacy and safety of CT-P13 compared with innovator infliximab when coadministered with methotrexate in patients with active rheumatoid arthritis: the PLANETRA study. Ann Rheum Dis. 2013 Oct;72(10):1613-20.
10. Jung SK, Lee KH, Jeon JW, Lee JW, Kwon BO, Kim YJ, et al. Physicochemical characterization of Remsima. MAbs. 2014;6(5):1163-77.
11. Abad Hernández MÁ, Andreu JL, Caracuel Ruiz MÁ, Belmonte Serrano MÁ, Díaz-González F, Moreno Muelas JV. Position paper from the Spanish Society of Rheumatology on biosimilar drugs. Reumatol Clin. 2015 Sep-Oct;11(5):269-78.
12. Park W, Yoo DH, Jaworski J, Brzezicki J, Gnylorybov A, Kadinov V, et al. Comparable long-term efficacy, as assessed by patient-reported outcomes, safety and pharmacokinetics, of CT-P13 and reference infliximab in patients with ankylosing spondylitis: 54-week results from the randomized, parallel-group PLANETAS study. Arthritis Res Ther. 2016 Jan 20;18:25.
13. Yoo DH, Racewicz A, Brzezicki J, Yatsyshyn R, Arteaga ET, Baranauskaite A, et al. A phase III randomized study to evaluate the efficacy and safety of CT-P13 compared with reference infliximab in patients with active rheumatoid arthritis: 54-week results from the PLANETRA study. Arthritis Res Ther. 2016 Apr 2;18:82.
14. Baert F, Noman M, Vermeire S, Van Assche G, D’ Haens G, Carbonez A, et al. Influence of immunogenicity on the long-term efficacy of infliximab in Crohn’s disease. N Engl J Med. 2003 Feb 13;348(7):601-8.
15. Benuccí M, Gobbi FL, Bandinelli F, Damiani A, Infantino M, Grossi V, et al. Safety, efficacy and immunogenicity of switching from innovator to biosimilarinfliximab in patients with spondyloarthritis: a 6-month real-life observational study. Immunol Res. 2016 Jul 23.
16. Martelli L, Peyrin-Biroulet L. Efficacy, safety and immunogenicity of biosimilars in inflammatory bowel diseases: A systematic review. Curr Med Chem. 2016 Oct 14. [Epub ahead of print].
17. Schulze K, Koppka N, Lutter F, Brandhorst G, Schreiber S, Helwig U. CT-P13 (Inflectra™, Remsima™) monitoring in patients with inflammatory bowel disease. Biologicals. 2016 Sep;44(5):463-6.
____
Descargar artículo en PDF: Análisis comparativo de efectividad y seguridad entre infliximab marca de referencia e infliximab biosimilar
