Manresa Ramón N, Sánchez Martínez I, Titos Arcos JC, León Villar J, Selvi Sabater P
Hospital Universitario Morales Meseguer. Murcia (España)
____
Resumen
Objetivo: Analizar efectividad y seguridad de bevacizumab (BVZ) en monoterapia y en combinación con temozolamida o irinotecán en glioma maligno. Esta indicación, hasta el momento, se encuentra fuera de ficha técnica.
Metodología: Estudio observacional, retrospectivo con límite temporal de 45 meses, en el que se incluyeron todos los pacientes diagnosticados de glioma maligno tratados con BVZ (n=22). Se recogieron variables demográficas, clínicas y terapéuticas. La efectividad se evalúo según la supervivencia libre de progresión (SLP), supervivencia global (SG) y respuesta al tratamiento de acuerdo a la escala OMS y la capacidad funcional según la escala ECOG (Eastern Cooperative Oncology Group). Para la seguridad se registraron las reacciones adversas a los medicamentos (RAMs).
Resultados: La distribución de los pacientes en función del esquema terapéutico con BVZ fue: monoterapia, asociado a temozolamida o asociado a irinotecán. La SLP, SG y porcentaje de respuesta con enfermedad estable fueron según esquema: BVZ monoterapia (5,6 meses, 6,2 meses y 15%), BVZ asociado a temozolamida (7,8 meses, SG: no evaluable y 15%) y BVZ asociado a irinotecán (6,2 meses, 2,5 meses y 5%). Se observó un 47,8% de empeoramiento del ECOG, un 47,8% de mantenimiento y un 4,4% una mejoría. La incidencia de RAMs fue del 32%, siendo más frecuentes hipertensión arterial y diarrea.
Conclusiones: Los mejores resultados de efectividad se hayan con BVZ más temozolamida, y los peores con BVZ e irinotecán asociado a un mayor número de RAMs. La terapia es bien tolerada, observándose un mantenimiento en la calidad de vida.
Palabras clave: Anti-angiogénesis, bevacizumab, efectividad, gliomas, off-label, respuesta, seguridad.
Analysis of the effectiveness and safety of bevacizumab in the treatment «off label» malignant gliomas
SUMMARY
Objetive: To analyze the effectiveness and the safety of bevacizumab (BVZ) alone and in combination with temozolomide and irinotecan in malignant glioma. This indication is off-label.
Methods: Observational and retrospective study, with time limit of 45 months, in which were included all patients diagnosed with malignant glioma treated with BVZ (n=22). Demographic, clinical and therapeutic variables were collected. The effectiveness was evaluated according to the progression-free survival (PFS), overall survival (OS) and response to treatment according to WHO scale and functional capacity according to ECOG scale (Eastern Cooperative Oncology Group). For safety, were recorded adverse drug reactions (ADRs).
Results: The distribution of patients according to regimen with BVZ was: alone, associated with temozolomide or associated with irinotecan. PFS, OS and response rate with stable disease were: BVZ monotherapy (5.6 months, 6.2 months and 15%), associated with temozolomide BVZ (7.8 months, SG: not evaluable and 15%) and BVZ associated with irinotecan (6.2 months, 2.5 months and 5%). We observed the 47.8% of worsening of ECOG, the 47.8% of maintenance and the 4.4% of improvement. The incidence of ADRs was 32%, being more frequent hypertension and diarrhea.
Conclusions: The best results of effectiveness have been with BVZ associated with BVZ, and the worst with BVZ and irinotecan for greater number of ADRs. Therapy is well tolerated, showing maintenance in quality of life.
Key Words: Anti-angiogenesis, bevacizumab, effectiveness, gliomas, off-label, responsiveness, assurance.
____
INTRODUCCIÓN
Los gliomas malignos son tumores cerebrales de rápida evolución que se dividen en base a sus características histopatológicas en: gliomas anaplásicos (astrocitoma anaplásico, oligodendroglioma anaplásico, y oligoastrocitoma anaplásico) y glioblastoma (GBM). De ellos el GBM grado IV es el más agresivo y frecuente (54% de los casos), y prácticamente incurable1. La incidencia de glioma maligno es de 3 a 5 casos por cada 100.000 habitantes/año2,3. Existe un ligero predominio en el sexo masculino y se desarrolla en todas las edades, siendo el pico de incidencia en la quinta y sexta década de vida3. Se asocian con una gama de síntomas y complicaciones como edema cerebral, convulsiones, endocrinopatía, fatiga, trastornos psiquiátricos, y el tromboembolismo venoso dependiendo de la localización y tamaño tumoral, afectando seriamente la calidad de vida del paciente.
El tratamiento estándar multimodalidad consiste en la máxima resección quirúrgica, seguido de la combinación de radioterapia con quimioterapia. La naturaleza difusa e invasiva del GBM impide su resección quirúrgica completa, lo que conduce inevitablemente a la recurrencia del tumor y la muerte en un intervalo aproximado de 15 a 21 meses4. La radioterapia externa fraccionada es la más empleada en pacientes con un buen ECOG (Eastern Cooperative Oncology Group), siendo la radioterapia hipofraccionada la más usual en pacientes con edad avanzada o peor ECOG5. Actualmente, hay un gran interés en la búsqueda de tratamientos eficaces incluyendo inmunológicos, nuevos agentes citotóxicos y agentes «selectivos». Los agentes “selectivos” son pequeñas moléculas o anticuerpos que bloquean enzimas o proteínas específicas sabiendo que son activas en células cancerígenas limitando el daño en células sanas.
Las terapias dirigidas contra la angiogénesis han adquirido gran interés terapéutico. Bevacizumab (BVZ) es un anticuerpo monoclonal humanizado contra el factor de crecimiento endotelial vascular, autorizado para GBM recurrentes por la FDA (Food and Drug Administration) desde 20095,6, sigue pendiente de autorización por la EMEA y por ello su uso en España es en condiciones diferentes a las autorizadas (off-label). El beneficio de BVZ es transitorio debido a la progresión tumoral tras una mediana de tan solo 3-5 meses5,6.
El objetivo de nuestro estudio es evaluar la efectividad y seguridad de BVZ en monoterapia y en combinación con temozolamida o irinotecan en pacientes diagnosticados de glioma cerebral.
MATERIAL Y MÉTODOS
Estudio retrospectivo descriptivo y observacional sobre una muestra de 22 pacientes diagnosticados de glioma cerebral y tratados con BVZ off-label desde enero de 2011 hasta septiembre de 2014 en un hospital de segundo nivel, realizando un seguimiento hasta octubre de 2014.
Se incluyeron los pacientes que cumplían los siguientes criterios: diagnóstico de glioma tratados o en tratamiento con BVZ durante al menos dos ciclos.
Se recogieron las siguientes variables: demográficas (sexo, edad), clínicas (tipos), tratamiento recibido (cirugía, radioterapia, líneas de quimioterapia, esquema), la capacidad funcional según la escala ECOG previa y al final tratamiento, efectividad (supervivencia libre de progresión (SLP), supervivencia global (SG), respuesta al tratamiento) y seguridad (reacciones adversas a medicamentos (RAMs)).
Los datos recogidos se obtuvieron mediante la consulta del programa de prescripción y validación electrónica de citostáticos FARMIS_ONCOFARM® versión 2011.0.4.18 y consulta del programa de historia clínica SELENE® versión 5.3.11.
La respuesta al tratamiento se evaluó según los criterios de la OMS7 considerándose: respuesta completa (RC) (desaparición de todas las lesiones), respuesta parcial (RP) (disminución >50% de lesiones de la suma de las áreas), enfermedad estable (EE) (si no RP ni progresión) y progresión de la enfermedad (PE) (si >25% de aumento de lesiones de la suma de las áreas o aparición de una nueva).
La evaluación de la seguridad se realizó mediante el registro de RAMs categorizadas en grados según los criterios de toxicidad de Common Terminology Criteria of Adverse Events v4.0 (CTCAE)8.
Se realizó un estudio descriptivo en el que las variables numéricas se describieron como medias y desviación típica si la distribución era normal, y las cualitativas como frecuencias y porcentajes. El análisis estadístico se realizó con la aplicación informática Microsoft Excel® 2003.
La principal limitación fue la muestra del estudio, pero hay que tener en cuenta que se trata de un tumor poco frecuente y que el tratamiento con BVZ en la mayoría de los casos es una terapia de rescate ante la ausencia de otros tratamientos.
RESULTADOS
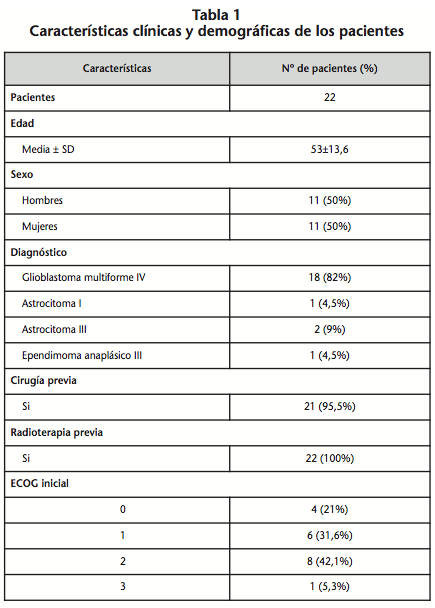
Se incluyeron 22 pacientes diagnosticados de glioma tratados con BVZ con una media de edad de 53 años ± 13,6. Las características clínicas y demográficas se muestran en la tabla 1. Los diagnósticos fueron confirmados histológicamente. 21 pacientes fueron intervenidos quirúrgicamente y 22 recibieron radioterapia. La distribución de pacientes por ECOG al inicio fue: 10 pacientes con ECOG 0-1 (52,6%) y 9 con ECOG ≥2 (47,4%).
El 90% de los pacientes recibió BVZ 10 mg/kg/14 días, y el resto 15 mg/kg/21 días, administrado según ritmo de infusión de ficha técnica9 (primera dosis en 90 minutos, segunda en 60 minutos y tercera en 30 minutos).
El 85% de los pacientes recibieron BVZ en segunda línea, y el resto en primera, tercera y cuarta línea (suponiendo un 5% en cada una de las líneas). La quimioterapia previa recibida fue temozolamida en 16 pacientes (80%), fotemustina en 1 (5%), etopósido en 1 (5%) y cisplatino en 1 (5%). En el estudio se identificaron tres grupos de pacientes en base al tratamiento recibido: BVZ en monoterapia, BVZ con temozolamida a 150-200 mg/m2/24h durante 5 días y BVZ con irinotecán a 125 mg/m2 cada dos semanas. Hubo un paciente que recibió la terapia con BVZ junto a temozolamida y posteriormente BVZ con irinotecán, analizándose por separado debido al tiempo transcurrido, es decir, como dos líneas de tratamiento independientes.
Atendiendo a ECOG, se observó un empeoramiento del ECOG (47,8% de los pacientes), mantenimiento (47,8%) y una mejoría (4,4%). Ningún tratamiento con BVZ fue suspendido debido al ECOG.
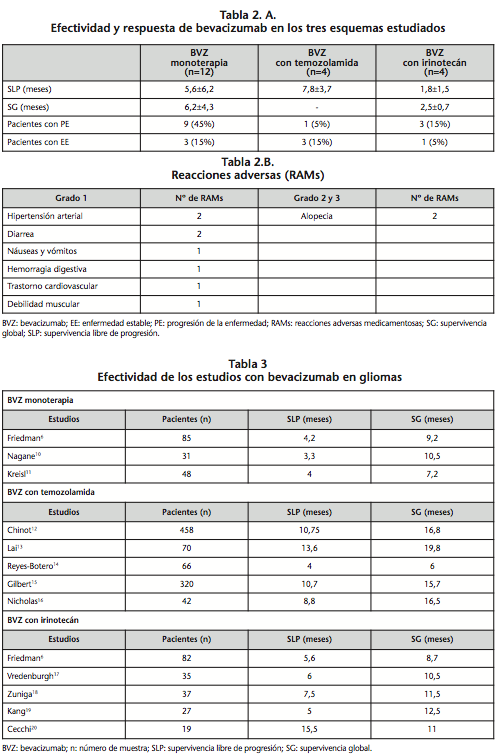
En la tabla 2.A. reflejamos la efectividad y tipo de respuesta según esquema con BVZ. Los mejores datos de SLP se obtienen con BVZ junto a temozolamida y sobre la SG hay una marcada diferencia entre BVZ monoterapia y BVZ con irinotecán (con irinotecán más agresiva y peor tolerada). En cuanto a respuesta, un 65% de los pacientes progresaron y un 35% presentaron EE.
La incidencia de RAMs fue del 31,6%, siendo clínicamente manejables y no registramos ninguna RAM de grado >3. En dos casos hubo reducción de dosis por la administración concomitante de terapia anticoagulante y en un caso se suspendió por neurotoxicidad. En la tabla 2.B. representamos las RAMs obtenidas en el seguimiento.
DISCUSIÓN
Uno de los primeros estudios publicados fue realizado por Friedman et al.6, en el cual BVZ adquirió la aprobación por parte de la FDA para GBM recurrente. Se incluyeron a 167 pacientes con primera o segunda recaída de GBM, se administró BVZ 10 mg/kg/14 días en monoterapia a 85 pacientes. El resultado de la eficacia de BVZ en monoterapia fue: SLP de 4,2 meses y SG de 9,2 meses. El estudio japonés10 obtuvo unos datos similares en monoterapia. En ambos estudios, los pacientes habían recibido previamente temozolamida con radioterapia y más del 70% de los pacientes presentaban un ECOG 0-1 inicial. Se excluyeron pacientes con enfermedades cardiovasculares significantes o alteraciones hematológicas, renales o hepáticas. En nuestro estudio, el 100% de los pacientes con BVZ en monoterapia habían recibido previamente temozolamida y radioterapia pero la SLP (5,6 meses) fue ligeramente superior y la SG menor (6,2 meses) a los estudios descritos. Puede estar justificada por la diferente distribución de ECOG, reducciones de dosis y a la no exclusión de pacientes.
En la tabla 3 se representan la efectividad de estudios con BVZ en gliomas según el esquema6,10-20.
Respecto a BVZ en combinación con temozolamida, estudios12-16 coinciden en valores superiores de SLP y no existe una clara mejoría en la SG. Dos estudios12,13 pueden presentar resultados distorsionados tras recibir una fase de mantenimiento con BVZ en monoterapia hasta PE o toxicidad inaceptable. Por otro lado, en pacientes ancianos se observa una gran reducción de efectividad14. En nuestro estudio, la SLP es inferior exceptuando el de ancianos, y la SG a un año fue del 100%. El 75% de los pacientes habían recibido tratamiento previo y en algunos estudios12,15 no se incluyeron pacientes con quimioterapia previa.
En BVZ junto a irinotecán, se observa una reducción de SLP y SG respecto a los estudios publicados6,17-20, pudiendo deberse a la elevada incidencia de RAMs. En la otra rama del estudio Friedman et al.6, se administró BVZ con irinotecán evidenciándose una mayor SLP y SG respecto al nuestro.
A pesar del tratamiento con temozolamida y BVZ (monoterapia o combinación) es frecuente la PE. El 65% de los pacientes presentan PE, destacando mayor porcentaje de EE (15%) en pacientes con BVZ en monoterapia o con temozolamida.
BVZ fue bien tolerado y todas las RAMs están registradas en ficha técnica. Nuestra incidencia de RAMs (31,6%) coincide con la mayoría de estudios mencionados.
CONCLUSIÓN
Los pacientes con GBM recién diagnosticados deben ser tratados con el tratamiento estándar multimodalidad, en combinación con BVZ, con el fin de prolongar la supervivencia, mantener o mejorar su capacidad funcional y es una terapia bien tolerada.
Conflicto de intereses: Los autores declaran no tener conflictos de intereses.
Bibliografía
- Ostrom QT, Gittleman H, Farah P, Ondracek A, Chen Y, Wolinsky Y, et al. CBTRUS statistical report: primary brain and central nervous system tumors diagnosed in the united states in 2006-2010. Neuro Oncology. 2013;15:1-56.
- Dolecek TA, Propp JM, Stroup NE, Kruchko C. CBTRUS statistical report: primary brain and central nervous system tumors diagnosed in the United States in 2005-2009. Neuro Oncol. 2012;14:1-49.
- Ferlay J, Parkin DM, Steliarova-Foucher E. Estimates of cancer incidence and mortality in Europe in 2008. Eur J Cancer. 2010;46:765-81.
- Grossman SA, Ye X, Piantadosi S, Desideri S, Nabors LB, Rosenfeld M, et al. Survival of patients with newly diagnosed glioblastoma treated with radiation and temozolomide in research studies in the United States. Clin Cancer Res. 2010;16:2443-9.
- Malmstrom A, Gronberg BH, Marosi C, Stupp R, Frappaz D, Schultz H, et al. Temozolamide versus standard 6-week radiotherapy versus hypofractionated radiotherapy in patients older than 60 years with glioblastoma: the Nordic randomised, phase 3 trial. Lancet Oncol. 2012;13(9):916-26.
- Friedman HS, Prados MD, Wen PY, Mikkelsen T, Schiff D, Abrey LE, et al. Bevacizumab alone and in combination with irinotecan in recurrent glioblastoma. J Clin Oncol. 2009;27:4733-40.
- World Health Organization WHO Handbook for Reporting Results of Cancer Treatment Offset Publication. Geneva. Switzerland, 1979 [consultado 3 Sep 2011]. Disponible en: http://whqlibdoc.who.int/publications/9241700483.pdf.
- National Cancer Institute. United States: Cancer therapy evaluating program. Reporting guidelines. Common Terminology Criteria of Adverse Events v4.0. Available at:http://ctep.cancer.gov/protocolDevelopment/electronic_applications/docs/ctcae_4_with_lay_ terms.pdf.
- Ficha técnica de Avastin®. Disponible en: http:// www.ema.europa.eu/docs/es ES/document library/EPAR-product Information/human/00582/WC500029271.pdf.
- Nagane M, Nishikawa R, Narita Y, Kobayashi H, Takano S, Shinoura N, et al. Phase II study of single-agent bevacizumab in Japanese patients with recurrent malignant glioma. Jpn J Clin Oncol. 2012;42(10):887-95.
- Kreisl TN, Kim L, Moore K, Duic P, Royce C, Stroud I, et al. Phase II trial of single agent bevacizumab followed by bevacizumab plus irinotecan at tumor progression in recurrent glioblastoma. J Clin Oncol. 2009; 27:740-5.
- Chinot OL, Wick W, Mason W, Henriksson R, Saran F, Nishikawa R, et al. Bevacizumab plus radiotherapy-temozolomide for newly diagnosed glioblastoma. N Engl J Med. 2014;370:709-22.
- Lai A, Tran A, Nghiemphu PL, Pope WB, Solis OE, Selch M, et al. Phase II study of bevacizumab plus temozolomide during and after radiation therapy for patients with newly diagnosed glioblastoma multiforme. J Clin Oncol. 2011;29:142-8.
- Reyes-Botero G, Honnorat J, Chinot OL, et al. Temozolomide plus bevacizumab in elderly patients with newly diagnosed glioblastoma and poor performance status: An Anocef phase II trial. J Clin Oncol. 2013;31 (suppl). Abstract 2020.
- Gilbert MR, Dignam JJ, Armstrong TS, Wefel JS, Blumenthal DT, Vogelbaum MA, et al. A randomized trial of bevacizumab for newly diagnosed glioblastoma. N Engl J Med. 2014;370:699-708.
- Nicholas MK, Lukas RV, Amidei C, et al. Final results of a single arm phase II study of bevacizumab and temozolomide following radiochemotherapy in newly diagnosed adult glioblastoma patients [abstract]. J Clin Oncol. 2013;31(suppl). Abstract 2076.
- Vredenburgh JJ, Desjardins A, Herndon JE 2nd, Dowell JM, Reardon DA, Quinn JA, et al. Phase II trial of bevacizumab and irinotecan in recurrent malignant glioma. Clin Cancer Res. 2007;13:1253-9.
- Zuniga RM, Torcuator R, Jain R, Anderson J, Doyle T, Ellika S, et al. Efficacy, safety and patterns of response and recurrence in patients with recurrent high-grade gliomas treated with bevacizumab plus irinotecan. J Neuro Oncol. 2009;91:329-36.
- Kang TY, Jin T, Elinzano H, Peereboom D. Irinotecan and bevacizumab in progressive primary brain tumors, an evaluation of efficacy and safety. J Neurooncol. 2008;89:113-8.
- Cecchi M, Vaiani M, Ceroti M, Banfi R. A retrospective observational analysis to evaluate the off-label use of bevacizumab alone or with irinotecan in recurrent glioblastoma. Int J Clin Pharm. 2013;35:483-7.
____