Canales Siguero D, Caro Teller JM, Martínez de la Torre F, Ferrari Piquero JM
Servicio de Farmacia. Hospital Universitario 12 de Octubre. Madrid (España)
Fecha de recepción: 20/12/2020 – Fecha de aceptación: 19/01/2021
Correspondencia: Dolores Canales Siguero – Universitario 12 de Octubre (Servicio de Farmacia) – Avenida de Córdoba, s/n – 28041 Madrid (España)
mcanales@salud.madrid.org
____
Resumen
Objetivos: Identificar, describir las interacciones farmacológicas potenciales de isavuconazol, estudiar el impacto clínico de aquellas más relevantes y establecer recomendaciones terapéuticas para las encontradas en pacientes ingresados.
Métodos: Estudio observacional descriptivo retrospectivo que incluyó todos los pacientes tratados con isavuconazol desde su comercialización hasta diciembre 2019.
Se recogieron variables demográficas y fármacos concomitantes a isavuconazol durante más de 48 horas que recibió el paciente. Se revisaron los tratamientos con Lexicomp® para detectar interacciones potenciales, se analizó su mecanismo de acción y se relacionó con los fármacos implicados, estableciéndose recomendaciones terapéuticas.
Para establecer el impacto clínico, se revisaron las historias clínicas de los pacientes con interacciones de mayor gravedad (D y X de Lexicomp®). En el caso de hallar alguna reacción adversa, se aplicó el algoritmo de Horn para establecer la probabilidad de que el efecto esté producido por la interacción farmacológica.
Resultados: Se analizaron 84 ingresos en 59 pacientes. Se produjeron 209 interacciones potenciales en el 84,5% de los ingresos. La mayoría, 84,7% fueron de carácter moderado (categoría C), la más frecuente con tacrolimus. El principal mecanismo de acción fue el efecto inhibidor sobre el citocromo CYP3A4 de isavuconazol (82,8%).
Se detectó una paciente con aumento de fosfatasa alcalina coincidente con el inicio concomitante de isavuconazol y claritromicina. Al aplicar el algoritmo de Horn, se consideró la interacción como posible.
Conclusiones: Se detectaron interacciones farmacológicas potenciales graves en un porcentaje inferior al 10% de los ingresos y solo se detectó una posible reacción adversa asociada a esta interacción, no pudiéndose clasificar como definitiva.
Palabras clave: Isavuconazol, interacción farmacológica, seguridad.
Analysis of drug interactions and therapeutic recommendations associated with the use of isavuconazole
Summary
Objetive: Identify, describe the potential pharmacological interactions of isavuconazole, study the clinical impact of the most relevant ones and establish therapeutic recommendations for those found in hospitalized patients.
Methods: Retrospective descriptive observational study that included all patients treated with isavuconazole from its marketing until December 2019.
Demographic variables and drugs concomitant to isavuconazole for more than 48 hours received by the patient were collected. The treatments with Lexicomp® were reviewed to detect possible interactions, its mechanism of action was analyzed and it was related to the drugs involved, establishing therapeutic recommendations.
To establish the clinical impact, the medical records of the patients with more severe interactions (D and X for Lexicomp®) were reviewed. In the case of finding any adverse reaction, Horn’s algorithm was applied to establish the probability that the effect is produced by the pharmacological interaction.
Results: 84 admissions in 59 patients were analyzed. There were 209 potential interactions in 84.5% of the admissions. The majority, 84.7%, were of a moderate nature (category C), the most frequent with tacrolimus. The main mechanism of action was the inhibitory effect on cytochrome CYP3A4 of isavuconazole (82.8%).
A patient with an increase in alkaline phosphatase coinciding with the concomitant initiation of isavuconazole and clarithromycin was detected. When applying Horn’s algorithm, the interaction is considered as possible.
Conclusions: Potential serious drug interactions were detected in less than 10% of admissions and only one possible adverse reaction associated with this interaction was detected, and it could not be classified as definitive.
Key words: Isavuconazole, pharmacological interaction, safety.
____
INTRODUCCIÓN
Las infecciones fúngicas tienen una baja incidencia en la población general; no obstante, en pacientes inmunodeprimidos, trasplantados o sometidos a quimioterapia supone una causa importante de morbimortalidad. Se estiman 250.000 casos de aspergilosis invasiva y 700.000 casos de candidiasis invasiva anualmente en el mundo1. No se conoce la prevalencia e incidencia exacta de estas patologías debido a deficiencias en los sistemas de notificación de casos, la no obligatoriedad en la declaración de estas enfermedades o los pocos estudios publicados. De cualquier modo, la mortalidad asociada a estas patologías supera los 1,6 millones de personas anuales en el mundo1.
El tratamiento de elección de la aspergilosis invasiva según las últimas guías europeas2 en el caso de pacientes con neoplasia hematológica y trasplante de progenitores hematopoyéticos (TPH) es voriconazol o isavuconazol en aspergilosis pulmonar y voriconazol en aspergilosis extrapulmonar. En el caso de pacientes con trasplante de órgano sólido (TOS) o pacientes VIH, el tratamiento de elección es voriconazol. En algunos casos puede ser necesaria la profilaxis antifúngica con posaconazol como fármaco de elección en pacientes con TPH y voriconazol en pacientes con TOS.
Pese a ser considerado el gold standard actualmente, el tratamiento con voriconazol puede tener limitaciones al ser un inhibidor potente del citocromo 3A4 que en pacientes en tratamiento con inmunosupresores y múltiples fármacos puede producir numerosas interacciones. Además, requiere monitorización de sus niveles, puede dar lugar a hepatotoxicidad, insuficiencia renal y alteraciones neurológicas2,3.
Isavuconazol es un fármaco antifúngico de la familia de los azoles, designado como medicamento huérfano en 20144 y comercializado en España en 20165. Al igual que el resto del grupo, su mecanismo de acción se basa en inhibir la síntesis del ergosterol, componente fundamental de la membrana celular de los hongos5,6. Está indicado en las aspergilosis invasivas o en las mucormicosis en las que el tratamiento con anfotericina B liposomal no ha sido efectivo5. Su espectro antifúngico es similar al que presenta voriconazol, incluyendo las especies de Candida krusei resistentes a fluconazol, las principales especies de Aspergillus ssp. y mucorales7. Presenta mejor perfil farmacocinético que los azoles de segunda generación puesto que es hidrosoluble; puede tomarse con o sin alimentos, no hace falta que se formule con ciclodextrinas en su presentación intravenosa e inhibe en menor medida el citocromo 3A47. Además, según varios estudios publicados, isavuconazol no precisa monitorización farmacocinética de rutina al no haberse hallado asociación entre los niveles plasmáticos y variables de efectividad y seguridad8,9.
El objetivo de este estudio es identificar y describir las interacciones farmacológicas potenciales de isavuconazol, estudiar el impacto clínico de las interacciones más relevantes y establecer recomendaciones terapéuticas para las que se han encontrado en pacientes ingresados.
MATERIAL Y MÉTODOS
Estudio observacional descriptivo retrospectivo en el que incluyeron a todos los pacientes tratados con isavuconazol desde su comercialización hasta diciembre de 2019 en un hospital de clase cinco según la clasificación Clúster de hospitales10.
Se realizó un seguimiento del tratamiento de los pacientes a través de la prescripción electrónica integrada en la historia clínica electrónica. Se recogieron variables demográficas y los fármacos que recibió el paciente de forma concomitante a isavuconazol durante más de 48 horas. Se revisaron los tratamientos con la aplicación Lexicomp® para detectar las potenciales interacciones y se clasificaron en tres categorías según su gravedad: leve para las clasificadas como B por Lexicomp, moderado para las C y grave para las D y X. Se analizó el mecanismo de acción de cada potencial interacción y se relacionó con los fármacos implicados, estableciéndose recomendaciones terapéuticas para cada una de ellas.
Para establecer el impacto clínico, se revisaron las historias clínicas de los pacientes con las interacciones de mayor gravedad (clase D y X de Lexicomp®). En el caso de hallar alguna reacción adversa relacionada con el tratamiento, se aplicó el algoritmo de Horn11 para establecer la probabilidad de que el efecto este producido por la interacción farmacológica.
RESULTADOS
Durante el periodo de estudio, se analizaron un total de 84 ingresos en 59 pacientes (42,4% mujeres) con edad media de 61±13,9 años en pacientes tratados con isavuconazol. La mediana de duración del tratamiento, excluyendo aquellos de menos de 48 horas, fue de 12,5 (6-20,5) días. Se analizaron 206 fármacos concomitantes diferentes, encontrándose interacciones potenciales con 35 de ellos. Se produjeron un total de 209 interacciones potenciales con isavuconazol en el 84,5% de los ingresos. El 84,7% (n=177) de estas interacciones fueron de carácter moderado (categoría C), mientras que el 8,1% (n=17) fueron de carácter grave (categoría D y X), siendo estas últimas interacciones potenciales del grupo de los azoles.
La mediana de interacciones potenciales por episodio de tratamiento fue de 21-3. La potencial interacción más frecuente fue con tacrolimus en 36 ingresos en 20 pacientes, siendo de categoría C. Las interacciones potenciales de categoría D que se produjeron fueron con fentanilo (n=3), colchicina (n=2) y tolvaptán (n=2). Las interacciones potenciales de categoría X que se produjeron fueron con claritromicina (n=4), domperidona (n=4), rifampicina (n=1) y primidona (n=1).
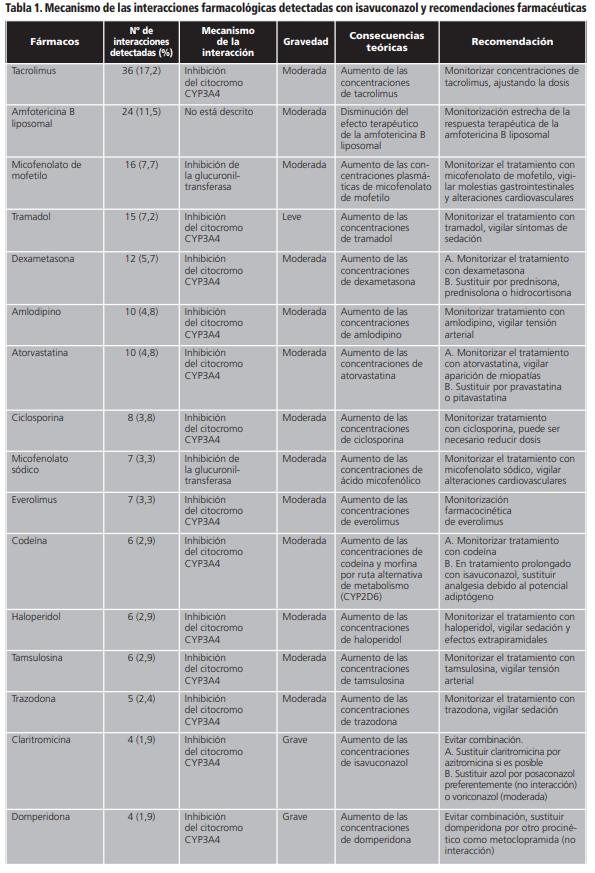
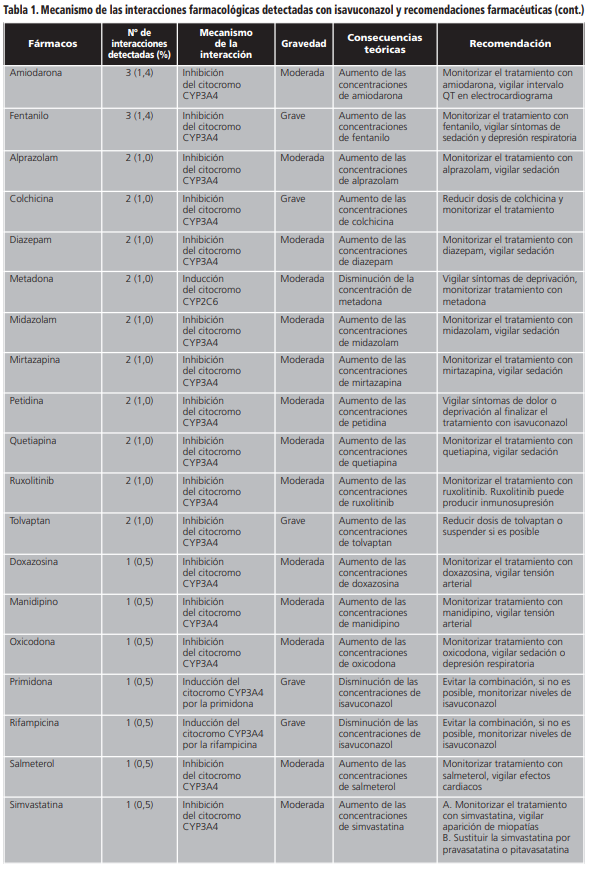
En las interacciones registradas, el principal mecanismo de acción implicado fue el efecto inhibidor sobre el citocromo CYP3A4 de isavuconazol (82,8%). Otros mecanismos minoritarios fueron la inhibición por isavuconazol de la enzima glucuronil-transferasa, la inducción del citocromo CYP2D6 por el azólico o la inducción por parte del otro fármaco implicado del citocromo CYP3A4. En la tabla 1 se detallan en orden decreciente de frecuencia los fármacos detectados con potencial interacción, el mecanismo por el que interaccionan, así como sus posibles consecuencias y las recomendaciones en función de la relevancia clínica.
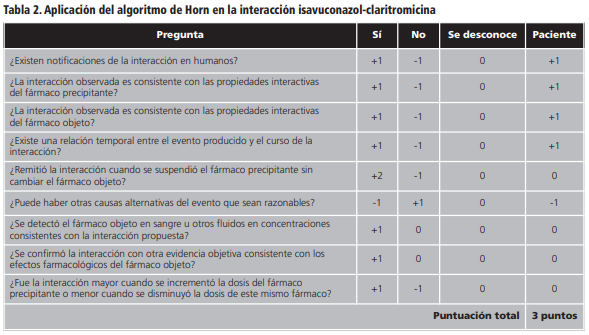
En cuanto a la relevancia clínica, solo se detectó en una paciente un aumento progresivo de la fosfatasa alcalina coincidente con el inicio de tratamiento concomitante con isavuconazol y claritromicina, alcanzando 952 U/L mes y medio después del inicio de ambos fármacos. El perfil hepático continuó deteriorado durante todo el tratamiento concomitante y no se pudo comprobar si mejoraba al retirar la combinación puesto que la paciente falleció un día después de suspender el tratamiento debido a insuficiencia respiratoria aguda en el contexto de progresión tumoral de un adenocarcinoma de páncreas diseminado. Al aplicar el algoritmo de Horn o escala de probabilidad de interacciones farmacológicas, se obtuvo una puntuación de 3, considerando la interacción como posible.
DISCUSIÓN
Las interacciones farmacológicas son una fuente conocida de efectos adversos graves que pueden llevar a la hospitalización. En el estudio realizado por Dechanont et al.12, se estimó que el 1,1% de las hospitalizaciones se producen como consecuencia de interacciones farmacológicas. No obstante, no se conoce la frecuencia con la que las potenciales interacciones farmacológicas producen una reacción adversa, ya que existen pocos estudios en los que se evalúa el impacto clínico real de las mismas. En el artículo publicado por Reis et al.13, estimaron que un 7% de las reacciones adversas a medicamentos se debieron a interacciones farmacológicas, y que por tanto, podrían haber sido evitados.
En nuestro estudio, la posible interacción que se detectó con mayor frecuencia fue la producida por tacrolimus e isavuconazol. Dado que las infecciones fúngicas tienen mayor prevalencia en pacientes trasplantados que en la población sana, es coherente que los pacientes en tratamiento con inmunosupresores, precisen tratamiento con antifúngicos azólicos. Se produce por la inhibición del citocromo 3A4, enzima responsable del metabolismo del tacrolimus, por lo que aumentan las concentraciones del mismo y es necesario monitorizar de forma estrecha sus niveles plasmáticos6,14. Está interacción es común a todo el grupo de antifúngicos azólicos, ya que todos son inhibidores de este citocromo en mayor o menor medida, siendo voriconazol, itraconazol y posaconazol inhibidores potentes citocromo 3A414. Dado que isavuconazol es un inhibidor más débil, teóricamente la interacción con este último tiene menor relevancia. En un estudio farmacocinético realizado en 20 pacientes que tomaron isavuconazol y tacrolimus en combinación y por separado, se obtuvo que la concentración máxima de tacrolimus en tratamiento concomitante con isavuconazol fue un 42% más elevada14. En cuanto a la relevancia clínica, un paciente abandonó el estudio debido a sensación de calor, rubor y hormigueo con la combinación del tratamiento sin que ninguno de los pacientes desarrollara hepatotoxicidad o insuficiencia renal14.
Respecto a las interacciones que potencialmente tienen mayor gravedad y cuya combinación está contraindicada, son aquellas con claritromicina, domperidona, rifampicina y primidona. Dos de los fármacos (primidona y rifampicina) se caracterizan por ser inductores potentes del citocromo 3A415,16, enzima encargada del metabolismo de isavuconazol, por lo que, en presencia de estos fármacos, reducen los niveles del azólic pudiendo limitar su efectividad. En un estudio farmacocinético realizado en 24 pacientes, se demostró que en combinación con rifampicina, la concentración máxima de isavuconazol se redujo a un 75% con respecto a la administración en monoterapia de este antifúngico17. Debido a esto, en estos casos, sí puede ser necesaria la monitorización de los niveles de isavuconazol para mantener la efectividad del mismo. En cuanto a claritromicina, es inhibidor del citocromo 3A418 por lo que puede aumentar las concentraciones de isavuconazol y, por tanto, su toxicidad. Respecto a la domperidona, no se recomienda su uso con fármacos que inhiban el citocromo 3A4 debido a que aumentan las concentraciones de domperidona y su toxicidad19.
En nuestro estudio, se detectaron posibles interacciones farmacológicas en más del 80% de las prescripciones con isavuconazol. Esto indica una necesidad de revisión de estos tratamientos con un análisis exhaustivo de la medicación concomitante prestando especial atención a las alteraciones analíticas o manifestaciones clínicas del paciente que pudieran responder a una potencial interacción (por ejemplo, aumento de la sedación en un paciente tratado con tramadol e isavuconazol o miopatías en el caso de atorvastatina e isavuconazol).
La principal fortaleza de nuestro trabajo es que, según nuestro conocimiento, se trata del primer estudio que recopila las posibles interacciones más frecuentes y las recomendaciones terapéuticas asociadas en la población potencialmente candidata a ser tratada con isavuconazol.
Entre las limitaciones del estudio se encuentran el carácter retrospectivo del estudio y el bajo tamaño muestral, ya que isavuconazol está considerado como medicamento huérfano y el número de pacientes tratados con este fármaco es escaso.
CONCLUCIONES
La potencial interacción medicamentosa más frecuentemente detectada en los pacientes tratados con isavuconazol fue con tacrolimus, siendo esta considerada de gravedad moderada. En cuanto a las interacciones farmacológicas potenciales graves, se detectaron en un porcentaje inferior al 10% de los ingresos y solo en una paciente se detectó una posible reacción adversa asociada a esta interacción, no pudiéndose clasificar como definitiva por el algoritmo de Horn.
Conflicto de intereses: Los autores declaran no tener conflicto de intereses.
____
BIBLIOGRAFÍA
1. Bongomin F, Gago S, Oladele RO, Denning DW. Global and Multi-National Prevalence of Fungal Diseases-Estimate Precision. J Fungi [Internet]. 18 de octubre de 2017 [citado 21 de octubre de 2020];3(4). Disponible en: https://www. ncbi.nlm.nih.gov/pmc/articles/PMC5753159/.
2. Ullmann AJ, Aguado JM, Arikan-Akdagli S, Denning DW, Groll AH, Lagrou K, et al. Diagnosis and management of Aspergillus diseases: executive summary of the 2017 ESCMID-ECMM-ERS guideline. Clin Microbiol Infect. mayo de 2018;24:e1-38.
3. Ficha tecnica vfend 200 mg comprimidos recubiertos con pelicula [Internet]. [citado 12 de noviembre de 2020]. Disponible en: https://cima.aemps.es/cima/ dochtml/ft/02212015/FT_02212015.html.
4. Informe de Posicionamiento Terapéutico de isavuconazol (Cresemba®) en el tratamiento de la aspergilosis invasora y la mucormicosis. Agencia Española de Medicamentos y Productos Sanitarios. [Internet]. [citado 13 de diciembre 2020]. Disponible en: https://www.aemps.gob.es/medicamentosUsoHumano/ informesPublicos/docs/IPT-isavuconazol-Cresemba-aspergilosis-mucormicosis.pdf.
5. Ficha tecnica cresemba 200mg polvo para concentrado para solucion para perfusion [Internet]. [citado 20 de octubre de 2020]. Disponible en: https://cima. aemps.es/cima/dochtml/ft/1151036001/FT_1151036001.html.
6. Perfil farmacológico del isavuconazol | Elsevier Enhanced Reader [Internet]. [citado 23 de octubre de 2020]. Disponible en: https://reader.elsevier.com/reader/sd/pii/ S1130140618300615?token=FF82806ED88B66DABAFEF4D795E07DE395551E2AFA39E18725D42D28A36E08BFA0981A4229CBA363A2727906170F2C75.
7. Jenks JD, Salzer HJ, Prattes J, Krause R, Buchheidt D, Hoenigl M. Spotlight on isavuconazole in the treatment of invasive aspergillosis and mucormycosis: design, development, and place in therapy. Drug Des Devel Ther. 30 de abril de 2018;12:1033-44.
8. Andes D, Kovanda L, Desai A, Kitt T, Zhao M, Walsh TJ. Isavuconazole Concentration in Real-World Practice: Consistency with Results from Clinical Trials. Antimicrob Agents Chemother. 7 de mayo de 2018;62(7):e00585-18, /aac/62/7/e00585-18.atom.
9. Maertens JA, Raad II, Marr KA, Patterson TF, Kontoyiannis DP, Cornely OA, et al. Isavuconazole versus voriconazole for primary treatment of invasive mould disease caused by Aspergillus and other filamentous fungi (SECURE): a phase 3, randomised-controlled, non-inferiority trial. The Lancet. 20 de febrero de 2016;387(10020):760-9.
10. Departamento de Métodos Cuantitativos en Economía y Gestión de la Universidad de Las Palmas. Clasificación de hospitales públicos españoles mediante el uso del análisis de conglomerados [Internet]. [citado 13 de diciembre 2020]. Disponible enhttp://www.mscbs.gob.es/estadEstudios/estadisticas/ docs/NormaGRD2008/CLASIFICACIONHOSPITALESCLUSTER.pdf.
11. Juárez JC. Conceptos generales sobres interacciones farmacológicas: clasificación y probabilidad. En: Girona L, coordinador. Introducción a las interacciones farmacológicas. Madrid. 1ªedición. 2013. p.67-94.
12. Dechanont S, Maphanta S, Butthum B, Kongkaew C. Hospital admissions/visits associated with drug-drug interactions: a systematic review and meta-analysis. Pharmacoepidemiol Drug Saf. mayo de 2014;23(5):489-97.
13. Reis AMM, Cassiani SHDB. Adverse drug events in an intensive care unit of a university hospital. Eur J Clin Pharmacol. 1 de junio de 2011;67(6):625-32.
14. Groll AH, Desai A, Han D, Howieson C, Kato K, Akhtar S, et al. Pharmacokinetic Assessment of Drug-Drug Interactions of Isavuconazole With the Immunosuppressants Cyclosporine, Mycophenolic Acid, Prednisolone, Sirolimus, and Tacrolimus in Healthy Adults. Clin Pharmacol Drug Dev. 2017;6(1):76-85.
15. Ficha técnica rimactan 300 mg capsulas duras [Internet]. [citado 25 de noviembre de 2020]. Disponible en: https://cima.aemps.es/cima/dochtml/ft/ 49034/FT_49034.html.
16. Ficha técnica mysoline 250 mg comprimidos [Internet]. [citado 25 de noviembre de 2020]. Disponible en: https://cima.aemps.es/cima/dochtml/ft/18498/FT_ 18498.html.
17. Townsend R, Dietz A, Hale C, Akhtar S, Kowalski D, Lademacher C, et al. Pharmacokinetic Evaluation of CYP3A4‐Mediated Drug‐Drug Interactions of Isavuconazole With Rifampin, Ketoconazole, Midazolam, and Ethinyl Estradiol/Norethindrone in Healthy Adults. Clin Pharmacol Drug Dev. 2017;6(1):44-53.
18. Ficha técnica claritromicina sandoz 25 mg/ml granulado para suspensión oral [Internet]. [citado 25 de noviembre de 2020]. Disponible en: https://cima.aemps.es/ cima/dochtml/ft/66388/FT_66388.html.
19. Ficha técnica domperidona gamir 10 mg, cápsulas duras [Internet]. [citado 25 de noviembre de 2020]. Disponible en: https://cima.aemps.es/cima/dochtml/ft/ 57096/FT_57096.html.
____