Forrester Quesada M, Faustino Santos JI, Gonçalves Aperta JM
Hospital Sousa Martins. Guarda (Portugal)
Fecha de recepción: 07/01/2022 – Fecha de aceptación: 24/02/2022
Correspondencia: Mario Forrester Quesada – Hospital Sousa Martins – Rua das Barreiras No.18 – 6300-521 Guarda (Portugal)
marioforrester89@gmail.com
____
Resumen
Los errores de medicación son cada vez más comunes lo cual pone en peligro la salud de los pacientes, de ahí la importancia de prevenirlos y controlarlos. El concepto de crear una herramienta de decisión clínica que permita gestionar mejor estos eventos no es nuevo. Utilizando una experiencia danesa, decidimos aplicar el algoritmo de MERIS (Medication Risk Score) en un servicio de accidente cerebrovascular de un hospital portugués con el fin de probar su aplicabilidad, determinar volumen de pacientes de riesgo y comprobar cual variable del algoritmo se correlaciona más con paciente de riesgo. Con una muestra de 65 pacientes con sus respectivos reportes MERIS se determinó que durante dos meses más de la mitad de los pacientes admitidos eran de alto riesgo para errores en su medicación. Se seleccionó la prueba de correlación de Spearman para determinar cuál de todas las variables de MERIS estaba más relacionada a un puntaje alto. Encontramos correlaciones positivas fuertes y estadísticamente significativas entre el puntaje de Meris y: función renal reducida, número de fármacos con bajo riesgo de daño, número de fármacos con alto riesgo de daño, número de fármacos, número de fármacos con riesgo medio de daño y número de fármacos con riesgo de interacción bajo a medio, siendo estos últimos tres los más significativos. No hubo una correlación estadísticamente significativa entre el puntaje MERIS y el número de fármacos con alto riesgo de interacción. Finalmente, modificamos la lista de medicamentos propuesta por los autores anteriores adaptada a nuestro hospital.
Palabras clave: Errores de medicación, efectos adversos, reconciliación de medicamentos, combinación de farmacoterapia, polifarmacia, gestión de medicamentos.
Analysis of a medication error risk algorithm: a portuguese experience
Summary
Medication errors are gradually more common, risking patients health, hence the importance of preventing and controlling them. The concept of creating a clinical decision tool to better manage these events is not new. Using a Danish experience, we applied the MERIS (Medication Risk Score) algorithm in a stroke unit of a Portuguese hospital in order to test its applicability, determine the volume of patients at risk and check which variable of the algorithm correlates more with patient risk. Using a sample of 65 patients with their respective MERIS reports, we determined that for two months more than half of the admitted patients were at high risk of errors in their medication. The Spearman correlation test was selected to determine which MERIS variable was most related to a high score. We found strong and statistically significant positive correlations between the Meris score and: reduced kidney function, number of drugs with low risk of damage, number of drugs with high risk of damage, number of drugs, number of drugs with medium risk of damage and number of drugs with low to medium risk of interaction, the latter three being the most significant. There was no statistically significant correlation between the MERIS score and the number of drugs with a high risk of interaction. Finally, we modify the list of medications proposed by the previous authors adapted to our hospital.
Key words: Medication errors, adverse effects, medication reconciliation, drug therapy combination, polypharmacy, medication therapy management.
____
INTRODUCCIÓN
Los medicamentos son sumamente importantes para la salud pública y con una población en constante envejecimiento, su uso ha aumentado substancialmente. En consecuencia, los errores de medicación han aumentado y se han convertido en un riesgo creciente para los sistemas de salud a nivel mundial. Un error de medicación se puede definir como errores durante los procesos de prescripción, transcripción, dispensación, administración y/o monitoreo de medicamentos que producen o pueden conducir a un uso inapropiado de medicamentos o daños al paciente mientras estos están bajo el control de profesionales de la salud, pacientes o consumidores1,2.
Los errores de medicación más frecuentes pueden ser fallas en la escogencia del tipo de fármaco, dosis, frecuencia, vía de administración y/o paciente. Se encuentran entre los errores más comunes que amenazan la salud de los pacientes, de ahí la importancia de prevenirlos y controlarlos. Si bien se cree que solo un pequeño porcentaje de los errores de medicación son fatales, las muertes han aumentado por lo que diversos estudios han demostrado que más de la mitad de todos los eventos adversos (EA) graves (que son respuestas nocivas y no deseadas a la medicación) se pueden prevenir3,4.
Las revisiones de medicamentos tienen como objetivo evitar los errores de medicación mejorando la calidad, la seguridad y el uso adecuado de los medicamentos. El potencial de estas revisiones se ha analizado mediante varios estudios que demostraron efectos positivos en problemas relacionados con fármacos, prescripción inadecuada y contactos con los servicios de urgencias. En consecuencia, algunos pacientes podrían beneficiarse más de este tipo de actividades que otros, lo que plantea la incógnita de qué tipo de enfoque es el más adecuado para identificar a los pacientes con alto riesgo de EA por fármacos5.
La idea de crear una herramienta, algoritmo o protocolo de decisión clínica para detectar mejor a los pacientes con eventos adversos a medicamentos no es nueva. En una revisión de 2012 sobre la detección de EA utilizando marcadores en los programas informáticos, los autores encontraron diversos protocolos de detección con una gran variación en la sensibilidad y especificidad, lo que dificulta obtener conclusiones sobre la eficacia en la detección electrónica de EA6.
En cuanto a la creación de algoritmos, Saedder et al., afirman que la construcción de dicha herramienta puede realizarse mediante una investigación básica o una revisión de la literatura. Ambos métodos deben incluir ítems que, a través de la observación empírica, sean características propias del grupo de personas estudiadas y una vez determinado esto construir la escala. El algoritmo MERIS es una puntuación de riesgo de medicación simple destinada a identificar los pacientes que tienen un mayor riesgo de errores de medicación utilizando variables relacionadas con el fármaco y el paciente5.
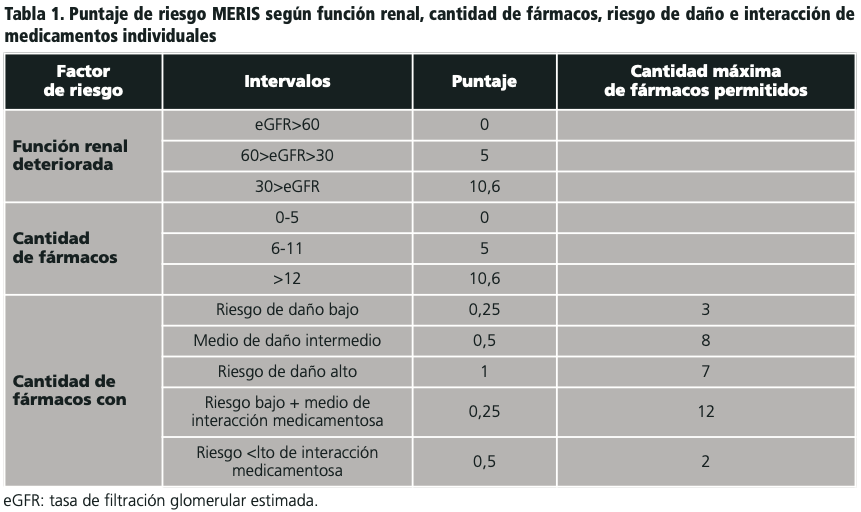
Con una metodología secuencial de cinco pasos (búsqueda bibliográfica, proceso Delphi, construcción del algoritmo, calibración del algoritmo, estudio piloto prospectivo), Saedder et al., desarrollaron, validaron y probaron la puntuación MERIS (Medication Risk Score) en un entorno clínico prospectivo. Las puntuaciones se ponderaron y se resumieron en un puntaje final con pacientes clasificados de bajo riesgo si la puntuación es <14 y pacientes de alto riesgo si la puntuación es >14. Su objetivo era medir la viabilidad y la relevancia clínica de las revisiones farmacoterapéuticas en pacientes marcados como de alto riesgo según MERIS. El estudio concluyó que esta herramienta cumplió con los objetivos propuestos5,6.
Las variables incluidas en la puntuación final del MERIS para categorizar a los pacientes de riesgo se muestan en la tabla 1.
Objetivos de nuestro estudio
• Probar el algoritmo MERIS y su aplicabilidad en nuestra rutina farmacéutica diaria en la Unidad de Accidente Cerebrovascular del Hospital Sousa Martins en Guarda, Portugal.
• Registrar las puntuaciones de los pacientes y determinar el porcentaje de pacientes de alto riesgo.
• Determinar mediante un análisis estadístico cuál de las variables del algoritmo MERIS tiene una correlación más significativa con puntuaciones más altas.
MÉTODOS
Entre los meses de enero y febrero de 2019, aplicamos el algoritmo MERIS en la Unidad de Accidente Cerebrovascular (ACV) del Hospital Sousa Martins de Guarda, Portugal. La unidad consta de una sala de 8 camas con un total de 16 pacientes tratados en enero de 2019 y 17 pacientes en febrero de 2019.
Se registró el sexo, la edad y el puntaje MERIS (con su respectiva cuantificación por variable). Además, realizamos un análisis estadístico utilizando el programa SPSS para correlacionar todas las variables del algoritmo MERIS con la puntuación real obtenida. La prueba seleccionada para este fue el análisis de correlación Rô de Spearman para las variables. La muestra incluyó un total de 65 informes MERIS de los cuales solo 15 tenían la puntuación sin ningún otro dato de las variables del algoritmo.
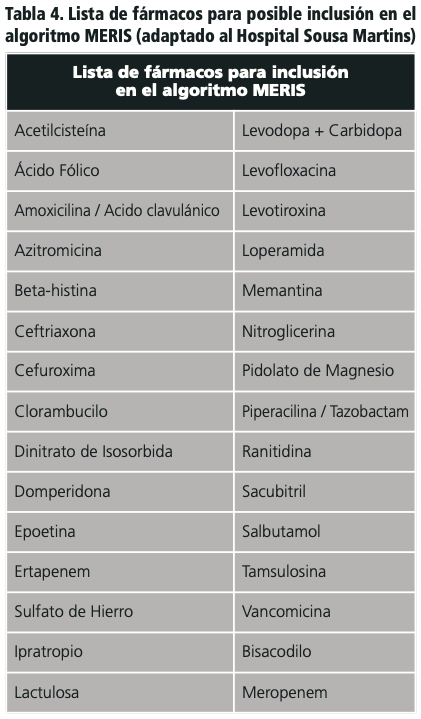
Además, analizamos la primera lista de fármacos propuesta para el algoritmo MERIS y encontramos varios fármacos en stock y de uso en nuestro hospital que no estaban incluidos en el estudio3.
RESULTADOS
En este estudio se analizaron un total de 50 informes MERIS correctamente completados. En la tabla 2 se muestran los datos ordenados en porcentajes para cada variable del algoritmo y puntuación obtenida.
En cuanto al análisis estadístico, se realizó una correlación de Spearman para evaluar la relación entre el Puntaje MERIS y cada una de las variables del algoritmo (función renal reducida, número de fármacos, fármacos con bajo riesgo de daño, fármacos con riesgo medio de daño, medicamentos con alto riesgo de daño, medicamentos con riesgo de interacción bajo a medio y medicamento con alto riesgo de interacción). Las evaluaciones preliminares para el análisis de correlación mostraron que todas las variables comparadas con la puntuacion de MERIS presentan relaciones de tipo monótonicas, según se evaluó mediante la inspección visual de los diagramas de dispersión que se muestran en los Anexos I al VII.
La tabla 3 muestra correlaciones positivas fuertes y estadísticamente significativas entre el puntaje de Meris y: función renal reducida, rs (763) = 0,534, p<0,0005; número de fármacos, rs (763) = 0,788, p<0,0005; número de fármacos con bajo riesgo de daño, rs (763) = 0,438, p<0,0005; número de fármacos con riesgo medio de daño, rs (763) = 0,764, p<0,0005; número de fármacos con alto riesgo de daño, rs (763) = 0,584, p<0,0005; y número de fármacos con riesgo de interacción bajo a medio, rs (763) = 0,833, p<0,0005.

Además, no hubo una correlación estadísticamente significativa entre el puntaje MERIS y el número de fármacos con alto riesgo de interacción rs (763) = -0,002, p<0,951.
El estudio de Saedder et al., propuso una lista a nivel local de cuarenta medicamentos y/o clases de medicamentos que causaron errores de medicación graves. En la tabla 4 se muestra una lista modificada que se ajusta mejor a la realidad del Hospital Sousa Martins de Guarda3.
DISCUSIÓN
El algoritmo Meris desarrollado por Saedder et al., basado en una exhaustiva revisión sistemática y mediante la opinión de expertos utilizando ponderaciones teóricas (Método Delphi) demostró su aplicabilidad en un entorno clínico agudo. Los factores relacionados a cada fármaco en el algoritmo MERIS se midieron en función de la toxicidad y las posibles interacciones fármaco-fármaco. En consecuencia, un mayor enfoque en los pacientes de alto riesgo podría reducir potencialmente el número y la duración de las hospitalizaciones; las complicaciones; y las condiciones que amenazan la vida y/o causan la muerte5.
A partir de nuestra propia experiencia en la Unidad de Atención de Accidentes Cerebrovasculares del Hospital Sousa Martins, encontramos que, de los 50 informes analizados, el 63,47% de la muestra era de alto riesgo, lo que significa que sus puntuaciones eran superiores a 14; más de la mitad de los informes no contaron ningún punto por función renal reducida y todos los pacientes tenían más de 6 fármacos en el momento de la admisión. Nuestro análisis de correlación de Spearman mostró correlaciones fuertes y estadísticamente significativas de la puntuación MERIS para todas las variables del algoritmo, excepto para el número de fármacos con alto riesgo de interacción.
Encontramos que la mayoría de los pacientes tenían entre cinco y doce fármacos con algún nivel de interacción y, contrariamente a nuestra premisa inicial, la función renal reducida y el número de fármacos con alto riesgo de daño no fueron mejor puntuados en este análisis. La correlación más fuerte de este análisis es el número de medicamentos con riesgo de interacción bajo a medio lo que indica un posible efecto sumatorio de los medicamentos que no se consideran potencialmente peligrosos, no obstante, su uso combinado aumenta el riesgo en la salud general del paciente. Adicionalmente, la tercera correlación más fuerte también involucra medicamentos con un daño de riesgo medio lo cual suma al problema en cuestión7.
Esto último puede justificar la necesidad de revisiones de medicamentos organizadas por el farmacéutico enfocadas en dosis, duración de la terapia, interacciones medicamentosas, medicamentos inapropiados y duplicación terapéutica. Lo anterior puede llevar a posibles recomendaciones en la terapéutica como: detener, agregar, reducir, aumentar, pausar y/o cambiar el tiempo de administración de un fármaco7-9.
Es con este tipo de iniciativas de gestión de medicamentos centradas en el paciente que los sistemas de salud pueden mejorar la adherencia a los medicamentos por parte del paciente y la gestión de la calidad del uso de medicamentos, aumentando así el valor de los farmacéuticos en un entorno clínico como proveedores de atención médica de alta calidad7-9.
En cuanto a la tabla 4, la lista original de fármacos del algoritmo MERIS no incluía algunos medicamentos habituales en nuestro Hospital y la Unidad de Accidentes Cerebrovasculares. Dado que el estudio piloto original se realizó en Dinamarca y los hospitales portugueses tienen sus propios recursos y flujo de trabajo, buscamos incorporar una lista de medicamentos adicionales en función de su nivel de interacción y daño potencial de acuerdo con la investigación en nuestras bases de datos3.
CONCLUSIONES
Nuestra experiencia con el algoritmo MERIS en el Hospital Sousa Martins de Guarda, Portugal, mostró una gran aplicabilidad en una unidad ACV, con una integración adecuada e intuitiva en el flujo de trabajo diario. Se logró recopilar información de los pacientes y determinar un mayor porcentaje de pacientes con alto riesgo de errores de medicación según el algoritmo.
Además, el análisis de correlación de Spearman determinó fuertes asociaciones entre la puntuación del algoritmo y el número de fármacos con riesgo de interacción bajo a medio, lo que indica que una intervención farmacéutica (como la revisión de medicamentos dirigidas por farmacéuticos) puede ser relevante, significativa y oportuna.
Sería interesante para futuras experiencias en hospitales portugueses, incluido el nuestro, medir la viabilidad de implementar el algoritmo MERIS y las revisiones de medicamentos en pacientes de alto riesgo. De esta manera, ayudar a determinar qué tipo de errores de medicación son los más comunes; qué medicamentos tienen más probabilidades de producir errores de medicación; tipos de recomendaciones dadas después de la revisión; y qué recomendaciones fueron aceptadas por el personal médico.
Finalmente, creemos que los análisis de correlación pueden variar entre las distintas unidades hospitalarias y sus pacientes; permitiendo aplicar esta misma metodología para determinar cuál variable tiene el efecto más significativo en las puntuaciones de riesgo de errores de medicación y posibles revisiones de tratamiento.
Conflicto de intereses: Los autores declaran no tener conflicto de intereses.
BIBLIOGRAFÍA
1. Chen Y, Wu X, Huang Z, Lin W, Li Y, Yang J, et al. Evaluation of a medication error monitoring system to reduce the incidence of medication errors in a clinical setting. Res. Soc. Adm. Pharm. 2019;15(7):883-8.
2. Chen CC, Hsiao FY, Shen LJ, Wu CC. The cost-saving effect and prevention of medication errors by clinical pharmacist intervention in a nephrology unit. Medicine. 2017;96(34):1-5.
3. Saedder EA, Brock B, Nielsen LP, Bonnerup DK, Lisby M. Classification of drugs with different risk profiles. Dan Med J. 2015;62(8).
4. Saedder EA, Lisby M, Nielsen LP, Bonnerup DK, Brock B, Allé M. Number of drugs most frequently found to be independent risk factors for serious adverse reactions: a systematic literature review. British Journal of Pharmacology. 2015; 80(4): 808-817.
5. Krogsgaard Bonnerup D, Lisby M, Eva, Saedder A, Charlotte, Sørensen A, et al. Risk of prescribing errors in acutely admitted patients: a pilot study. Int J Clin Pharm. 2016;38:1157-63.
6. Saedder EA, Lisby M, Nielsen LP, Rungby J, Andersen LV, Bonnerup DK, et al. Detection of Patients at High Risk of Medication Errors: Development and Validation of an Algorithm. Basic Clin Pharmacol Toxicol. 2016;118(2):143-9.
7. Brulhart MI, Joel, Wermeille P. Multidisciplinary medication review: evaluation of a pharmaceutical care model for nursing homes. Int J Clin Pharm. 2011;33:549-57.
8. Mcmullen CK, Safford MM, Bosworth HB, Phansalkar S, Leong A, Fagan MB, et al. Patient-centered priorities for improving medication management and adherence. Patient Education and Counseling. 2015;98:102-110.
9. Watkins JL, Landgraf A, Barnett CM, Michaud L. Evaluation of pharmacist-provided medication therapy management services in an oncology ambulatory setting. J Am Pharm Assoc. 2012;52(2):170.4.
____