Gómez Valbuena I, Cortijo Cascajares S, Alioto D, Goyache Goñi MP, Ferrari Piquero JM
Servicio de Farmacia. Hospital Universitario 12 de Octubre. Madrid (España)
Resumen
Objetivo: Analizar la efectividad del uso combinado de los anticuerpos (Ac) monoclonales y quimioterapia frente a la quimioterapia en cáncer colorrectal, describir y comparar la utilización de los Ac monoclonales autorizados con las distintas guías de expertos.
Métodos: Se realizó un estudio retrospectivo observacional durante un año, en el que se incluyeron todos los pacientes que iniciaron tratamiento quimioterápico intravenoso con cáncer colorrectal. De estos se recogieron las siguientes variables: edad, sexo, localización y estadio de la enfermedad, tipo de gen K-RAS, y los esquemas quimioterápicos que se les prescribieron en las distintas líneas del tratamiento, separándolos según si habían recibido o no Ac monoclonales.
Resultados: Durante el periodo de tiempo en el que se desarrolló el estudio iniciaron tratamiento quimioterápico intravenoso 81 pacientes. En 25 de estos pacientes se prescribió uno o varios anticuerpos monoclonales. Todos se encontraban en fase metastásica de la enfermedad.
Tanto la mediana de duración del tratamiento como la mediana del número de ciclos recibidos en primera línea con Ac monoclonales fue mayor que en aquellos pacientes que únicamente recibieron quimioterapia.
De los 22 pacientes que recibieron bevacizumab, en 16 pacientes se usó en primera línea; 3 pacientes lo recibieron en segunda línea; 2 en tercera línea, y 1 paciente lo recibió en cuarta línea. El 55,6% tenía el gen K-RAS nativo.
Tanto en el grupo de los pacientes con cetuximab como en el de panitumab hubo 3 pacientes, en ambos casos a 2 pacientes se le administró en primera línea, y 1 paciente en segunda. Todos estos pacientes presentaban el gen K-RAS nativo.
Conclusiones: Basándonos en nuestros resultados, podemos afirmar que el uso combinado de Ac monoclonales con quimioterapia aumenta el tiempo hasta la progresión de la enfermedad frente a los pacientes que no reciben Ac monoclonales. También podemos afirmar que en nuestro Hospital se siguen las pautas recomendadas por la mayoría de las guías.
Palabras clave: Anticuerpos monoclonales, cáncer colorrectal.
Analysis of the use of monoclonal antibodies in colorectal cancer
SUMMARY
Objetive: Analyze the effectiveness of the combined use of antibodies (Ab) and monoclonal chemotherapy versus chemotherapy in colorectal cancer, describe and compare the use of monoclonal Ac authorized various expert guides.
Material and methods: A retrospective observational study was conducted over a year, in which all colorectal cancer patients who began treatment with intravenous chemotherapy were included. Of these patients were collected the following variables: age, sex, location and stage of disease, type K-RAS gene and diagrams of chemotherapy were prescribed in different lines of treatment, separating them according to whether they had received or not some Ac monoclonal.
Results: During the period in which it developed the study began chemoteherapeutic intravenous treatment 81 patients. In 25 of these patients was prescribed one or more monoclonal antibodies. All patients were in metastatic stage of the disease.
Both the median duration as the median number of cycles received frontline with monoclonal Ab was higher than in those patients who received only chemotherapy.
Of the 22 patients who received bevacizumab in 16 patients was used in the first line; 3 patients received it in second line; 2 in third line, and 1 patient received it in fourth line. 55.6% had native K-RAS gene.
Both in the group of patients with cetuximab as with panitumab there were 3 patients, in 2 patients were administered in first line, and in 1 patient at second. All these patients had the K-RAS native gene.
Conclusions: Based on our results, we found that the combined use of monoclonal Ac with chemotherapy increases time to disease progression compared with patients not receiving monoclonal Ab. We can also say that recommended by most guidelines are followed in our Hospital.
Key Words: Monoclonal antibodies, colorectal cancer.
____
Descargue aqui el artículo en PDF: Análisis del uso de anticuerpos monoclonales en cáncer colorrectal metastático
Artículo dentro del número: VOL. 25 – Nº2 – 2015
____
Introducción
El cáncer colorrectal es el tercer cáncer en incidencia y el segundo en mortalidad en Estados Unidos1. La tasa de mortalidad de este tipo de cáncer ha ido disminuyendo tanto en hombres como en mujeres durante más de 20 años. Probablemente esta disminución se debe a diversos factores, como la existencia de programas de cribado cada vez más específicos, a que los pólipos detectados con estos son extirpados antes de que se transformen en tumores y al tratamiento temprano de la enfermedad2.
El cáncer colorrectal se estratifica por estadios, que determinan el pronóstico y las recomendaciones de tratamiento. El sistema de estratificación que se usa actualmente es el del American Joint Committee on Cancer (AJCC), también conocido como el sistema TNM3,4. Este sistema se divide en tres piezas claves:
- La letra T describe lo lejos que el tumor primario ha crecido hacia la pared del intestino y si ha crecido hacia las áreas adyacentes.
- La letra N describe la extensión de la propagación a los ganglios (nódulos) linfáticos regionales.
- La M indica si el cáncer se ha propagado (ha producido metástasis) a otros órganos del cuerpo.
A parte cada letra va seguida de un número que provee de más información. Estos números van del 1 al 4, indicando la gravedad en orden ascendente. Cuando no se puede valorar la gravedad por falta de información, estas letras van seguidas de la letra X4 (Tabla 1).
Posteriormente estas categorías se pueden agrupar en estadios más extensos que van desde el estadio I al IV.
El tratamiento de elección para el estadio I (T1/2N0M0) es la cirugía. En el estadio II (T3/4N0M0) el procedimiento quirúrgico puede ser el único tratamiento, aunque si existen factores de mal pronóstico, como afectación del margen radial, grado histológico G3-G4, bordes quirúrgicos y tumor residual, se debe asociar quimioterapia adyuvante. En enfermedad en estadio III (TcualquieraN1/2M0) se aconseja un tratamiento combinado (cirugía y quimioterapia). Mientras que en el estadio IV (Tcualquiera/Ncualquiera/M1) la quimioterapia es la mejor opción terapéutica4.
Respecto al tratamiento quimioterápico existen distintas alternativas, por ejemplo prescribir únicamente agentes quimioterápicos, un anticuerpo (Ac) monoclonal en monoterapia, o la combinación de las dos alternativas.
Se sabe que existen alteraciones moleculares, las cuales predisponen a los pacientes que las padecen a sufrir este tipo de enfermedad, los genes más habituales donde se dan estas mutaciones son el gen APC, el gen TGFBR2, el gen BAX, el gen BRAF5,6.
Además estas alteraciones moleculares también están relacionadas con el pronóstico de la enfermedad, y con la tasa de respuesta a distintas terapias. Es el caso del estado de mutación del gen K-RAS, el cual sirve como factor predictivo de la respuesta o no a terapias específicas frente al receptor del factor de crecimiento epidérmico (EGFR), como son los Ac monoclonales Cetuximab y Panitumumab5-7.
Los fármacos anti-EGFR son útiles únicamente en pacientes cuya enfermedad presente el gen K-RAS wild type (nativo), pero el descubrimiento del gen N-RAS, ha servido para ampliar esta información, ya que estudios posteriores han demostrado que los pacientes con el gen K-RAS y N-RAS en estado nativo responden mejor a la terapia en primera línea con los Ac monoclonales anti-EGFR8. Esto ha hecho que la Asociación Europea del Medicamento (EMA) restrinja el uso de los Ac monoclonales anti-EGFR en pacientes con el estado nativo de los dos genes anteriormente nombrados, recomendando la determinación del estado de mutación de estos genes antes de iniciar tratamiento con la terapia biológica. Hay que tener en consideración que la mutación del gen K-RAS, presente en el 40% de los casos de cáncer colorrectal, es más frecuente que la mutación en el gen N-RAS, solo presente en el 3-5% de los casos9.
En 2005 se autorizó el primer Ac monoclonal para el cáncer colorrectal metastásico, bevacizumab, cuyo mecanismo de acción es unirse de forma selectiva al factor de crecimiento del endotelio vascular (VEGF), e inhibir el crecimiento de los vasos sanguíneos de las células tumorales impidiendo que le lleguen nutrientes y oxígeno.
El objetivo de este estudio es analizar la efectividad del tratamiento combinado con Ac monoclonales junto con la quimioterapia, frente a quimioterapia sola. También se analiza la utilización de los Ac monoclonales autorizados para cáncer colorrectal metastásico en un hospital de tercer nivel.
Material y Métodos
Se realizó un estudio retrospectivo observacional durante un año (desde enero 2013 hasta diciembre 2013), en el que se incluyeron todos los pacientes con cáncer colorrectal que iniciaron con tratamiento quimioterápico intravenoso. De todos ellos se recogieron los siguientes datos: la edad, el sexo, la localización de la enfermedad, estado del gen K-RAS (mutado o nativo), los esquemas de quimioterapia en las distintas líneas, duración del tratamiento y número de ciclos que recibieron en cada línea, y las reacciones adversas más importantes. Los datos se obtuvieron de la Historia Clínica Electrónica del paciente, y del programa de prescripción Oncofarm®. Para su análisis se utilizó el programa informático Microsoft Excel®.
Posteriormente se compararon los datos recogidos de los pacientes que habían recibido algún Ac monoclonal con los datos de los pacientes que no habían recibido ninguno. También se analizó la utilización de los Ac monoclonales con las recomendaciones de las distintas guías (guía NCCN, guía ESMO, y guía NICE) sobre el tratamiento del cáncer colorrectal en estadio metastásico.
Resultados
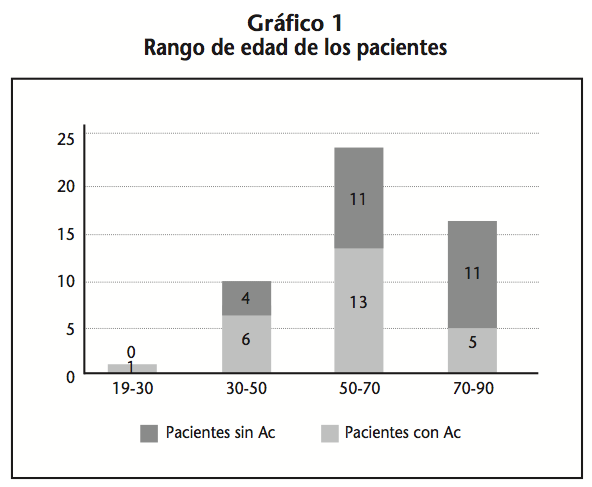
Durante el periodo de tiempo en el que se desarrolló el estudio iniciaron tratamiento quimioterápico intravenoso 81 pacientes con cáncer colorrectal. A los 56 pacientes que no se les prescribió ningún anticuerpo monoclonal, 3 se encontraban en grado II de la enfermedad, 27 en estadio III, y 26 en estadio IV. Todos los pacientes que tenían cáncer colorrectal estadio II o III recibieron quimioterapia adyuvante, por lo que no estaba indicado el uso de Ac monoclonales en ellos. Los pacientes cuya enfermedad estaba en estadio IV y no recibieron ningún Ac monoclonal tenían una mediana de edad de 64 años (rango: de 40 a 84 años) (Gráfico 1). Estos pacientes presentaban la enfermedad en estado muy avanzado, y con una alta comorbilidad. Los esquemas que más pacientes recibieron en primera línea fue XELOX, en un 60% de los pacientes, seguido de TOMOX y FOLFOX. Las reacciones adversas que se observaron en estos pacientes fueron astenia, diarrea, neurotoxicidad, mucositis, etc…
En 25 pacientes se prescribió uno o varios anticuerpos monoclonales (20 pacientes en primera y 5 en líneas posteriores). Todos ellos se encontraban en fase metastásica (estadio IV) de la enfermedad. La mediana de edad fue de 58 años (rango: de 19 a 83 años) (Gráfico 1). La localización más predominante fue el colon en un 48% de los pacientes; la segunda fue el recto, presente en un 28% de los pacientes, seguido por el cáncer localizado en el sigma en un 20%, y por último en el 4% restante de los pacientes se localizaba en el ciego. Estos pacientes presentaban un grado de comorbilidad mucho menor que los pacientes que solo recibieron quimioterapia.
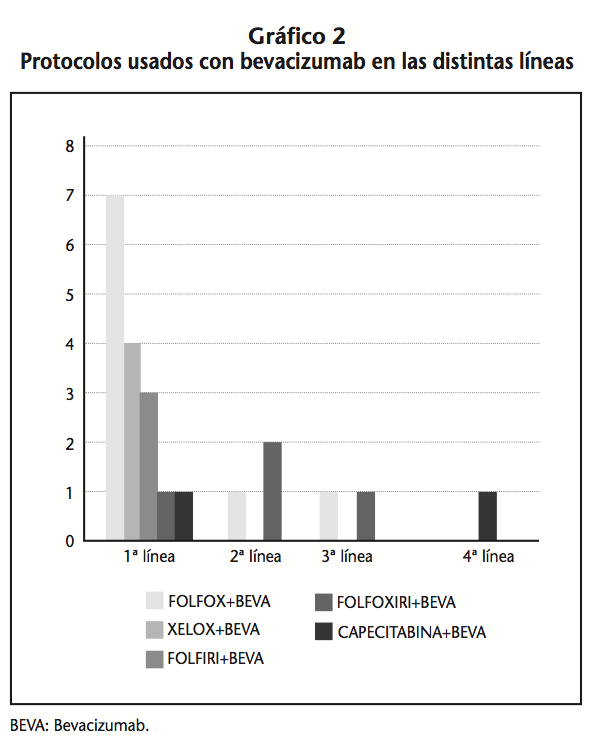
22 pacientes recibieron tratamiento con bevacizumab. En 16 pacientes se usó en primera línea, siendo la asociación con FOLFOX la más frecuente (43,8%), seguida por la combinación con XELOX (25%) y FOLFIRI en un 18,75% de los pacientes; 3 pacientes lo recibieron en segunda línea (dos en combinación con FOLFIRI); 2 en tercera línea, (uno asociado a FOLFOX y el otro a FOLFIRI) y a 1 paciente se le prescribió en cuarta línea junto con Capecitabina (Gráfico 2). El 55,6% tenía el gen K-RAS nativo. De los 22 pacientes que recibieron bevacizumab solo 1 paciente tuvo una reacción adversa al Ac monoclonal, crisis hipertensiva, pero no supuso la retirada del fármaco. A otros 2 pacientes también se le tuvo que retirar el bevacizumab en un ciclo, debido a que este Ac monoclonal retrasa la cicatrización, y los pacientes presentaban heridas graves.
3 pacientes recibieron tratamiento con cetuximab. 2 en primera línea, uno asociado a FOLFIRI y el otro a FOLFOX. El otro paciente recibió en segunda línea el anticuerpo monoclonal junto a FOLFIRI, habiendo recibido previamente FOLFOX+BEVACIZUMAB. Todos los pacientes tuvieron como reacción adversa rash cutáneo, pero no se le retiró el Ac monoclonal, puesto que existen pruebas de que la efectividad de este Ac monoclonal está directamente relacionado con la aparición de este evento.
3 pacientes fueron tratados con panitumumab. 2 de los pacientes fueron tratados en primera línea, uno de ellos asociado a FOLFOX y el otro a FOLFIRI. El otro paciente lo recibió en segunda línea, en combinación con FOLFIRI, tras haber recibido bevacizumab junto a XELOX en primera línea. Dos pecientes tuvieron una reacción dérmica tipo rash, que se relacionó con el Ac monoclonal pero no conllevó la retirada del fármaco.
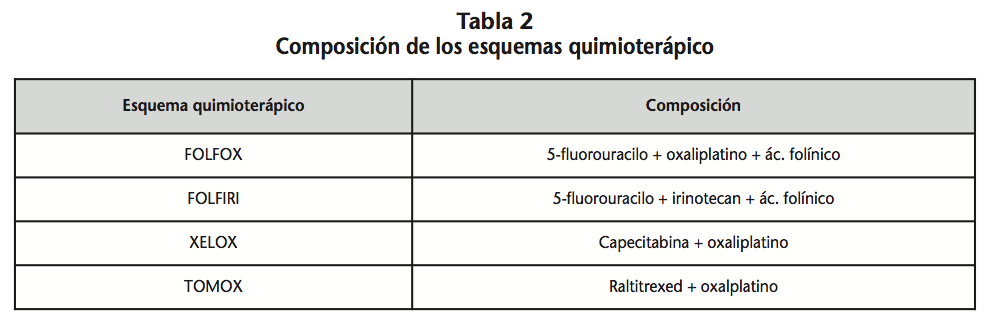
En la tabla 2 se detallan los componentes de cada esquema quimioterapico.
Todos los pacientes que recibieron cetuximab y panitumumab tenían el gen K-RAS nativo.
Los pacientes que recibieron terapia con Ac monoclonales también presentaron reacciones adversas relacionadas con la quimioterapia, como por ejemplo: astenia, neutropenia, mucositis, neurotoxicidad y diarrea. Tanto en los pacientes con Ac monoclonales como en los que no recibieron terapia biológica el fármaco que en más pacientes se tuvo que retirar fue el oxiplatino por la neurotoxicidad que produjo en los pacientes.
Si nos centramos en los pacientes con enfermedad en estadio IV, y comparamos la mediana de duración de tratamiento en primera línea de los 20 pacientes que habían recibido algún Ac monoclonal (7,5 meses) observamos que fue mayor respecto la mediana de duración de tratamiento de los 26 pacientes que no recibieron ningún Ac monoclonal en ninguna línea (5 meses). Lo mismo ocurrió con la mediana de número de ciclos para dichos pacientes, 11,5 ciclos en los pacientes con Ac monoclonales frente a 7 ciclos de los que solo recibieron quimioterapia. Respecto al resto de líneas no se pudieron analizar al no ser comparable el tamaño muestral.
Discusión
Al comparar la efectividad de los tratamientos basados en Ac monoclonales con los que no, observamos que los resultados son concordantes con las publicaciones10-12 realizadas hasta el momento donde el uso de Ac monoclonales refleja un aumento en el tiempo hasta la progresión de la enfermedad frente a la quimioterapia sola. Al igual que también coinciden nuestros resultados de toxicidad con la bibliografía, ya que la terapia biológica fue bien tolerada, sin ser la causa de retirada o de retraso en el tratamiento.
En nuestro estudio el bevacizumab es el Ac monoclonal que más se ha prescrito en primera línea, en estadio IV de cáncer colorrectal. Esto puede ser debido a que fue el primero en ser autorizado en España para esta neoplasia y del cual existe más evidencia. En los pacientes estudiados se siguieron las recomendaciones de la Guía NCCN13 de cáncer de colón y de la guía ESMO14 en primera línea. Estas guías contemplan la posibilidad de usar la combinación en primera línea de bevacizumab junto con FOLFOX, XELOX, o FOLFIRI, o bien con capecitabina, capeOX, o 5-FU. En cuanto al tratamiento en segunda línea la prescripción en nuestros pacientes se adecuó a la guía NCCN13, que aconsejan el uso de todas las combinaciones mencionadas pero no a la guía ESMO14, que solo recomienda el uso de bevacizumab junto con FOLFOX en segunda línea.
El uso de cetuximab tanto en primera como en segunda línea siguió en todos los casos las recomendaciones de la Guía ESMO14, que permite el uso de este Ac monoclonal junto a FOLFOX, FOLFIRI o irinotecan, pero no las de la guía NCCN13.
La prescripción en los pacientes que recibieron panitumumab sí se ajustó tanto a las recomendaciones de la Guía NCCN13 como a las de la guía ESMO14 tanto en primera línea como en segunda, ya que estas dos aconsejan su uso en primera línea en combinación con FOLFOX, o FOLFIRI y junto a FOLFIRI o irinotecan, en segunda línea.
La guía NICE15 no recomienda el uso de bevacizumab ni de panitumumab en ninguna línea de tratamiento, respecto al cetuximab solo permite su uso en primera línea y en combinación con FOLFOX o FOLFIRI. Cabe destacar que esta guía15 no es una guía de uso clínico clásico, sino que es un método del sistema sanitario público británico para evaluar la relación coste-efectividad de los distintos fármacos. Por eso esta guía no recomienda el uso de Ac monoclonales debido a que no existen evidencias científicas que demuestren beneficios claros que justifiquen el alto coste de la terapia con estos fármacos. Teniendo en cuenta las estrictas recomendaciones de esta guía, nuestro estudio solo cumpliría con ella en el uso de cetuximab en primera línea.
Conclusión
La adición de los Ac monoclonales a la quimioterapia estándar contribuye a un aumento en el tiempo hasta progresión de la enfermedad en pacientes diagnosticados de cáncer colorrectal en estadio IV, tal y como refleja nuestro estudio y la revisión bibliografía realizada. Al igual que también se puede concluir que son fármacos con un grado de tolerancia razonable.
La experiencia de uso de anticuerpos monoclonales en cáncer colorrectal en nuestra muestra de pacientes permite concluir que estos fármacos se usan en estadio IV de la enfermedad y en pacientes con una edad no excesivamente avanzada y un estado de salud mejor que los pacientes que no reciben terapia basada en la combinación con Ac monoclonales. Al igual que también podemos decir que se prescriben con un alto nivel de adecuación en cuanto a línea de tratamiento y combinaciones a lo recomendado en las Guía NCCN y ESMO, pero con una utilización muy alejada de lo recogido en la guía NICE.
Una de las debilidades que presenta nuestro estudio es que no pudimos analizar la eficacia de la determinación del gen N-RAS, ya que en las historias clínicas de los pacientes no se hacía referencia al estado de mutación de dicho gen en el periodo durante el que se realizó el estudio.
Conflicto de intereses: Los autores declaran no tener conflictos de intereses.
BibliografÍa
- American Cancer Society: Cáncer Colorrectal [Acceso en Marzo 2014]. Disponible en: http://www.cancer. org/acs/groups/cid/documents/webcontent/002290-pdf.pdf.
- López Torres G, Hernández Carmona A. Cribado del cáncer colorrectal. AMF. 2010;6(6):338-345.
- American Cancer Society. Cáncer Colorrectal. Detección temprana, diagnóstico, y clasificación por etapas. [Acceso Diciembre 2014]. Disponible en: http://www. cancer.org/espanol/cancer/colonyrecto/guiadetallada/cancer-colorrectal-early-staged.
- Kim DH, Pickhardt PJ. Cáncer colorrectal: estadificación, tratamiento, y prónostico. En: Colonografia por TC: Principios y práctica de la colonoscopia virtual + DVD. Edición en español de la primera edición de la obra original en inglés: CT Colonography: Principies and practice of virtual colonoscopy. Barcelona: Elseiver; 2011. pags 33-43.
- Perea J, Lomas M, Hidalgo M. Bases moleculares del cáncer colorrectal: ¿Hacia un manejo individualizado? Rev Esp Enferm Dig. 2011;103(1):29-35.
- Sanford D, Markowitz MD, Monica M, Bertagnolli, MD. Molecular Origins Cancer: Melocular Basis of Colorectal Cancer. N Engl J Med. 2009;361(25):2449-2460.
- Jimeno A, Messersmith WA, Hirsch FR, Franklin WA, Eckhardt SG. KRAS mutations and Sensitivity to Epidermal Growth Factor Receptor Inhibitors in Colorectal Cancer: Practical Application of Patient Selection. J Clin Oncol. 2009;27(7):1130-1136.
- Hendifar A, Tan CR, Tuli R. Biomarker-driven EGFR therapy improves outcomes in patients with metastatic colorectal cancer. Expert Rev. Anticancer Ther. 2014; 14(9):1051-1061.
- Schirripa M, Cremolini C, Loupakis F, Morvillo M, Bergamo F, Zoratto F, et al. Role of NRAS mutations as prognostic and predictive markers in metastatic colorectal cancer. Int J Cancer. 2015 Jan;136:83-90.
- Michl M, Holtzem B, Koch J, Moosmann N, Holch J, Hiddemann W, et al. Metastatic colorectal cancer–analysis of treatment modalities and survival now and then. Dtsch Med Wochenschr. 2014 Oct;139(41): 2068-72.
- Kirstein MM, Lange A, Prenzler A, Manns MP, Kubicka S, Vogel A. Targeted therapies in metastatic colorectal cancer: a systematic review and assessment of currently available data. Oncologist. 2014 Nov;19(11):1156-68.
- Bekaii-Saab T, Wu C. Seeing the forest through the trees: A systematic review of the safety and efficacy of combination chemotherapies used in the treatment of metastasic colorectal cancer. Crit Rev Oncol/Hematol. 2014;91(1):9-34.
- NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines) Colon Cancer. Version 3. 2014, 27/01/2014.
- Van Cutsem E, Cervantes A, Nordlinger B, Arnold D. Metastasic Colorectal Cancer: ESMO clinical practice guidelines. Ann Oncol. 2014;25 (suppl 3): iii1-iii9.
- Guía NICE (Managing Advanced and Metastatic Colorectal Cáncer). Agosto 2013.