Rev. OFIL 2017, 27;2:171-178
Fecha de recepción: 16/05/2016 – Fecha de aceptación: 26/10/2016
Pérez-Diez C1, Navarro-Aznárez H1, Lou-Arnal LM2, Abad Sazatornil MR1
1 Servicio de Farmacia
2 Servicio de Nefrología
Hospital Universitario Miguel Servet. Zaragoza (España)
____
Correspondencia:
Cristina Pérez Diez
Hospital Universitario Miguel Servet
(Servicio de Farmacia)
Pº Isabel la Católica, 1-3
50009 Zaragoza
Correo electrónico: cperezd9@gmail.com
____
Resumen
Objetivos: Determinación de la dosis media de epoetina β y darbepoetina α para alcanzar niveles de hemoglobina (Hb) entre 10,0-12,5 g/dl en pacientes en prediálisis y análisis de los factores implicados en la respuesta.
Métodos: Estudio observacional retrospectivo. Se incluyeron pacientes con ERC que iniciaron tratamiento con AEEs entre enero-diciembre 2013. Periodo de seguimiento: 6 meses. Variables recogidas: demográficas; datos analíticos al inicio, 3 y 6 meses; comorbilidades, AEE dispensado y tratamientos farmacológicos. Fuente de datos: historia clínica y farmacoterapéutica (Farmatools®).
Resultados: 81 pacientes. Características medias basales: 59,3% hombres, 74 años (30-88), estadio 3 (29,7%), 4 (57,8%) y 5 (12,5%); Hb 10,13±1,16 g/dl; 40,7% recibieron epoetina β (dosis media semanal: 7.718,18±6.155,72 UI) y 59,3% darbepoetina α (dosis media semanal: 20,55±10,30 µg). El nivel de Hb aumentó a los 3 meses de tratamiento (incremento medio 1,52 g/dl, p<0,001) y 6 meses (1,60 g/dl, p<0,001); también aumentó el hematocrito (4,82 g/dl, p<0,001) y (5,08 g/dl, p<0,001) respectivamente. A los 3 meses, el 53,1% de los pacientes presentaban Hb 10,0-12,5 g/dl. Dosis medias semanales para alcanzar la Hb objetivo: 6.875,0 UI de epoetina β y 20,4 μg de darbepoetina α, lo que representa una relación entre ambas dosis: 337:1. Ser exfumador (p=0,004), padecer IC (p=0,006), recibir IECAs (p=0,043) y epoetina β (p=0,003) son factores que disminuyen la respuesta.
Conclusiones: A los 3 meses, el 50% de los pacientes obtienen respuesta con una relación de dosis entre epoetina β y darbepoetina α de 300 UI/1µg.
Palabras clave: Anemia, epoetina-β, darbepoetina-α, insuficiencia-renal-crónica, prediálisis.
____
INTRODUCCIÓN
La anemia, definida por la Organización Mundial de la Salud (OMS)1 como una concentración de hemoglobina (Hb) <13,0 g/dl en hombres adultos y mujeres postmenopáusicas y Hb <12,0 g/dl en mujeres premenopáusicas, es una complicación frecuente de la enfermedad renal crónica (ERC) asociada con otras complicaciones clínicas, mayoritariamente de origen cardiovascular2. Casi el 90,0% de los pacientes con un filtrado glomerular (FG) <25-30 ml/min tienen anemia, muchos de ellos con un nivel de Hb <10 g/dl3.
La anemia asociada a ERC es habitualmente normocítica, normocrómica y de origen multifactorial. La principal causa es la deficiencia en la producción de eritropoyetina (EPO) endógena y la disminución de la vida media de los hematíes4.
Los agentes estimulantes de la eritropoyesis (AEEs) incrementan los niveles de Hb permitiendo reducir el número de transfusiones necesarias de forma significativa5. Los AEEs actualmente disponibles en Europa para uso clínico son epoetina β (autorizada por la European Medicine Agency (EMA) en 1997), darbepoetina α (2001), metoxi-polietilenglicol epoetina β (2007) epoetina α y epoetina delta (2008), epoetina zeta (2009). Los AEEs que se están utilizando en el sistema sanitario de nuestra Comunidad tras la adjudicación por concurso son darbepoetina α y epoetina β.
Se define Hb objetivo como el valor clínicamente óptimo según las características de cada paciente. Las guías de la Kidney Disease: Improving Global Outcomes (KDIGO) de 20126 recomendaron iniciar el tratamiento con AEEs en prediálisis si la Hb ≤10 g/dl ó incluso antes según los riesgos y la sintomatología del paciente. Las guías de la Nacional Kidney Foundation (NKF) Dialysis Outcomes Quality Initiative (DOQI) para el manejo de la anemia asociada a ERC se publicaron por primera vez en 19977, con revisiones en 20018 y 20069. La actualización del 200710 recomendaba niveles de Hb entre 11,0 g/dl-12,0 g/dl sin sobrepasar nunca los 13,0 g/dl, mientras que las guías NKF- KDOQI del 20018 no establecían ningún límite superior en los niveles de Hb. Las guías KDIGO6 2012 recomendaban en general no utilizar AEEs para mantener concentraciones de Hb >11,5 g/dl y las guías europeas11 niveles de Hb >11,0 g/dl en prediálisis. Las fichas técnicas de epoetina β12 y darbepoetina α13 recomiendan empezar el tratamiento con AEEs en prediálisis sólo cuando la Hb <10 g/dl y mantener niveles de Hb entre 10,0 g/dl-12,0 g/dl, debido al aumento del riesgo de fallecimiento y de acontecimientos cardiovasculares o cerebrovasculares graves observados, incluido el infarto.
Entre las causas de resistencia al tratamiento con AEEs destacan el déficit absoluto o funcional de los depósitos corporales de hierro14; las pérdidas sanguíneas; procesos como la inflamación, infección o neoplasia; deficiencias vitamínicas y nutricionales; fármacos inhibidores del sistema renina-angiotensina-aldosterona (SRAA): IECAs y ARAII,; e incumplimiento terapéutico. Los pacientes con insuficiencia cardiaca (IC) tienen un índice de resistencia a la EPO (IRE) aumentado15.
Los objetivos que nos planteamos en el estudio fueron:
1. Evaluar la efectividad y seguridad de epoetina β y darbepoetina α en la ERC.
2. Determinar la dosis media para alcanzar niveles de Hb adecuados y la relación entre la dosis de epoetina β y darbepoetina α.
3. Estudiar los factores que pueden influir en la respuesta a dichos AEEs.
MÉTODOS
Diseño del estudio: Estudio observacional retrospectivo.
Criterios de inclusión: Se incluyeron pacientes de ambos sexos, mayores de 18 años, con ERC en prediálisis, que iniciaron tratamiento con AEEs entre el 1 de enero y el 31 de diciembre de 2013.
Criterios de exclusión: Se excluyeron pacientes en terapia renal sustitutiva (TRS), trasplantados renales, así como aquellos con datos incompletos en su historia clínica o en los que no fue posible completar el seguimiento.
Fuentes de datos: Programa de dispensación a pacientes externos de la base de datos informatizada del Servicio de Farmacia (SF) (Farmatools®) y sistema informatizado de historias clínicas del hospital.
Variables recogidas:
– Sexo, edad, comorbilidades (HTA, diabetes mellitus (DM), enfermedad pulmonar obstructiva crónica (EPOC), dislipemia, IC, hiperuricemia, tratamientos farmacológicos concomitantes, obesidad (definida por índice de masa corporal (IMC) ≥30), consumo habitual de alcohol (>40 g de etanol/día en varones y >24 g de etanol/día en mujeres) y tabaquismo.
– Estadio de ERC según la clasificación K/DOQI16. El FG estimado se determinó por la fórmula four-variable Modification of Diet in Renal Disease-(MDRD-4)17.
– Datos del tratamiento con AEEs: tipo de AEE (epoetina β ó darbepoetina α), dosis y frecuencia.
– Datos analíticos basales, a los 3 y 6 meses tras el inicio de tratamiento con AAEs: bicarbonato, hierro, ferritina, transferrina, saturación transferrina, glucosa, urea, creatinina, ácido úrico, colesterol, HDL, LDL, albúmina, proteínas, cloro, sodio, potasio, fosfatasa, glutamato-oxalacetato transaminasa (GOT), glutamato-piruvato transaminasa (GPT), Hb, hematocrito, plaquetas, ácido fólico, vitamina B12, hormona paratiroidea (PTH), vitamina D, calcio y fósforo.
Variables generadas: Equivalencia entre epoetina β y darbepoetina α: Relación entre las dosis medias para alcanzar niveles de Hb 10,0-12,5 g/dl, definida como el cociente entre UI de epoetina β: µg de darbepoetina α.
Selección del tipo de AEE: El tipo de AEE de inicio se determinó según decisión del nefrólogo.
Seguimiento: 6 meses posteriores al inicio de tratamiento con AEEs. Al ser un estudio retrospectivo, la analítica no se realizó exactamente a los 3 y 6 meses de tratamiento, resultando ser a los 3,18±1,03 meses y a los 6,57±1,62 meses respectivamente.
Análisis estadístico: Se realizó la estadística descriptiva calculando las proporciones de las variables cualitativas y las medias con sus correspondientes desviaciones estándar en el caso de las variables cuantitativas. Para contrastar las variables cualitativas se aplicó el test de Chi-cuadrado. En el caso de las variables cuantitativas se comprobó si seguían una distribución normal con el test de Kolmogorov-Smirnov. Cuando las variables eran normales y a igualdad de varianzas se compararon las medias utilizando el test de t-Student. En caso contrario se utilizó la prueba no paramétrica U de Mann-Whitney. La comparación de medias se realizó con la prueba t para muestras relacionadas, ya que se trabajaba con variables medidas en los mismos casos en momentos temporales diferentes. El nivel de confianza fijada en las comparaciones fue del 95%, aceptándose como significativas las diferencias con un valor de p≤0,05. El análisis estadístico se realizó con el programa SPSS versión 20.0.
RESULTADOS
De los 103 pacientes en prediálisis que iniciaron tratamiento con AEEs en 2013, se perdieron 22 pacientes: 15 por falta de datos y 7 por no ser posible completar el seguimiento (5 por éxitus y 2 por inicio de TRS). Finalmente, se incluyeron un total de 81 pacientes. El 59,3% varones, edad media de 74±10 años (rango 30-88 años). Los estadios de ERC fueron 3a (24,7%), 3b (5,0%), 4 (57,8%) y 5 (12,5%). El 59,2% de los pacientes recibieron darbepoetina α (dosis media basal: 20,55±10,30 µg/semana (5-50 µg)) y el 41,0% epoetina β (dosis media basal: 7.718,18±6.155,72 UI/semana (500-30.000 UI)).
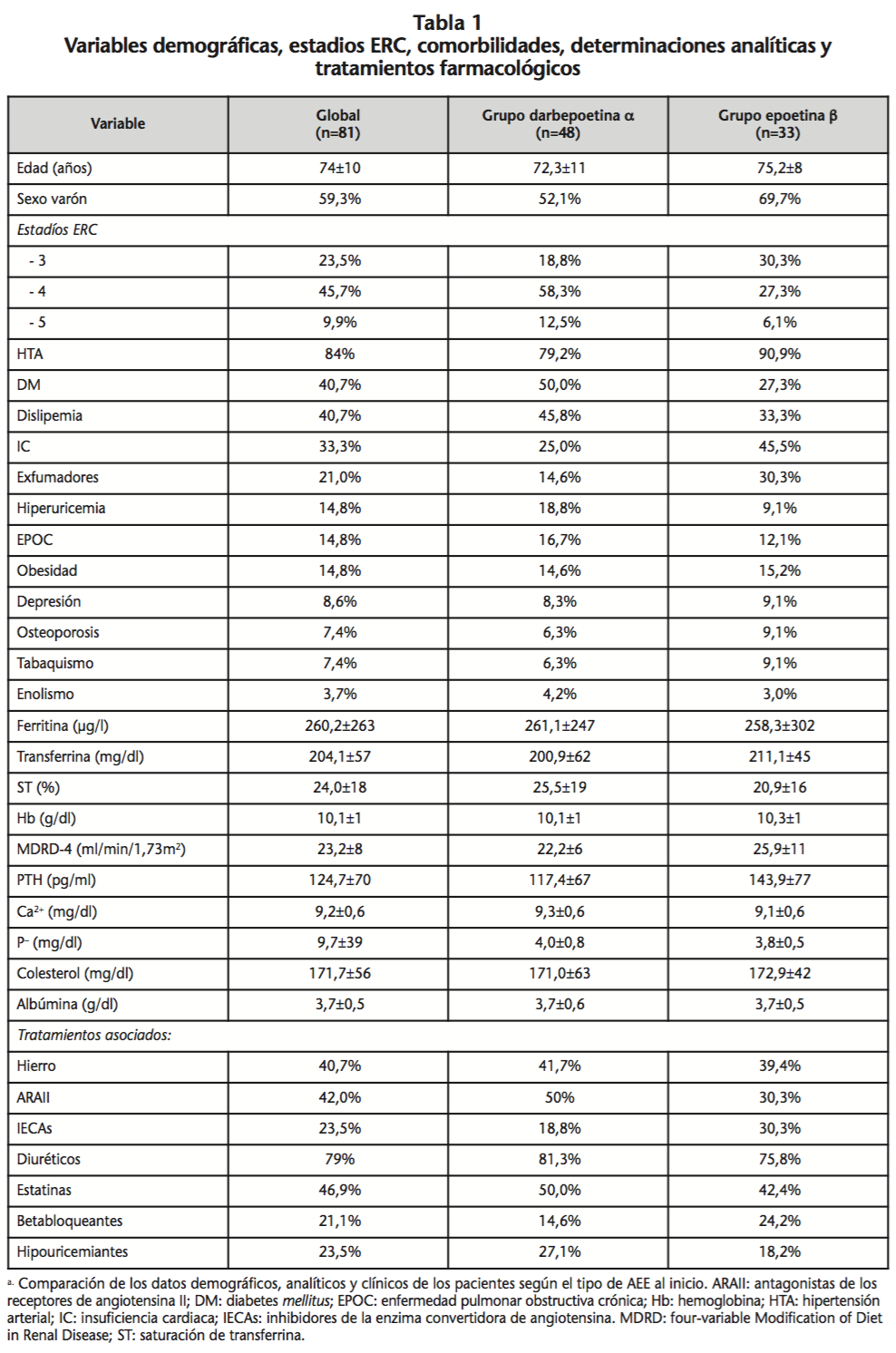
No se encontraron diferencias significativas en los datos demográficos, analíticos basales, comorbilidades y tratamientos concomitantes según el tipo de AEEs de inicio (Tabla 1).
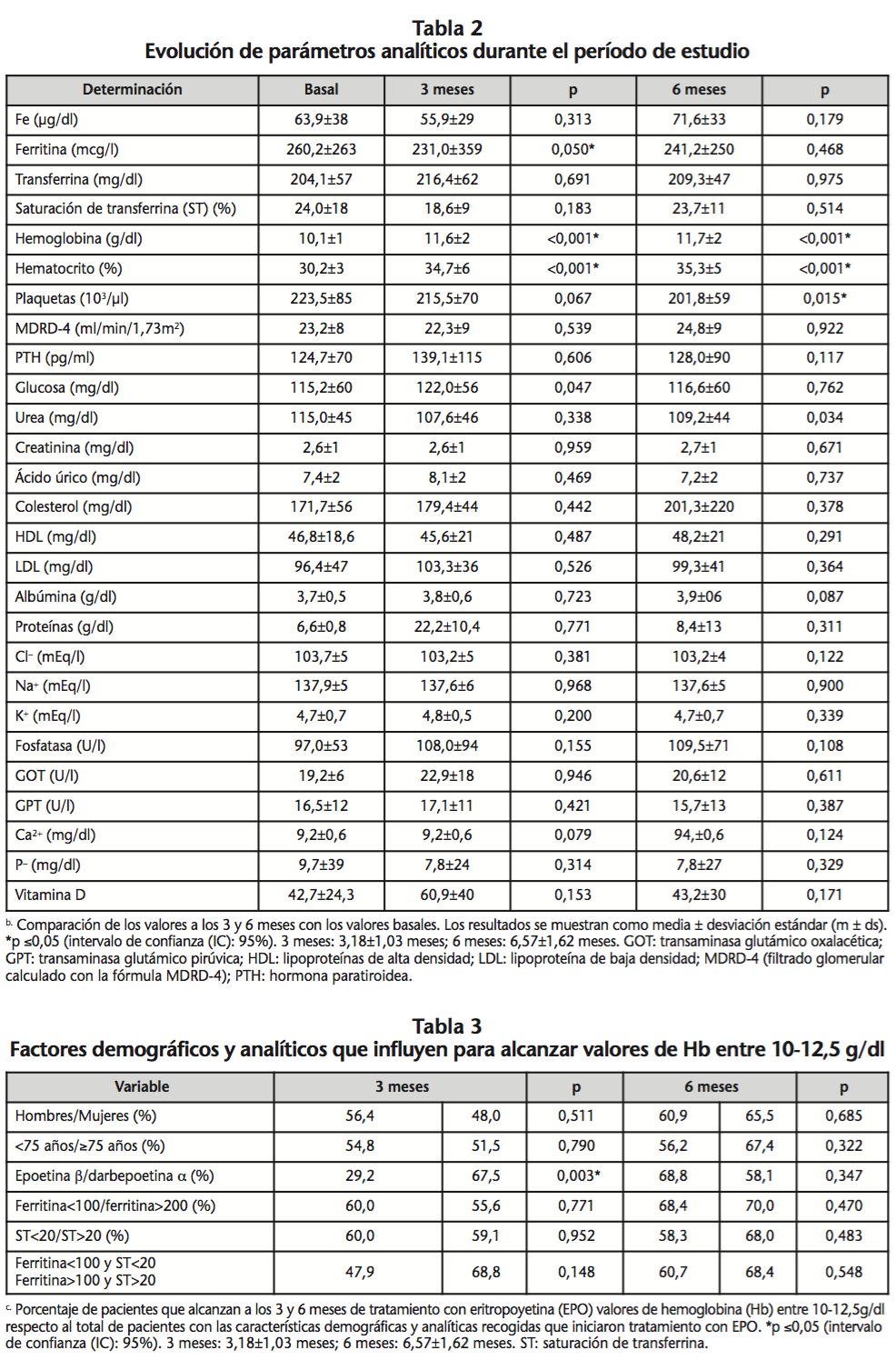
La Hb media basal fue de 10,13±1,16 g/dl; a los 3 meses, de 11,57±1,87 g/dl (p<0,001), y a los 6 meses, de 11,68±1,65 g/dl (p<0,001). El valor medio de hematocrito aumentó significativamente a los 3 y 6 meses de tratamiento con AEEs: 34,7% (p<0,001) y 35,3% (p<0,001) respectivamente respecto al valor basal de 30,2%. El valor de ferritina mostró diferencias estadísticamente significativas a los 3 meses de inicio del tratamiento con una media de 231,0 ng/ml respecto a 260,2 ng/ml al inicio (p=0,005). El valor de plaquetas a los 6 meses de seguimiento descendió a 210,8±58,7 103/µl respecto al valor basal de 223,53±85,45 103/µl (p=0,015). El valor de saturación de transferrina, niveles de PTH, calcio, fósforo, fosfatasa alcalina, calcio, colesterol, HDL, LDL, proteínas totales en suero, sodio, potasio y enzimas hepáticas no mostraron diferencias estadísticamente significativas a los 3 y 6 meses del inicio del tratamiento con AEEs (Tabla 2). En cuanto a la seguridad, a los 3 y 6 meses de tratamiento con AEEs, el 20,3% y el 18,7% de los pacientes, respectivamente, presentaron niveles de Hb ≥13,0 g/ dl (Tabla 3).
Al inicio del tratamiento con AEEs, el 47,0% de los pacientes presentó niveles de Hb ≤10 g/dl. A los 3 meses, el 53,1% alcanzaró niveles de Hb 10,0-12,5 g/dl, con una dosis media semanal de 6.875,0 UI de epoetina β y 20,4 µg de darbepoetina α, resultando una relación entre ambas dosis de 337:1. A los 6 meses, el 62,7% logró el objetivo de Hb 10,0-12,5 g/dl con una dosis media semanal de 7.035,0 UI de epoetina β y 18,70 µg de darbepoetina α, resultado una equivalencia de 376:1.
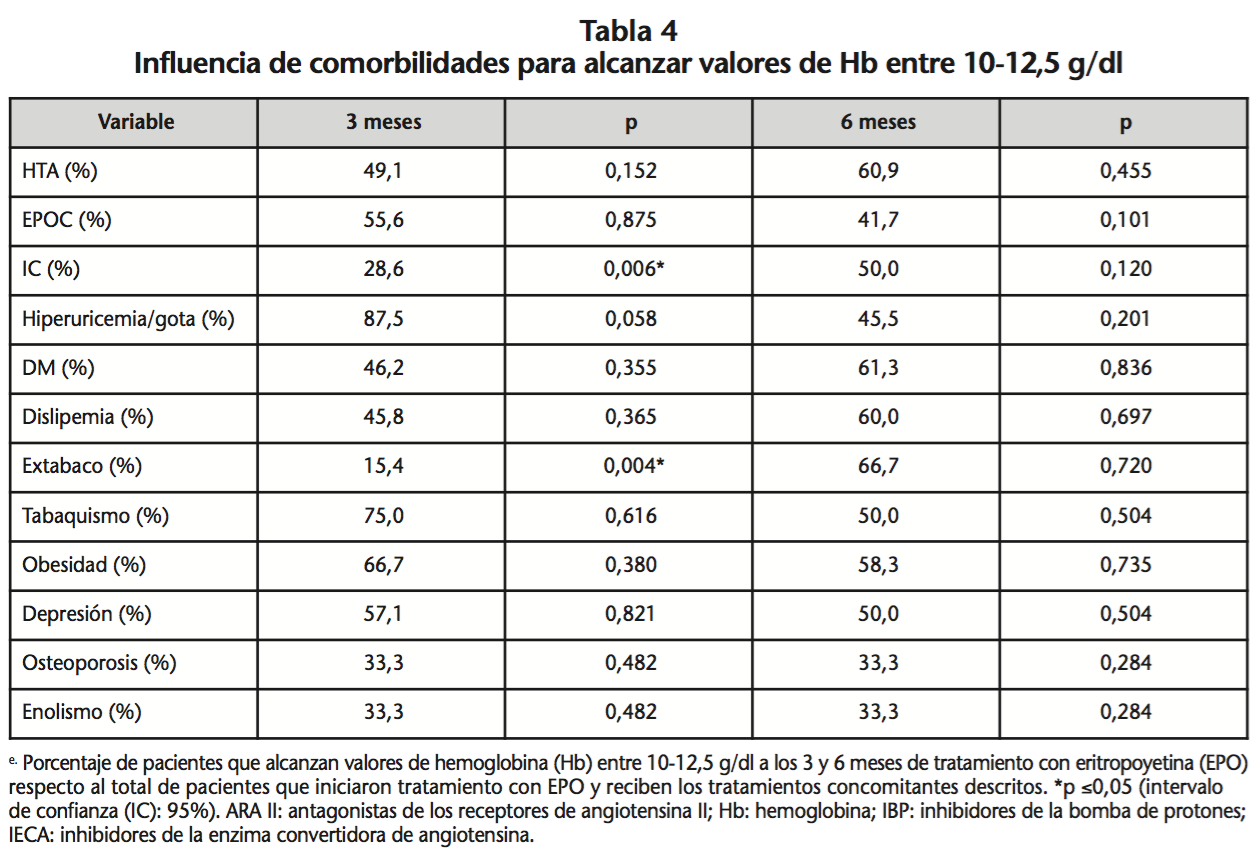
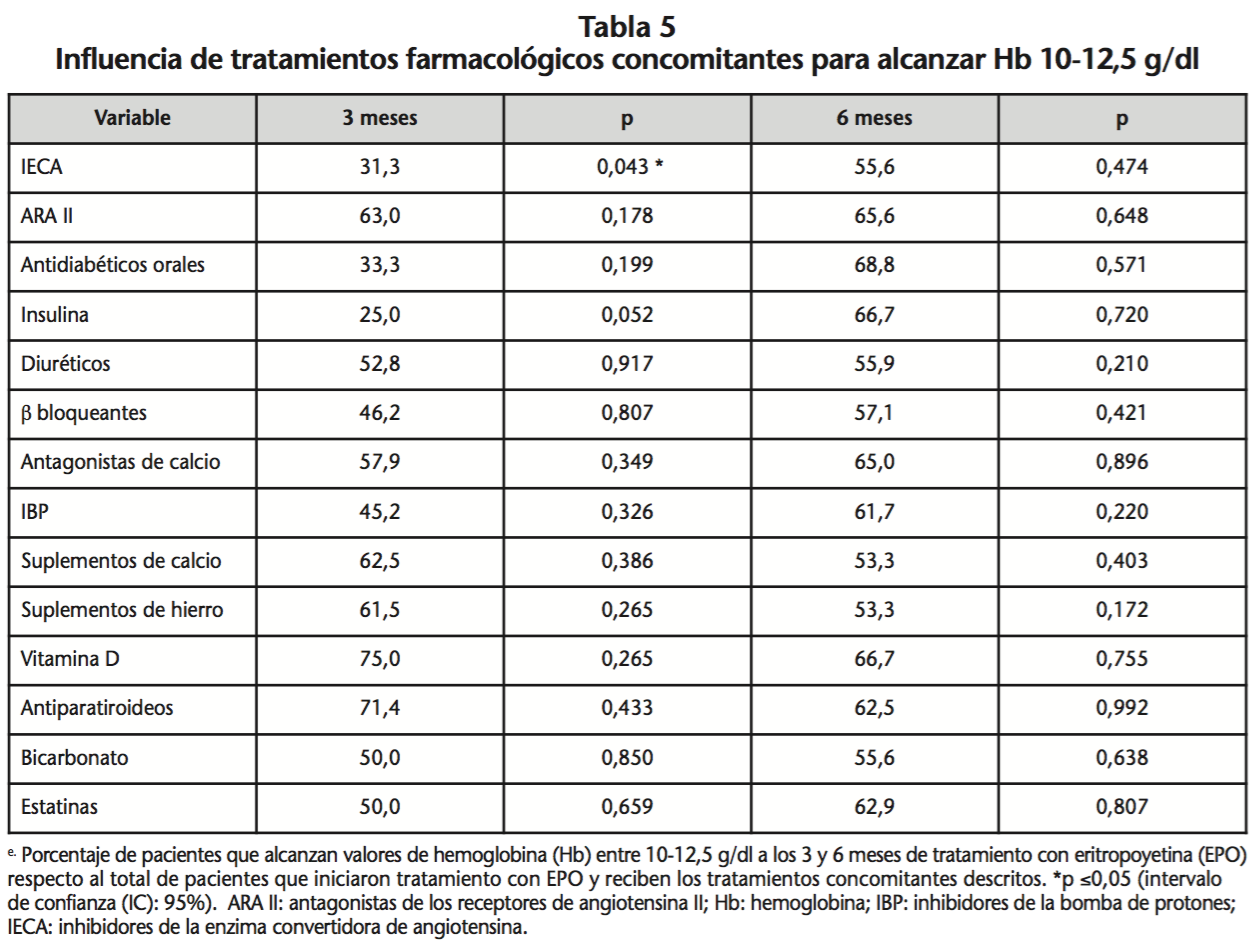
Ser exfumador, padecer IC y estar en tratamiento concomitante con IECAs influyó en una menor respuesta al tratamiento con AEEs (p=0,004; p=0,006 y p=0,043, respectivamente) (Tabla 4). El 67,5% de los pacientes tratados con darbepoetina α frente al 29,2% que recibió epoetina β, alcanzó valores de Hb entre 10,0-12,5 g/dl (p=0,003) (Tabla 5).
DISCUSIÓN
En nuestra serie, la utilización de AEEs fue mayor en varones (59,3%) y la edad media elevada (74 años). El estudio EPIRCE18 y otras referencias bibliográficas19-21 mostraron que la ERC afecta con mayor frecuencia a mujeres, aunque este dato podría justificarse por la tendencia de la fórmula MDRD a subestimar en ellas el FG. La edad de los pacientes concuerda con los datos del estudio EPIRCE18 (el 21,4% de los pacientes con ERC era >64 años) y más aún con el EROCAP22 (el 50% de la población con ERC en prediálisis tenía edades >65 años). Los pacientes con ERC presentan una alta prevalencia de factores de riesgo cardiovascular. Por ejemplo, los pacientes del estudio EPIRCE18 presentaron dislipemia (29,3%), obesidad (26,1%), tabaquismo activo (25,5%), HTA (24,1%) y DM (9,2%). Esta prevalencia es todavía mayor en pacientes en prediálisis incluidos en los estudios de Guerreo-Riscos et al.19 y Rodríguez-Villareal et al.3: HTA 96% y 97,4% y DM 29,4% y 33,0%, respectivamente.
La evolución de ferritina y hematocrito en los pacientes de nuestro estudio fue similar a la observada por Padullés-Zamora et al.2 y a la recogida en ficha técnica13, que describen la disminución de los valores séricos de ferritina simultáneamente con el aumento del hematocrito. Sin embargo, el aumento dosis-dependiente moderado en la cifra plaquetaria durante el tratamiento con AEEs descrito en ficha técnica12-13, no se corresponde con nuestro estudio, en el que se observa una disminución significativa del número de plaquetas (p<0,05) a los de 6 meses de tratamiento con EPO.
La ferropenia es frecuente en prediálisis. Según la bibliografía disponible, la concentración óptima de ferritina debe ser superior a 100 mg/ml (nivel mínimo exigido para iniciar tratamiento con AEEs) ó a 300 mg/ml, aunque existe un consenso para niveles entre 200 mg/ml-500 mg/ml20. En nuestro estudio, un 63,0% de los pacientes presentó niveles basales de ferritina >100 mg/ml y el 40,7%, valores >200 mg/ml. Se recomienda que el índice de saturación de transferrina (IST) sea mayor del 20% para obtener una buena respuesta con EPO12-13, siendo la media basal del IST de nuestros pacientes del 24±18%. Además de la deficiencia de hierro, algunas carencias de vitamina B12 o de ácido fólico pueden contribuir a empeorar el grado de anemia. Sin embargo, este tipo de carencias es muy infrecuente en la población en prediálisis. De hecho, los pacientes incluidos en nuestro estudio presentaron niveles plasmáticos basales de ácido fólico y de vitamina B12 normales.
Los distintos ensayos randomizados en pacientes con ERC en prediálisis no acaban de establecer el nivel óptimo de Hb (CREATE en Europa, CHOIR en EE.UU., TREAT en DM tipo 2)21-24. Estos trabajos recomiendan mantener a los pacientes en general con Hb entre 11,0-12,5 g/dl, sin sobrepasar los 13,0 g/dl, y dejando los niveles más elevados para casos seleccionados25-26. La Food and Drug Administration (FDA) y la EMA emitieron advertencias de seguridad sobre el uso de AEEs y los valores de Hb, concluyendo ambas que niveles superiores a 13,0 g/dl podrían ser perjudiciales para los pacientes. La FDA recomendó usar la dosis más baja posible de AEEs e incrementarla de forma gradual para evitar la necesidad de transfusiones sin superar concentraciones de Hb >12,0 g/dl. La EMA en un informe postautorización, informó de que valores de Hb >12,0 g/dl en pacientes con ERC se asociaban con un aumento de las complicaciones graves cardiovasculares y de mortalidad por cualquier causa. En nuestra serie, el 20,3% y 18,7% de pacientes a los 3 y 6 meses respectivamente presentaron valores de Hb >13,0 g/dl, disminuyéndose la dosis de AEE semanal en 5 y 4 pacientes respectivamente.
En cuanto al análisis de los factores implicados en la respuesta al tratamiento, señalar en primer lugar, la influencia del tipo de AEE. La efectividad de darbepoetina α para lograr valores de Hb entre 10,0-12,5 g/dl fue superior que la de epoetina β (p=0,003). La relación entre las dosis medias utilizadas de epoetina β y darbepoetina α para mantener valores de Hb estables en dicho intervalo resultó en 337:1, que difiere del ratio utilizado en los ensayos pivotales de darbepoetina α12: 200:1. Nuestro resultado concuerda con el de Andreas Bock et al.27, que obtuvieron una relación entre epoetina β y darbepoetina α de 336:1 para mantener una Hb media de 11,8±0,6 g/dl. También concluyeron que el factor de conversión 200:1 es apropiado para pacientes que han recibido previamente dosis bajas de epoetina β (<5.000 UI/semana), mientras que para aquellos tratados con dosis de epoetina β ≥5.000 UI/semana es más adecuado un factor de conversión 250:1-350:1. En el estudio de Arrieta et al. 28, el factor de conversión 300:1 fue apropiado para pacientes en hemodiálisis que recibieron dosis de epoetina α ≤200 UI/kg/semana y 350:1 para pacientes tratados con dosis mayores. Los resultados obtenidos en relación al factor de conversión entre los dos AEE deben ser confirmados en estudios posteriores con mayor tamaño muestral, valorando si las características de los dos grupos de pacientes son homogéneas y no hay diferencias en algún factor que pueda influir en la efectividad de los mismos, como la comorbilidad. En pacientes en los que coinciden simultáneamente la disminución de la disponibilidad de hierro, HTA e IC, (síndrome reno-cardíaco crónico IV y V) es de esperar que la resistencia a EPO ocurra con más frecuencia, precisando la administración de dosis mayores para mantener niveles de Hb similares14. La coexistencia de ambas enfermedades condiciona una situación de inflamación con aumento de citocinas inflamatorias (IL-1, IL-6, interferón, etc.), que inducen apoptosis de los progenitores eritroides y, al estimular la producción de hepcidina, disminuyen la disponibilidad del hierro.
El tratamiento con inhibidores del SRAA influye en una menor respuesta al tratamiento con AEEs. López-Gómez et al.29 también concluyeron mayor resistencia a EPO en pacientes en tratamiento concomitante con IECAs. Fernández Gallego et al.14 sugirieron la necesidad de dosis mayores de EPO en pacientes en prediálisis tratados con IECAs al compararlos a los no tratados. Algunos de los productos del metabolismo de los IECAs podrían actuar inhibiendo la eritropoyesis en fases precoces, dando lugar a una disminución en la respuesta a la EPO. Los IECAs producen una disminución de la secreción de EPO a nivel renal, pudiendo agravar la anemia de pacientes con IRC, portadores de trasplante renal25 o en hemodiálisis14. Además, en un artículo reciente en enfermos con IRC avanzada, Ahmed et al.30 concluyeron que la retirada de los fármacos inhibidores del SRAA se asociaba a una mejoría relevante y persistente de la función renal, con un aumento de la TFG superior al 25% en el 61,5% de los casos estudiados.
Nuestro estudio tiene como principales limitaciones ser un estudio retrospectivo, con un periodo de seguimiento corto de 6 meses, un tamaño de muestra reducido y limitado a un centro. El diseño del estudio no está planteado para calcular el factor de conversión, a pesar de que los grupos son homogéneos ya que no presentan diferencias significativas en datos demográficos, comorbilidades, valores analíticos, ni fármacos concomitantes según el tipo de AEE de inicio y nuestros resultados concuerdan con trabajos que plantean este objetivo. Por otra parte, nuestra serie aporta datos de efectividad y seguridad obtenidos en condiciones reales de práctica clínica que pueden ser útiles para optimizar el tratamiento con EPO.
CONCLUSIONES
1. Se comprueba la efectividad del tratamiento con AEEs, ya que los valores medios de Hb y hematocrito aumentan de forma significativa a los 3 y 6 meses de tratamiento con respecto a los valores de Hb y hematocrito basales. En cuanto a la seguridad, el 20,3% y 18,7% de pacientes a los 3 y 6 meses respectivamente presentaron niveles de Hb >13,0 g/dl.
2. La efectividad conseguida con darbepoetina α es mayor que con epoetina β en cuanto a la consecución de lograr valores de Hb entre 10,0-12,5 g/dl. Además, darbepoetina α permite una frecuencia de administración más cómoda para el paciente y una relación entre dosis más coste/efectiva que lo que supondría la relación 1:200 referida en ficha técnica.
3. En cuanto a los factores modificadores de la respuesta, ser exfumador y padecer IC influyen de forma significativa en una menor respuesta al tratamiento con AEEs. Los requerimientos de EPO se modifican por la administración concomitante de IECAs, por lo que hay que valorar la relación coste-beneficio de estos antihipertensivos en el tratamiento de la anemia con EPO.
Conflicto de intereses: Los autores declaran no tener conflictos de intereses.
BIBLIOGRAFÍA
1. World Health Organization. Nutritional Anaemias: Report of a WHO Scientific Group. Geneve: Switzerland: World Health Organization, 1968.
2. Rodríguez Villareal I, Ortega O, Gallar P, Sánchez M, Callejas R, Gracia C, et al. Características clínicas y bioquímicas de pacientes en prediálisis con respecto a los niveles de 25-hidroxivitamina D. Nefrología. 2011;31(2):185-91. doi:10.3265/Nefrologia.pre2011.Jan.10560.
3. Sarrias Lorenz X, Bardón Otero E, Vila Paz ML. El paciente en prediálisis: toma de decisiones y libre elección terapéutica. Nefrología [Internet]. 2008 [citado 30 diciembre 2014]; Supl.3: 119-122: [aprox. 4 p.]. Disponible en: www.senefro.org.
4. Molina M, Sevillano AM, Ramos-Estévez LE. Anemia en paciente con enfermedad renal crónica: “no todo es insuficiencia renal”. Nefrología Sup Ext. 2012;3(5):8-13. doi:10.3265/NefrologiaSuplementoExtraordinario.pre2012. Sep.11709.
5. Jauréguy M, Choukroun G. Factors affecting the response to erythropoiesis-stimulating agents. Nephrol Ther. 2006 Sep;2 Suppl 4:S274-82. PubMed: PMID 17373270.
6. KDIGO clinical practice guidelines for anemia in chronic kidney disease. Kidney Int [Internet]. Suppl 2012 [citado 4 noviembre 2014]; 2:288: [aprox 12 p.]. Disponible en: www.uptodate.com.
7. NKF-DOQI clinical practice guidelines for the treatment of anemia of chronic renal failure. Am J Kidney Dis [Internet]. 1997 [citado 4 noviembre 2014]; 30:S192: [aprox 12 p.]. Disponible en: www.uptodate.com.
8. NKF-K/DOQI Clinical Practice Guidelines for Anemia of Chronic Kidney Disease: update 2000. Am J Kidney Dis [Internet]. 2001 [citado 4 noviembre 2014]; 37:S182: [aprox 12 p.]. Disponible en: www.uptodate.com.
9. NKF-K/DOQI Clinical Practice Guidelines for Anemia of Chronic Kidney Disease. Am J Kidney Dis [Internet]. 2006 Suppl 4 [citado 4 noviembre 2014]; 47:S1: [aprox 12 p.]. Disponible en: www.uptodate.com.
10. KDOQI Clinical Practice Guideline and Clinical Practice Recommendations for anemia in chronic kidney disease: 2007 update of haemoglobin target. Am J Kidney Dis. [Internet]. 2007 [citado 4 noviembre 2014]; 50:471: [aprox 12 p.]. Disponible en: www.uptodate.com.
11. Drueke TB, Locatelli F, Clyne N, Eckardt KU, Macdougall IC, Tsakiris D, et al. Normalization of haemoglobin level in patients with chronic kidney disease and anemia. N Engl J Med. 2006;355:2071-84. Ref.(4) en López Gómez JM. Manejo de la anemia en la enfermedad renal crónica. Nefrología [Internet]. 2008 [citado 5 diciembre 2014]; Supl.3:63-6: [aprox 4p.]. Disponible en: www.senefro.org.
12. Ficha técnica de Neorecormon®. Breda: Amgen; 2012.
13. Ficha técnica de Aranesp®. Welwyn Garden City: Roche; 2011.
14. Fernández-Gallego J, Ramos B, Ruiz A, Contreras J, Alvarez Bustos G, López de Novales E. Estudio de algunos factores que pueden influir en el tratamiento con eritropoyetina de la anemia en hemodiálisis. Nefrología. 2000;20(2):164-70.
15. Locatelli F, Aljama P, Barany P, Canaud B, Carrera F, Eckardt KU, et al. European Best Pracitce Guidelines Working Group. Revised European best practice guidelines for the management of anaemia in patients with chronic renal failure. Nephrol Dial Transplant. 2004;19 (Supl.2):1-47. Ref.(1) en López Gómez JM. Manejo de la anemia en la enfermedad renal crónica. Nefrología [Internet]. 2008 [citado 5 diciembre 2014]; Supl.3:63-6: [aprox 4p.]. Disponible en: www.senefro.org.
16. Jofré R. Factores que afectan a la calidad de vida en pacientes en predialisis, diálisis y trasplante renal. Nefrología. 1999;19 (Supl.1):84-90.
17. Levey AS, Greene T, Kusek JW. A simplified equation to predict glomerular filtration rate from serum creatinine. J Am Soc Nephrol. 2000;11:155A.
18. Otero González A, De Francisco A, Ganoso P, García F. Prevalencia de la IRC en España: resultados del estudio EPIRCE. Nefrología. 2010;30(1):78-86.
19. Guerrero-Riscos MA, Montes-Delgado R, Seda-Guzmán M, Praena-Fernández JM. Resistencia a eritropoyetina y supervivencia en pacientes con enfermedad renal crónica 4-5 no-D y enfermedad cardiaca. Nefrología [Internet]. 2012 [citado 13 diciembre 2014]; 32(3):343-52: [aprox 10p.]. Disponible en: www.revistanefrologia.com.
20. Caravaca F, Villa J, García de Vinuesa E, Martínez del Viejo C, Martínez Gallardo R, Macías R, et al. Asociación entre fósforo sérico y progresión de la enfermedad renal crónica avanzada. Nefrología [Internet]. 2011 [citado 13 diciembre 2014]; 31(6):707-15: [aprox 9p.]. Disponible en: www.revistanefrologia.com.
21. Alcázar R, Tato A, García F, Barrios V, Quereda C. ¿Cambiará la prescripción de agentes estimulantes de la eritropoyesis en prediálisis tras los resultados del estudio TREAT? Revista Nefrología [Internet]. 2010 [citado 13 diciembre 2014]; 30(1):114-8: [aprox 5p.]. Disponible en: www.revistanefrologia.com.
22. De Francisco ALM, De la Cruz JJ, Cases A, De la Figuera M, Egocheaga MI, Górriz JI, et al. Prevalencia de insuficiencia renal en Centros de Atención Primaria en España: Estudio EROCAP. Nefrología. 2007;27(3):300-6.
23. López Gómez JM. Manejo de la anemia en la enfermedad renal crónica. Nefrología [Internet]. 2008 [citado 5 diciembre 2014]; Supl.3:63-6: [aprox 4p.]. Disponible en: www.senefro.org.
24. Locatelli F and Del Vecchio L. Haemoglobin levels and health-related quality of life; a neglected hard end point. Nephrol Dial Transplant. 2014;29:1272-1274. doi: 10.1093/ndt/gfu059.
25. Goeij de M, Meuleman Y, Van Dijk S, Grootendorst DC, Dekker FW, Halbesma N, et al. Haemoglobin levels and health-related quality of life in Young and elderly patients on specialized predialysis care. Nephrol Dial Transplant. 2014;29:1391-1398. doi:10.1093/ndt/gft533.
26. Anaya S, Rivera F, Sánchez de la Nieta MD, Carreño A, Vozmediano C, Alcalde MP, et al. Relación entre comorbilidad, anemia y respuesta a derivados eritropoyéticos en pacientes incluidos en programa de hemodiálisis periódicas. Nefrología. 2008;28(2):186-92.
27. Andreas Bock H, Hirt-Minkowski P, Brünisholz M, Keusch G, Rey S, Von Albertini B. Darbepoetin alpha in lower-than-equimolar doses maintains haemoglobin levels in stable haemodialysis patients converting from epoetin α/β. Nephrol Dial Transplant. 2008;23:301-08. doi:10.1093/ndt/gfm579.
28. Arrieta J, Moina I, Molina J, Gallardo I, Muñiz ML, Robledo C, et al. Switch from epoetin to darbepoetin alfa in hemodialysis: dose equivalence and hemoglobin stability. International journal of Nephrology and Renovascular Disease. 2014;353-359.
29. López-Gómez JM, Portolés JM, Aljama P. Factors that condition the response to erythropoietin in patients on hemodialysis and their relation to mortality. Kidney Int. Suppl 2008; (111):75-81. PubMed: PMID 19034333.
30. Ahmed AK, Kamarth NS, El Kossi M, El Nahas AM. The impact of stopping inhibitors of the renin-angiotensin system in patients with advance chronic kidney disease. Nephrol Dial Transplant. 2010;25:3977-82. Ref.(1) en Díaz-Domínguez ME, Fernández-Lucas M, Gomis-Couto A. Efectos de la suspensión de IECA y ARA II en enfermedad crónica avanzada. [carta] Nefrología 2012;32(3):400-1.
____
Descargar artículo en PDF: Análisis de los factores que influyen en la respuesta a agentes estimulantes de la eritropoyesis en enfermedad renal crónica
