Mir Cros M, Rius Perera J, Gilabert Sotoca M, Mangues Bafalluy I
Hospital Universitari Arnau de Vilanova. Servicio de Farmacia. Lleida (España)
Fecha de recepción: 29/03/2022 – Fecha de aceptación: 18/04/2022
Correspondencia: Marta Mir Cros – Hospital Universitari Arnau de Vilanova (Servicio de Farmacia) – Av. Alcalde Rovira Roure, 80 – 25198 Lleida (España)
mmirc.lleida.ics@gencat.cat
___
Resumen
Osimertinib es un inhibidor de tirosina quinasa (ITK) de tercera generación aprobado para el cáncer de pulmón no microcítico localmente avanzado o metastásico con mutación del EGFR. La prevalencia de efectos adversos hematológicos graves asociados a este fármaco es infrecuente según ficha técnica.
Se describe el caso de una mujer de 69 años diagnosticada de cáncer de pulmón no microcítico localmente avanzado en tratamiento con osimertinib en primera línea con aparición de trombocitopenia severa que requirió de ingresos hospitalarios, transfusiones de sangre y plaquetas y de tratamiento con eltrombopag sin conseguir resultados favorables para la paciente.
Palabras clave: Osimertinib, eltrombopag, trombocitopenia, cáncer de pulmón no microcítico, aplasia medular.
Bone marrow aplasia associated with osimertinib: a case report
Summary
Osimertinib is a third generation, tyrosine kinase inhibitor (TKI) approved for locally advanced or metastatic non-small cell lung cancer with EGFR mutation. The prevalence of serious haematological adverse events associated with osimertinib is uncommon according to the summary of product characteristics.
The case of study describes a 69-year-old woman diagnosed with locally advanced non-small cell lung cancer treated with osimertinib, with onset of severe thrombocytopenia that required hospital admissions, blood and platelet transfusions, and treatment with eltrombopag, without achieving favourable results.
Key words: Osimertinib, eltrombopag, thrombocytopenia, non-small cell lung cancer, bone marrow aplasia.
____
Introducción
El cáncer de pulmón es el cuarto tipo de cáncer más frecuente en España y se considera la primera causa de muerte por cáncer a nivel mundial1. Podemos distinguir dos grandes tipos de tumor, siendo más prevalente el cáncer de pulmón no microcítico o de células no pequeñas (CPNM), representando un 80-85% de los pacientes2.
Para el tratamiento del CPNM localmente avanzado o metastásico es importante determinar biomarcadores específicos: mutación del receptor del factor de crecimiento epidérmico (EGFR), ALK y ROS1, así como la expresión de PD-L1, para poder conseguir una terapia más individualizada. Dentro de las mutaciones con terapia dirigida aprobada, la más prevalente con un 17% de los CPNM avanzados es la del EGFR, seguida de la de ALK con un 3% y de ROS1 con un 1% de los pacientes. Dentro de los inhibidores del EGFR, osimertinib es el inhibidor de tercera generación indicado para el tratamiento en primera línea de pacientes adultos con CPNM localmente avanzado o metastásico con mutaciones del EGFR3.
Los efectos adversos más comúnmente descritos en ficha técnica del osimertinib son alteraciones gastrointestinales (49%), trastornos de la piel relacionados con erupciones (47%) o piel seca (33%) y alteraciones hematológicas que implican la disminución del recuento de plaquetas (54%), de leucocitos (68%) y de neutrófilos (35%), aunque grado 3-4 según los criterios CTCAE versión 5,04, la frecuencia disminuye considerablemente (1,6%, 1,5% y 4,1% respectivamente)3.
Descripción del caso
Mujer de 69 años, con antecedentes de lupus cutáneo en remisión y fibrilación auricular en tratamiento domiciliario con ácido acetilsalicílico y bisoprolol. En agosto de 2019, con ECOG 0, es diagnosticada de adenocarcinoma de pulmón T4N3M0 no resecable con expresión de PD-L1 del 4%, ALK negativo y EGFR mutado (Ex19Del). Realiza tratamiento de quimo-radioterapia para cáncer de pulmón no microcítico avanzado inoperable/irresecable según las guías (ICO-ICS praxi pulmón pendiente publicación). Tras 4 ciclos de cisplatino-vinorelbina intravenosos cada 21 días inicia radioterapia secuencial consiguiendo respuesta parcial tras una dosis de 20 Gy. La paciente es candidata a recibir durvalumab intravenoso, anticuerpo anti-PDL1, de mantenimiento durante 12 meses (estudio PACIFIC)5. A los 10 meses se observa progresión de la enfermedad con una lesión hipermetabólica en hilio pulmonar izquierdo, por lo que se inicia tratamiento de primera línea con osimertinib 80 mg/día vía oral. El Servicio de Farmacia efectúa tres dispensaciones a la paciente en las que realiza conciliación del tratamiento domiciliario, información sobre su tratamiento, estudio de interacciones, seguimiento de adherencia, seguimiento de toxicidades y los cuestionarios de calidad de vida reportados por la paciente: Morisky-Green, EQ-5D-3L, EORTC QLQ-LC13, BriefIPQ y SATMED-Q.
A los dos meses del inicio con osimertinib, la paciente refiere parestesias y en la analítica se observa trombocitopenia y neutropenia de grado 1 según los criterios CTCAE versión 5.04. A la semana siguiente, acude a urgencias por hematuria y plaquetopenia grado 4 (18×109/L) con un ingreso hospitalario de 18 días y la interrupción del tratamiento oncológico con osimertinib. La figura 1 muestra la evolución de la trombocitopenia, que alcanzó niveles casi indetectables de plaquetas (1×109/L) a pesar de la suspensión del tratamiento y las transfusiones de plaquetas.
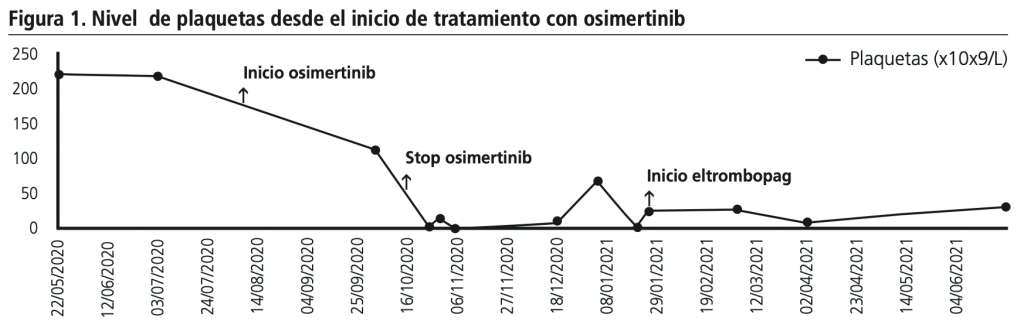
En noviembre de 2020 se le diagnostica pancitopenia con predominio de la serie megacariocítica descartándose cualquier patología hematológica primaria. En enero de 2021, inicia tratamiento con eltrombopag 50 mg/día vía oral (aprobado en la comisión de tratamientos especiales). Con este tratamiento se intenta inducir la proliferación y diferenciación de las células progenitoras de la médula ósea. Aparece como nuevo síntoma hemipoestesia derecha que posteriormente se relaciona con progresión de la enfermedad a nivel de sistema nervioso central. Se aumentó la dosis de eltrombopag de 50 a 125 mg/día sin alcanzar los niveles de plaquetas deseables. La paciente en total requiere de 8 ingresos en el centro hospitalario, 7 transfusiones de concentrados de hematíes y 11 transfusiones de concentrados de plaquetas durante un período de 5 meses, sin llegar a niveles aceptables del recuento de células sanguíneas. La paciente es exitus en junio de 2021.
Discusión
Los efectos hematológicos graves relacionados con la administración de osimertinib están descritos como poco frecuentes en ficha técnica. Sin embargo, en la literatura se han publicado casos de toxicidad hematológica derivados de su administración. Un caso de anemia aplásica grave con pancitopenia fue descrito por Hiroaki et al.6, asociando como muy probable la administración de osimertinib como causa del efecto adverso, sin poder descartar por completo otras causas y con una evolución estable durante los 12 meses posteriores a la suspensión del tratamiento. Un caso de eritrocitosis con posterior trombosis arterial fue descrita por Shota Kodaira et al.7, sin observarse recurrencia de estos eventos hematológicos con la retirada de osimertinib.
En el caso descrito en nuestro hospital, se descarta cualquier patología hematológica primaria en la paciente y se confirma que se trata de mielotoxicidad farmacológica. Aplicando el algoritmo de Naranjo, se concluye con una puntuación de 6 que la relación entre la reacción adversa al medicamento y osimertinib es “probable”.
La integración entre equipos multidisciplinares del hospital ha sido fundamental para el manejo de los distintos tratamientos que se pautan, para realizar búsquedas bibliográficas con evidencia en el caso del tratamiento con eltrombopag o la aprobación de éste en la comisión de tratamientos especiales.
Es importante la notificación de reacciones adversas a medicamentos al sistema de farmacovigilancia. Este caso ha sido notificado al Centro de Farmacovigilancia correspondiente.
Conflicto de intereses: Las autoras declaran no tener conflicto de intereses.
BIBLIOGRAFÍA
1. Cifras_del_cancer_en_Espnaha_2021.pdf [Internet]. [citado 1 de febrero de 2022]. Disponible en: https://seom.org/images/Cifras_del_cancer_en_Espnaha_2021.pdf.
2. Revisin_de_Frmacos_Cncer_de_Pulmn.pdf [Internet]. [citado 1 de febrero de 2022]. Disponible en: https://gruposdetrabajo.sefh.es/gedefo/images/stories/documentos/2021/MonografiaPulmon/Revisin_de_Frmacos_Cncer_de_Pulmn.pdf.
3. FT_1161086002.pdf [Internet]. [citado 1 de febrero de 2022]. Disponible en: https://cima.aemps.es/cima/pdfs/es/ft/1161086002/FT_1161086002.pdf.
4. Common Terminology Criteria for Adverse Events (CTCAE). 2017;155.
5. AstraZeneca. A Phase III, Randomised, Double-blind, Placebo-controlled, Multi-centre, International Study of MEDI4736 as Sequential Therapy in Patients With Locally Advanced, Unresectable Non-Small Cell Lung Cancer (Stage III) Who Have Not Progressed Following Definitive, Platinum-based, Concurrent Chemoradiation Therapy (PACIFIC) [Internet]. clinicaltrials.gov; 2022 ene [citado 2 de marzo de 2022]. Report No.: NCT02125461. Disponible en: https://clinicaltrials.gov/ct2/show/NCT02125461.
6. Ogata H, Yamamoto Y, Harada T, Nakanishi Y, Okamoto I, Iwama E, et al. Severe Aplastic Anemia during Osimertinib Therapy in a Patient with EGFR Tyrosine Kinase Inhibitor-Resistant Non-Small Cell Lung Cancer. J Thorac Oncol. mayo de 2017;12(5):e46-7.
7. Kodaira S, Ehara J, Takamizawa S, Ogita S, Norisue Y, Nakama T, et al. Acute Lower Extremity Arterial Thrombosis Associated with Osimertinib-Induced Erythrocytosis. Am J Case Rep. 7 de septiembre de 2021;22:e932252.
____
