Miranda-Pérez de Alejo C1, Fernández-Cervera M2, Reyes-Naranjo MI3, Cabrera-Pérez MA1
1 Centro de Bioactivos Químicos. Universidad Central «Marta Abreu» de Las Villas (Cuba)
2 Departamento de Farmacia. Instituto de Farmacia y Alimentos (IFAL). Universidad de La Habana (Cuba)
3 Laboratorios SOLMED. Unidad empresarial de base MEDSOL, Biocubafarma (Cuba)
Fecha de recepción: 07/08/2019 – Fecha de aceptación: 09/10/2019
Correspondencia: Miguel Ángel Cabrera-Pérez – Centro de Bioactivos Químicos. Universidad Central «Marta Abreu» de Las Villas – Carretera a Camajuaní Km 51/2 – Santa Clara, Villa Clara, C.P. 54830 (Cuba)
macabreraster@gmail.com / macabrera@uclv.edu.cu
____
RESUMEN
El siguiente trabajo tiene como objetivos clasificar los ingredientes farmacéuticos activos (IFAs) de los sólidos orales de liberación inmediata del Cuadro Básico de Medicamentos de Cuba (CBM) que son producidos nacionalmente, según el Sistema de Clasificación Biofarmacéutica (SCB), y proponer aquellos que podrían demostrar su intercambiabilidad terapéutica a través de ensayos de disolución in vitro. Para ello se utilizó el listado de medicamentos del CBM de Cuba del 2019 y se realiza una clasificación biofarmacéutica provisional consenso, a partir de diferentes clasificaciones biofarmacéuticas publicadas y de una extensiva revisión de la literatura.
Se identificó que aproximadamente el 48% de los IFAs del CBM presentan polimorfismo y que el 12,3% de las formas sólidas orales del CBM de Cuba tienen un estrecho margen terapéutico, por lo que no pueden ser bioexonerados mediante estudios de bioequivalencia in vitro basados en el SCB. Se constató que un 50,8% de los IFAs de formas sólidas orales de liberación inmediata del CBM de Cuba han sido clasificados según el SCB por la OMS.
La aplicación conjunta de diversas metodologías de clasificación biofarmacéutica permitió clasificar provisionalmente todos los IFAs de las formas sólidas orales del CBM, demostrando que el 66,1% pertenece a las clases I, III y I/III del SCB, por lo que podrían ser bioexonerados de ensayos de bioequivalencia in vivo en humanos.
Palabras clave: Bioequivalencia, productos genéricos, equivalencia terapéutica, disolución, permeabilidad, solubilidad, Cuba.
Application of the Biopharmaceutical Classification System to the Basic Table of Medicines of Cuba: bioequivalence in vivo or dissolution in vitro?
SUMMARY
The goals of the present work are to classify the active pharmaceutical ingredients (APIs) of the oral solids of immediate release of the Essential List of Medicines of Cuba (CBM) that are produced nationally, according to the Biopharmaceutical Classification System (BCS), and to propose those that could demonstrate their therapeutic interchangeability through in vitro dissolution tests. For this was used the Cuban CBM drug list of 2019, and a provisional consensus biopharmaceutical classification is proposed, based on different published biopharmaceutical classifications and an extensive review of the literature.
It was identified that approximately 48% of the CBM IFAs present polymorphism and that 12.3% of the oral solid forms of CBM in Cuba have a narrow therapeutic margin, for which reason they cannot be bioexonerated through in vitro bioequivalence studies based on BCS. It was found that 50.8% of the oral solid forms of CBM in Cuba have been classified according to SCB by WHO.
The joint application of diverse methodologies of biopharmaceutical classification allowed to provisionally classify all the IFAs of the oral solid forms of CBM, demonstrating that 66.1% belongs to classes I, III and I/III of the SCB, reason why they could be biowaivered from in vivo bioequivalence assays in humans.
Key Words: Bioequivalence, generic products, therapeutic equivalence, dissolution, permeability, solubility, Cuba.
____
INTRODUCCIÓN
Según la Organización Mundial de la Salud (OMS), un medicamento multifuente es un equivalente farmacéutico o alternativa farmacéutica que puede o no ser equivalente terapéutico1. Los medicamentos multifuentes se insertan en el mercado después que los medicamentos de referencia, por lo que requieren de evidencias que demuestren que son terapéuticamente equivalentes, es decir, que pueden ser administrados en sustitución de los innovadores, con resultados terapéuticos similares (son intercambiables)1. La intercambiabilidad terapéutica de productos farmacéuticos multifuentes siempre deberá estar documentada en las solicitudes de inscripción del registro de medicamentos mediante estudios in vivo como estudios de bioequivalencia, estudios farmacodinámicos comparativos en humanos, ensayos clínicos comparativos, o mediante ensayos de disolución in vitro2.
Los estudios de bioequivalencia in vivo han sido considerados el “estándar de oro” para la demostración de la intercambiabilidad terapéutica de productos multifuentes. Sin embargo, en los últimos 15 años este enfoque ha cambiado con la aplicación del Sistema de Clasificación Biofarmacéutica (SCB)3, acogido y adaptado inicialmente por la FDA (Food and Drug Administration, USA) y difundido actualmente en todo el mundo. El SCB es un marco científico para clasificar un fármaco considerando su solubilidad acuosa (relativa a la dosis) y su permeabilidad intestinal. La combinación de estas propiedades con la disolución del medicamento, se consideran los tres factores más importantes que modulan la velocidad y cantidad absorbida de un ingrediente farmacéutico activo (IFA), a partir de formas farmacéuticas sólidas orales de liberación inmediata. Una vez clasificado el fármaco es posible establecer si los ensayos de disolución in vitro pueden sustituir las pruebas de bioequivalencia in vivo, que es lo que se conoce como bioexención.
La OMS ha implementado la bioexención basados en el SCB para sustituir los estudios de bioequivalencia in vivo para los IFAs de sólidos orales de liberación inmediata, clasificados como clase I (alta solubilidad y alta permeabilidad) y clase III (alta solubilidad y baja permeabilidad)1, teniendo su aplicación un creciente impacto en la práctica regulatoria4.
Varios esquemas de clasificación biofarmacéutica provisional, basados en métodos teóricos y experimentales, han sido desarrollados para apoyar la aplicación del SCB en las etapas iniciales de desarrollo de fármacos5-8. Estas metodologías, aunque no consideran la determinación de la permeabilidad a través de ensayos de biodisponibilidad en humanos o por métodos de perfusión en humanos, han sido ampliamente utilizadas en la clasificación biofarmacéutica provisional del listado de medicamentos esenciales de la OMS o de los productos más vendidos en los listados de EE.UU, Gran Bretaña, España y Japón9-11.
La industria farmacéutica cubana tiene como uno de sus principales programas el desarrollo de medicamentos multifuentes y productos farmacéuticos de avanzada, sin embargo los estudios para demostrar la intercambiabilidad terapéutica de los medicamentos multifuentes está muy limitado a un grupo de productos considerando la prioridad terapéutica, riesgo sanitario, experiencia nacional en el uso clínico y el criterio de otras autoridades sanitarias y organizaciones internacionales como la OMS12. Los IFAs sólidos orales de liberación inmediata que forman parte del Cuadro Básico de Medicamentos (CBM) de Cuba no se encuentra clasificado según el SCB, lo cual imposibilita la aplicación de dicha herramienta al desarrollo de medicamentos multifuentes intercambiables. En el presente trabajo se clasifican provisionalmente los IFAs de los medicamentos multifuentes orales de liberación inmediata del CBM de Cuba 2019, según el SCB, para identificar productos que podrían ser bioexonerados de ensayos de bioequivalencia in vivo y su intercambiabilidad terapéutica podría demostrarse mediante ensayos de disolución in vitro.
MATERIAL Y MÉTODOS
Se analizaron los IFAs de formas sólidas de producción nacional que forman parte del CBM de Cuba del 201913. Para el análisis se excluyeron los productos con IFAs de estrecho índice terapéutico y aquellos administrados por vía parenteral, tópica, rectal, sublingual, transdérmica y los de liberación modificada, a los cuales no es aplicable el SCB. También fueron eliminados los suplementos nutricionales.
Se clasificaron provisionalmente, según el SCB, 124 IFAs de sólidos orales de liberación inmediata. Para la clasificación de la solubilidad, se obtuvieron los valores experimentales descritos en la literatura14. El número de dosis (D0) se calculó mediante la ecuación D0=(M0/V0*S), donde M0 es la dosis de mayor fortaleza (según OMS), S es el valor de solubilidad acuosa descrito en la literatura o calculado (mg/ml) y V0 es el volumen de agua equivalente a 250 ml. Los fármacos con D0 ≤1 se clasificaron como de alta solubilidad y con D0 >1 como de baja solubilidad.
La predicción de la permeabilidad se realizó según modelo consenso descrito por Cabrera-Pérez y col.10, donde se analizaron los valores de permeabilidad obtenidos en humanos, en modelos in situ en ratas, en líneas celulares, en membranas artificiales y a través de modelos computacionales. Además, se incluyeron otras variables relevantes como son: polimorfismo, riesgo sanitario e índice terapéutico (IT).
Para llegar a una clasificación biofarmacéutica provisional final se tomaron en consideración las diferentes clasificaciones biofarmacéuticas publicadas:
a) Clasificación realizada por la OMS al listado de medicamentos esenciales (SCBOMS)15.
b) Clasificación biofarmacéutica provisional del listado de medicamentos esenciales de la OMS, basada en propiedades moleculares (SCBlogP)5.
c) Clasificación de los fármacos orales del listado de medicamentos esenciales de la OMS, de acuerdo al SCB (SCBexp)16.
d) Clasificación de fármacos de acuerdo al sistema de clasificación biofarmacéutica de disposición de fármacos (SCBDF)17.
e) Clasificación biofarmacéutica provisional, basado en la permeabilidad en células de adenocarcinoma de colon humano (Caco-2) y el número de dosis (SCBcaco-2)18.
Tomando en consideración la variabilidad en la determinación de la permeabilidad, para la clasificación biofarmacéutica final se tomó como criterio el consenso entre todas las metodologías anteriores. Toda la información fue introducida en una base de datos propia. Los resultados fueron presentados en forma de tablas para facilitar su correcta interpretación.
RESULTADOS
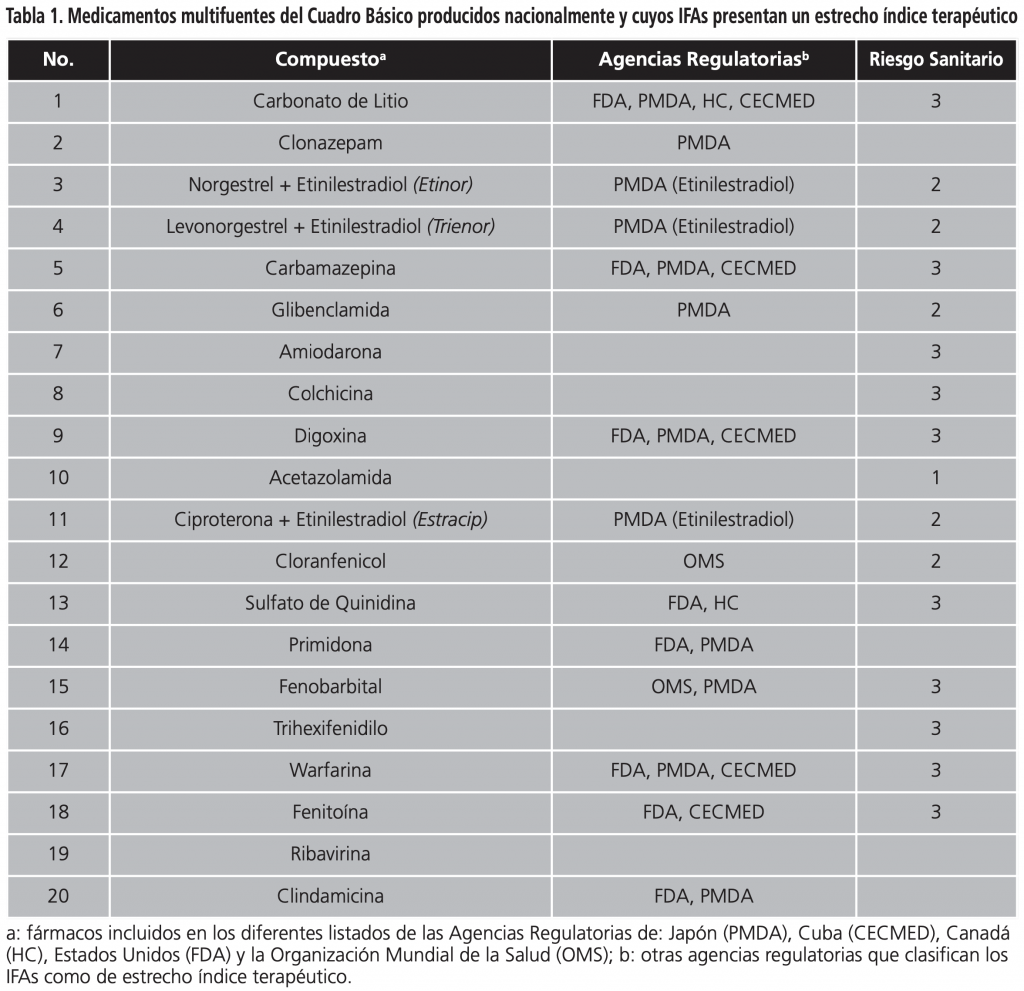
De los sólidos orales de liberación inmediata incluidos en el CBM y producidos nacionalmente, se identificaron 20 compuestos con estrecho índice terapéutico (IT ≤2). La demostración de la intercambiabilidad terapéutica de estos compuestos debe ser por estudios de bioequivalencia in vivo en humanos. Como se puede apreciar en la Tabla 1, para definir el índice terapéutico de los fármacos del CBM, se consideraron las clasificaciones realizadas por diferentes agencias regulatorias y organismos internacionales como: la Agencia de Productos Farmacéuticos y Dispositivos Médicos de Japón (PMDA) (https://www.pmda.go.jp), la Agencia Europea del Medicamento (EMA) (https://www.ema.europa.eu), el Centro para el Control de Medicamentos, Equipos y Dispositivos Médicos de Cuba (CECMED) (https://www.cecmed.cu), Salud Canadá (HC) (https://www.canada.ca/en/ health-canada.html), la FDA (https://www.fda.gov) y la OMS (https://www.who.int/es), respectivamente.
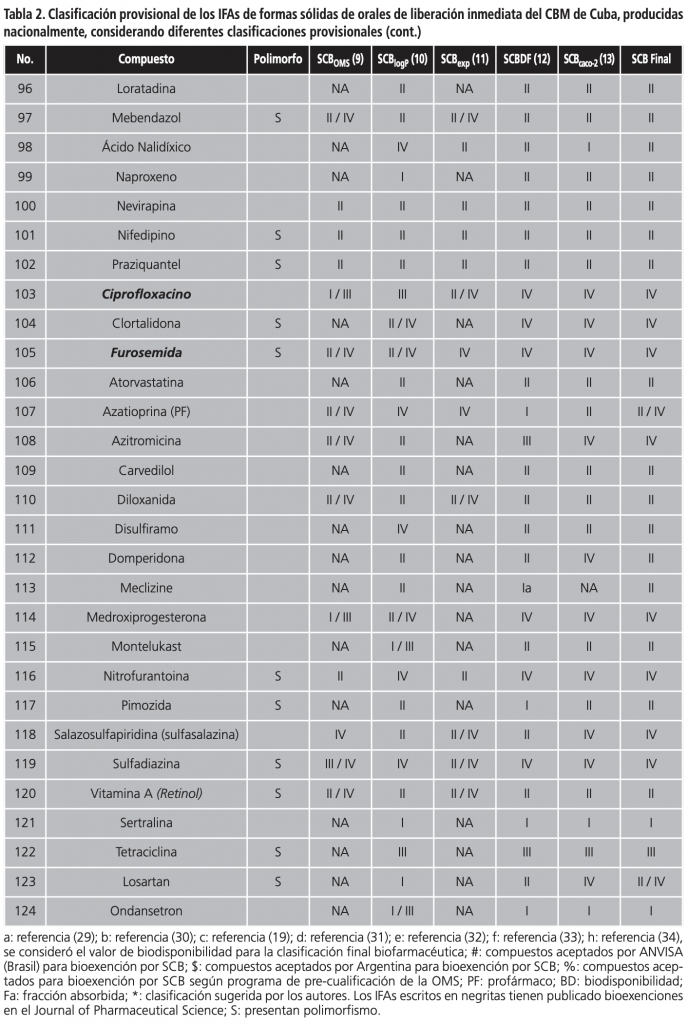
En la Tabla 2 se muestra la clasificación de los IFAs de multifuentes orales de liberación inmediata producidos nacionalmente, según las diferentes clasificaciones provisionales, y si presentan o no polimorfismo. Como se puede observar, un 48,4% de los IFAs (60/124) presentan polimorfismo. De los 124 IFAs de formas sólidas orales de liberación inmediata la OMS clasifica solamente 63 de estos compuestos (50,8%), y 18 de ellos no tienen bien definida su clase dentro del SCB, por lo que solamente un 36,3% de los IFAs de sólidos orales del CBM tiene una clasificación. Resultados similares se alcanzaron siguiendo la clasificación provisional propuesta por Lindenberg y col.16, donde sólo un 31,5% obtuvo una clasificación dentro del SCB. La propuesta de clasificación biofarmacéutica descrita por Kasim y col.5, permitió clasificar un 83,1% de los IFAs, mientras que las clasificaciones provisionales de Pham-The y col.18 y Benet y col.17 permitieron clasificar un 90,3% y un 95,9% de los IFAs, respectivamente.
En la Tabla 2 también se aprecia la clasificación provisional final de los IFAs (SCB final) de formas sólidas de orales de liberación inmediata del CBM de Cuba, considerando las diferentes clasificaciones provisionales publicadas en la literatura. Siguiendo esta metodología, el 66,1% (82/124) de los IFAs fueron clasificados como clase I, III y I/III del SCB. En la clase (I/III) se incluyeron aquellos IFAs cuyos valores de permeabilidad descritos en la literatura eran contradictorios o no estaban determinados.
DISCUSIÓN
Aunque el número de IFAs con estrecho índice terapéutico, identificados dentro de las formas sólidas orales de liberación inmediata del CBM, es bajo (20 compuestos), es pertinente recalcar que no aplican para bioexención por SCB ya que la comparación de perfiles de disolución no permitirá identificar las pequeñas diferencias en biodisponibilidad que pudieran provocar niveles fuera de la ventana terapéutica (producto multifuente sub-biodisponible o supra-biodisponible), conduciendo a una eficacia terapéutica reducida o a la ocurrencia de efectos tóxicos19. Un listado donde se aprecien claramente aquellos fármacos con estrecho índice terapéutico debería incluirse dentro de las guías regulatorias del CECMED vinculadas con la bioequivalencia y la intercambiabilidad terapéutica de medicamentos multifuentes2,20,21.
Como se puede apreciar en la Tabla 2, un 48,4% de los IFAs de los productos multifuentes nacionales presentan, al menos, un polimorfo. Sin embargo, un 68,3% de estos compuestos (41/60) son clasificados como clase I y III del SCB, por lo que su alta solubilidad hace que el polimorfismo no influya en la bioequivalencia. El único efecto que podría tener el polimorfismo en estos fármacos está relacionado con su formulación22. Para el resto de los polimorfos clasificados dentro de las clases II y IV del SCB y que tienen una baja solubilidad, la formulación tiene que ser desarrollada de forma que minimice el efecto del polimorfismo sobre la disolución y la bioequivalencia. Esto no ocurre para estos IFAs cuando la biodisponibilidad está limitada solamente por su permeabilidad intestinal23.
Un total de 39 IFAs fueron provisionalmente clasificados como clase I según el SCB. De ellos hay tres pro-fármacos (difenhidramina, dexclorfeniramina y zidovudina) y una mezcla de productos (dimenhidrinato). Doce de ellos tienen publicadas monografías de bioexención por la Federación Internacional de Farmacéuticos (http://www.fip.org/), sin embargo es conveniente comentar algunos casos, donde se deben tomar en consideración otros aspectos para evitar el potencial riesgo de bioinequivalencia.
La codeína se metaboliza a morfina por la enzima CYP2D6 y su posible efecto tóxico está relacionado con el polimorfismo genético de la misma. Como su efectividad y dosis letal son dependientes de este polimorfismo, es difícil determinar su índice terapéutico. No obstante, la mayoría de la población tiene altos valores de actividad de esta enzima, por lo que se sugiere que la codeína es un buen candidato para bioexención24. La zidovudina es clase I del SCB e inicialmente se consideró un fármaco con estrecho índice terapéutico. Tomando en consideración la relevancia clínica y las severas consecuencias de su bioinequivalencia, es altamente recomendable para una bioexención que se seleccionen cuidadosamente sus excipientes, limitándolos a las mismas cantidades presentes en los productos comerciales. Esto es consistente con lo planteado por la OMS para evitar fallos en la bioequivalencia25. Tanto la zidovudina como la estavudina (clase I del SCB) pueden ser sujetos a bioexención por medio de ensayos de disolución in vitro, no siendo necesario realizar estudios de bioequivalencia en humanos25,26.
En el caso de la cloroquina, aunque los datos de solubilidad y permeabilidad no brindan una completa información sobre el efecto en la absorción gastrointestinal, es clasificado como clase I, por lo que se sugiere su bioexención. Sin embargo, en esta decisión hay que considerar las características peculiares de distribución y eliminación de este producto. Su gran volumen de distribución (entre 200-800 L/kg) conduce a una semivida de eliminación entre 20 y 60 días y hace muy complejo un estudio de bioequivalencia in vivo27. El riesgo de bioinequivalencia es bajo, si el formulado contiene excipientes conocidos e incluidos en productos comerciales de este IFA y si cumple los requerimientos de rápida velocidad de disolución a pH entre 1-6,828.
La amitriptilina es un compuesto clasificado como clase I y aunque tiene una alta permeabilidad, sus datos de solubilidad en las condiciones de pH y temperatura del SCB no se describen en la literatura, es por ello que se clasifica en la frontera entre clase I/II29. Sin embargo, aun cuando tenga una solubilidad limitada a pH=7,5 y a 37ºC, esto no es un impedimento para que ocurra su absorción in vivo, pues posee una alta permeabilidad y su absorción ocurre en la primera porción del intestino delgado donde el valor de pH es inferior a 7. Debido a esto, puede esperarse que los ensayos de disolución in vitro detecten bio-inequivalencias causadas por diferencias en la disolución in vivo29.
Por otro lado, un total de 27 IFAs fueron provisionalmente clasificados como clase III del SCB y de ellos, seis tienen publicadas monografías sobre bioexención (ver Tabla 2). Aunque estos fármacos son considerados para bioexención por las principales agencias regulatorias, se debe tener un control de los excipientes utilizados en el formulado y que tengan una muy rápida velocidad de disolución (ej. piracinamida y lamivudina)30,31.
Existe otro grupo de clasificación donde se incluyeron los compuestos con alta solubilidad, pero con datos de permeabilidad no claramente definidos (clase I/III). En la Tabla 2 se da una clasificación provisional entre uno de los dos grupos, tomando en consideración un profundo análisis de los datos de permeabilidad descritos en la literatura. Un total de 16 IFAs fueron provisionalmente clasificados en este grupo y de ellos hay dos que son mezclas de productos (rutascorbin y kogrip) y un profármaco (prednisona). De estos IFAs, tres tienen publicadas monografías sobre bioexención. Uno de estos compuestos es la isoniazida, y aunque sus datos de excreción urinaria y de biodisponibilidad sugieren una alta permeabilidad, los mismos no son completamente confiables por las metodologías experimentales utilizadas para la determinación de ambas propiedades. Se recomienda una bioexención, sólo si contiene los mismos excipientes utilizados en productos comerciales de isoniazida. Si la formulación contiene lactosa u otra sacarina se deben realizar estudios de bioequivalencia in vivo32. Otro de los IFAs clasificados en este grupo es la prednisona. Este compuesto presenta características interesantes, tiene alta solubilidad para dosis inferiores a 50 mg, sus valores de permeabilidad en líneas celulares son bajos, mientras que la fracción absorbida es alta. Algunos autores lo sitúan en la frontera de un clase I, pero se han descrito correlaciones in vitro/in vivo, lo cual no está en concordancia con lo que se espera para este grupo33.
De forma general, se puede considerar que cualquier bioexención de productos de liberación inmediata de estos IFAs, deben seguir el criterio de una muy rápida velocidad de disolución (más del 85% de la dosis disuelta en 15 minutos) y tomar en consideración el uso de excipientes conocidos y que estén presentes en productos comerciales aprobados por la ICH (International Conference of Harmonization) (https://www.ich.org).
El total de IFAs clasificados dentro de las clases I, III y I/III del SCB es de 82, lo que representa el 66,1% del total de IFAs de formulaciones sólidas orales de liberación inmediata y acción sistémica del CBM producidas en Cuba. Este resultado sugiere que la intercambiabilidad terapéutica puede demostrarse potencialmente con un ensayo de disolución in vitro menos costoso y más fácil de realizar, manteniendo la eficacia y calidad de los productos multifuentes.
Aunque los IFAs clase II y IV no son considerados para bioexención por el SCB, se hizo un análisis de sus propiedades biofarmacéuticas que permitió su clasificación en este sistema. Un total de 30 IFAs fueron provisionalmente clasificados como clase II, nueve como clase IV, y 3 como clase II/IV, según el SCB. De estos IFAs, cuatro tienen publicadas monografías sobre bioexención (ver Tabla 2).
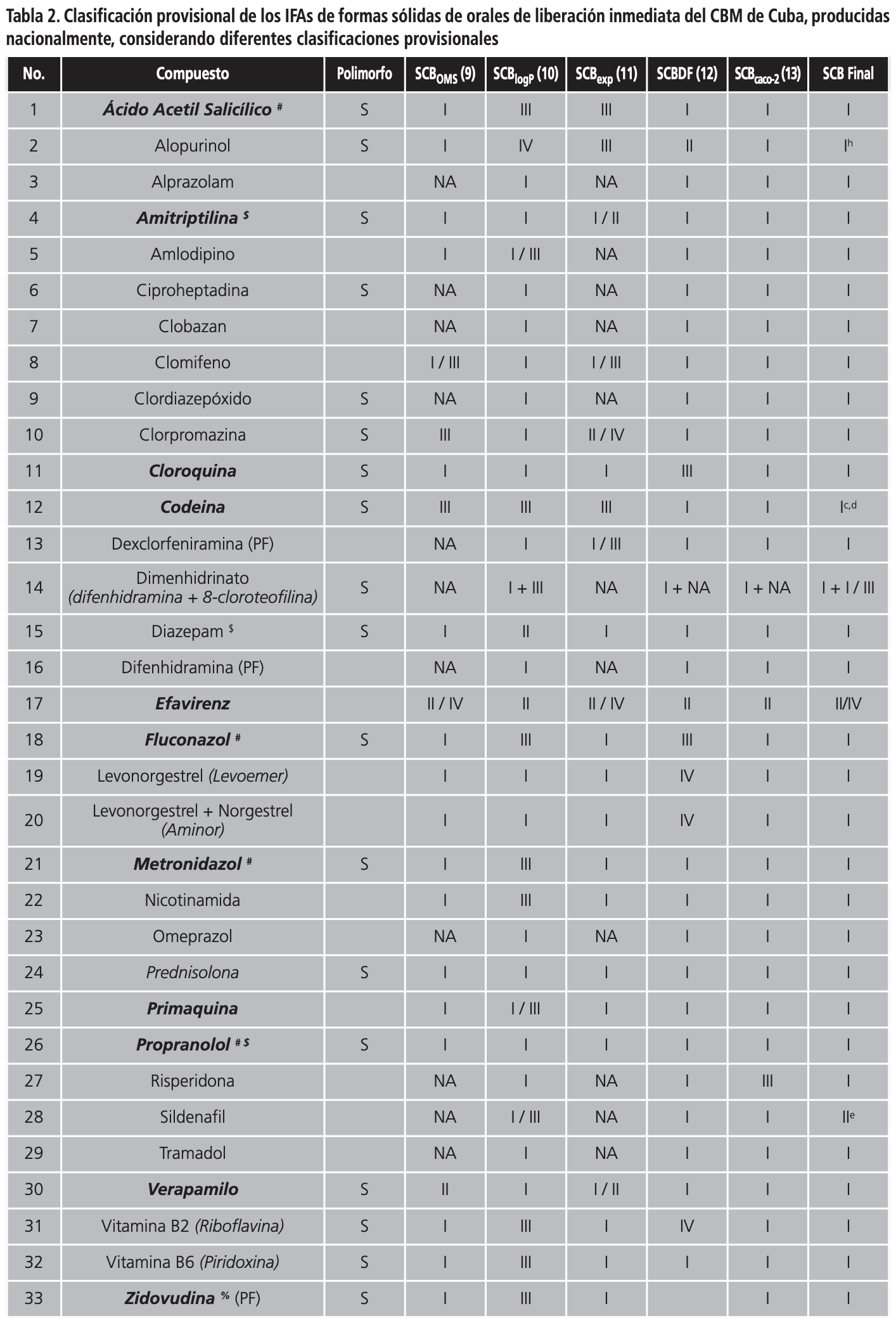
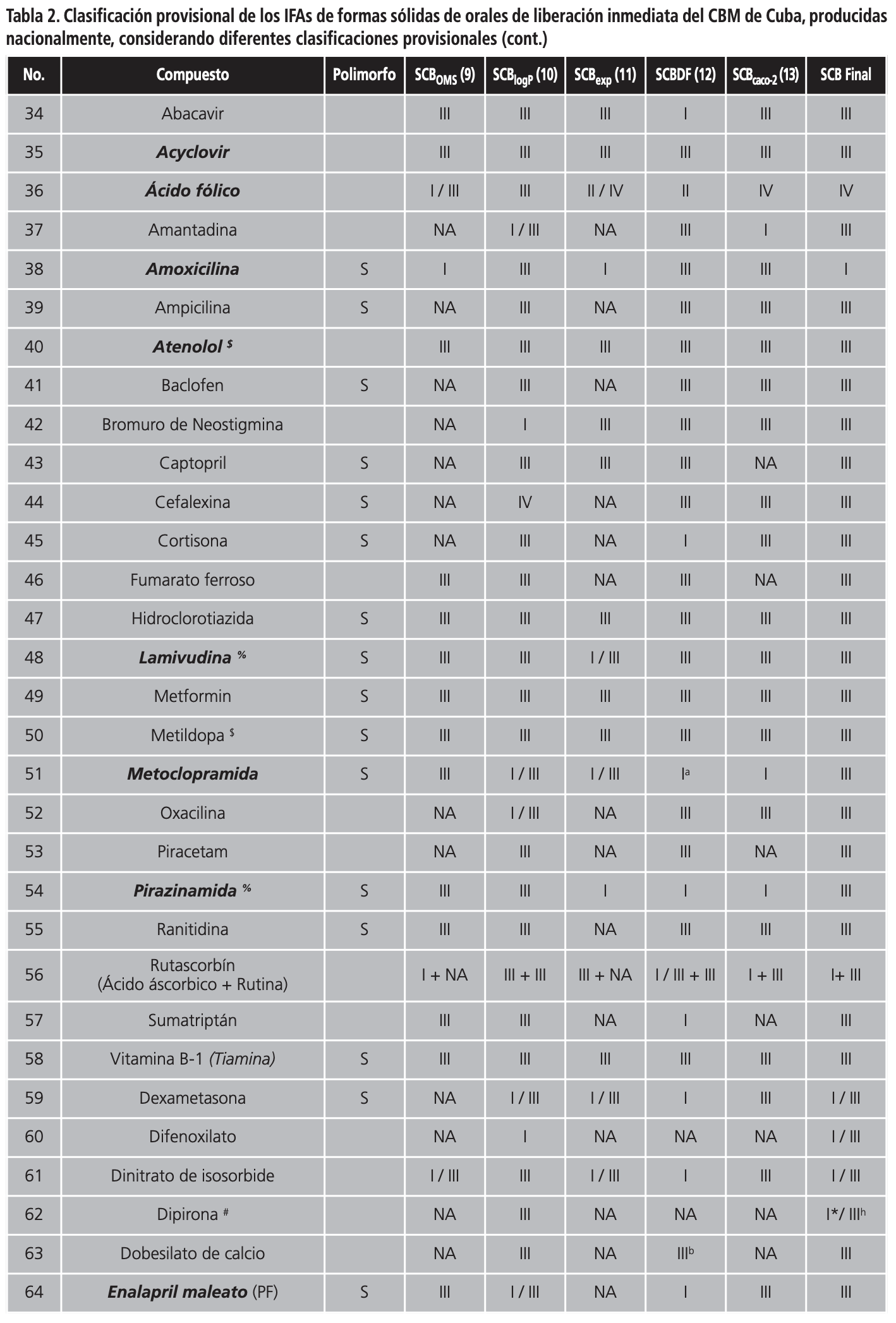
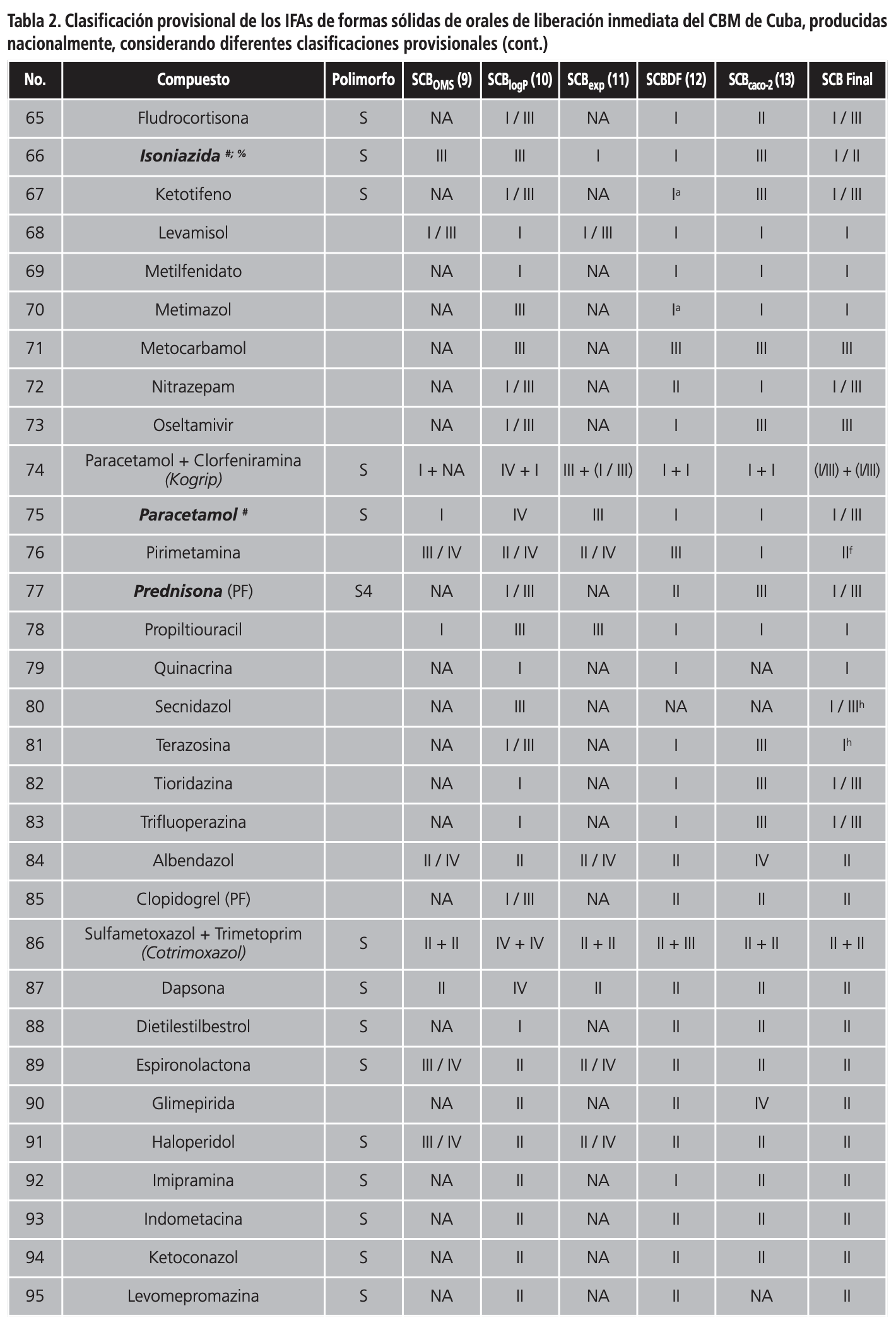
Recientemente, Amidon y col. han propuesto una extensión del SCB para incluir sub-especificaciones para compuestos ácidos, básicos y neutros clasificados dentro de las clases II y IV del SCB34, considerando el impacto que tiene el pKa en la solubilidad acuosa de estos fármacos.
La sustitución de los costosos ensayos in vivo en humanos por estudios de velocidad de disolución, simples y estandarizados, garantiza un adecuado comportamiento clínico de los productos comercializados. Esta simple sustitución tiene una peculiar relevancia en países en vías de desarrollo, ya que representa un sustancial ahorro de recursos, si se toma en consideración el costo que implica un ensayo clínico para la demostración de intercambiabilidad terapéutica de productos multifuentes.
En muchas situaciones los estudios de bioequivalencia in vitro son superiores a los estudios de bioequivalencia in vivo35. Los estudios de bioequivalencia in vitro permiten una evaluación directa del comportamiento del fármaco que los ensayos farmacocinéticos en humanos en los estudios de bioequivalencia, ya que los primeros comparan la absorción de fármacos entre el producto de ensayo y el de referencia, mientras que los estudios in vivo pueden sufrir complicaciones (ej. fármacos de alta variabilidad), debido a procesos de metabolismo y reciclaje enterohepático, siendo una aproximación indirecta. Aunque los estudios de bioequivalencia son considerados “el estándar de oro”, se debe tener presente que estos son una simulación de la situación real porque se realizan en voluntarios sanos y bajo condiciones muy controladas. En la práctica, la administración a pacientes podría conducir fácilmente a otros resultados debido a una fisiología gastrointestinal diferente o variaciones en las condiciones de dosificación. Es por ello que los ensayos de velocidad de disolución a diferentes valores de pH, pudieran representar mejor el comportamiento real y discriminar mejor el producto innovador del de ensayo. Este argumento es especialmente válido para compuestos muy solubles (clase I y III del SCB), ya que además del pH, otras variaciones en la fisiología del tracto gastrointestinal no son tan importantes en el comportamiento del fármaco. Finalmente, los aspectos éticos se decantan a favor de la aplicación de la bioequivalencia in vitro.
De forma general, la metodología seguida para lograr una clasificación provisional, según el SCB, de los IFAs de formas sólidas orales de liberación inmediata del Cuadro Básico de Medicamentos, se ha empleado en la clasificación del Listado de Medicamentos Esenciales de la OMS10 y pudiera utilizarse en la clasificación de los listados de medicamentos de los diferentes países que incluyen en su regulatoria la utilización del SCB para demostrar la intercambiabilidad terapéutica de productos multifuentes, contribuyendo a una potencial armonización de la regulatoria.
CONCLUSIONES
La aplicación combinada de los diferentes sistemas de clasificación biofarmacéutica clasificó provisionalmente, dentro de las clases I, III y I/III del SCB, el 66,1% de los IFAs de formas sólidas orales de liberación inmediata del CBM de Cuba, los cuales podrían ser bioexonerados de ensayos de bioequivalencia in vivo en humanos.
La sustitución de los costosos ensayos de bioequivalencia in vivo en humanos por ensayos de disolución rápidos, sencillos y confiables permitiría demostrar la intercambiabilidad terapéutica de los productos multifuentes nacionales a un menor costo económico y ético, posibilitando el registro y comercialización de medicamentos seguros y efectivos.
Conflicto de intereses: Los autores declaran no tener conflicto de intereses.
BIBLIOGRAFÍA
1. WHO. Multisource (generic) pharmaceutical products:guidelines on registration requirements to establish interchangeability. Annex 6, WHO Tech Rep Ser No 1003. 2017:181-236.
2. CECMED. Regulación 18-07: Requerimientos Para Estudios de Biodisponibilidad y Bioequivalencia. Habana; 2007.
3. Amidon GL, Lennernäs H, Shah VP, Crison JR. A theoretical basis for a biopharmaceutic drug classification: the correlation of in vitro drug product dissolution and in vivo bioavailability. Pharm Res. 1995;12(3):413-420.
4. Mehta MU, Uppoor RS, Conner DP, et al. Impact of the US FDA Biopharmaceutics Classification System (BCS) Guidance on Global Drug Development. Mol Pharm. 2017;14(12):4334-4338. doi:10.1021/acs.molpharmaceut. 7b00687
5. Kasim NA, Whitehouse M, Ramachandran C, et al. Molecular Properties of WHO Essential Drugs and Provisional Biopharmaceutical Classification. Mol Pharm. 2004;1(1):85-96.
6. Wu CY, Benet LZ. Predicting drug disposition via application of BCS: transport/absorption/ elimination interplay and development of a biopharmaceutics drug disposition classification system. Pharm Res. 2005;22(1):11-23.
7. Pham-The H, Garrigues T, Bermejo M, et al. Provisional classification and in silico study of biopharmaceutical system based on caco-2 cell permeability and dose number. Mol Pharm. 2013;10(6):2445-2461.
8. Dahan A, Wolk O, Kim YH, et al. Purely in Silico BCS Classification: Science Based Quality Standards for the World’s Drugs. Mol Pharm. 2013;10:4378-4390.
9. Lindenberg M, Kopp S, Dressman JBB. Classification of orally administered drugs on the World Health Organization Model list of Essential Medicines according to the biopharmaceutics classification system. Eur J Pharm Biopharm. 2004;58(2):265-278.
10. Cabrera-Pérez MÁ, Pham-The H, Cervera MF, Hernández-Armengol R, Miranda-Pérez de Alejo C, Brito-Ferrer Y. Integrating theoretical and experimental permeability estimations for provisional biopharmaceutical classification: Application to the WHO essential medicines. Biopharm Drug Dispos. 2018;39(7): 354-368.
11. Takagi T, Ramachandran C, Bermejo M, Yamashita S, Yu LX, Amidon GL. A Provisional Biopharmaceutical Classification of the Top 200 Oral Drug Products in the United States, Great Britain, Spain, and Japan. Mol Pharm. 2006; 3(6):631-643.
12. Sánchez González CA. Experiencia Reguladora Cubana en Calidad y Bioequivalencia para la Intercambiabilidad Terapéutica de Medicamentos Genéricos. Acta Farm Bonaer. 2006;25(3):468-473.
13. Dirección de Medicamentos y Tecnologías Médicas. Ministerio de Salud. Cuadro Básico de Medicamentos de Cuba 2019. La Habana; 2019.
14. Yalkowsky SH, He Y, Jain P. Handbook of Aqueous Solubility Data. Second. 6000 Broken Sound Parkway NW, Suite 300 Boca Raton, FL 33487-2742, USA: CRC Press Taylor & Francis Group; 2010.
15. WHO. Proposal to waive in vivo bioequivalence requirements for WHO Model List of Essential Medicines immediate-release, solid oral dosage forms. Annex 8, of WHO Expert Committee on Specification for Pharmaceutical Preparations. In: WHO Technical Report Series, No. 937. 40th ed. Geneva: World Health Organization: WHO Expert Committee on Specification for Pharmaceutical Preparations; 2006:391-461.
16. Lindenberg M, Kopp S, Dressman JBB. Classification of orally administered drugs on the World Health Organization Model list of Essential Medicines according to the biopharmaceutics classification system. Eur J Pharm Biopharm. 2004;58(2):265-278.
17. Benet LZ, Broccatelli F, Oprea TI. BDDCS Applied to Over 900 Drugs. AAPS J. 2011;13(4):519-547.
18. Pham-The H, Garrigues T, Bermejo M, González-Álvarez I, Monteagudo MC, Cabrera-Pérez MÁ. Provisional Classification and in Silico Study of Biopharmaceutical System Based on Caco-2 Cell Permeability and Dose Number. Mol Pharm. 2013;10(6):2445-2461.
19. Davit B, Braddy AC, Conner DP, Yu LX. International Guidelines for Bioequivalence of Systemically Available Orally Administered Generic Drug Products: A Survey of Similarities and Differences. AAPS J. 2013;15(4):974-990.
20. CECMED. Regulación No. 48 / 2007 Requisitos Para Aplicar y/o Diseñar Un Ensayo de Disolución En Cápsulas y Tabletas de Liberación Inmediata. 2007.
21. CECMED. Regulación 41/2005: Requerimientos de La Demostración de Intercambiabilidad Terapéutica Para El Registro de Los Productos Farmacéuticos Multiorigen. La Habana; 2005.
22. Sánchez E, Jung H, Yépez L, Hernández-Abad V. Relevancia del polimorfismo en el área farmacéutica. Rev Mex Ciencias Farm. 2007;38(2):57-76.
23. Raw a. Regulatory considerations of pharmaceutical solid polymorphism in Abbreviated New Drug Applications (ANDAs). Adv Drug Deliv Rev. 2004;56(3): 397-414.
24. Dahan A, Wolk O, Zur M, et al. Biowaiver Monographs for Immediate-Release Solid Oral Dosage Forms: Codeine Phosphate. J Pharm Sci. 2014:1-9.
25. Soares KC, Rediguieri CF, Souza J, et al. Biowaiver monographs for immediate-release solid oral dosage forms: Zidovudine (Azidothymidine). J Pharm Sci. 2013;102(8):2409-2423.
26. Silva ALL, Cristofoletti R, Storpirtis S, et al. Biowaiver Monographs for Immediate-Release Solid Oral Dosage Forms: Stavudine. 2012;101(1):10-16.
27. Verbeeck RK, Junginger HE, Midha KK, Shah VP, Barends DM. Biowaiver Monographs for Immediate Release Solid Oral Dosage Forms Based on System (BCS) Literature Data: Chloroquine Phosphate, Chloroquine Sulfate, and Chloroquine Hydrochloride. J Pharm Sci. 2005;94(7):1389-1395.
28. Verbeeck RK, Junginger HE, Midha KK, Shah VP, Barends DM. Biowaiver Monographs for Immediate Release Solid Oral Dosage Forms Based on Biopharmaceutics Classification System ( BCS ) Literature Data: Chloroquine Phosphate, Chloroquine Sulfate, and Chloroquine Hydrochloride. 2005;94(7): 1389-1395.
29. Manzo RH, Olivera ME, Amidon GL, Shah VP, Dressman JB, Barends DM. Biowaiver Monographs for Immediate Release Solid Oral Dosage Forms: Amitriptyline Hydrochloride. J Pharm Sci. 2006;95(5):966-973.
30. Becker C, Dressman JB, Amidon GL, et al. Biowaiver Monographs for Immediate Release Solid Oral Dosage Forms: Pyrazinamide. J Pharm Sci. 2008; 97(9):3709-3720.
31. Strauch S, Jantratid E, Dressman JB, et al. Biowaiver Monographs for Immediate Release Solid Oral Dosage Forms: Lamivudine. J Pharm Sci. 2011; 100(6):2054-2063.
32. Becker C, Dressman JB, Amidon GL, et al. Biowaiver Monographs for Immediate Release Solid Oral Dosage Forms: Isoniazid. J Pharm Sci. 2007; 96(3):522-531.
33. Vogt M, Derendorf H, Kramer J, et al. Biowaiver Monographs for Immediate Release Solid Oral Dosage Forms : Prednisone. J Pharm Sci. 2007;96(6):1480-1489.
34. Tsume Y, Mudie DM, Langguth P, Amidon GE, Amidon GL. The Biopharmaceutics Classification System: Subclasses for in vivo predictive dissolution (IPD) methodology and IVIVC. Eur J Pharm Sci. 2014;57:152-163.
35. Polli JE. In Vitro Studies are Sometimes Better than Conventional Human Pharmacokinetic In Vivo Studies in Assessing Bioequivalence of Immediate-Release Solid Oral Dosage Forms. AAPS J. 2008;10(2):289-299.
_____
