Rev. OFIL 2018, 28;1:44-56
Fecha de recepción: 30/11/2017 – Fecha de aceptación: 06/12/2017
Gaspar Carreño M1, Márquez Peiró JF2, Achau Muñoz R1
1 Servicio de Farmacia. Hospital Intermutual de Levante. Valencia (España)
2 Servicio de Farmacia. Hospital Vithas Perpetuo Internacional. Alicante (España)
____
Resumen
Los equipos de protección individual (EPI) están destinados a la protección del trabajador de riesgos que puedan amenazar su seguridad, debiendo considerarse el último recurso o barrera de protección entre el trabajador y el riesgo. Por ello, su utilización se deberá realizar cuando la implantación de medidas de protección colectiva o prevención primaria, no garanticen la suficiente limitación de riesgos para la seguridad de los trabajadores, como es el caso de la manipulación de medicamentos peligrosos en el ámbito sanitario.
En el presente artículo, se recogen las exigencias mínimas de seguridad relacionadas con la utilización de los EPI por el personal sanitario en el manejo de medicamentos peligrosos, recogidas en la legislación española y directrices europeas. Así mismo, también se contemplan las recomendaciones de los organismos relacionados con la salud laboral, para realizar una adecuada selección de los equipos de protección individual, recogiendo, para cada tipo de EPI, las condiciones de utilización, y las especificaciones técnicas y de calidad que deben cumplir para asegurar la adecuada protección del personal encargado del manejo de medicamentos peligrosos.
Palabras clave: Equipo protección individual, trabajadores sanitarios, medicamento, peligroso, salud laboral.
____
Correspondencia:
Marisa Gaspar Carreño
Hospital Intermutual de Levante
(Servicio de Farmacia)
Autovía CV-35 Valencia a Ademuz Km 11,7 – Salida nº 12
46184 San Antonio de Benagéber (Valencia)
Correo electrónico: mgaspar@hilevante.com
_____
Introducción y conceptos básicos
Medidas de protección individual
El artículo 40.2 de la Constitución Española1 encomienda a los poderes públicos, como uno de los principios rectores de la política social y económica, velar por la seguridad e higiene en el trabajo. Este mandato constitucional conlleva la necesidad de desarrollar una política de protección de la salud de los trabajadores mediante la prevención de los riesgos derivados de su trabajo y encuentra en la Ley de Prevención de Riesgos Laborales2 su pilar fundamental. En Latinoamérica, en países como Costa Rica en el artículo 38 de la Ley General de Sanidad3, así como en su Reglamento sobre gestión de desechos infecto-contagiosos, refiere que es función esencial del Estado velar por la protección de la salud de la población4.
En cumplimiento del deber de protección, el empresario deberá garantizar la seguridad y la salud de los trabajadores a su servicio en todos los aspectos relacionados con el trabajo. El empresario deberá realizar una evaluación de los riesgos para la seguridad y salud de los trabajadores. Si esta pusiera de manifiesto situaciones de riesgo, el empresario realizará aquellas actividades preventivas necesarias para eliminar o reducir y controlar tales riesgos.
En este sentido, deberá proporcionar a sus trabajadores equipos de protección individual (EPI) adecuados para el desempeño de sus funciones y velar por el uso efectivo de los mismos cuando, por la naturaleza de los trabajos realizados, sean necesarios. Los EPI deberán utilizarse cuando los riesgos no se puedan evitar, o no puedan limitarse suficientemente por medios técnicos de protección colectiva o mediante medidas o procedimientos de organización del trabajo.
Marco legislativo para los equipos de protección individual
Un EPI es cualquier equipo destinado a ser llevado o sujetado por el trabajador para que lo proteja de uno o más riesgos que puedan amenazar su seguridad y/o salud, así como cualquier complemento destinado al mismo fin.
En Europa, los EPI se regulan siguiendo los objetivos de la legislación del nuevo enfoque, y, por tanto, se quiere con estas normativas garantizar la seguridad de los productos, y al mismo tiempo, asegurar el libre comercio.
Las directivas que siguen este modelo legislativo tienen como características:
– Definición de requisitos esenciales, o aspectos imprescindibles de obligado cumplimiento. No son iguales para todos los EPI, sino que dependen del tipo del que se trate. En el anexo II del RD 1407/19925 y del Reglamento 2016/4256, se establecen las exigencias esenciales de sanidad y seguridad que deben cumplir los EPI, tanto los requisitos de alcance general, las exigencias complementarias comunes a varios tipos o clases de EPI y las exigencias complementarias específicas de los riesgos que hay que prevenir. En este sentido, en el punto 3.10 se establecen las exigencias complementarias específicas que deben cumplir los EPI para la protección contra sustancias peligrosas y agentes infecciosos.
– Referencia a normas técnicas, elaboradas por organismos de normalización, que tratan sobre los procedimientos de fabricación, y otros aspectos. No son de obligado cumplimiento, pero son unas guías para alcanzar los requisitos esenciales. Las que desarrollan los requisitos esenciales o requisitos derivados de los mismos, se denominan normas armonizadas y aunque no dejan de ser voluntarias, si se siguen, se asegura el cumplimiento de los requisitos esenciales. En cada tipo de EPI existirán diferentes normas técnicas que es importante conocer si cumplen o no, en la evaluación y selección.
– Flexibilidad en procedimientos de evaluación, distinto según el riesgo para la salud que conlleve un fallo en el EPI. Esto obliga a clasificar los EPI en categorías (RD 1407/1992)5:
✓ Categoría I: corresponde a los EPI destinados a proteger contra riesgos mínimos cuyos efectos, cuando sean graduales, puedan ser percibidos a tiempo y sin peligro.
✓ Categoría II: EPI que no se incluyan en la categoría I y III.
✓ Categoría III: equipos destinados a proteger contra riesgos de consecuencias graves, mortales o irreversibles sin que el usuario pueda descubrir a tiempo su efecto inmediato. A esta categoría pertenecen, por ejemplo, los EPI que solo brinden una protección limitada en el tiempo contra las agresiones químicas. Es el caso de los EPI utilizados para la manipulación de medicamentos peligrosos (MP).
– Evaluación desvinculada de las autoridades, ya que los organismos que evalúan la conformidad con los requisitos esenciales son los organismos notificados (ON).
– Reconocimiento mutuo de las evaluaciones de los ON por todos los estados miembros y como consecuencia, libre circulación de los productos que ostenten el marcado CE.
En la Unión Europea, existe un doble marco normativo, para garantizar la calidad y seguridad de los EPI. Por una parte, tenemos el Real Decreto 773/19977, sobre disposiciones mínimas de seguridad y salud relativas a la utilización por los trabajadores de EPI, transposición del ordenamiento jurídico español de la Directiva Comunitaria 85/656/CEE7, y en el que se basó el Instituto Nacional de Salud e Higiene en el Trabajo (INSHT) para la publicación de la Guía Técnica para la utilización por los trabajadores de equipos de protección individual8.
Por otra parte, tenemos la Directiva 89/686/CEE del Consejo9, sobre aproximación de las legislaciones de los Estado miembros relativas a los EPI, transpuesta en España a través del Real Decreto 1407/19925, por el que se regulan las condiciones para la comercialización y libre circulación intracomunitaria de los EPI. Esta directiva, ha sido derogada por el Reglamento 216/425 del Parlamento Europeo y del Consejo6, relativo a los EPI, que será de aplicación en su mayor parte a partir del 21 de abril de 2018. Este nuevo reglamento establece los requisitos sobre el diseño y fabricación de los EPI que vayan a comercializarse, para garantizar la protección de la salud y la seguridad de los usuarios, y establecer las normas relativas a la libre circulación de EPI en la Unión Europea. De esta forma se establecen normas claras y detalladas que no dan margen a una transposición divergente por parte de los Estados miembros.
De acuerdo con este Reglamento, se presumirá que los EPI que son conformes con normas armonizadas o parte de estas, cuyas referencias se han publicado en el Diario Oficial de la Unión Europea, son conformes con los requisitos esenciales de salud y seguridad que se definen en el Anexo II del Reglamento6.
El fabricante es responsable de evaluar el EPI frente a los requisitos esenciales y ha de tener en cuenta en el proceso de diseño, tanto el uso previsto, como el uso previsible. Los procedimientos de evaluación de conformidad que deben seguirse respecto a cada categoría de riesgos, se definen en el Reglamento 216/4256. Además, en el caso de los EPI utilizados en la manipulación de MP, al ser de categoría III, de acuerdo con el Anexo I del Reglamento 216/4256, se debe realizar un examen UE de tipo (parte de procedimiento de evaluación de la conformidad mediante la cual un organismo notificado (ON) examina el diseño técnico de un EPI, verifica y certifica que dicho diseño técnico cumple los requisitos del Reglamento que le son aplicables), y cualquiera de las dos opciones siguientes:
– Conformidad con el tipo basada en el control interno de la producción, más un control supervisado de producto a intervalos aleatorios. Se efectúa con la evaluación de la adecuación del diseño técnico del EPI mediante el examen de la documentación técnica, además de realizar los exámenes pertinentes a un ejemplar representativo de la producción prevista del EPI completo.
– Conformidad con el tipo basada en el aseguramiento de la calidad del proceso de producción. El fabricante debe cumplir las siguientes obligaciones: 1) Elaborar una documentación técnica donde garantiza y declara, que el EPI en cuestión es conforme con el tipo descrito en el certificado de examen UE de tipo. 2) Toma todas las medidas necesarias para que el proceso de fabricación y su supervisión garanticen la conformidad del EPI fabricado con el tipo descrito en el certificado de examen UE de tipo y con los requisitos aplicables del presente Reglamento. 3) Acompañar el marcado CE en cada EPI y su declaración UE de conformidad.
El plazo de validez del nuevo certificado expedido y, en su caso, del certificado renovado no excederá de cinco años. Es obligatorio la presentación de la Declaración UE de conformidad en cada uno de los EPI, o bien incluir una página web en el folleto informativo donde se pueda encontrar la misma. Esta documentación estará a disposición de las autoridades nacionales durante un período de diez años a partir de la introducción del EPI en el mercado.
Los equipos destinados a usarse como EPI y como producto sanitario (PS), se denominan productos de uso dual. Por ello, están sujetos en cuanto a su diseño y fabricación a los requisitos legales de la Directiva 89/686/CEE9, transpuesta al ordenamiento español por el Real Decreto 1407/19925. Como PS, tienen el fin de prevenir una enfermedad en el paciente por transmisión al mismo de agentes biológicos portados por él deben cumplir además con las disposiciones relativas a la comercialización de PS (Directiva 93/42/CEE10, modificada por la Directiva 2007/47/CE11, hasta la entrada en vigor de los nuevos Reglamentos sobre PS. A nivel nacional, el contenido de estas Directivas, está recogido, en el Real Decreto 1591/200912, por el que se regulan los productos sanitarios (aún en vigor)).
Selección de Equipos de Protección
En el artículo 6 del Real Decreto 773/19977, se establecen las actuaciones que deben llevarse a cabo para la elección de los equipos de protección individual, y que se representan de manera esquemática en la Guía Técnica para la utilización por los trabajadores de equipos de protección individual del INSHT (Figura 1)8.
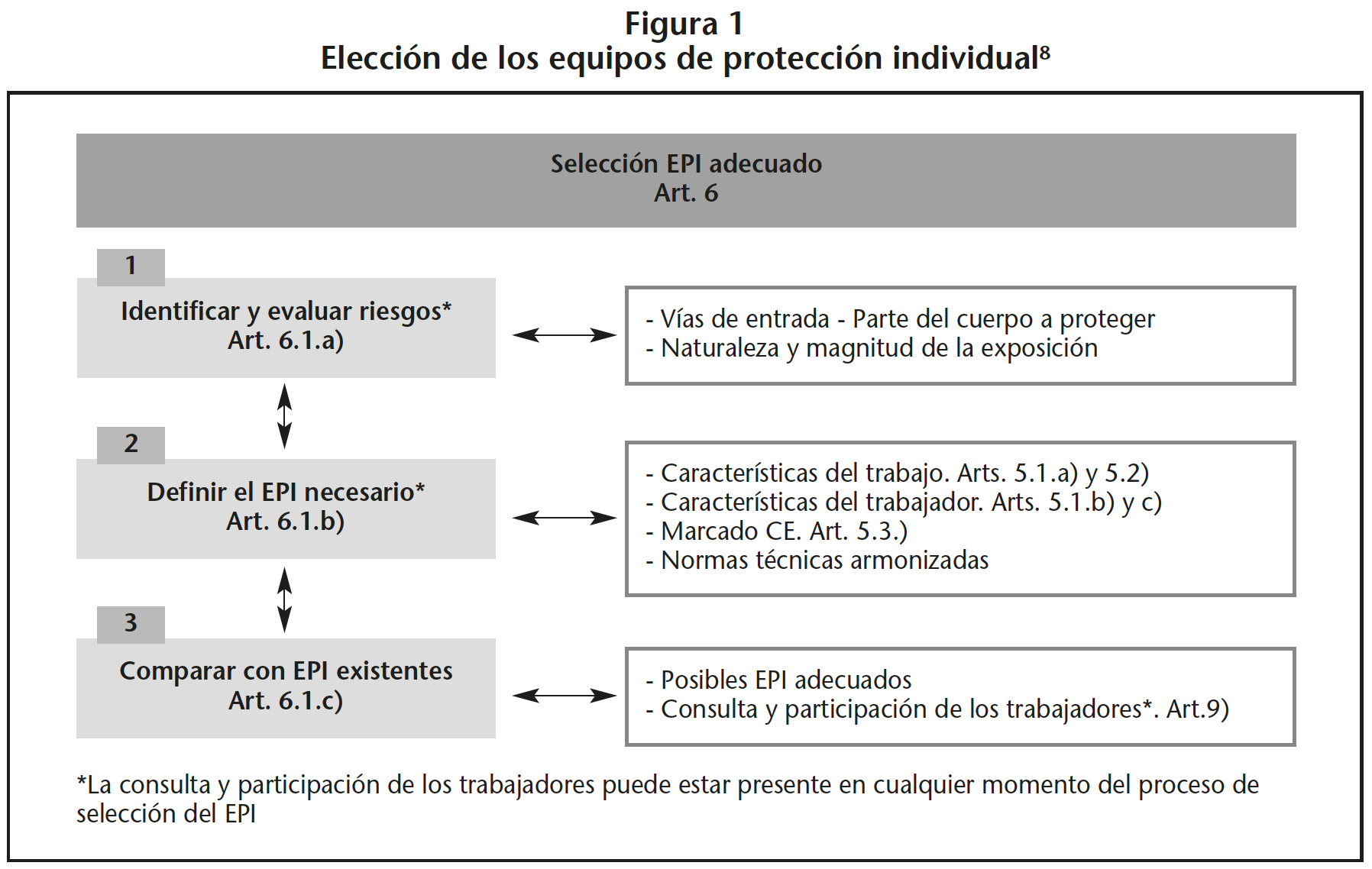
Así, en la manipulación de MP, deben utilizarse EPI que permitan una protección eficaz frente a los riesgos que motivan su uso, sin suponer por sí mismos un riesgo adicional ni molestias innecesarias. Se recomienda llevar a cabo el siguiente decálogo de actuaciones previas para elegir el EPI adecuado:
- Analizar y evaluar los riesgos existentes que no pueden evitarse con los medios de prevención primaria cuando se manipulan MP, según las características del trabajo.
- Identificar las vías de exposición principales y excepcionales de potencial contaminación para los manipuladores en cada tarea específica.
- Identificar las condiciones del lugar de trabajo donde puede ocurrir la exposición a MP y las condiciones relativas al desarrollo de cada tarea específica.
- Definir las características que deberán reunir los EPI para garantizar su función.
- Comparar los productos existentes en el mercado.
- Comprobar que cumplen con el marcado CE, con la especificación de producto sanitario si así se requiere, y con las normas técnicas armonizadas exigibles.
- Comprobar que cumplen con normas de calidad adicionales recomendadas.
- Establecer las condiciones de uso para evitar riesgos por utilización incorrecta.
- Verificar las condiciones anatómicas, para lo cual se considera imprescindible la participación de los manipuladores para comprobar la comodidad, el ajuste y las preferencias personales; en concreto, la talla y el diseño para que se adapte correctamente con los ajustes necesarios.
- Las condiciones fisiológicas y el estado de salud del trabajador, con especial atención a la sensibilidad de determinados trabajadores a materiales y a las características fisiológicas particulares de ellos.
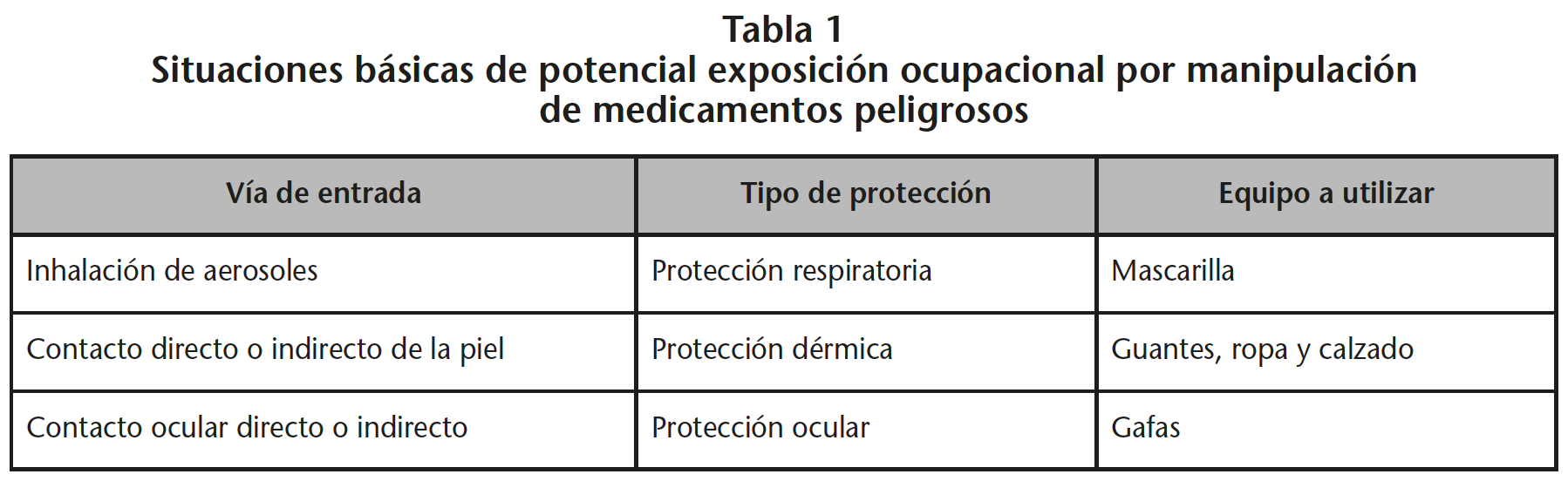
Aplicando estas actuaciones al manejo de MP podemos observar que existe riesgo de exposición en cualquiera de las fases en las que se manipula o entra en contacto con el medicamento y/o sus residuos, ya sea en la recepción de los medicamentos en el almacén de farmacia, como durante el almacenamiento, preparación, distribución interna, administración, y/o gestión de residuos y excretas. La exposición se puede producir cuando se generan aerosoles y/o polvo en suspensión durante estas fases, al limpiar líquidos derramados o por contacto con superficies contaminadas. En el resto de los casos se deben utilizar EPI para prevenir la exposición. Atendiendo a esto, se deben utilizar EPI que eviten la exposición por estas vías, como protección respiratoria, protección ocular, ropa de protección y guantes (Tabla 1).
No todas las actividades presentan el mismo riesgo de exposición, siendo necesario conocer no solo la naturaleza de la exposición, sino también su magnitud. Se tendrá que tener en cuenta las características del trabajo y las del trabajador. Así, por ejemplo, el National Institute for Occupational Safety and Health (NIOSH)13 establece los siguientes EPI para determinadas actividades en las que existe riesgo de exposición a MP. Estas recomendaciones del EPI a utilizar, han sido recogidas en el Documento Técnico 87.1:16, Medicamentos Peligrosos, medidas de prevención para su preparación y administración14, del INSHT, y en la Monografía de Farmacia Hospitalaria y de Atención Primaria: Medicamentos peligrosos, que edita la SEFH15 (Tabla 2).
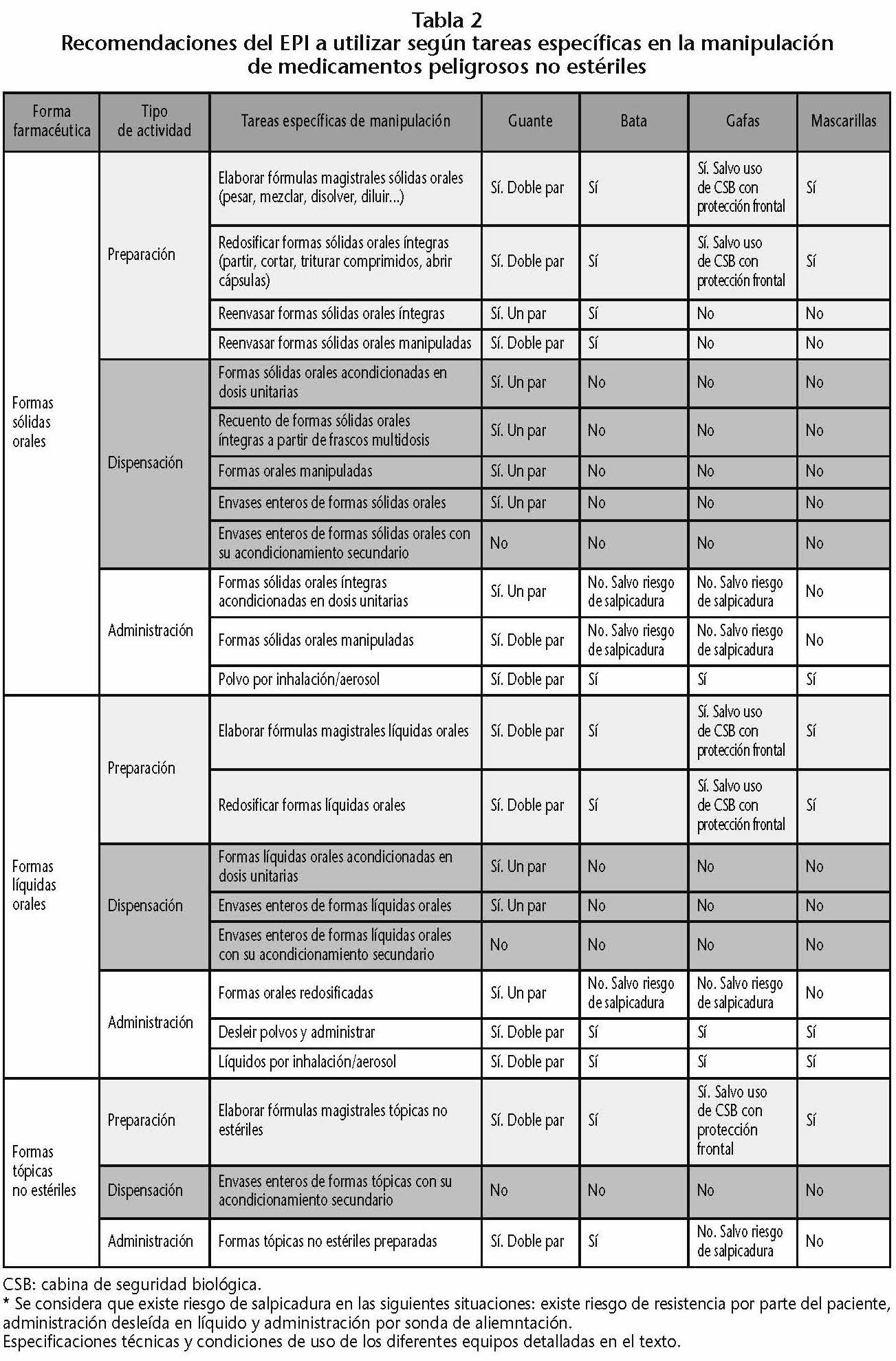
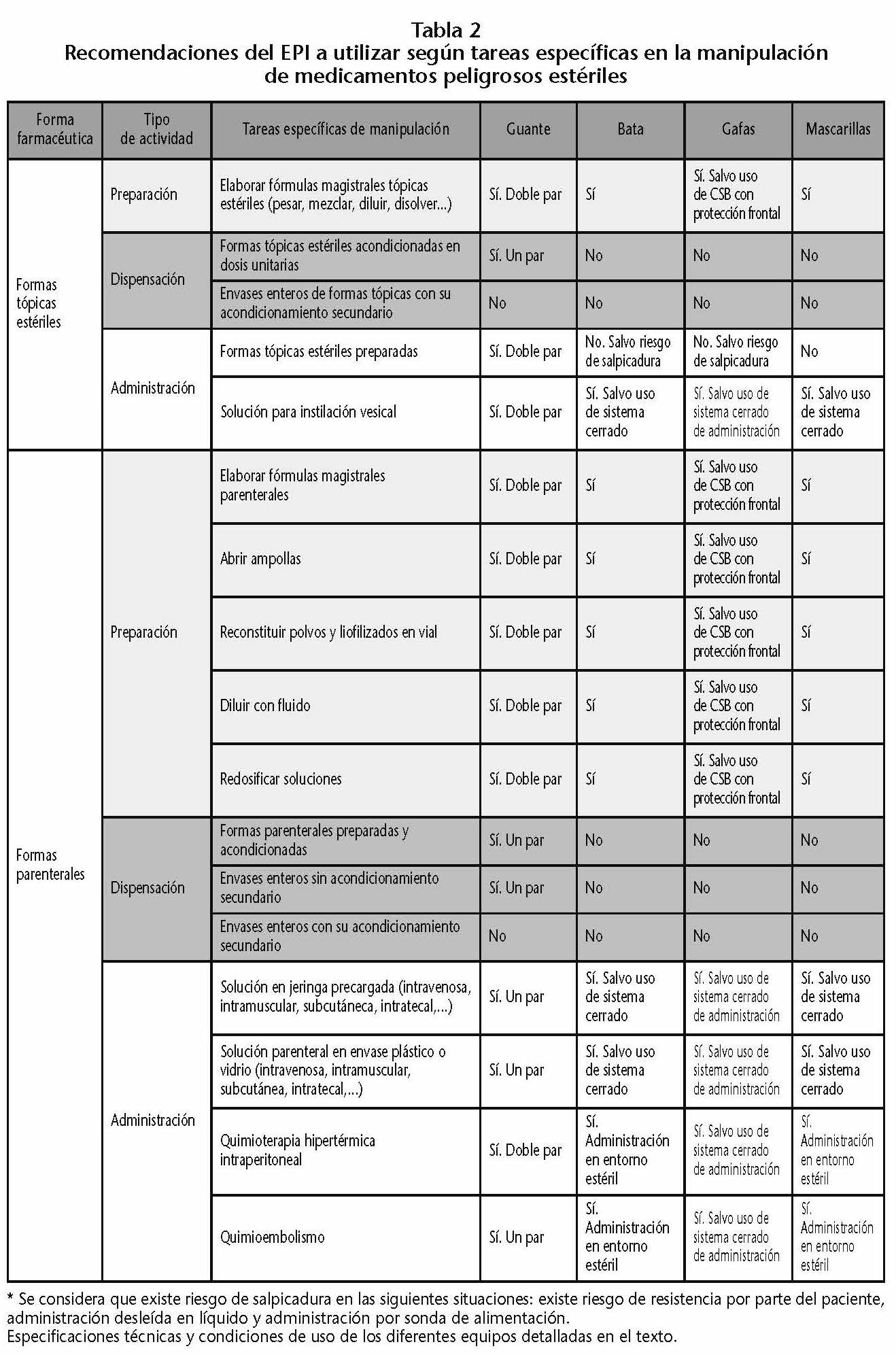
Es de interés mencionar que en el Anexo D de la USP 80016 (http://www.usp.org/sites/default/files/usp/document/our-work/healthcare-quality-safety/general-chapter-800.pdf) se da por válido para las preparaciones no estériles de MP tanto el uso de de CSB Clase I como de CVE (containiment ventilated enclosure). Estos CVE quedan definidos en la USP como recintos o contenedores cerrados total o parcialmente que utilizan principios de ventilación para capturar, contener y eliminar los contaminantes e impedir su liberación al ambiente de trabajo.
Una vez identificados estos aspectos, es necesario seleccionar el EPI a adquirir entre todos los disponibles en el mercado. Para ello, inicialmente debemos asegurarnos que cumplen con los requisitos legales básicos de acuerdo a la categoría del EPI, así como las normas técnicas que cumplen para cada tipo específico de EPI como criterio adicional de calidad del producto. En el caso de productos de uso dual, estos deben haberse sometido también al procedimiento de evaluación de la conformidad apropiado como producto sanitario.
Una vez comprobado esto, se debe seleccionar el producto a adquirir atendiendo a otros criterios como puede ser el coste, proveedor, cantidad mínima de compra, etc., y siempre de forma consensuada o con la validación de los profesionales que van a utilizar el EPI. De esta forma el EPI será aceptado y usado de manera efectiva.
Especificaciones técnicas y de calidad de los Equipos de Protección
1. Guantes de protección
Objetivo
Las manos son la parte del cuerpo que suele entrar en contacto con mayor frecuencia con salpicaduras u objetos potencialmente contaminados. Los guantes son EPI que tienen como objetivo la protección del manipulador evitando la exposición al MP a través de su piel. Pueden cubrir parcialmente el antebrazo y el brazo.
Condiciones de utilización
– Se deben utilizar en todas las actividades en las que se entre en contacto con un MP o con objetos potencialmente contaminados (Tabla 2).
– En el caso de que se vaya a entrar en contacto con el paciente, se utilizarán guantes clasificados como guantes médicos.
– En función de la actividad a realizar se utilizarán guantes estériles o no estériles.
– Uso obligado en todos los procesos de manipulación de MP, aunque en la recepción, la dispensación, el transporte y la manipulación de contenedores de residuos no es necesario que los guantes de protección sean estériles.
– En el manejo de MP, emplear doble par o un solo par de guantes según lo indicado para cada actividad (Tabla 2), y siempre doble par de guantes cuando no cumplan la certificación ASTM D6978 – 05(2013)17, tan solo la UNE-EN 16523-1:201518. El NIOSH recomienda usar doble guante en las actividades de mayor riesgo, como en la preparación de medicamentos13.
– Uso obligado de guantes estériles en la elaboración de MP estériles en cabina de seguridad biológica (CSB). El primer par de guantes se incorporará en la esclusa (antes de entrar en la sala de elaboración) y el segundo una vez sentado frente a la CSB.
– El manipulador deberá realizar una inspección visual de los guantes antes de usarlos para asegurarse de que no tienen defectos.
– Colocación de los guantes según técnica aséptica, el primer par por debajo de la manga de la bata/mono y el segundo por encima de estos.
– Evitar el contacto de las manos protegidas por los guantes con la cara, la boca, la nariz y el cabello durante la manipulación de MP.
– Frecuencia de recambio. En condiciones normales de trabajo, se cambiarán siempre que se contaminen, se rompan o deterioren, al finalizar el procedimiento o al atender a otro paciente. Durante la preparación, como medida de precaución se recomienda su recambio cada 30 minutos. En caso de MP muy lipófilos, se cambiarán inmediatamente después de cada preparación, también, si el guante es de látex, si se ha trabajado con carmustina o tiotepa, por su menor resistencia a la permeación.
– El personal no puede salir de la sala de elaboración con los guantes puestos. Llegado el momento, el orden de retirada será: guante, bata/mono y guante. Se desecharán en un contenedor de residuos del grupo IV.
– Lavado de manos con jabón antimicrobiano en lugar de soluciones hidroalcohólicas, con objeto de facilitar el arrastre de posibles MP que hayan podido permear el guante, sobre todo en el lavado aséptico tras manipulación. Como referencia básica para la higiene de manos se pueden consultar las recomendaciones técnicas descritas por la OMS19.
Especificaciones técnicas y de calidad
En la selección de guantes desechables para la manipulación de MP se debe incluir el marcado CE como EPI y, en aquellas situaciones en las que se va a estar en contacto con el paciente, el marcado CE como PS (producto de uso dual).
Se recomienda utilizar guantes sintéticos (nitrilo, poliuretano, neopreno), que no sean alergénicos (con una concentración baja de proteínas, máximo 30 µg/g de guante), y libres de polvo, ya que el polvo incrementa la cantidad de partículas en la sala de elaboración y CSB, que en caso de manipular MP pueden adsorber posibles partículas aerosolizadas, aumentando el riesgo de absorción en caso de exposición. Los guantes de vinilo están desestimados porque su permeabilidad es más alta que la de los otros materiales.
Para una adecuada protección del manipulador, se requiere que el material del que está hecho el guante sea “impermeable”. No obstante, la permeación frente a productos químicos está limitada en el tiempo y es dependiente de la sustancia química con la que se entra en contacto. La medida de esta resistencia relativa, se expresa en minutos a través del parámetro Breakthrough Time o Tiempo de Paso, que se expresa como el tiempo en minutos tras el cual se detecta el inicio del proceso de permeación, y que caracteriza la resistencia de un material frente a una determinada sustancia. La combinación de los parámetros tiempo de paso y tasa de permeabilidad máxima permite establecer un índice de paso (o índice de permeabilidad) que ayuda a establecer el grado de protección que ofrece el guante en una escala que va desde la clase 1 a la clase 6, siendo la clase 6 la mayor de capacidad de protección. El índice de permeabilidad no depende solo del material del que está fabricado el guante, sino que intervienen otros factores como las características del fármaco, el espesor del guante y el tiempo de contacto con el fármaco, entre otros.
La tasa de permeabilidad máxima es el límite máximo permitido de permeabilidad por superficie y tiempo de una sustancia a través de un material.
Para que un guante se certifique como guante de protección química, debe alcanzar al menos, un tiempo de paso correspondiente a clase 2, con tres productos de una lista que incluye la norma EN correspondiente. Si no se alcanza esta situación, pero sí se cumplen los requisitos de la norma UNE-EN 374-2:201620, que permite determinar la resistencia a la penetración por productos químicos y/o microorganismos de un material poroso, serán considerados como guantes de baja protección química. En la figura 2 se muestran los principales pictogramas para los guantes.
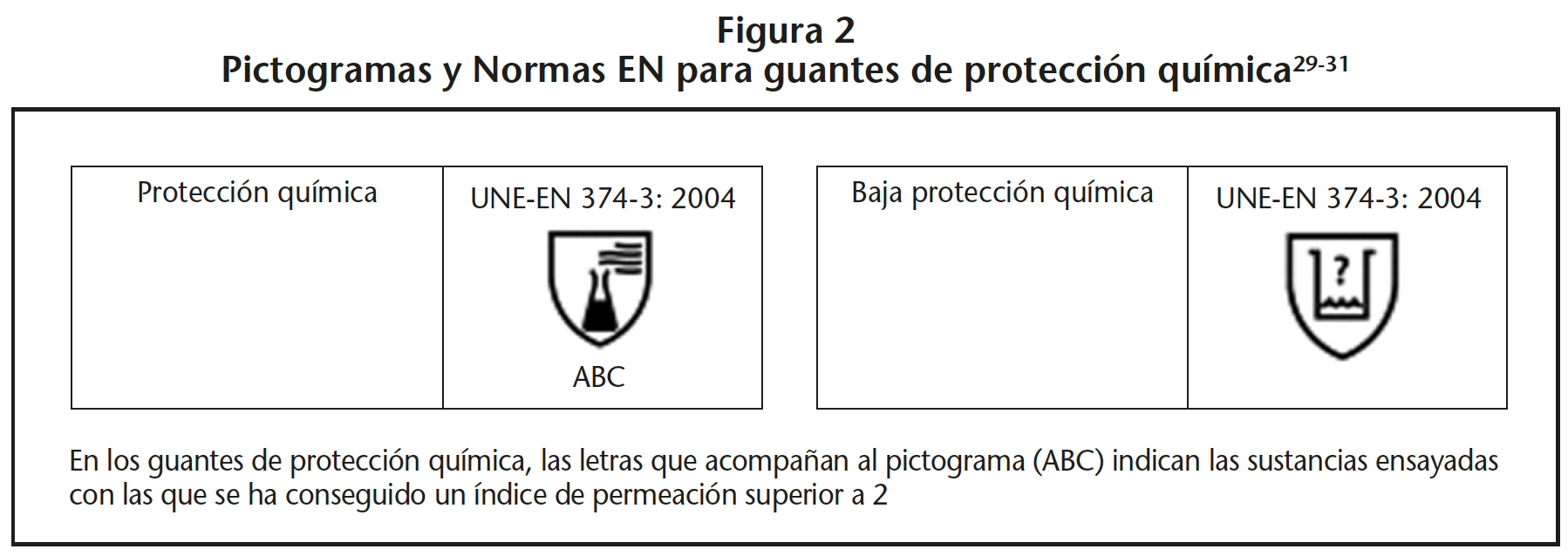
Aunque el grosor del guante, puede variar según el material, se recomienda un mínimo de 0,3 mm, y un límite máximo de permeabilidad de 1 µg/cm2 por minuto. No obstante, la American Society for Testing and Materials (ASTM) estableció en abril de 2006 el estándar ASTM D6978 – 05(2013)17, específico para fármacos antineoplásicos, con un límite máximo de permeabilidad permitido de 0,01 µg/cm2 por minuto, cien veces inferior al establecido en la norma UNE-EN 16523-1:201518. Los guantes que cumplen la norma americana son calificados como “guantes para citostáticos”. Este tipo de guantes es el recomendado para el manejo de medicamentos citotóxicos, y, por ende, a todos los MP. No obstante, como valor añadido, los fabricantes pueden presentar estudios por laboratorio homologados, de permeación a citostáticos u otros MP, aportando esta información como un aspecto de calidad de su guante.
Para guantes médicos, la nueva norma europea UNE-EN 455-2:201521, determina como control de estanqueidad, un nivel mínimo de calidad aceptable (AQL, acceptable quality limit) de 1,5 en el control estadístico de producción por lotes. Dado que en el mercado español hay fabricantes que ofrecen un nivel de control AQL de 0,65, se recomienda que en la selección de guantes para manipular MP se considere este parámetro como requisito de calidad adicional.
Certificaciones recomendadas
– Marcado CE.
– Certificado como EPI de categoría III.
– Certificado de producto sanitario (si procede). De clase I para los guantes de examen o de clase IIa para los guantes quirúrgicos.
– Normas técnicas:
✓ UNE-EN 420:2004+A1:201022 – Guantes de protección. Requisitos generales y métodos de ensayo.
✓ UNE-EN ISO 374-1:201623 – Guantes de protección contra los productos químicos y los microorganismos. Parte 1: Terminología y requisitos de prestaciones para riesgos químicos. (ISO 374-1:2016).
✓ UNE-EN 374-2:201620 – Guantes de protección contra los productos químicos y los microorganismos. Parte 2: Determinación de la resistencia a la penetración.
✓ UNE-EN 16523-1:201518 – Determinación de la resistencia de los materiales a la permeabilidad de los productos químicos. Parte 1: Permeabilidad por un producto químico líquido en condiciones de contacto continuo.
✓ UNE-EN 455:2010. Guantes médicos para un solo uso (guantes quirúrgicos, guantes para exploración/procedimiento y guantes médicos de puño largo). Destinados a uso médico para proteger al paciente y al usuario de una contaminación cruzada. Parte 124 (Requisitos y ensayos para determinar la ausencia de agujeros). Parte 225 (Requisitos y ensayos para la determinación de las propiedades físicas). Parte 326 (Requisitos y ensayos para la evaluación biológica). Parte 427 (Requisitos y ensayos para la determinación de la vida útil).
✓ ASTM D6978 – 05(2013)17. Guantes para citostáticos. Práctica estándar para la evaluación de la resistencia de guantes médicos a la permeabilidad de fármacos de quimioterapia.
✓ UNE-EN 388:201628. Guantes de protección contra riesgos mecánicos. No es un requisito, pero nos da información sobre la resistencia a la abrasión, el rasgado y la perforación.
– Otros posibles datos de permeación y clase de protección frente a citostático u otros MP29-31.
2. Ropa de protección: batas y monos
Objetivo
Evitar la contaminación microbiológica y por partículas de los productos que se elaboran y de la propia área de elaboración, así como evitar la exposición del manipulador al MP a través de la piel por derrames o salpicaduras.
Condiciones de utilización
– Operaciones que supongan un riesgo para el manipulador del MP (Tabla 2).
– De uso obligatorio en las salas limpias de elaboración.
– Cuando se trabaje en salas limpias, el EPI se debe incorporar antes de acceder a la sala, y no se saldrá de esta con el EPI puesto. Se desechará en contenedor de residuos grupo IV.
– En ausencia de información sobre la resistencia a la permeación (nivel de permeabilidad) se recomienda su cambio cada 2-3 horas o inmediatamente si existe una exposición durante la manipulación del fármaco peligroso (derrame, etc.).
– Si se dispone de información específica sobre el producto manipulado, se deben seguir las instrucciones indicadas en el folleto informativo del EPI.
Especificaciones técnicas y de calidad
De la misma forma que en el caso de los guantes, deben incluir el marcado CE como EPI, y, en situaciones en las que se va a estar en contacto con el paciente, del marcado CE como PS (producto de uso dual).
Se recomienda que sea larga, desechable, que no desprenda fibras ni partículas (recomendable material no tejido a base de poliolefinas), con abertura en la parte trasera, mangas largas y puños elásticos ajustados cerrados a la altura de la muñeca mediante goma. El material debe ser de baja permeabilidad, sin costuras ni cierres, o impermeable al menos en la zona delantera (pecho y vientre) y en las mangas (zonas de mayor riesgo de exposición) para evitar la absorción de MP y la cesión de partículas. Para una mayor impermeabilidad, se recomienda que los materiales estén revestidos con polietileno o polipropileno, así como otros materiales laminados, ya que son los que ofrecen una mayor protección. Por ello es básico conocer el material del tejido, ya que en función del tipo de material se le aplicarán unos ensayos para determinar su grado de protección. Así, para los materiales impermeables, se les aplican los mismos ensayos de permeación que a los guantes. Para los tejidos y textiles sin tejer, se realizarán ensayos de penetración y repelencia.
La clasificación de la ropa de protección química que indican las normas europeas armonizadas, se basa en la hermeticidad de esta, y distingue varios tipos de ropa. La selección del tipo adecuado debe basarse en el tipo del producto químico (gas, líquido, etc.) y cómo puede contactar con el trabajador según la evaluación de riesgos (Tabla 3)32.
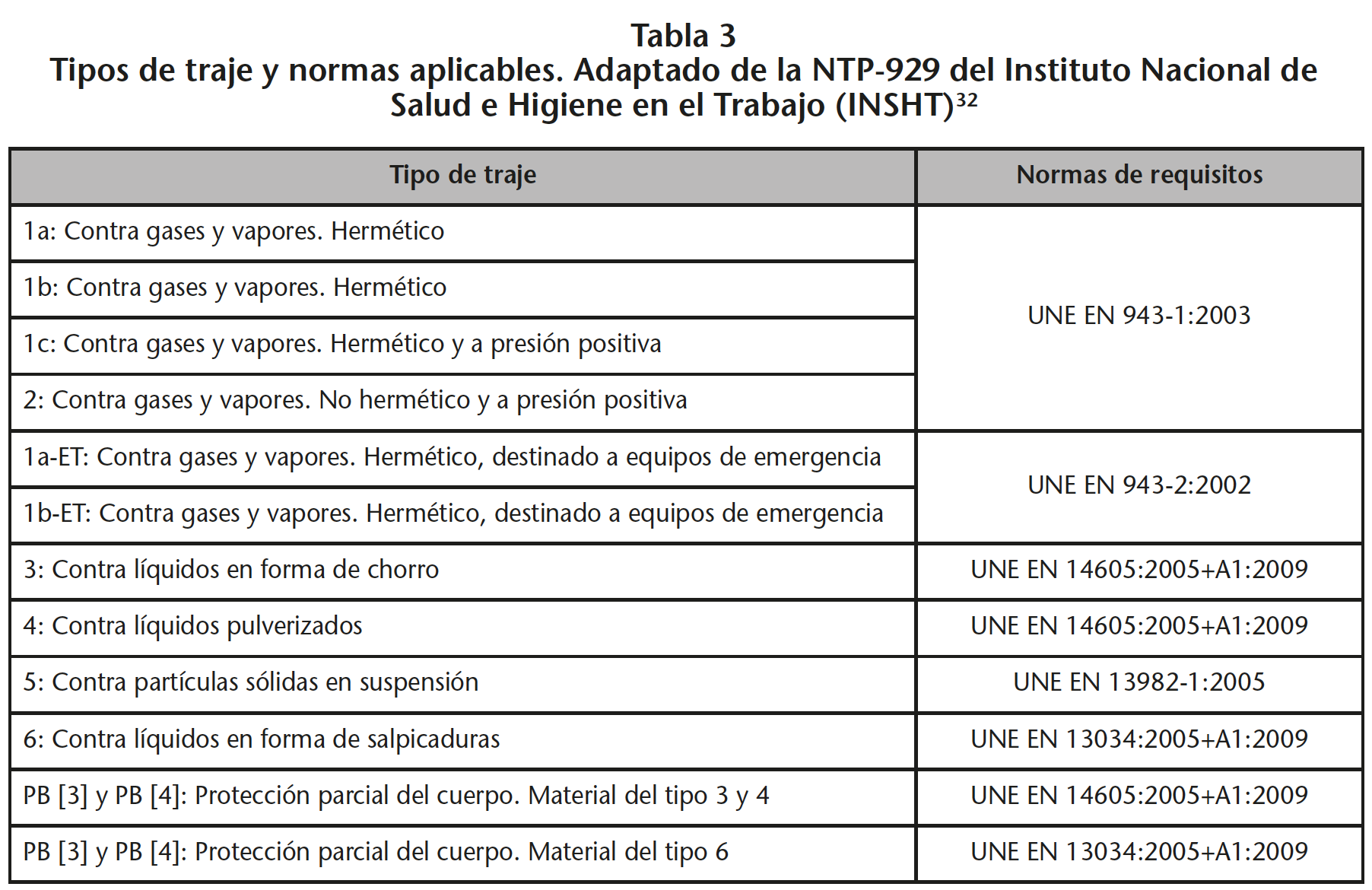
Para el manejo de MP, es exigible, como mínimo, que cumpla para los niveles de tipo 6 (barrera frente a salpicaduras de intensidad limitada) y tipo 5 (barrera frente a partículas), y deseable que cumpla el tipo 4 (barrera frente a pulverización). Los materiales revestidos con polietileno-polipropileno y otros materiales laminados ofrecen mayor protección que los no revestidos. El vestuario de laboratorio, las batas quirúrgicas, la ropa de aislamiento y el vestuario de materiales absorbentes no son apropiados en la manipulación de MP porque permiten la permeación de estos.
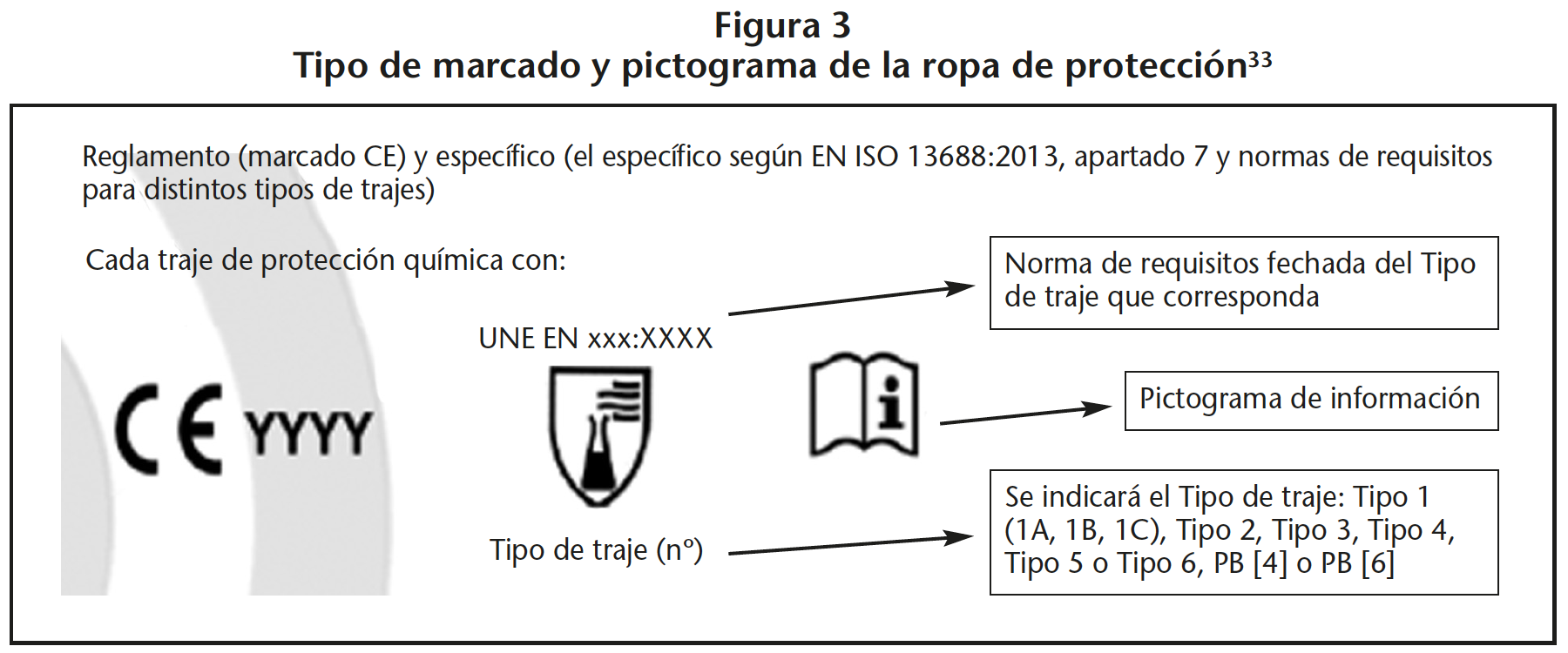
En el folleto informativo y en el etiquetado debe aparecer el pictograma de protección química y la norma EN que cumple (Figura 3)33.
Certificaciones recomendadas
– Marcado CE.
– Certificado como EPI de categoría III.
– Certificado de producto sanitario (si procede).
– Normas técnicas:
✓ UNE-EN ISO 13688:201334. Ropa de protección. Requisitos generales (ISO 13688:2013).
✓ UNE-EN ISO 6530:200535. Ropa de protección. Protección contra productos químicos líquidos. Método de ensayo para la resistencia de los materiales a la penetración por líquidos (ISO 6530:2005).
✓ UNE-EN 14325:200436. Ropa de protección contra productos químicos. Métodos de ensayo y clasificación de las prestaciones de los materiales, costuras, uniones y ensamblajes de la ropa de protección contra productos químicos.
3. Protección respiratoria: mascarillas
Objetivo
Evitar la inhalación de partículas, gotículas, vapores y aerosoles. Evitar la absorción por contacto e impedir la contaminación microbiológica.
Condiciones de utilización
– Operaciones que supongan un riesgo para el manipulador del MP (Tabla 2), y, cuando exista riesgo de salpicaduras.
– De uso obligatorio en las salas limpias de elaboración.
– Cuando se trabaje en salas limpias, el EPI se debe incorporar antes de acceder a la sala, y no se saldrá de esta con el EPI puesto. Se desechará en contenedor de residuos grupo IV, salvo que el fabricante indique que puede reutilizarse.
– En el caso de que sea reutilizable, no se debe sacar de la zona de elaboración. Las mascarillas con válvula no filtran el aire exhalado, por lo que no se recomiendan en ambientes estériles, salvo que la válvula esté recubierta.
– Debe ajustar herméticamente en la cara del usuario para protegerse, comprobándolo mediante prueba de estanqueidad, tapando la válvula de entrada de aire con la mano e inspirando para comprobar el colapso de la máscara.
– No debe utilizarse si se lleva barba, dado que no permite asegurar la protección.
Especificaciones técnicas y de calidad
Las mascarillas filtrantes ofrecen protección de tres clases contra aerosoles acuosos y oleosos, humo y partículas finas durante el trabajo, debiendo cumplir con la norma UNE-EN 149:2001+A1:201037. Aplicando esta normativa, se obtiene una clasificación según el Factor de Protección Nominal (FPN), que se define como: el número calculado a partir del porcentaje máximo de fuga total hacia el interior, permitido en las normas europeas correspondientes para una clase dada de un equipo de protección respiratoria. Una FPN de 10 significa que el tipo de equipo de protección usado correctamente puede ser seguro en un ambiente que tiene una concentración peligrosa de hasta 10 veces la permitida.
Dependiendo de la fuga total y del filtrado de partículas de un tamaño de hasta 0,6 µm, las máscaras respiratorias se clasifican en FFP1, FFP2 y FFP3, y ofrecen protección respiratoria para varias concentraciones de contaminantes.
– FFP1: protege de partículas no tóxicas en concentraciones ≤4,5xTLV (valor umbral límite).
– FFP2: protege de partículas de baja y media toxicidad en concentraciones ≤12xTLV.
– FFP3: ofrecen protección contra partículas de baja, media y alta toxicidad, sólidos radioactivos y aerosoles, en concentraciones de hasta 50xTLV.
La fuga total en las mascarillas FFP3 puede ascender hasta un máximo del 5% de partículas de tamaño superior a 0,6 µm. Este es el tipo recomendado para manipular MP, ya que dispone de filtro de protección respiratoria contra aerosoles y partículas, con la mayor capacidad de retención. Las mascarillas quirúrgicas no ofrecen protección respiratoria frente a los aerosoles, tan solo ayudan a bloquear gotitas más grandes de partículas, derrames o salpicaduras, sin crear un sello hermético con la piel.
También se pueden considerar reutilizables, aspecto que se indica con la sigla R en el marcado del EPI.
Certificaciones recomendadas
– Marcado CE.
– Certificado como EPI de categoría III.
– UNE-EN 149:2001+A1:201037. Dispositivos de protección respiratoria. Medias máscaras filtrantes de protección contra partículas. Requisitos, ensayos, marcado.
4. Protección ocular: gafas
Objetivo
Evitar el contacto con vapores, gotas vaporizadas, aerosoles, humos y partículas procedentes de la manipulación de MP.
Condiciones de utilización
– Situaciones en las que exista riesgo de salpicadura que pueda afectar a la cara, como puede suceder la administración de medicamentos, operaciones de fraccionamiento y trituración de medicamentos o contacto con aerosoles (limpieza de instalaciones, contención de derrames, etc.) (Tabla 2).
– De uso obligatorio en la elaboración de MP estériles si la CSB no dispone de cristal de protección.
– Se deben poder utilizar por encima de las gafas normales que pueda llevar el usuario.
– En la preparación de MP, el panel frontal de vidrio de la CSB debe ofrecer protección adecuada ante salpicaduras, y el flujo laminar vertical protege de partículas aerosolizadas.
– La retirada se hará evitando tocar la superficie externa que pudiera estar contaminada, retirándolas por la parte posterior de la cabeza, de atrás hacia delante.
– Cuando se trabaje en salas limpias, el EPI se debe incorporar antes de acceder a la sala, y no se saldrá de esta con el EPI puesto. Se desechará en contenedor de residuos grupo IV, salvo que el fabricante indique que puede reutilizarse.
Especificaciones técnicas y de calidad
Pueden ser protectores oculares tipo gafa o protectores faciales cuando se precisa ampliar la protección a la cara o parte de ella. Los protectores oculares o gafas, se pueden clasificar por la forma de la montura en:
– Montura universal: diseño semejante al de uso normal.
– Montura integral: protección y montura forman una sola pieza.
– Tipo cazoleta: dos elementos unidos mediante un puente.
– Adaptable al rostro: la montura ajusta herméticamente al rostro del usuario.
– Gafa de suplemento.
El Real Decreto 1407/19925, no obliga a la existencia de marcado de seguridad más que en lo que se refiere a la clase de protección de los oculares filtrantes. Según la normativa europea, las gafas para uso laboral han de estar certificadas en su conjunto, es decir, montura más lente. No contando con una certificación cada una de sus partes por separado.
Estos EPI deben tener el marcado CE como equipo de protección. La norma EN que deben cumplir es la UNE-EN 166:200238, de exigencias generales, y la UNE-EN 168:200236 sobre los métodos de ensayo no ópticos. En la montura se debe marcar el número de la norma europea, e indicar el campo de uso de la gafa. La montura y el ocular deberán ser marcados por separado, pero si forman ambos una unidad, deberá realizarse el marcado completo sobre la montura. En este caso, el marcado comprende el marcado completo del ocular, un guion, el número de la EN y los símbolos que correspondan, indicando el campo de uso40 y el grado de protección. En el marcado ocular se debe indicar la identificación del fabricante, la clase óptica y si fuera aplicable el símbolo de resistencia mecánica.
Habitualmente se recomienda utilizar gafas de montura integral que son las que protegen frente a riesgos ocasionados por agentes químicos gaseosos y partículas de polvo finas, con un campo de uso 5 (protección frente a gas, vapor, spray, humo y polvo con grosor de partícula <5 μm). Es importante que disponga de protección lateral para asegurar la estanqueidad y disminuir el riesgo de exposición ante salpicaduras.
Certificaciones recomendadas
– Marcado CE.
– Normas técnicas:
✓ UNE-EN 166:200238. Protección individual de los ojos.
✓ UNE-EN 168:200239. Protección de los ojos. Métodos de ensayo no ópticos.
5. Otros accesorios
Además de los EPI, se utilizan otros accesorios para reducir la contaminación del personal, y la diseminación de esta a otras áreas del hospital, como son las calzas y los gorros. Por tanto, se utilizarán en salas limpias y zona de elaboración, debiendo de ser incorporadas antes de acceder a la sala de elaboración, y retiradas antes de salir de esta. Deben estar compuestos de material que no desprenda partículas, desechable y que ofrezcan una cobertura adecuada del cabello y del calzado.
Gorro
Debe cubrir el pelo y las orejas por completo. Su uso es obligado en el proceso de elaboración de preparados estériles de cualquier tipo. El manipulador deberá realizar una inspección visual del gorro antes de usarlo para asegurarse de que no tiene defectos. Se colocará antes de acceder al área de elaboración y se desechará antes de salir en un contenedor de residuos del grupo IV.
Calzas
Constituye un requisito de las salas limpias, por lo que es de uso obligado para todo el personal que circula en la sala de elaboración. El manipulador deberá realizar una inspección visual de las calzas antes de usarlas para asegurarse de que no tienen defectos. El calzado sanitario no sustituye la obligatoriedad de utilizar calzas. Cuando el acceso a la sala de elaboración en la que se sitúa la CSB se realiza desde una sala también clasificada como limpia, debe incorporarse otro par de calzas en la esclusa previa al acceso a la sala de elaboración de MP. El personal no puede salir del área de elaboración con las calzas puestas. Se desechan en un contenedor de residuos del grupo IV.
Recomendaciones para el uso simultáneo de varios EPI
En función de la actividad a realizar, será necesario utilizar varios EPI de forma simultánea. Es importante confirmar que estos EPI son compatibles de forma que no se reduce el nivel de protección que ofrecerían por separado.
Un aspecto básico en estas situaciones, es realizar de forma correcta y en el momento y orden adecuado la colocación y retirada de los EPI, para evitar una contaminación accidental durante esta operación. En general, el orden de colocación de los EPI será el siguiente: gorro y calzas, mascarilla, guantes, bata y, por último, el segundo par de guantes, si fuese necesario.
La indumentaria para preparar MP estériles, se colocará en la esclusa previa al área de elaboración, en el siguiente orden (salvo si se utiliza un segundo par de guantes, en cuyo caso, se colocarán en la sala de elaboración):
- Lavado de arrastre de manos con jabón común antes de proceder a la antisepsia, si las manos están visiblemente sucias.
- Protección del calzado sanitario con calzas estándar.
- Colocación de gorro estándar y gafas de protección (si procede).
- Colocación de la mascarilla específica.
- Lavado antiséptico de manos con jabón antimicrobiano, seguido de secado completo.
- Colocación del primer par de guantes específicos, siguiendo técnica aséptica.
- Incorporación de la bata/mono específica/o, prestando especial cuidado a que las mangas se encuentren correctamente dispuestas con los puños por encima de los guantes.
- Colocación del segundo par de guantes específicos, quedando dispuestos por encima de los puños de la bata, dentro del área de elaboración, una vez sentado el manipulador en la CSB.
La retirada del EPI se realizará siempre antes de salir del área de elaboración, ya que podrían diseminarse los posibles contaminantes adheridos a ellos. Puede hacerse en la esclusa si el ambiente está clasificado y se garantiza la presión negativa mínima diferencial entre las zonas.
Sea cual sea la actividad realizada manipulando MP, es obligatorio desechar toda la indumentaria utilizada en contenedores de residuos del grupo IV.
Conflicto de intereses: Los autores declaran no tener conflicto de intereses.
Bibliografía
- Constitución Española de 27 de diciembre de 1978 (BOE número 311, de 29 de diciembre de 1978).
- Ley 31/1995, de 8 de noviembre, de prevención de riesgos laborales (BOE número 269, de 10 de noviembre de 1995).
- Ley General de Salud número 5395. Asamblea legislativa de la República de Costa Rica 1973. Actualizada 5/5/2014.
- Decreto Ejecutivo 30965 del 17/12/2002: Reglamento sobre la gestión de los desechos infecto-contagiosos que se generan en establecimientos que prestan atención a la salud y afines. República Costa Rica.
- Real Decreto 1407/1992, de 20 de noviembre, por el que se regulan las condiciones para la comercialización y libre circulación intracomunitaria de los equipos de protección individual (BOE número 311, de 28 de diciembre de 1992).
- Reglamento (UE) 2016/425 del Parlamento Europeo y del Consejo, de 9 de marzo de 2016, relativo a los equipos de protección individual y por el que se deroga la Directiva 89/686/CEE del Consejo (DOUE número L81/51, de 31 de marzo de 2016).
- Real Decreto 773/1997, 30 de mayo, sobre disposiciones mínimas de seguridad y salud relativas a la utilización por los trabajadores de equipos de protección individual (BOE número 140, de 12 de junio de 1997).
- Instituto Nacional de Seguridad e Higiene en el Trabajo (INSHT). Guía Técnica para la utilización por los trabajadores de equipos de protección individual. 2ª Edición. 2012. [Internet]. [Consultado: 16/11/2017]. Disponible en: http://www.insht.es/inshtweb/contenidos/normativa/guiastecnicas/ficheros/epi.pdf.
- Directiva 89/686/CEE del Consejo, de 21 de diciembre de 1989, sobre aproximación de las legislaciones de los Estados Miembros relativas a los equipos de protección individual (DOUE número L399/18, de 30 de diciembre de 1989).
- Directiva 93/42/CEE del Consejo, de 14 de junio de 1993, relativa a los productos sanitarios (DOUE número L169, de 12 de julio de 1993).
- Directiva 2007/47/CE Parlamento Europeo y del Consejo, de 5 de septiembre de 2007, por la que se modifica la Directiva 90/385/CEE del Consejo relativa a la aproximación de las legislaciones de los Estados miembros sobre los productos sanitarios implantables activos, la Directiva 93/42/CEE del Consejo relativa a los productos sanitarios y la Directiva 98/8/CE relativa a la comercialización de biocidas (DOUE número 247/21, de 21 de septiembre de 2007).
- Real Decreto 1591/2009, de 16 de octubre, por el que se regulan los productos sanitarios (BOE número 268, de 6 de noviembre de 2009).
- U.S. Department of Health and Human Services, Public Health Service, Centers for Disease Control and Prevention, National Institute for Occupational Safety and Health, DHHS (NIOSH). NIOSH List of Antineoplastic and Other Hazardous Drugs in Healthcare Settings, 2016. [Internet]. Cincinnati, septiembre 2016. [Consultado: 14/11/2017]. Disponible en: https://www. cdc.gov/niosh/topics/antineoplastic/pdf/hazardous-drugs-list_2016-161.pdf.
- Instituto Nacional de Seguridad e Higiene en el Trabajo (INSHT). Documento Técnico 87.1:16, Medicamentos Peligrosos, medidas de prevención para su preparación y administración. 1ª Edición. Barcelona, 2016. [Internet]. [Consultado: 16/11/2017]. Disponible en: http:// www.insht.es/InshtWeb/Contenidos/Documentacion/FICHAS%20DE%20PUBLICACIONES/EN%20CATALOGO/Higiene/2016%20medicamentos%20peligrosos/Medicamentos%20peligrosos.pdf.
- VV.AA. Monografías de Farmacia Hospitalaria y de Atención Primaria: Medicamentos Peligrosos (nº6). Barcelona: Bayer Hispania SL, 2016.
- USP 2016 General Chapter <800> Hazardous Drugs-Handling in Healthcare Settings. United States Pharmacopeia. USP 2016. Disponible en http://www.usp. org/sites/default/files/usp/document/our-work/healthcare-quality-safety/general-chapter-800.pdf.
- American Society for Testing and Materials International. ASTM D6978 – 05(2013) Práctica estándar para la evaluación de la resistencia de guantes médicos a la permeabilidad de fármacos de quimioterapia, 2013 [Internet]. [Consultado: 14/11/2017]. Disponible en: https://www.astm.org/Standards/D6978.htm.
- Asociación Española de Normalización y Certificación (AENOR). UNE-EN 16523-1:2015 – Determinación de la resistencia de los materiales a la permeabilidad de los productos químicos. Parte 1: Permeabilidad por un producto químico liquido en condiciones de contacto continuo. 2015. [Internet]. [Consultado: 14/11/2017]. Disponible en: http://www.ca.aenor.es/aenor/normas/ normas/fichanorma.asp?tipo=N&codigo=N0055625&pdf=#.Wgv2cErT6M8.
- Organización Mundial de la Salud (OMS). Manual técnico de referencia para la higiene de las manos, 2009. [Internet]. [Consultado: 14/11/2017]. Disponible en: http://apps.who.int/iris/bitstream/10665/ 102537/1/WHO_IER_PSP_2009.02_spa.pdf?ua=1.
- Asociación Española de Normalización y Certificación (AENOR). UNE-EN 374-2:2016 – Guantes de protección contra los productos químicos y los microorganismos. Parte 2: Determinación de la resistencia a la penetración. 2016. [Internet]. [Consultado: 14/11/2017]. Disponible en: http://www.aenor.es/aenor/normas/ normas/fichanorma.asp?tipo=N&codigo=N0056106&pdf=#.Wgv6zkrT6M8.
- Asociación Española de Normalización y Certificación (AENOR). UNE-EN 455-2:2015 – Guantes médicos para un solo uso. Parte 2: Requisitos y ensayos para la determinación de las propiedades físicas. 2015. [Internet]. [Consultado: 15/11/2017]. Disponible en: http:// www.aenor.es/aenor/normas/normas/fichanorma.asp?tipo=N&codigo=N0055136&pdf=#.Wgv7t0rT6M8.
- Asociación Española de Normalización y Certificación (AENOR). UNE-EN 420:2004+A1:2010 – Guantes de protección. Requisitos generales y métodos de ensayo. 2014. [Internet]. [Consultado: 15/11/2017]. Disponible en: http://www.aenor.es/aenor/normas/normas/fichanorma.asp?tipo=N&codigo=N0046067#.Wgv8mErT6M8.
- Asociación Española de Normalización y Certificación (AENOR). UNE-EN 374-1:2016 – Guantes de protección contra los productos químicos y los microorganismos. Parte 1: Terminología y requisitos de prestaciones para riesgos químicos. (ISO 374-1:2016). 2016. [Internet]. [Consultado: 15/11/2017]. Disponible en: http:// www.aenor.es/aenor/normas/normas/fichanorma.asp?tipo=N&codigo=N0058291&pdf=#.Wgv9wUrT6M8.
- Asociación Española de Normalización y Certificación (AENOR). UNE-EN 455-1:2001 – Guantes médicos para un solo uso. Parte 1: Requisitos y ensayos para determinar la ausencia de agujeros. 2012. [Internet]. [Consultado: 15/11/2017]. Disponible en: http://www. aenor.es/aenor/normas/normas/fichanorma.asp?tipo=N&codigo=N0024817#.WgwWRUrT6M9.
- Asociación Española de Normalización y Certificación (AENOR). UNE-EN 455-2:2015 – Guantes médicos para un solo uso. Parte 2: Requisitos y ensayos para la determinación de las propiedades físicas. 2015. [Internet]. [Consultado: 15/11/2017]. Disponible en: http:// www.aenor.es/aenor/normas/normas/fichanorma.asp?tipo=N&codigo=N0055136#.WgwWQkrT6M9.
- Asociación Española de Normalización y Certificación (AENOR). UNE-EN 455-3:2015 – Guantes médicos para un solo uso. Parte 3: Requisitos y ensayos para la evaluación biológica. 2015. [Internet]. [Consultado: 15/11/2017]. Disponible en: http://www.aenor.es/ aenor/normas/normas/fichanorma.asp?tipo=N&codigo=N0055012&pdf=#.Wgxmv0rT6M8.
- Asociación Española de Normalización y Certificación (AENOR). UNE-EN 455-4:2010 – Guantes médicos para un solo uso. Parte 4: Requisitos y ensayos para la determinación de la vida útil. 2014. [Internet]. [Consultado: 15/11/2017]. Disponible en: http://www.aenor. es/aenor/normas/normas/fichanorma.asp?tipo=N&codigo=N0044646#.WgwWO0rT6M9.
- Asociación Española de Normalización y Certificación (AENOR). UNE-EN 388:2016 – Guantes de protección contra riesgos mecánicos. 2017. [Internet]. [Consultado: 15/11/2017]. Disponible en: http://www.aenor. es/aenor/normas/normas/fichanorma.asp?tipo=N&codigo=N0058771&pdf=#.WgxpJkrT6M9.
- Gaspar Carreño M, Arias Pou M, Rodríguez Berges O, Gamundi MC, Carbonell Tatay F. Revisión sobre uso de guantes en los hospitales. El Farmacéutico Hospitales. 2011;197:6-23.
- Márquez Peiró JF. Selva Otaolaurruchi J. Utilización de guantes en el manejo de fármacos antineoplásicos. Panorama Actual del Medicamento. 2010;34(334):480-5.
- Wallemacq PE, Capron A, Vanbinst R, et al. Permeability of 13 different gloves to 13 cytotoxic agents under controlled dynamic conditions. AJHSP 2006;63(6):547-56.
- Instituto Nacional de Seguridad e Higiene en el Trabajo (INSHT). NTP-929 – Ropa de protección contra productos químicos. 2012. [Internet]. [Consultado: 15/11/2017]. Disponible en: http://www.insht.es/InshtWeb/Contenidos/Documentacion/NTP/NTP/926a937/929w.pdf.
- Instituto Nacional de Seguridad e Higiene en el Trabajo (INSHT). Ropa de protección química. 2014. [Internet]. [Consultado: 16/11/2017]. Disponible en: http:// www.insht.es/EPI/Contenidos/Promocionales/Ropa%20y%20guantes%20de%20proteccion/Promocional%20a%20Contenido/Fichas%20seleccion%20y%20uso%20de%20equipos%20nivel%202/ficheros/Ropaquimica.pdf.
- Asociación Española de Normalización y Certificación (AENOR). UNE-EN ISO 13688:2013 – Ropa de protección. Requisitos generales (ISO 13688:2013). 2014. [Internet]. [Consultado: 16/11/2017]. Disponible en: http://www.aenor.es/aenor/normas/normas/fichanorma.asp?tipo=N&codigo=N0052319&pdf=#.Wg1lp0rT6M8.
- Asociación Española de Normalización y Certificación (AENOR). UNE-EN ISO 6530:2005 – Ropa de protección. Protección contra productos químicos líquidos. Método de ensayo para la resistencia de los materiales a la penetración por líquidos (ISO 6530:2005). 2018. [Internet]. [Consultado: 16/11/2017]. Disponible en: http://www. aenor.es/aenor/normas/normas/fichanorma.asp?tipo=N&codigo=N0033859#.Wg1mU0rT6M8.
- Asociación Española de Normalización y Certificación (AENOR). UNE-EN 14325:2004 – Ropa de protección contra productos químicos. Métodos de ensayo y clasificación de las prestaciones de los materiales, costuras, uniones y ensamblajes de la ropa de protección contra productos químicos. 2013. [Internet]. [Consultado: 16/11/2017]. Disponible en: http://www.aenor. es/aenor/normas/normas/fichanorma.asp?tipo=N&codigo=N0032108#.Wg1pcUrT6M8.
- Asociación Española de Normalización y Certificación (AENOR). UNE-EN 149:2001+A1:2010 – Dispositivos de protección respiratoria. Medias máscaras filtrantes de protección contra partículas. Requisitos, ensayos, marcado. 2011. [Internet]. [Consultado: 16/11/2017]. Disponible en: http://www.aenor.es/aenor/normas/ normas/fichanorma.asp?tipo=N&codigo=N0044643#.Wg1w7UrT6M8.
- Asociación Española de Normalización y Certificación (AENOR). UNE-EN 166:2002 – Protección individual de los ojos. Especificaciones. 2015. [Internet]. [Consultado: 16/11/2017]. Disponible en: http://www.aenor. es/aenor/normas/normas/fichanorma.asp?tipo=N&codigo=N0026750#.Wg1yBErT6M8.
- Asociación Española de Normalización y Certificación (AENOR). UNE-EN 168:2002 – Protección individual de los ojos. Métodos de ensayo no ópticos. 2014. [Internet]. [Consultado: 16/11/2017]. Disponible en: http:// www.aenor.es/aenor/normas/normas/fichanorma.asp?tipo=N&codigo=N0026829#.Wg1yV0rT6M8.
- Instituto Nacional de Seguridad e Higiene en el Trabajo (INSHT). Gafas de protección de montura integral. 2014. [Internet]. [Consultado: 16/11/2017]. Disponible en: http://www.insht.es/EPI/Contenidos/Promocionales/Proteccion%20ocular%20y%20facial/Promocional%20a%20Contenido/Fichas%20seleccion%20y%20%20y%20uso%20de%20equipos/ficheros/Gafasmonturaintegral.pdf.
____
Descargar artículo en pdf: Equipos de protección individual para el manejo de medicamentos peligrosos
