García García D
Empresa Comercializadora y Distribuidora de Medicamentos EMCOMED. La Habana (Cuba)
Fecha de recepción: 15/02/2019 – Fecha de aceptación: 04/04/2019
Diana García García – Empresa Comercializadora y Distribuidora de Medicamentos EMCOMED – Calzada de Vento No. 4161. Entre Línea del Ferrocarril y Callejón Miraflores. Cerro – La Habana (Cuba)
diana.garcia@oc.emcomed.cu
____
RESUMEN
Introducción: Una cadena de frío de calidad es aquella en la que se aseguran de manera integral todos los elementos necesarios para su adecuado desempeño.
Objetivos: Diseñar un sistema de gestión integral de la cadena de frío de la Empresa Comercializadora y Distribuidora de Medicamentos EMCOMED, que permita garantizar la calidad de las operaciones de almacenamiento y transportación, y preservar la integridad de los productos farmacéuticos termosensibles durante su manipulación.
Métodos: Se realizó una búsqueda bibliográfica para seleccionar bibliografía actualizada y de rigor científico aplicable a la gestión de calidad de la cadena de frío. Se aplicó la técnica del diagrama causa-efecto para establecer las variables requeridas para el manejo integral de la cadena de frío y elaborar el procedimiento normalizado de operación (PNO) aplicable a las diferentes operaciones de la empresa.
Resultados: Se identificaron los cuatro elementos principales que permiten asegurar integralmente la calidad de la cadena de frío de EMCOMED. Se elaboró el PNO “Directrices para el manejo integral de la cadena de frío”.
Conclusiones: El sistema de gestión de la cadena de frío de la empresa EMCOMED está basado en el aseguramiento de cuatro elementos principales. Las actividades necesarias para garantizar el manejo integral, están documentadas en un PNO. Su aplicación práctica reporta beneficios en los órdenes económico y social; y puede ser tomado como referente por empresas afines dedicadas a la distribución de productos termosensibles.
Palabras clave: Cadena de frío, calidad, sistema de gestión, procedimiento normalizado de operación, productos termosensibles.
Cold chain quality assurance in pharmaceutical distribution
SUMMARY
A solid cold chain is one that entirely assures all the necessary elements for an adequate performance.
Objective: To design a cold chain management system for the Cuban Wholesale Distribution Company of Pharmaceuticals EMCOMED that guarantees the quality of warehousing and transportation operations and the preservation of product integrity during handling.
Methods: A search was conducted to select updated bibliography with scientific rigor concerning the cold chain quality management system to be used as a reference. The cause-effect technique was applied to establish the necessary elements for the cold chain integral management and to draw up a standard operation procedure (SOP).
Results: Four main elements were identified to be necessary for establishing the cold chain management system of the company. The SOP “Guidelines for the cold chain integral management” was drawn up.
Conclusions: The cold chain management system of EMCOMED is based on four main elements. The SOP drawn up, sets out the necessary activities for the cold chain quality assurance. Its practical application brings economic and social benefits to the company and it could be an example to other distribution companies of temperature sensitive products.
Key Words: Cold chain, quality, management system, standard operation procedure, temperature sensitive product.
____
INTRODUCCIÓN
La distribución mayorista es un eslabón de crucial importancia en la calidad, eficacia y oportunidad del suministro de productos farmacéuticos a los restantes eslabones de la cadena del medicamento. En Cuba, esta actividad es realizada íntegramente por la Empresa Comercializadora y Distribuidora de Medicamentos EMCOMED, organización de alcance nacional que se encarga de almacenar, distribuir y transportar hacia los diferentes puntos de entrega del país, todas las especialidades farmacéuticas que utiliza el sistema nacional de salud en los distintos niveles de atención.
En el amplio sistema logístico de EMCOMED, las operaciones con productos sensibles a la temperatura constituyen uno de los mayores retos. Estos productos, también llamados termosensibles o termolábiles, requieren condiciones especiales de almacenamiento que deben ser proporcionadas por medio de una cadena de frío capaz de mantener la temperatura dentro del rango de +2° a +8° C de principio a fin.
Este tipo particular de cadena de suministro, conocida como cadena de frío, puede definirse como el conjunto de condiciones o elementos que permiten conservar a una temperatura controlada un producto biológico o producto termolábil desde el momento de su fabricación hasta el de su utilización en el lugar de administración1.
Las interrupciones accidentales en esta cadena de temperatura controlada comprometen la estabilidad del producto, su eficacia y su seguridad en un grado variable, en función de sus características, de la temperatura máxima o mínima registrada y del tiempo que haya estado expuesto a esas temperaturas, pudiendo además comprometer los efectos farmacológicos y ocasionar importantes pérdidas económicas por el elevado coste de estos productos2-3.
Las buenas prácticas de distribución (BPD) son la parte del aseguramiento de la calidad que garantiza que se mantenga la calidad de los medicamentos en todas las fases de la cadena de suministro4. Conforme a las BPD, los medicamentos deben ser adecuadamente almacenados, transportados y manipulados, de acuerdo a sus especificaciones de calidad.
Desde años recientes, las agencias reguladoras a nivel internacional han incrementado el nivel de supervisión entre los diferentes actores que integran las cadenas de suministro farmacéutico, con el propósito de asegurar la integridad de los productos. Así mismo, muchos requisitos recogidos en las regulaciones de BPD existentes, con frecuencia se relacionan con el modo en que se mantiene la cadena de frío en la distribución de los medicamentos5.
En su rol de distribuidor mayorista y operador logístico de la industria biofarmacéutica cubana, la empresa EMCOMED debe cumplir con los requisitos fijados en la regulación de BPD vigente en el país. Uno de ellos es el referido a asegurar que los materiales y productos farmacéuticos sean almacenados, distribuidos y manejados de forma tal que su calidad se mantenga durante todo el período de validez6.
Tras llevar a cabo acciones preliminares como la implantación de un procedimiento normalizado de operación (PNO) para el control de la temperatura durante la transportación de los productos termosensibles, tanto la repercusión de las condiciones de almacenamiento en la calidad de los medicamentos como los extensos flujos logísticos de EMCOMED en la cadena de suministro farmacéutica nacional, hacen necesario diseñar un sistema de gestión de la cadena de frío que permita garantizar la calidad de las operaciones de almacenamiento y transportación y preservar la integridad de los productos farmacéuticos termosensibles durante su manipulación.
Objetivos
1) Establecer los elementos o variables necesarias de asegurar por el sistema de gestión de la cadena de frío de la empresa EMCOMED.
2) Elaborar el PNO de gestión o manejo integral de la cadena de frío, aplicable a todas las operaciones y todas las dependencias de la empresa.
MATERIAL Y MÉTODOS
Se realizó una búsqueda bibliográfica dirigida a la identificación de bibliografía actualizada y de rigor científico, de guías, normas y PNO de las principales agencias reguladoras y organizaciones internacionales como la Organización Mundial de la Salud (OMS)7,8 y la Asociación para la Cadena de Frío (CCA, del inglés Cool Chain Association)9, enfocadas específicamente en la gestión de calidad de la cadena de frío.
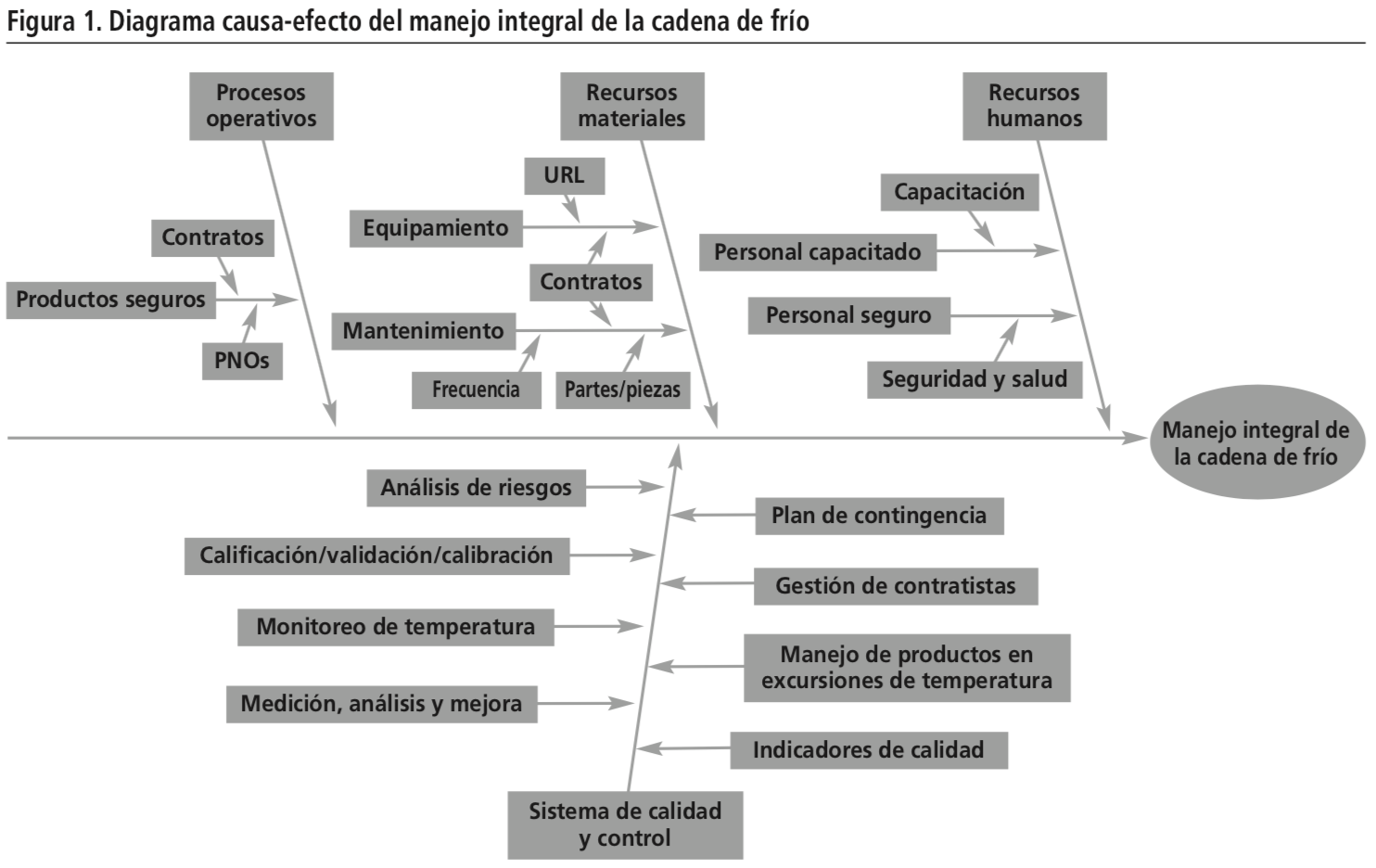
Se seleccionaron los documentos normativos de referencia para la cadena de frío de EMCOMED y conforme a lo encontrado en esta bibliografía, aplicando la técnica del diagrama causa-efecto, diagrama de espina de pescado o diagrama de Ishikawa10, se realizó la representación gráfica de todos los elementos que de manera relacional deben ser asegurados en el manejo integral de la cadena de frío y que son necesarios para garantizar su calidad.
Con la información obtenida se procedió a elaborar el PNO aplicable a las diferentes operaciones de cadena de frío que tienen lugar en las distintas dependencias de la empresa. El documento elaborado se sometió a revisión por un grupo de expertos conformado por especialistas de la propia EMCOMED antes de ser aprobado.
RESULTADOS
Como variables de efecto directo en la gestión o manejo integral de la cadena de frío, se identificaron cuatro elementos principales:
1. Procesos operativos.
2. Recursos materiales.
3. Recursos humanos.
4. Sistema de calidad y control.
Cada uno de ellos, a su vez, se relaciona con elementos secundarios de naturaleza común.
La representación gráfica de todos los elementos necesarios para el manejo integral de la cadena de frío de la empresa EMCOMED se muestran en la Figura 1.
Se elaboró el PNO “Directrices para el manejo integral de la cadena de frío”, compuesto por 70 páginas y dividido en los siguientes acápites: objetivos, alcance, nivel de acceso, términos y definiciones, responsabilidades, medidas de seguridad, desarrollo, registro, bibliografía y anexos.
El desarrollo quedó conformado por los sub-acápites: transportación por camiones y remolques, almacenamiento de larga duración, almacenamiento de corta duración/centro de distribución, programa de mantenimiento, respuesta a situaciones de emergencia, manejo de excursiones de temperatura, seguridad en el trabajo en cámaras de refrigeración y cámaras de congelación, capacitación de los recursos humanos, contratos e indicadores de gestión de las operaciones de la cadena de frío.
Se establecieron 8 registros de trabajo necesarios para evidenciar la gestión de calidad de la cadena de frío en las operaciones: formulario de registro del viaje para vehículos refrigerados, formulario de registro del viaje en el aprovisionamiento, control del monitoreo continuo, gráfico de temperatura y humedad, gráfico de temperatura, informe de revisión mensual de la temperatura y la humedad, trazabilidad de la temperatura en sistemas pasivos y control de rupturas de la cadena de frío.
En el procedimiento también se especificaron los requerimientos que deben satisfacer las cámaras de temperatura controlada, las cámaras de refrigeración y los vehículos refrigerados que se emplean en el almacenamiento y la transportación de productos farmacéuticos termosensibles.
DISCUSIÓN
Cualquier cadena de frío es tan fuerte como su eslabón más débil. Algo que caracteriza particularmente esta cadena, es el estricto control de la temperatura que se requiere en todas sus fases.
Para ello, no resulta suficiente con disponer de recursos materiales óptimos, sino que también es necesario garantizar otros elementos de gran repercusión en la calidad de las operaciones a temperatura controlada como, por ejemplo, contar con personal capacitado y entrenado para ejecutar de forma correcta todas las actividades y desarrollar los procesos operativos eficientemente para no poner en riesgo la calidad de los productos.
Es así que, con visión de proceso, una cadena de frío debe partir de un diseño que tome en cuenta los riesgos existentes e integre el aseguramiento de elementos claves como son: el sistema de gestión de calidad y control, la infraestructura, los recursos humanos, los procesos operativos y el flujo logístico a temperatura controlada desde el fabricante hasta el paciente11.
Este sistema logístico a temperatura controlada puede ser considerado como un sistema de gestión o manejo integral, que comprende tanto las BPD como el análisis de riesgos, tal como reflejan las guías, normas y procedimientos enfocados de manera particular en la calidad de la cadena de frío.
Dentro del universo de normas, guías y procedimientos que abordan de manera específica el aseguramiento de la calidad de la cadena de frío, destacan tres referencias que centran su atención en la gestión logística, los requerimientos de los procesos operativos y la preservación de la integridad de los productos termosensibles en la cadena de suministro.
La primera de ellas es la Norma Indicadores de Calidad de la Cadena de Frío (CCQI del inglés Cool Chain Quality Indicators)9, una norma industrial que establece los requisitos a cumplir por las empresas que manejan productos perecederos y sensibles a la temperatura que desean mejorar la calidad de su cadena de frío.
El sistema de gestión de calidad que describe esta norma consta de dos partes. La primera evalúa cuantitativamente la calidad de las operaciones individuales de la cadena de frío de la empresa a través de la comparación con indicadores para cada operación llamados puntos CCQI. La segunda, llamada CCQC (Cool Chain Quality Conformance), describe los requisitos de conformidad, tanto obligatorios como recomendables, que debe cumplir la empresa y su sistema de gestión de la cadena del frío para ser considerada conforme.
Ambas partes en su conjunto, establecen un incentivo para mejorar la operación de la cadena de frío en virtud de normas de alta calidad, haciendo posible una comparación entre diferentes estadios de una misma organización o entre diferentes organizaciones que realicen el mismo tipo de operación.
La norma tiene además la ventaja de no competir con otros sistemas de gestión del tipo ISO 9000, con los que es perfectamente integrable, ya que al igual que ellos incorpora elementos similares como la política respecto a la cadena del frío, el control de la documentación y los registros, la gestión de la competencia del personal, el control de los proveedores y los procesos subcontratados, las reclamaciones del cliente, las auditorías y la revisión por la dirección.
Al ser una norma hecha por y para empresas que gestionan la cadena de frío en sus operaciones, pone a disposición de la organización un modelo de excelencia en la gestión de la cadena del frío. Los puntos de referencia CCQI marcan para cada tipo de operación no solo los valores obtenidos, sino también las áreas de mejora que se pueden desarrollar para proporcionar servicios de mayor calidad, por lo que es una herramienta de gestión que permite a las empresas la mejora continua de los procesos para lograr más calidad en la cadena de frío.
Las Directrices para el Almacenamiento y Transporte de Productos Farmacéuticos Sensibles al Tiempo y la Temperatura7 es otra guía de la OMS que describe los principales requerimientos para el correcto almacenamiento y distribución de los productos termolábiles. Se basa en regulaciones de BPD existentes, de un amplio número de fuentes internacionales. Fue diseñada para ofrecer una visión general balanceada de los principales aspectos presentes en las regulaciones de BPD, aplicables al manejo de los productos farmacéuticos termosensibles.
Como tercera referencia de aplicación en la gestión de la cadena de frío, destacan los Modelos de Procedimientos Operativos Estándar (POE) para la Gestión Efectiva de Vacunas (GEV)8, los cuales tienen como objetivo proporcionar una orientación detallada sobre las buenas prácticas relativas a muchas de las tareas rutinarias que se deben llevar a cabo como parte de la logística de inmunización.
Dichos POE se redactan y clasifican de manera que puedan corresponder a los nueve criterios de la GEV. Esta valiosa herramienta de evaluación establece estándares para la cadena de suministro de vacunas, permitiendo el análisis sistemático de fortalezas y debilidades y la identificación de áreas de mejora, por lo que contribuye a fortalecer la cadena de frío, la cadena de suministros y logística, así como los sistemas de gestión de vacunas en todos los niveles del país.
Es por tanto una novedad, la armonización dentro del PNO “Directrices para el manejo integral de la cadena de frío”, de aspectos relativos a la gestión de la cadena de frío de los productos farmacéuticos termosensibles contenidos en estas referencias de aplicación global que confieren un alto grado de fiabilidad y calidad a las operaciones a temperatura controlada. Así mismo, contempla el cumplimiento de requisitos presentes en las regulaciones de BPD, tanto cubana6 como del ámbito internacional12-16.
La inclusión de elementos de la norma CCQI9 en el PNO posibilita la mejora continua de las operaciones de cadena de frío que desarrollan las dependencias de la empresa y la correspondencia con los modelos de POE de la GEV8, adaptados al contexto de la cadena de suministro nacional, viabiliza el propósito de la GEV de fortalecer las prácticas de gestión de la calidad como elemento esencial para una cadena de suministro de vacunas, las cuales se destacan por requerir el manejo más exigente.
La aplicación práctica de este PNO reporta beneficios en los órdenes económico y social, al tiempo que contribuye a evitar tanto pérdidas materiales a causa de la afectación de los productos por efecto de las excursiones de temperatura2-3 como la manifestación de consecuencias potenciales en los pacientes, relacionadas con la administración de medicamentos cuyas condiciones de conservación no han sido las adecuadas, las que pueden ir desde una ligera pérdida de eficacia sin relevancia clínica, hasta una pérdida total de actividad o incluso toxicidad17.
En su conjunto, cabe decir que, por la información técnica actualizada y de gran valor que contiene, el PNO “Directrices para el manejo integral de la cadena de frío” puede ser usado como referente por otras empresas del sector de la distribución de productos termosensibles, para la puesta en marcha de un sistema de cadena de frío de calidad.
CONCLUSIONES
Se definieron como elementos principales del sistema de gestión de la cadena de frío de la empresa EMCOMED: los procesos operativos, los recursos materiales, los recursos humanos y el sistema de calidad y control.
Se elaboró el PNO “Directrices para el manejo integral de la cadena de frío”, el cual constituye la base para el funcionamiento del sistema de gestión, concebido para garantizar la calidad de las operaciones de almacenamiento y transportación y preservar la integridad de los productos farmacéuticos termosensibles durante su manipulación en todas las dependencias de la empresa.
Conflicto de intereses: La autora declara no tener conflicto de intereses.
BIBLIOGRAFÍA
1. Merial Laboratorios. Cadena de frío: La cadena del valor. Disponible en: http://decein.com/images/dcn/Decein_Merial_guia_frio.pdf. Consultado en: 2 de enero de 2017.
2. Ricote-Lobera I, Ortiz-Martín B, Fraile-Gil S, Santos-Mena B, Hidalgo-Correas FJ, García-Díaz B. Estabilidad de los medicamentos termolábiles ante una interrupción accidental de la cadena de frío. Farm Hosp. 2014;38(3):169-192.
3. Kumar N, Jha A. Temperature excursion management: A novel approach of quality system in pharmaceutical industry. Saudi Pharmaceutical Journal. 2017; 25:176-183. Disponible en: https://www.sciencedirect.com/science/article/pii/ S131901641630069X?via%3Dihub. Consultado en: 3 de marzo de 2017.
4. Spiggelkötter N. A global review of good distribution practices. Cold Chain IQ Temperature Control Logistics & Quality Networkk. Disponible en: http:// www.iqpc.com/media/8378/34072.pdf. Consultado en: 10 de enero de 2017.
5. Bishara RH. Cold chain management – an essential component of the global pharmaceutical supply chain. American Pharmaceutical Review. Disponible en: http://www.intelsius.com/wp-content/uploads/2011/10/Pharma-Cold-Chain-Bishara_APR.pdf. Consultado en: 3 de marzo de 2017.
6. CECMED. Regulación 11-2012. Directrices sobre Buenas Prácticas de Distribución de Productos Farmacéuticos y Materiales. Disponible en: http://www. cecmed.cu/sites/default/files/adjuntos/Reglamentacion/reg_11-2012_directrices_sobre_bpdistribucion_de_productos_farmaceuticos_y_materiales.pdf. Consultado en: 3 de marzo de 2017.
7. WHO. Model guidance for the storage and transport of time and temperature sensitive pharmaceutical products. 2011. Technical Report Series No. 961, Annex 9. Disponible en: http://www.who.int/medicines/areas/quality_safety/ quality_assurance/ModelGuidanceForStorageTransportTRS961Annex9.pdf. Consultado en: 3 de marzo de 2017. Consultado en: 3 de marzo de 2017.
8. WHO. Modelos de procedimientos operativos estándar para la gestión efectiva de vacunas. Junio 2013. Versión 3. Disponible en: http://www.who. int/immunization/programmes_systems/supply_chain/EVM_model_SOP_manual_EN_June_2013_compact.pdf. Consultado en: 3 de marzo de 2017.
9. Germanischer Lloyd Certification & Cool Chain Association. Cool Chain Quality Indicator Standard. 28th July 2009. Version 2.2. Disponible en: https:// www.scribd.com/document/316550049/Norma-CCQI-Traducida-v-2-2. Consultado en: 3 de marzo de 2017.
10. Análisis de causa raíz: el diagrama de espina de pescado. Disponible en: http://managing-ils-reporting.itcilo.org/es/herramientas/analisis-de-causa-raiz-el-diagrama-de-espina-de-pescado. Consultado en: 3 de marzo de 2017.
11. Vértiz Combe U. La cadena de frío en la industria farmacéutica: del fabricante al paciente. Ingeniería Industrial. 2011;29:11-34. Disponible en: http:// fresno.ulima.edu.pe/sf/sf_bdfde.nsf/OtrosWeb/Ing29Cadena/$file/01-ingenieria-produccion-VERTIZ.pdf. Consultado en: 2 de enero de 2017.
12. WHO. Good Distribution Practices for pharmaceutical products. 2010. Technical Report Series No. 957, Annex 5. Disponible en: http://apps.who.int/medicinedocs/documents/s18678en/s18678en.pdf. Consultado en: 3 de marzo de 2017.
13. European Commission. Good Distribution Practice (GDP) guideline. 8 September 2013. 2013/C 68/01. Disponible en: https://ec.europa.eu/health/ sites/ health/files/files/eudralex/vol-1/2013_c343_01/2013_c343_01_en.pdf. Consultado en: 3 de marzo de 2017.
14. Health Canada. Guidelines for Temperature Control of Drug Products during Storage and Transport. 2013, GUI-0069. Disponible en: https://www.canada.ca/content/dam/hc-sc/migration/hc-sc/dhp-mps/alt_formats/pdf/ compli-conform/gmp-bpf/docs/GUI-0069-eng.pdf. Consultado en: 3 de marzo de 2017.
15. U.S. Pharmacopeia. Chapter 1079. Good Storage and Distribution Practices for Drug Products. Disponible en: https://pharmacy.ks.gov/docs/default-source/ default-document-library/ups-36-good-storage-and-shipping-practices.pdf. Consultado en: 3 de marzo de 2017.
16. U.S. Pharmacopeia. Chapter 1083. Good Distribution Practices. Disponible en: http://www.uspnf.com/sites/default/files/usp_pdf/EN/USPNF/1083_introduction_pf_40_2.pdf. Consultado en: 3 de marzo de 2017. Consultado en: 3 de marzo de 2017.
17. Steffen WH, Newton DW, Miller KW. Room Temperature and drug stability. Am J Hosp Pharm. 1994;51:406-9.
____