Fecha de recepción: 30/04/2018 – Fecha de aceptación: 23/07/2018
Gómez-de Rueda F1, Tena-Sempere ME2, Elósegui-Horno I1, Salcedo-Lagullón JL3, López-Mudarra LC3, Gálvez del Postigo-Ruiz A4
1 UGC Farmacia Hospitalaria. Complejo Hospitalario de Jaén. Jaén (España)
2 UGC Oftalmología,. H.S.J.D Aljarafe, Bormujos. Sevilla (España)
3 Dirección Gerencia y Médica. Complejo Hospitalario de Jaén. Jaén (España)
4 Dpto. Ciencias de la Salud. Cátedra de Microbiología de los Alimentos. Universidad de Jaén. Jaén (España)
____
Correspondencia:
Félix Gómez-De Rueda w UGC Farmacia Hospitalaria, Complejo Hospitalario de Jaén w Avda. Ejército Español, 10 w 23007 Jaén (España)
felixj.gomez.sspa@juntadeandalucia.es
____
Resumen
Objetivo: Analizar las características clínico-epidemiológicas y las medidas de contención para prevenir brotes infecciosos por gérmenes multirresistentes (MR) y los posibles errores cometidos durante el manejo del mismo.
Materiales y método: Estudio observacional y retrospectivo de una serie de casos de pacientes infectados por Klebsiella pneumoniae Oxa48 en una Unidad de Cuidados Intensivos de 7 meses de duración, donde se analizaron las características clínicas y epidemiológicas de los pacientes.
Resultados: De los 12 pacientes analizados, 10 de ellos eran hombres con edad media superior a los 60 años y todos ellos infectados o colonizados por K. pneumoniae 0xa48. Los datos analíticos fueron compatibles con paciente crítico ingresado en una UCI, lo que contribuyó al infausto pronóstico y desenlace de los pacientes. La estancia media de hospitalización fue de 68 días y donde todos los pacientes recibieron antibiótico dirigido de amplio espectro.
El bajo grado de aplicación de las medidas de prevención tanto del personal como de familiares, no resultaron efectivas y permitieron la diseminación del germen MR con un balance final de 10 exitus, contribuyendo a este infausto desenlace el inestable estado clínico de los pacientes.
Conclusiones: Es necesario un conocimiento preciso del germen y mayor severidad en la aplicación de las medidas para contener brotes de infecciones por multirresistentes. La frágil situación del paciente crítico, lo hace más sensible a un desenlace fatal.
Palabras clave: Klebsiella pneumoniae, epidemiología, medidas de control.
____
INTRODUCCIÓN
En torno a un 15% de los pacientes hospitalizados son susceptibles de una infección relacionada con la asistencia sanitaria (IRAS), siendo especialmente interesantes aquellos microorganismos resistentes a los tratamientos comúnmente utilizados. Estos gérmenes –a menudo bacterias– están directamente relacionados con una mayor morbimortalidad, lo que implica mayores estancias hospitalarias y consumo de recursos1,2, siendo comúnmente conocidas como bacterias multirresistentes (BMR).
La principal expresión de la inactividad a antibióticos es la existencia de bacterias patógenas con resistencia combinada a diferentes antibióticos3, lo que se conoce como multirresistencia (MDR).
Magiorakos et al.4 definieron la MDR como la ausencia de sensibilidad al menos a un antibiótico de tres o más familias útiles para el tratamiento de las infecciones producidas por cada una de las especies bacterianas consideradas. En este mismo trabajo se definió la resistencia extendida (XDR) como la ausencia de sensibilidad al menos a un antibiótico de todas las familias excepto una o dos, y la pan-resistencia (PDR) como la ausencia de sensibilidad a todos los antibióticos de todas las familias habitualmente utilizadas en el tratamiento.
Además, el European Centre for Disease Prevention and Control (ECDC)5 establece cuatro marcadores de resistencia a antimicrobianos (RAM): Staphylococcus aureus resistente a la meticilina (SARM), Enterococos resistentes a vancomicina (ERV), Enterobacterias resistentes a cefalosporinas de 3ª generación y microorganismos resistentes a antibióticos carbapenémicos.
Desde un punto de vista epidemiológico, la verdadera importancia de las BMR estriba en la rápida transmisión de diferentes mecanismos para evadir el efecto de los ATB, facilitando la selección de cepas resistentes6.
Así, durante la última década estamos asistiendo a un aumento, cada vez más frecuente, de infecciones causadas por bacterias gramnegativas resistentes a múltiples fármacos, incluyendo Enterobacterias-MR (EB-MR), Pseudomonas aeruginosa-MR (PSA-MR) y Acinetobacter baumanii-MR (AB-MR)7-9.
Algunas de estas enterobacterias son productoras de enzimas beta-lactamasas capaces de hidrolizar el anillo beta-lactámico, inutilizando a estos antibióticos y determinando el mecanismo de su resistencia. La mayoría de trabajos publicados, relacionan la multirresistencia de enterobacterias con la producción de beta-lactamasas de espectro extendido (BLEE) y carbapenemasas fundamentalmente, siendo estas últimas, las responsables de inactivar a los antibióticos carbapenémicos. Estas carbapenemasas10, se clasifican según Ambler11, en tres clases: clase A (KPC), clase B o metalo-beta-lactamasas (VIM, IMP y NDM) y clase C o serín-carbapenemasas (OXA48), constituyendo en la actualidad un problema clínico y de salud pública en continua evolución, cuya velocidad de diseminación conlleva un difícil control y tratamiento.
Según la experiencia de la que disponemos actualmente, los principales factores de riesgo para la adquisición de una infección por estas bacterias son entre otros, el ingreso de pacientes en UCI, la utilización de antibióticos (ATB) de amplio espectro y la cirugía12-16.
Estos microorganismos están generalmente implicados en infecciones graves, lo que suponen un gran problema de salud pública mundial. Las infecciones que causan tienen peor pronóstico que las debidas a patógenos sensibles, y es en parte debido a que los tratamientos antimicrobianos instaurados, previos a conocer datos microbiológicos que orienten o confirmen la etiología del proceso, no son efectivos en un significativo número de casos17. El principal mecanismo de transmisión de estos gérmenes se produce a través de las manos del personal sanitario, que se colonizan al entrar en contacto con pacientes ya infectados o colonizados.
En la actualidad, Klebsiella pneumoniae, es la más relevante especie del género y responsable del 70% de las infecciones en humanos18, ya que debido a su ubicuitaria distribución, son múltiples las localizaciones de infección o colonización de esta bacteria19,20, haciendo especialmente sencilla la contaminación de profesionales, familiares y objetos inanimados, que actúan como vectores de transmisión21.
El propósito por tanto de nuestro trabajo fue analizar las características clínico-epidemiológicas de los pacientes durante un brote de Klebsiella pneumoniae Oxa48 acaecido en la Unidad de Cuidados Intensivos (UCI) de un hospital de tercer nivel del sur de España, así como las medidas de contención para prevenir brotes y los posibles errores cometidos durante el manejo del mismo.
MÉTODO
Diseño
Estudio retrospectivo y observacional de una serie de casos consecutivos de 12 pacientes infectados por Klebsiella pneumoniae Oxa48, en el que se analizaron las características clínicas y epidemiológicas.
Ámbito
Estudio llevado a cabo en una UCI de un hospital de tercer nivel del sur de España con actividad médico-quirúrgica, coronaria, neurocríticos, traumatológica y general. El análisis de situación, recogida, tratamiento de datos y aplicación de las medidas correctoras, fueron llevadas a cabo tras yugular el brote de Klebsiella pneumoniae ocurrido en el último trimestre de 2017.
Sujetos
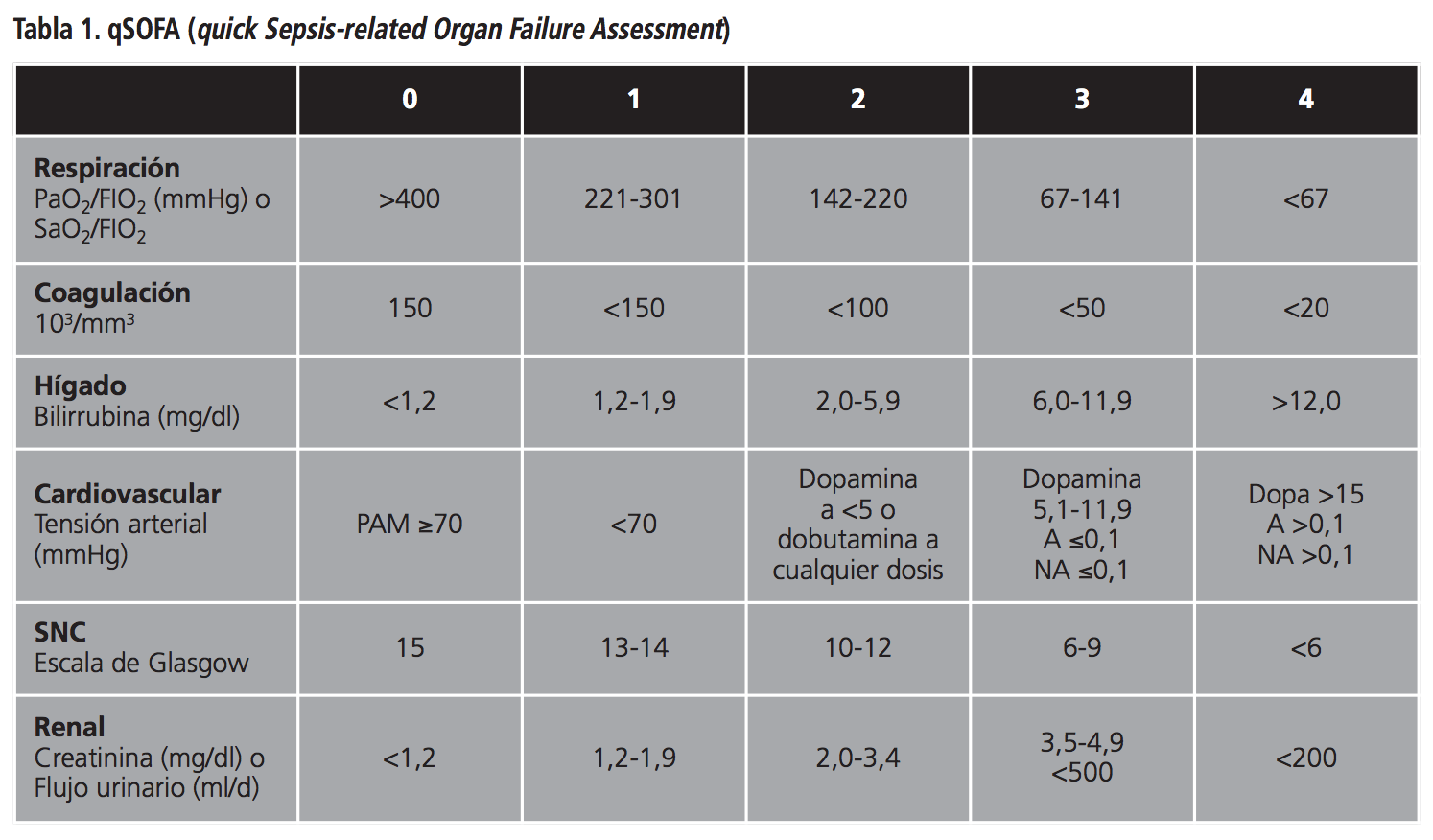
Para ello, se revisaron las historias clínicas de todos los pacientes clasificados de infección o colonización por K. pneumoniae Oxa48. La sospecha de colonización se estableció de acuerdo a resultados microbiológicos positivos en alguna de las muestras biológicas analizadas (generalmente realizadas mediante hisopo rectal), mientras que los casos de infección, además iban acompañados de signos y síntomas propios de infección. Una de las técnicas utilizadas para el diagnóstico precoz de infección, fue la escala qSOFA (quick Sepsis-related Organ Failure Assessment), herramienta sencilla que establece la sospecha o infección documentada de sepsis al cumplir criterios de infección y ≥2 puntos en la escala (Tabla 1).
Fuentes de datos
Todos los datos fueron recopilados a través de la aplicación corporativa “Diraya Atención Hospitalaria” (DAH), módulo de historia única digital de la Consejería de Salud de la Junta de Andalucía y del software corporativo MPA® de resultados bioquímicos y microbiológicos. El periodo de estudio estuvo comprendido durante los meses de septiembre de 2017 a marzo de 2018.
Variables
Las variables consideradas fueron analíticas, antropométricas de pacientes e higiénicas de la propia Unidad de ingreso hospitalario.
En el marco clínico, se consideraron variables analíticas de control como creatinina sérica (mg/dl), leucocitos (mm3), ácido láctico (mmol/L), frecuencia respiratoria (rpm), presión arterial media (PAm, mmHg), enzimas hepáticas (GGT, GOT y GPT) (U/L), hemoglobina (g/L), plaquetas (103/mm3), registro de temperatura (ºC) y PCR (proteína C reactiva, mg/L)) como reactante de fase aguda. Entre las antropométricas, se recopilaron talla (cm), peso (kg) y sexo (v/m). También se filió el germen, los días de ingreso hospitalario en UCI y el desenlace de los pacientes.
Se registró la procedencia de los pacientes (Servicios médicos y quirúrgicos) con el fin de establecer una posible relación entre el Servicio de origen y el potencial foco de infección, sin poder concluir ninguna asociación, si bien la patología quirúrgica fue más prevalente que la médica.
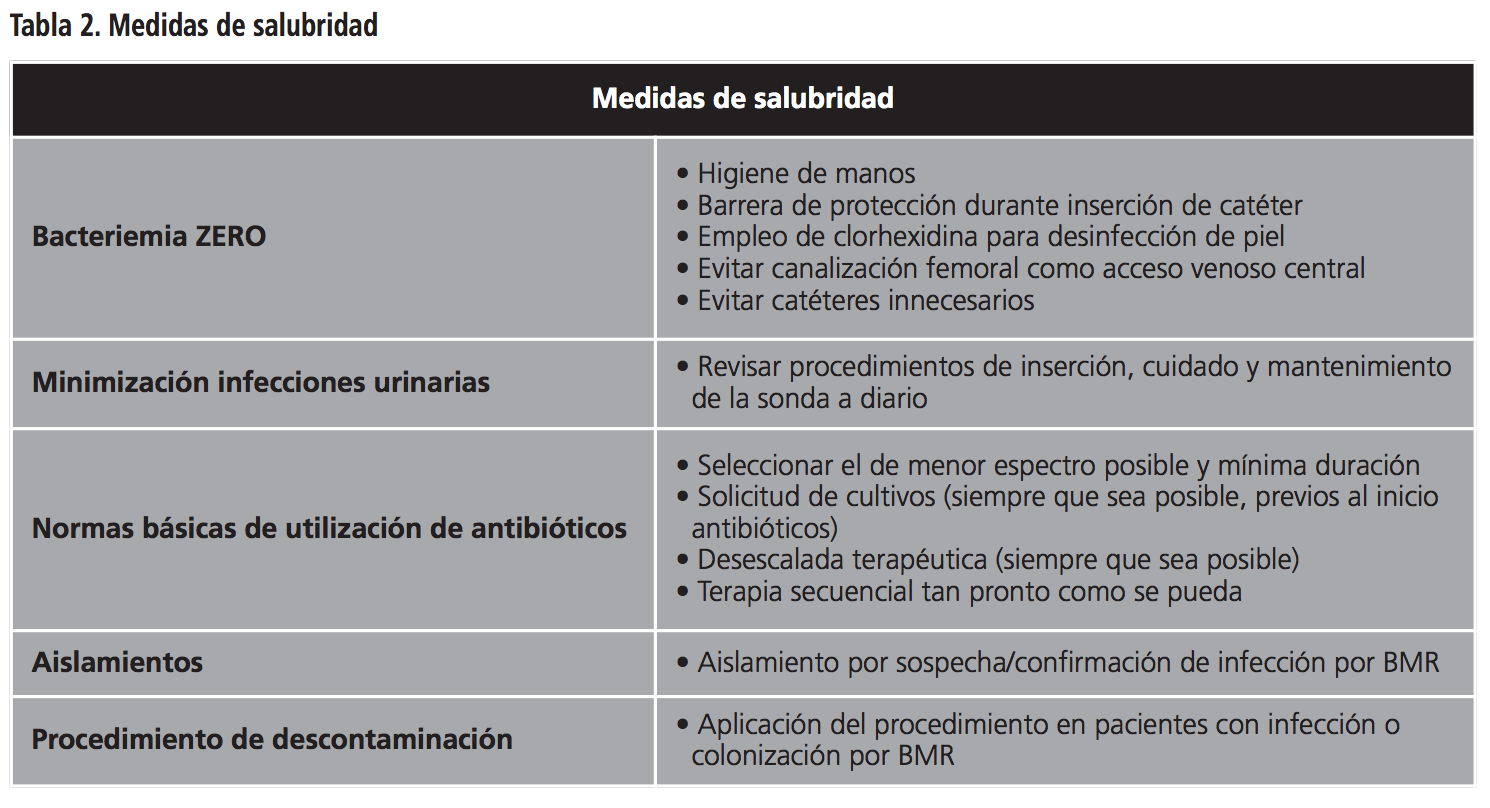
Las medidas salubres (Tabla 2) aplicadas, son las contempladas en los protocolos consensuados entre dicha Unidad de Gestión Clínica (UGC) y el Servicio de Medicina Preventiva del Centro Hospitalario, auspiciadas por la Sociedad Española de Medicina Preventiva, Salud Pública e Higiene (SEMPSPH).
Independientemente de las medidas habituales de descontaminación, una vez que el box de ingreso y estancia hospitalaria era abandonado, se utilizaban dispositivos de emisión de gases derivados de amonio cuaternario (AirTotal®) con actividad desinfectante, antes de ocupar de nuevo la estancia, asumiendo así una situación de esterilidad de partida al ingreso del nuevo paciente.
Entre las higiénicas, se tuvieron en cuenta medidas recomendadas para prevenir infecciones por BMR, tales como22: designación de un intensivista supervisor del uso de antiinfecciosos (especialmente aquellos de amplio espectro o restringidos en el Centro Hospitalario de referencia), evitar uso empírico de ATB restringidos o de amplio espectro cuando exista sospecha de sepsis por BMR, enfermera de referencia para garantizar las medidas de contención, comprobación mediante “check-list” de posibles portadores de BMR, aislamientos, protocolo de limpieza y desinfección de instalaciones, esterilización de utensilios, higiene de manos, higiene diaria de pacientes colonizados, cultivos de control y tipificación molecular del agente etiológico.
RESULTADOS
Se revisaron datos analíticos de 12 historias de salud, considerando paciente infectado o colonizado por K. pneumoniae durante su estancia en la Unidad de Cuidados Intensivos. Del total de pacientes en seguimiento, el 83% eran hombres, con una edad media de 63 años y rango de (53-76).
Todos los pacientes presentaban criterios de infección, con cifras de leucocitos superiores a 12.000/mm3 o inferiores a 4.000/mm3, lactato superior a 2 mmol/L (en ausencia de hipovolemia) y taquipnéicos con frecuencias respiratorias superiores 22 rpm. Además, 3 de los 12 pacientes, fueron clasificados de sepsis (requirieron fluidoterapia) y uno de ellos se clasificó de shock séptico dada la necesidad de utilizar drogas vasoactivas para mantener presiones arteriales medias (PAm) superiores a 65 mmHg. A todos se les realizó la escala q-SOFA (quick Sepsis-related Organ Failure Assessment), para identificación de sepsis, evidenciando además de los datos referidos, alteraciones del nivel de conciencia con registros en la escala de Glasgow ≤13 (GCS o Glasgow Coma Scale).
La estancia media de hospitalización fue de 68,82 días (IC95% 40,36 a 97,28), llegándose a registrar un valor máximo de 156. Los valores medios de los principales biomarcadores fueron de 1,24 (IC95% 0,93 a 1,54) y rango (0,66-2,20) mg/dl de creatitinemia, 16,6×109/L leucocitos, 9,71 g/dl de hemoglobina (IC95% 7,42 a 11,98), 4,28 mmol/L ácido láctico (IC95% 1,41 a 7,15), 162.375 plaquetas, GGT: 830,3 U/L (IC95% 546,82 a 1059,77), GOT: 237,5 U/L (IC95% 119,08 a 335,91) y GPT: 120,8 U/L (IC95% 41,65 a 199,94).
Tanto los pacientes colonizados como aquellos con signos de infección y clínica compatibles, dieron positivo para Klebsiella pneumoniae Oxa48, habiéndose computado un valor medio de días transcurridos desde el ingreso hasta cultivos positivos para esta bacteria de 7,36 días (IC95% 4,89 a 9,83) y rango de (3-16). La técnica empleada para las sospechas de colonización fue el frotis rectal.
Los valores medios analíticos para PCR y temperatura corporal fueron de 160,9 mg/L (IC95% 121,32 a 200,47) y 38,7ºC (IC95% 38,33 a 39,27), no documentándose Procalcitonina (PCT) debido a valores aislados e irregularmente solicitados.
Un dato curioso y relevante, fue que de los 12 pacientes en seguimiento solo 10 tuvieron registro de cultivos y antibiogramas de sensibilidad antibiótica, lo que permitió poder implementar tratamiento dirigido con Ceftazidima/Avibactam (2g/0,5g) a razón de 1 vial cada 8 h, según indicaciones de ficha técnica. Al 56% de los pacientes, hubo que ajustarles en algún momento la medicación por función renal.
Los dos pacientes restantes fueron igualmente tratados y considerados a pesar de no disponer de screening microbiológico, ya que tanto la clínica como la evolución fueron compatibles con el resto de los afectados.
A pesar de todos los esfuerzos realizados, 10 de los 12 pacientes (83%) fallecieron en UCI antes de poder darles el alta a planta.
DISCUSIÓN
Desde el punto de vista epidemiológico y de salud pública, uno de los principales problemas detectados, fue que en ocasiones y a pesar de las medidas de prevención implementadas, la escasez de enfermeros, auxiliares y técnicos obligó a realizar incursiones repetidas en los diferentes boxes de hospitalización, tanto de usuarios infectados/colonizados como sanos, provocando así cierto grado de diseminación bacteriana.
A pesar de habilitar un estetoscopio exclusivo para cada box de ingreso, depositado en la entrada y restringiendo su uso a ese habitáculo para evitar así la contaminación de instrumental, resultó muy difícil evitar roces y fricciones con aparataje, utensilios de intubación, sistemas de circulación e incluso la propia ropa desechable del personal facultativo.
Otro de los puntos débiles detectados y analizados, fue la contaminación y difusión de gérmenes durante los pases de visitas de los familiares, quienes en ocasiones y desoyendo la opinión del facultativo responsable, accedían al habitáculo en aislamiento sin las medidas de protección oportunas o sin llevar a cabo de forma estricta las recomendaciones de seguridad biológica. Esto sin duda contribuyó a una potencial diseminación del germen estudiado a pacientes limpios.
Por otro lado, en aquellos pacientes caracterizados inicialmente como “colonizados” y comportándose como portadores del microorganismo motivo de estudio pero sin clínica compatible con infección, se acordó realizar una “descontaminación digestiva selectiva (DDS)” siguiendo protocolos publicados por López-Santamaría et al.23 en la Sociedad Española de Farmacia Hospitalaria (SEFH), a base de cápsulas de estreptomicina/neomicina.
A los pocos días de los primeros ingresos, se testó la sensibilidad de la cepa de Klebsiella pneumoniae Oxa48 aislada, siendo ésta resistente a aminoglucósidos, lo que indujo a suspender el protocolo tras haber observado la ausencia de negativización de KP en el cultivo rectal y considerando la actuación como un aumento innecesario de la presión antibiótica.
Finalmente y tras un periodo de ingreso y análisis de unos 5 meses aproximadamente, 10 de los 12 pacientes motivo de estudio fueron exitus.
Esta situación fue relacionada con la condición crítica de los pacientes estudiados, pues la presencia de graves patologías de base, contribuyó sin duda a este infausto desenlace.
CONCLUSIONES
– Las infecciones producidas por bacterias multirresistentes han demostrado condicionar gravemente la evolución de los pacientes en una Unidad de Cuidados Intensivos.
– Es necesaria una buena filiación microbiológica para seleccionar el antibiótico más adecuado lo antes posible, minimizando así el empeoramiento clínico.
– La situación crítica basal, junto al complicado manejo clínico-terapéutico de estos gérmenes-MR y los prolongados ingresos hospitalarios, llevan asociada una elevada morbi-mortalidad.
– Es fundamental el cumplimiento de las medidas higiénico-preventivas tanto por profesionales como por familiares, para evitar la dispersión de gérmenes, especialmente los multirresistentes.
– El laxo cumplimiento de las normas de contención condujo a una probable diseminación del germen con un balance de exitus muy elevado.
Aportación a la literatura científica
La importancia de este trabajo reside en que las infecciones originadas por BMR generan inconvenientes adicionales por la resistencia intrínseca a la mayoría de los antimicrobianos más modernos y selectivos, lo que ocasiona una dificultad añadida para alcanzar éxito clínico y terapéutico. Por tanto, nuestra única pretensión, es que esta experiencia pudiera contribuir a otros profesionales sanitarios en la mejora sobre el manejo de estas infecciones, reflexionando de lo que se debería o no hacer.
Financiación: Los autores no han recibido financiación alguna durante la preparación de este manuscrito.
Conflicto de intereses: Los autores declaran no tener conflicto de intereses.
BIBLIOGRAFÍA
1. Rodríguez-Pardo D, Mirelis B, Navarro F. Infecciones producidas por Clostridium difficile. Enferm Infecc Microbiol Clin. 2013;31(4):254-63.
2. Asensio A, Monge D. Epidemiología de la infección por Clostridium difficile en España. Enferm Infecc Microbiol Clin. 2012;30(6):333-7.
3. Red Nacional de Vigilancia Epidemiológica (RENAVE). Protocolo de vigilancia y control de microorganismos multirresistentes o de especial relevancia clínico-epidemiológica (ProtocoloMMR). Madrid, 2016.
4. Magiorakos et al. Multidrug-resistant, extensively drug-resistant and pandrug-resistant bacteria: an international expert proposal for interim standard definitions for acquired resistance. Clin Microbiol Infect. 2012 Mar;18(3):268-81.
5. European Centre for Disease Prevention and Control/European Medicines Agency. ECDC/EMEA joint technical report: the bacterial challenge: time to react.: European centre for disease prevention and control & European medicines agency, Stockholm, Sweden & London, United Kingdom, 2009.
6. European Centre for Disease Prevention and Control. Point prevalence survey of healthcare-associated infections and antimicrobial use in European acute care hospitals. Stockholm: ECDC; 2013. Disponible en: http://ecdc.europa.eu/ en/publications/Publications/healthcareassociatedinfectionsantimicrobial-use-PPS.pdf.
7. L. Martínez-Martínez, J. Calvo. The growing problem of antibiotic resistance in clinically relevant Gram-negative bacteria: Current situation Enferm Infecc Microbiol Clin. 28 (2010), pp. 25-31. http://dx.doi.org/10.1016/S0213-005X (10)70027-6.
8. N. Woodford, J.F. Turton, D.M. Livermore. Multiresistant Gram-negative bacteria: The role of high-risk clones in the dissemination of antibiotic resistance. FEMS Microbiol Rev, 35 (2011), pp. 736-755. http://dx.doi.org/10.1111/j.1574-6976.2011.00268.x.
9. J. Ho, P.A. Tambyah, D.L. Paterson. Multiresistant Gram-negative infections: A global perspective. Curr Opin Infect Dis. 23 (2010), pp. 546-553. http://dx. doi.org/10.1097/QCO.0b013e32833f0d3e.
10. J. Oteo, et al. Enferm Infecc Microbiol Clin. 2014;32(10):666-670.
11. T.R. Walsh. International Journal of Antimicrobial Agents. 2010;36:S8-S14.
12. Sánchez-Romero I, Asensio A, Oteo J, Muñoz-Algarra M, Isidoro B, Vindel A, et al. Nosocomial outbreak of VIM-1-producing Klebsiella pneumoniae isolates of multilocus sequence type 15: Molecular basis, clinical risk factors, and outcome. Antimicrob Agents Chemother. 2012;56:420-7.
13. Lee GC, Burgess DS. Treatment of Klebsiella pneumoniae carbapenemase (KPC) infections: A review of published case series and case reports. Ann Clin MicrobiolAntimicrob. 2012;11:32.
14. Oteo J, Hernández-Almaraz JL, Gil-Antón J, Vindel A, Fernández S, Bautista V, et al. Outbreak of VIM-1-carbapenemase-producing Enterobacter cloacae in a pediatric intensive care unit. Pediatr Infect Dis J. 2010;29:1144-6.
15. Paño-Pardo JR, Ruiz-Carrascoso G, Navarro-San Francisco C, Gómez-Gil R, Mora-Rillo M, Romero-Gómez MP, et al. Infections caused by OXA-48-producing Klebsiella pneumoniae in a tertiary hospital in Spain in the setting of a prolonged, hospital-wide outbreak. J Antimicrob Chemother. 2013;68:89-96.
16. Cantón R, Bryan J. Global antimicrobial resistance: From surveillance to stewardship. Part 1: Surveillance and risk factors for resistance. Expert Rev Anti Infect Ther. 2012;10:1269-71.
17. M.C. Fariñas, L. Martínez-Martínez. Infecciones causadas por bacterias gramnegativas multirresistentes: enterobacterias, Pseudomonas aeruginosa, Acinetobacter baumannii y otros bacilos gramnegativos no fermentadores. Enferm Infecc Microbiol Clin. 2013;31(6):402-409.
18. Hansen DS, Gottschau A, Kolmos HJ. 1998. Epidemiology of Klebsiella bacteraemia: a case control study using Escherichia coli bacteraemia as control. J Hosp Infect 38:119-32. http://dx.doi.org/10.1016/S0195-6701(98)90065-2.
19. Broberg CA, Palacios M, Miller VL. 2014. Klebsiella: a long way to go towards understanding this enigmatic jet-setter. F1000Prime Rep 6:64.
20. Daikos GL, Markogiannakis A, Souli M, Tzouvelekis LS. 2012. Bloodstream infections caused by carbapenemase-producing Klebsiella pneumoniae: a clinical perspective. Expert Rev Anti Infect Ther. 10:1393-1404. http://dx.doi.org/ 10.1586/eri.12.138.
21. Johann D. D. Pitout,a,b,c,d Patrice Nordmann,e,f Laurent Poirel. Carbapenemase-Producing Klebsiella pneumoniae, a Key Pathogen Set for Global Nosocomial Dominance. Antimicrob Agent Chemother. 2015;59(10).
22. Prevención del desarrollo de bacterias multirresistentes en pacientes críticos. Grupo de trabajo Resistencia Zero, Hospital Vall d´hebron. 2014.
23. López-Santamaría Donoso J, Guerra Viguera I. Nueva formulación de neomicina y estreptomicina para la descontaminación digestiva de klebsiella pneumoniae productora de carbapenemasas. Farm. Hosp. 2017;41(5):646-647.
____
Descargar artículo en PDF: Características clínico-epidemiológicas de un brote de Klebsiella pneumoniae Oxa48 en una UCI médico-quirúrgica. Una experiencia para reflexionar
