Fecha de recepción: 01/03/2018 – Fecha de aceptación: 05/03/2018
García Gil S1, Gutiérrez Nicolás F1, Ramos Díaz R2, Nazco Casariego GJ1, Carrillo Palau M3
1 Servicio de Farmacia
2 Fundación Canaria de Investigación Sanitaria (FUNCANIS)
3 Servicio de Gastroenterología
Complejo Hospitalario Universitario de Canarias. Tenerife (España)
____
Correspondencia:
Sara García Gil
Complejo Hospitalario Universitario de Canarias
(Servicio de Farmacia)
Carretera Ofra, s/n
38320 San Cristóbal de La Laguna (Santa Cruz de Tenerife)
Correo electrónico: saragg1991@gmail.com
____
Resumen
Los polimorfismos en Tiopurina-metiltransferasa y Nudix-hydrolase 15 han sido relacionados con toxicidad grave asociada al uso de fármacos derivados de tiopurina. Con el presente trabajo hemos querido mostrar como su determinación ha permitido un adecuado control de la enfermedad inflamatoria intestinal en un paciente con una inmunodeficiencia congénita grave.
Palabras clave: TPMT, NUDT15, azatioprina, inmunodeficiencia variable común.
____
Introducción
La azatioprina, derivado de tiopurina, se ha convertido en uno de los fármacos claves para el manejo farmacoterapéutico de la enfermedad inflamatoria intestinal (EII). Concretamente, se trata de un profármaco de la 6-mercaptopurina, la cual es transformada en tioinosina monofosfato (TIMP), dando lugar a nucleótidos de tioguanina, que son a su vez incorporados al ADN y al ARN, ejerciendo así su efecto citotóxico. Sin embargo, el interés farmacogenético de la azatioprina reside en su metabolismo. Éste viene condicionado, en gran parte, por la tiopurina metiltransferasa (TPMT), enzima responsable de la metilación de 6-mercaptopurina, limitando de esta forma la formación de TIMP. Han sido descritos varios polimorfismos para el gen TPMT, cuya presencia implica una disminución en la capacidad metabólica del fármaco, ocasionando situaciones de toxicidad grave, incluso fatales1. Concretamente, se han identificado seis posibles alelos no funcionales que dan lugar a los diferentes fenotipos de actividad en la TPMTi:
Fenotipo con riesgo intermedio; heterocigoto (HT):
*1/*2, *1/*3A, *1/*3B, *1/*3C y *1/*4.
Fenotipo de alto riesgo; homocigoto mutado (HM):
*2/*3A, *3A/*3A, *3C/*3A, *3C/*4, *3C/*2 y *3A/*4.
La relación entre la presencia de estos polimorfismos y los niveles plasmáticos de los diferentes metabolitos activos de la azatioprina ha sido demostrada en diversas publicaciones1,2. Sin embargo, en un 20% de los pacientes, estas mutaciones en TPMT no son capaces de explicar, por sí solas, la toxicidad asociada al uso de tioguaninas. De tal forma que, recientemente han sido identificadas otras variantes en el gen NUDT15 (nudix hydrolase 15), las cuales están relacionadas con la toxicidad a azatioprina y 6-mercaptopurina3,4. Uno de los polimorfismos identificados (rs116855232), se asocia con mielosupresión tras el tratamiento con tiopurinas en pacientes con EII y en niños con leucemia linfoblástica aguda (LLA). Incluso Yang JJ, et al. establecen que los pacientes portadores de la mutación en homocigosis, únicamente son capaces de tolerar un 8% de la dosis estándar4. De este modo, algunos autores defienden que la causa de toxicidad severa en los pacientes WT para TPMT, podrían ser estas alteraciones en el gen NUDT155. Sin embargo, los datos disponibles actualmente sobre la influencia de este nuevo gen en la farmacodinamia de estos fármacos se encuentran limitados únicamente a la población asiática.
Con el siguiente trabajo queremos presentar el caso de un paciente diagnosticado de inmunodeficiencia severa congénita como patología de base, que además desarrolla una EII de tipo yeyunitis ulcerativa resistente a varias líneas de tratamiento, al cual se le prescribe azatioprina para el control de la misma y de cómo la determinación farmacogenética permite llevar a cabo un adecuado manejo de la enfermedad evitando la aparición de toxicidad.
DESCRIPCIÓN DEL CASO
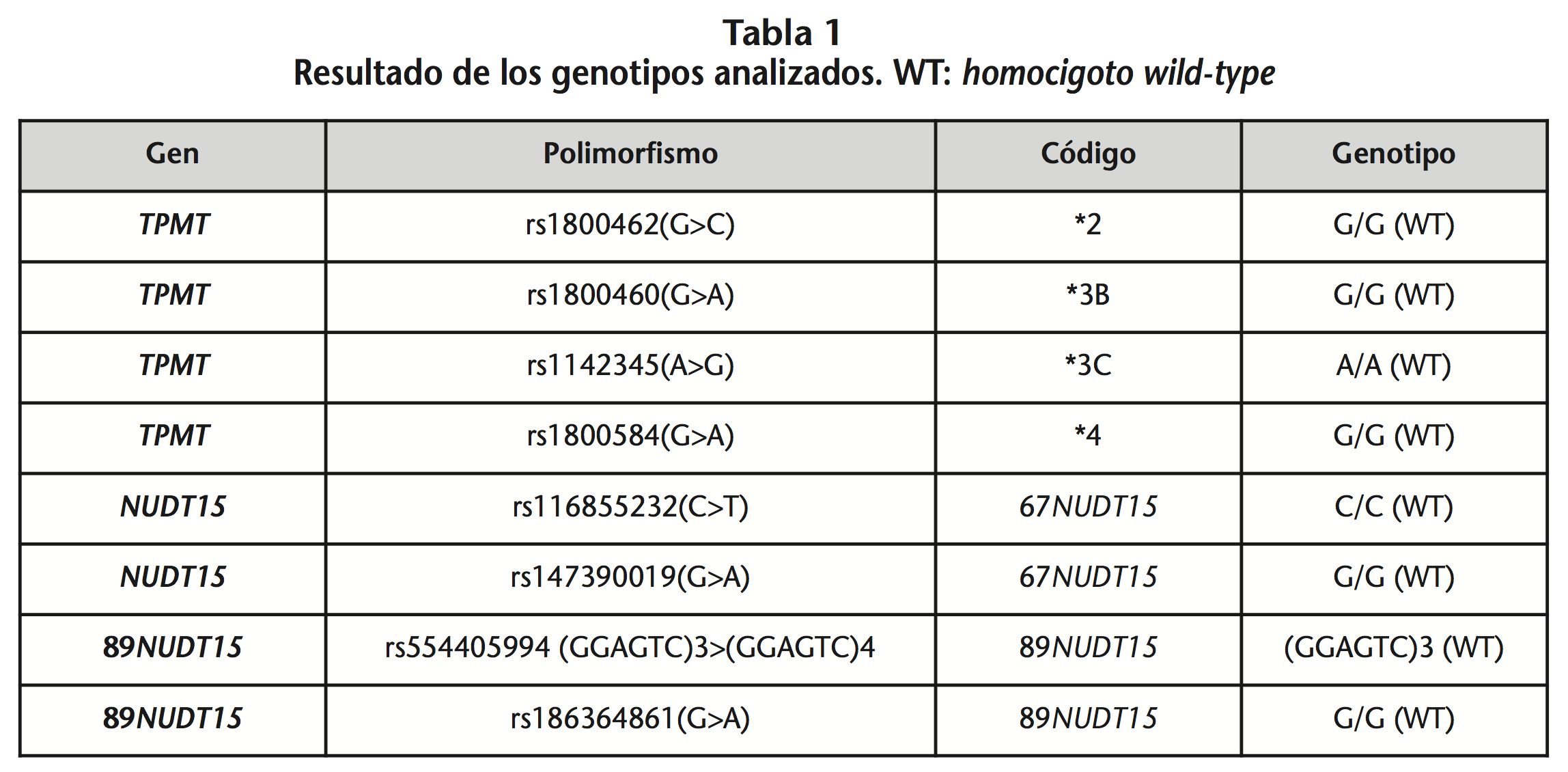
Paciente varón, de 21 años de edad, diagnosticado a los 8 años de inmunodeficiencia variable común (IVC) con manifestación principalmente de tipo gastrointestinal. En 2002 es diagnosticado de yeyunitis ulcerative, recibiendo diferentes líneas de tratamiento (mesalazina y corticoterapia) sin lograr un correcto control de la enfermedad. Frente a esta situación, el médico responsable decide iniciar tratamiento con azatiorpina como siguiente escalón terapéutico. Dado el riesgo de inmunosupresión severa derivado del uso de este fármaco, se decide realizar un análisis farmacogenético para los polimorfismos de la TPMT (rs2842934, rs2842934, rs1800460, rs1800584 y rs1142345) y NUDT15 (rs116855232, rs147390019, rs554405994 y rs186364861).
La extracción de ADNg se realizó mediante el método Ramos et al. (2015)5. En cuanto a la caracterización genética, fue realizada mediante la plataforma LightClycler®480 y posterior secuenciación del ADNg.
El paciente firmó un consentimiento informado para la realización de la determinación.
Los resultados de la determinación genética mostraron que el paciente no era portador de ninguna mutación en la serie de genes analizados (Tabla1).
En base a los resultados del test farmacogenético se inició el tratamiento con azatioprina a dosis plenas (2 mg/kg/día). Tras seis meses de tratamiento (junio 2016-enero 2017) se logró un control adecuado de la EII, sin observarse ninguna alteración en los niveles plasmáticos de neutrófilos, ni otro tipo de toxicidad asociada al tratamiento con azatioprina. Actualmente el paciente continúa con su tratamiento habitual.
DISCUSIÓN
La integración de los Servicios de Farmacia en equipos multidisciplinares, está facilitando la implantación de la farmacogenética en la práctica clínica diaria de nuestros hospitales. Este tipo de determinaciones aportan a los clínicos prescriptores herramientas con las que mejorar la efectividad y seguridad de los tratamientos. Además, el presente trabajo es, según nuestro conocimiento, el primero en el cual se realiza la determinación de polimorfismos en NUDT15 en población caucásica.
Con el presente caso hemos querido mostrar un ejemplo en el que la determinación del perfil genético WT para TMPT y NUDT15 ha permitido emplear dosis plenas de azatioprina desde el inicio del tratamiento, hecho que ha demostrado un mejor control de la enfermedad1; en un paciente con una patología de base que podría dar lugar a complicaciones graves asociadas al tratamiento con azatioprina.
Conflicto de intereses: Los autores declaran no tener conflicto de intereses.
Bibliografía
1. Relling MV, Gardner EE, Sandborn WJ, Schmiegelow K, Pui CH, Yee SW, et al. Clinical Pharmacogenetics Implementation Consortium. Clinical Pharmacogenetics Implementation Consortium guidelines for thiopurine methyltransferase genotype and thiopurine dosing. Clin Pharmacol Ther. 2011;89:387-91.
2. Lee MN, Kang B, Choi SY, Kim MJ, Woo SY, Kim JW, et al. Relationship between azathioprine dosage, 6-thioguanine nucleotide levels, and therapeutic response in pediatric patients with IBD treated with azathioprine. Inflamm Bowel Dis. 2015;21:1054-62.
3. Suzuki H, Fukushima H, Suzuki R, Hosaka S, Yamaki Y, Kobayashi C, et al. Genotyping NUDT15 can predict the dose reduction of 6-MP for children with acute lymphoblastic leukemia especially at a preschool age. J Hum Genet. 2016;61:797-801.
4. Yang JJ, Landier W, Yang W, Liu C, Hageman L, Cheng C, et al. Inherited NUDT15 variant is a genetic determinant of mercaptopurine intolerance in children with acute lymphoblastic leukemia. J Clin Oncol. 2015;33:1235-42.
5. Ramos-Díaz R, Gutiérrez-Nicolás F, Nazco-Casariego GJ, González-Perera I, Pérez-Pérez JA. Validation of a fast and low-cost alkaline lysis method for gDNA extraction in a pharmacogenetic context. Cancer Chemother Pharmacol. 2015;75:1095-8.
____
Descargar artículo en PDF: Implicación clínica de la farmacogenética de Tiopurina-metiltransferasa y Nudix-hidrolase 15. A propósito de un caso
