Rev. OFIL 2017, 27;1:85-87
Fecha de recepción: 20/06/2016 – Fecha de aceptación: 20/09/2016
____
Gómez-Álvarez S1, Sancho-Calabuig MA2, Hermenegildo-Caudevilla M3, Climente-Martí M4
1 Farmacéutico Especialista. Sevicio de Farmacia
2 Facultativo Especialista. Servicio de Nefrología
3 Facultativo Especialista. Servicio de Farmacia
4 Jefe de Servicio de Farmacia
Hospital Universitario Doctor Peset. Valencia (España)
____
Correspondencia:
Sandra Gómez Álvarez
Hospital Universitario Doctor Peset
(Servicio de Farmacia)
Avda. Gaspar Aguilar, 90
46017 Valencia
Correo electrónico: gomal.sandra@gmail.com
____
Resumen
El pronóstico de la infección por VIH ha mejorado con la introducción de la terapia antirretroviral de gran actividad, considerando el trasplante de órgano sólido una alternativa terapéutica en estos pacientes con enfermedad renal avanzada. Presentamos un caso de interacción farmacológica entre tacrolimus y la combinación de dos inhibidores de la proteasa, darunavir y ritonavir, en un paciente trasplantado renal, infectado por una cepa de VIH multirresistente, que se complicó posteriormente con la aparición de nefropatía por el virus BK en el injerto renal y donde la monitorización farmacocinética permitió el ajuste preciso del tratamiento inmunosupresor, evitando el cambio de tratamiento antirretroviral y el desarrollo de nefrotoxicidad crónica sobre el injerto.
Palabras clave: Trasplante renal, tacrolimus, interacción, antirretrovirales, virus BK.
____
Introducción
El pronóstico de la infección por VIH ha mejorado significativamente desde la introducción de la terapia antirretroviral de gran actividad, considerando el trasplante de órgano sólido (TOS) como alternativa en pacientes VIH con enfermedad renal avanzada1-3. La inmunosupresión debe ser manejada con precaución debido al riesgo de infecciones oportunistas e interacciones con el tratamiento antirretroviral4,5. La inmunosupresión en el trasplante renal incluye una inducción, con anticuerpos monoclonales anti-IL2 (basiliximab) o anticuerpos antilinfocitarios (timoglobulina), y un mantenimiento con la combinación de un inhibidor de la calcineurina (tacrolimus o ciclosporina), un antiproliferativo (micofenolato de mofetilo o sódico) o un inhibidor m-TOR (sirolimus o everolimus) y esteroides. El tacrolimus, sustrato de la glicoproteína P con metabolismo a través del citocromo P450 (CYP3A4), es el inmunosupresor más utilizado actualmente6. Los inhibidores de la proteasa (IP) son inhibidores potentes del CYP3A4, sustratos de la glicoproteína P y suelen emplearse de forma combinada4,5. Ritonavir se combina con un segundo IP cuyo metabolismo inhibe, elevando sus niveles sanguíneos con el consecuente bloqueo del CYP3A4. Esta inhibición incrementa la semivida del tacrolimus y sus concentraciones sanguíneas4,5 pudiendo ocasionar toxicidad a múltiples niveles. La elevada variabilidad farmacocinética intra e interindividual, la correlación entre la concentración sanguínea y la respuesta terapéutica y el riesgo de interacciones hacen necesaria la monitorización de los niveles sanguíneos de tacrolimus.
CASO CLÍNICO
Varón de 60 años con infección VIH por una cepa viral multirresistente, estadio C3, en tratamiento con darunavir (600 mg/12h), ritonavir (100 mg/12h), raltegravir (400 mg/12h) y tenofovir/emtricitabina (200/245 mg/24h). En junio de 2012 presentó fracaso renal agudo secundario a nefritis túbulo-intersticial crónica, diagnosticada por biopsia, que se atribuyó a nefrotoxicidad por tenofovir, y que condujo a la suspensión del mismo e introducción de etravirina (200 mg/12h), manteniendo el resto del tratamiento antirretroviral. Precisó hemodiálisis periódica hasta que en agosto de 2014 se realizó un trasplante renal de donante cadáver. Recibió basiliximab, micofenolato de mofetilo (1000 mg/12h), tacrolimus de liberación rápida 9 mg diarios desde el día +2 y prednisona en pauta descendente.
Dada la multirresistencia de la cepa del VIH del paciente, con escasas alternativas disponibles, se inició su tratamiento antirretroviral habitual a pesar del riesgo de interacción. La primera monitorización farmacocinética de tacrolimus (día +4) objetivó una Cs >30 ng/ml (límite superior de detección de la técnica analítica), reduciéndose la dosis hasta 4 mg/24h sin obtener modificación de la Cs y presentando el paciente hiperglucemia, acidosis metabólica, elevación de bilirrubina y transaminasa glutámico-pirúvica atribuidos a toxicidad por tacrolimus, decidiendo la suspensión del tratamiento el día +8 (Figura 1). A pesar de ello, las concentraciones sanguíneas de tacrolimus (obtenidas mediante dilución manual de la muestra) fueron de 98,4 ng/ml el día +10 y 58 ng/ml el día +17, evidenciando la escasa eliminación del fármaco. Finalmente, ante la ausencia de mejoría de función renal con necesidades de hemodiálisis periódica en el contexto de nefrotoxicidad grave por tacrolimus, se suspendió el tratamiento con darunavir y ritonavir (día +18), introduciendo raltegravir (400 mg/12h), etravirina (200 mg/12h) y lamivudina (100 mg/24h). El día +22, 96 horas tras la suspensión de los IP y 14 días después de la suspensión del tacrolimus, la Cs de tacrolimus fue de 8,8 ng/ml, reiniciándose darunavir (600 mg/12h) y ritonavir (100 mg/12h), y suspendiendo la lamivudina. Ante la estabilidad de la Cs se reintrodujo tacrolimus a dosis de 0,5 mg/24h, realizándose una estrecha monitorización farmacocinética, siendo dado de alta el día +27 con tacrolimus 0,5 mg/48h (Cs 11,1 ng/ml) y creatinina de 3,45 mg/dl (Filtrado glomerular estimado: 18 ml/min).
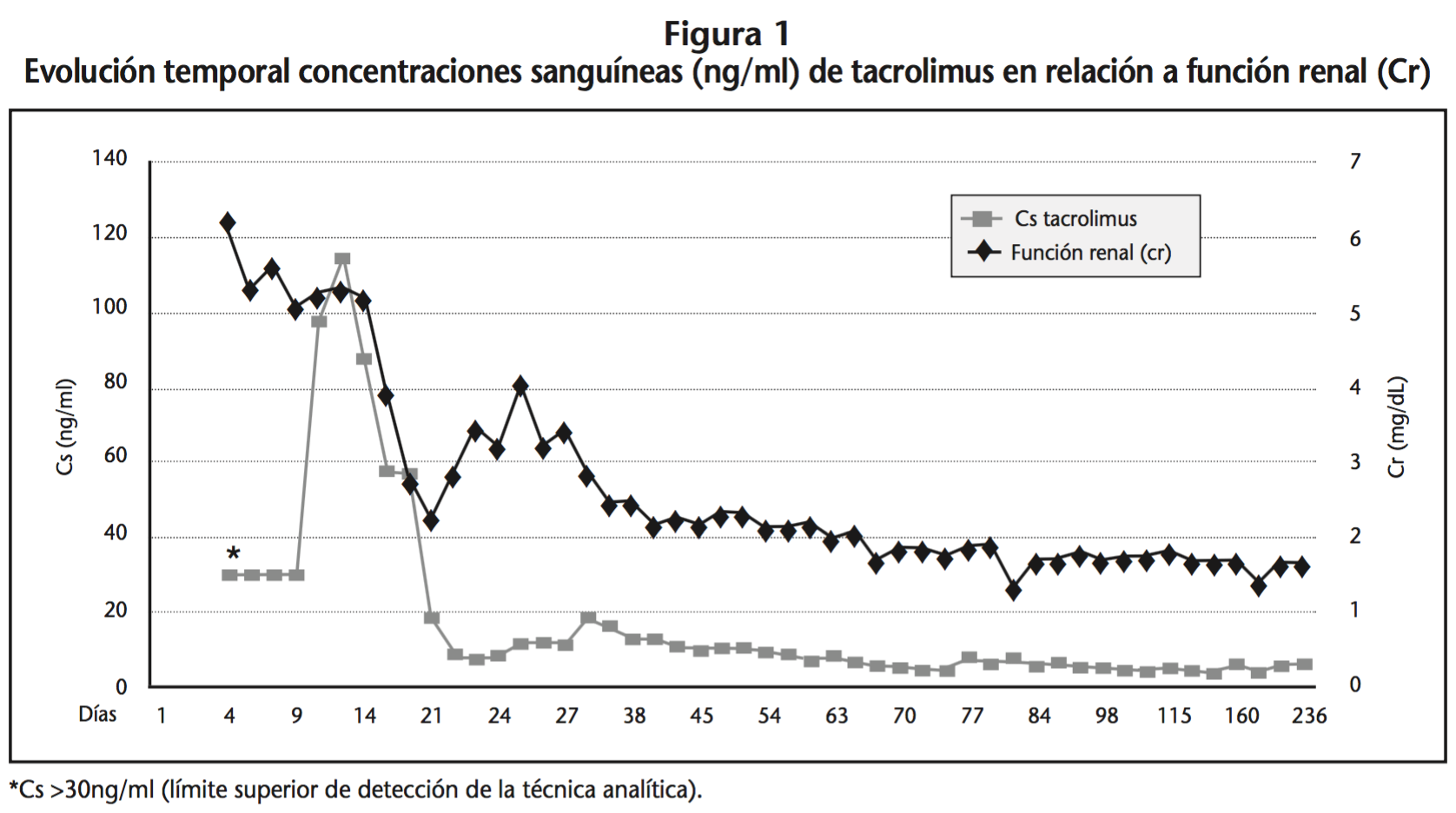
Al mes del trasplante, se objetivó una PCR del virus BK en plasma >10.000 copias/ml, confirmándose la existencia de nefropatía por el virus BK (grado B) mediante biopsia. Ante estos hallazgos se suspendió el micofenolato sódico, se introdujo everolimus (0,25 mg/12h/vo) y se redujo la dosis de tacrolimus a 0,2 mg/24h mediante conversión a la suspensión oral de tacrolimus de liberación retardada, estableciendo como objetivo terapéutico una Cs everolimus en torno a 4-6 ng/ml y tacrolimus en torno a 3-4 ng/ml. Al mes de la conversión la PCR del BK fue de 438 copias/ml.
Se realizaron monitorizaciones farmacocinéticas cada 2-3 días los dos primeros meses tras el alta. Un año y 4 meses postrasplante, el paciente presenta Cr: 1,38 mg/dl, recibe tacrolimus 0,2 mg/6días y everolimus 0,25 mg/48h, y la CV del VIH y virus BK son negativas.
DISCUSIÓN
En pacientes trasplantados renales con infección por VIH el tratamiento antirretroviral de elección no está establecido, aunque debería mantener una CV <20 copias/ml, CD4 >200 cels/μL, e idealmente no presentar interacciones con el tratamiento inmunosupresor para garantizar una mayor supervivencia del injerto y del paciente7,8. Es por ello que se desaconseja el uso de antirretrovirales que interaccionen con el tratamiento inmunosupresor, sean nefrotóxicos o precisen de ajuste de dosis según función renal, como los inhibidores de la transcriptasa inversa no análogos de nucleósidos y los IP, siendo una alternativa los inhibidores de la integrasa o los de la transcriptasa inversa análogos de nucleósidos7.
En nuestro caso, el tratamiento antirretroviral, en concreto tenofovir fue el causante de la nefritis túbulo-intersticial que provocó el deterioro de la función renal en el paciente. El servicio de Medicina Interna de nuestro hospital realiza controles periódicos de la función renal a todos los pacientes VIH, siendo más frecuentes cuando reciben tratamientos potencialmente nefrotóxicos como el tenofovir. Al detectarse el fracaso renal agudo en uno de los controles, se realizó una interconsulta al servicio de Nefrología el cual realizó una biopsia renal diagnosticándose la nefritis túbulo-intersticial. Ello condujo al cambio de tratamiento antirretroviral, suspendiéndose el tenofovir e introduciendo la etravirina.
El hospital donde se realizó el trasplante ya tenía experiencia en trasplantes en pacientes VIH, en los casos previos se había llevado a cabo siguiendo las recomendaciones terapéuticas habituales pero en este caso no se consideró inicialmente la suspensión de darunavir y ritonavir al tratarse de una cepa multirresistente. El equipo médico conocía la potencial interacción farmacológica, pero no así la magnitud de la misma y su mantenimiento en el tiempo. Debido a que ambos fármacos se administran conjuntamente, se produjo una doble inhibición del CYP3A4 y la inhibición prolongada del metabolismo del tacrolimus4,5 incrementando su Cs por encima del intervalo terapéutico de referencia a lo largo de 3 semanas. Se precisó la suspensión temporal de ambos IP para eliminar el tacrolimus y normalizar su Cs, reintroduciendo posteriormente ambos IP y el tacrolimus a dosis mínimas.
En pacientes trasplantados renales con tratamiento antirretroviral con IP, se debería iniciar el tratamiento con tacrolimus a dosis mínimas (0,5 mg/24h)9,10 con monitorización diaria de las Cs hasta establecer una pauta posológica definitiva. En nuestro caso se monitorizó cada 2-3 días durante los primeros tres meses tras el alta hospitalaria administrándose únicamente si los niveles estaban en el límite inferior del intervalo terapéutico deseado. El establecimiento de una estrategia terapéutica previa al trasplante administrando una dosis única de tacrolimus al paciente, calculando el área bajo la curva y la semivida de eliminación del fármaco10, hubiera permitido la estimación de una dosis de inicio y evitar la toxicidad derivada de la interacción con los IP.
La infección por el BK, secundaria a la inmunosupresión excesiva tras la interacción de los IP con el tacrolimus, motivó la conversión a everolimus para aprovechar su efecto antiviral en el control de la replicación viral, permitiendo un mayor reducción de la dosis de tacrolimus y consecuentemente el control de la infección por BK.
Conclusión
En el caso de pacientes con VIH en tratamiento con IP es necesaria una reducción importante de la dosis de tacrolimus y la ampliación del intervalo de dosificación para evitar la nefrotoxicidad derivada de la interacción de los mismos. En nuestro caso la monitorización precisa de tacrolimus y el abordaje interdisciplinar consiguió la evolución satisfactoria de la función del injerto y de la infección por VIH, así como de las complicaciones derivadas de un exceso de inmunosupresión, como la nefropatía por BK.
Conflicto de intereses: Los autores declaran no tener conflictos de intereses.
Bibliografía
1. Panel de Expertos del Grupo de Estudio de Sida (GESIDA) de la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica (SEIMC), la Sociedad Española de Nefrología (S.E.N.) y la Sociedad Española de Bioquímica Clínica y Patología Molecular (SEQC). Documento de consenso sobre el manejo de la patología renal en pacientes con infección por VIH. Nefrología. 2014;34(suppl. 2):1-81.
2. Fine DM, Perazella MA, Lucas GM, Atta MG. Renal disease in patients with HIV infection: epidemiology, pathogenesis and management. Drugs. 2008;68(7):963-80.
3. Yoon SC, Hurst FP, Jindal RM, George SA, Neff RT, Agodoa LY, et al. Trends in renal transplantation in patients with human immunodeficiency virus infection: an analysis of the United States renal data system. Transplantation. 2011;91(8):864-8.
4. Marko K, Greenstein S. Antiretroviral and immunosuppressive drug-drug interactions in human immunodeficiency virus-infected liver and kidney transplant recipients. Transplant Proc. 2009;41(9):3796-9.
5. Van Maarseveen EM, Rogers CC, Trofe-Clark J, van Zuilen AD, Mudrikova T. Drug-Drug interactions between antiretroviral and immunosuppressive agents in HIV-infected patients after solid organ transplantation: a review. AIDS Patient Care STDS. 2012;26(10):568-81.
6. Astellas Pharma, S.A. Advagraf cápsulas duras de liberación prolongada. Briefing Document. Silver Spring, MD: U.S. Food and Drug Administration; 23 abril 2007. Accedido Febrero 2015: http://www.ema.europa.eu/docs/es_ES/document_library/EPAR_-_Product_Information/human/000712/ WC500022234.pdf.
7. Trullas JC, Cofan F, Tuset M, Ricart MJ, Brunet M, Cervera C, et al. Renal transplantation in HIV-infected patients: 2010 update. Kidney Int. 2011;79(8):825-42.
8. Miró JM, Torre-Cisneros J, Moreno A, Tuset M, Quereda C, Laguno M, et al. Documento de consenso GESIDA/GESITRA-SEIMC, SPNS y ONT sobre trasplante de órgano sólido en pacientes infectados por el VIH en España (marzo 2005). Enferm Infecc Microbiol Clin. 2005;23(6):353-62.
9. Hardy G, Stanke-Labesque F, Contamin C, Serre-Debeauvais F, Bayle F, Zaoui P, et al. Protease inhibitors and diltiazem increase tacrolimus blood concentration in a patient with renal transplantation: a case report. Eur J Clin Pharmacol. 2004;60(8):603-5.
10. Bickel M, Anadol E, Vogel M, Hofmann WP, von Hentig N, Kuetscher J, et al. Daily dosing of tacrolimus in patients treated with HIV-1 therapy containing a ritonavir-boosted protease inhibitor or raltegravir. J Antimicrob Chemother. 2010;65(5):999-1004.
____
Descargar PDF: Casos Clínicos: Manejo de la interacción entre tacrolimus y antirretrovirales en un paciente trasplantado renal infectado por VIH
