Claramunt García R, Merino Almazán M, Sánchez Casanueva T.
Hospital Virgen de Altagracia de Manzanares
Fecha de recepción: 10/02/2023 – Fecha de aceptación: 14/03/2023
Correspondencia: Raquel Claramunt García · Hospital Virgen de Altagracia de Manzanares, Avda Don Emiliano García Roldán s/n C.P.13200, Manzanares, Ciudad Real, España · raquel_kudt93@hotmail.com
____
Resumen
Objetivo: Establecer, mediante una comparación indirecta (CI), si filgotinib, tofacitinib, baricitinib y upadacitinib pueden considerarse alternativas equivalentes en eficacia para el tratamiento de la artritis reumatoide.
Métodos: Se realizó una búsqueda en Pubmed de ensayos clínicos pivotales (EC) de filgotinib, baricitinib, tofacitinib y upadacitinib para la artritis reumatoide en tres grupos de estudio: pacientes naive, intolerantes o con fallo a FAME e intolerantes o con fallo a metotrexato. La variable principal de comparación fue el ACR20 (American College of Rheumatology con respuesta del 20%) en la semana 12-24 tras el inicio del tratamiento. Se calculó el riesgo relativo (RR) en comparación con placebo. Se realizó un CI de estos fármacos mediante el método Bucher (calculadora ITC, Indirect Treatment Comparisons, de la Agencia Canadiense de Evaluación de Tecnologías Sanitarias). Se analizó si existían diferencias estadísticamente significativas entre ellos.
Resultados: Se encontraron 12 EC: uno para para fármaco y grupo de estudio. Ninguno de las CI mostró diferencias estadísticamente significativas, excepto en la comparación de filgotinib 200mg frente a upadacitinib 30mg y tofacitinib 10mg en pacientes naive, a favor de filgotinib.
Conclusiones: Dado que no se han establecido diferencias estadísticamente significativas entre los distintos fármacos en términos de eficacia, y en aquellos en los que sí se han encontrado no podemos saber si es una diferencia clínicamente relevante, la elección de uno u otro debería basarse en criterios de seguridad y eficiencia.
Palabras clave: artritis reumatoide, eficacia, filgotinib, tofacitinib, baricitinib, upadacitinib.
Drug-induced syncope episodes in the emergency department abstract
Objective: To establish, by indirect comparison (IC), whether filgotinib, tofacitinib, baricitinib and upadacitinib can be considered equivalent alternatives in efficacy for the treatment of rheumatoid arthritis.
Methods: A Pubmed search for pivotal clinical trials (CTs) of filgotinib, baricitinib, tofacitinib and upadacitinib for rheumatoid arthritis was performed in three study groups: naïve, DMARD-intolerant and methotrexate-intolerant patients. The primary endpoint of comparison was ACR20 (American College of Rheumatology with 20% of response) at week 12-24 after treatment initiation. Relative risk (RR) was calculated in comparison with placebo. An IC of these drugs was performed using the Bucher method (ITC calculator, Indirect Treatment Comparisons, of the Canadian Agency for Health Technology Assessment). We analyzed whether there were statistically significant differences between them.
Results: Twelve CIs were found: one for each drug and study group. None of the CI showed statistically significant differences, except in the comparison of filgotinib 200mg versus upadacitinib 30mg and tofacitinib 10mg in naive patients, in favor of filgotinib.
Conclusions: Given that no statistically significant differences have been established between the different drugs in terms of efficacy, and in those in which they have been found we cannot know if it is a clinically relevant difference, the choice of one or the other should be based on safety and efficiency criteria.
Keywords: rheumatoid arthritis, efficacy, filgotinib, tofacitinib, baricitinib, upadacitinib.
____
Introducción
La artritis reumatoide (AR) es una enfermedad autoinmune sistémica, de carácter inflamatorio y crónico. Como consecuencia de dicho carácter inflamatorio, esta patología puede afectar a otros órganos como el corazón, riñón, pulmón, piel y ojos, al sistema hematopoyético o incluso a nivel neuropsiquiátrico 1,2.
Los signos y síntomas más frecuentes son el dolor y tumefacción de articulaciones. Otros síntomas generales son fatiga, malestar general, rigidez matutina, debilidad, limitación funcional, depresión, además de afectación de zonas extraarticulares, como piel, sistema cardiovascular o hueso, entre otros. Todo ello afecta a la calidad de vida del paciente1,2.
La etiología a día de hoy es desconocida y depende de múltiples factores. Factores genéticos, ambientales, hormonales, infecciosos y estrés, entre otros, se han relacionado con el desarrollo de AR1,2. Su prevalencia en España es del 1,07% en la población adulta, afectando más frecuentemente a mujeres y a personas mayores de 60 años 3.
Respecto al tratamiento de la AR, este debe abarcar la educación sanitaria del paciente, intervenciones psicosociales, ejercicio físico adaptado al paciente y consejo dietético y nutricional, entre otros1,2. A nivel farmacológico, es importante el tratamiento precoz con Fármacos Antirreumáticos Modificadores de la Enfermedad (FAME), pues esto se asocia a mayores probabilidades de conseguir una remisión sostenida o en su defecto una baja actividad1.
En los últimos años las terapias biológicas, junto con los fármacos inhibidores de la JAK cinasa, han abierto el abanico de posibilidades de tratamiento para esta patología. Respecto a estos últimos, son varios los medicamentos inhibidores de JAK que están aprobados para el tratamiento de la AR, entre ellos tofacitinib, baricitinib, upadacitinib y filgotinib. No obstante, hoy en día no se disponen de ensayos clínicos que comparen todas estas alternativas entre sí. Por lo tanto, el objetivo de este estudio es establecer, a través de una comparación indirecta (CI) frente a placebo o metotrexato (MTX) (según el comparador común disponible), si estos cuatro inhibidores de JAK pueden considerarse alternativas equivalentes en eficacia para el tratamiento de la artritis reumatoide.
Métodos
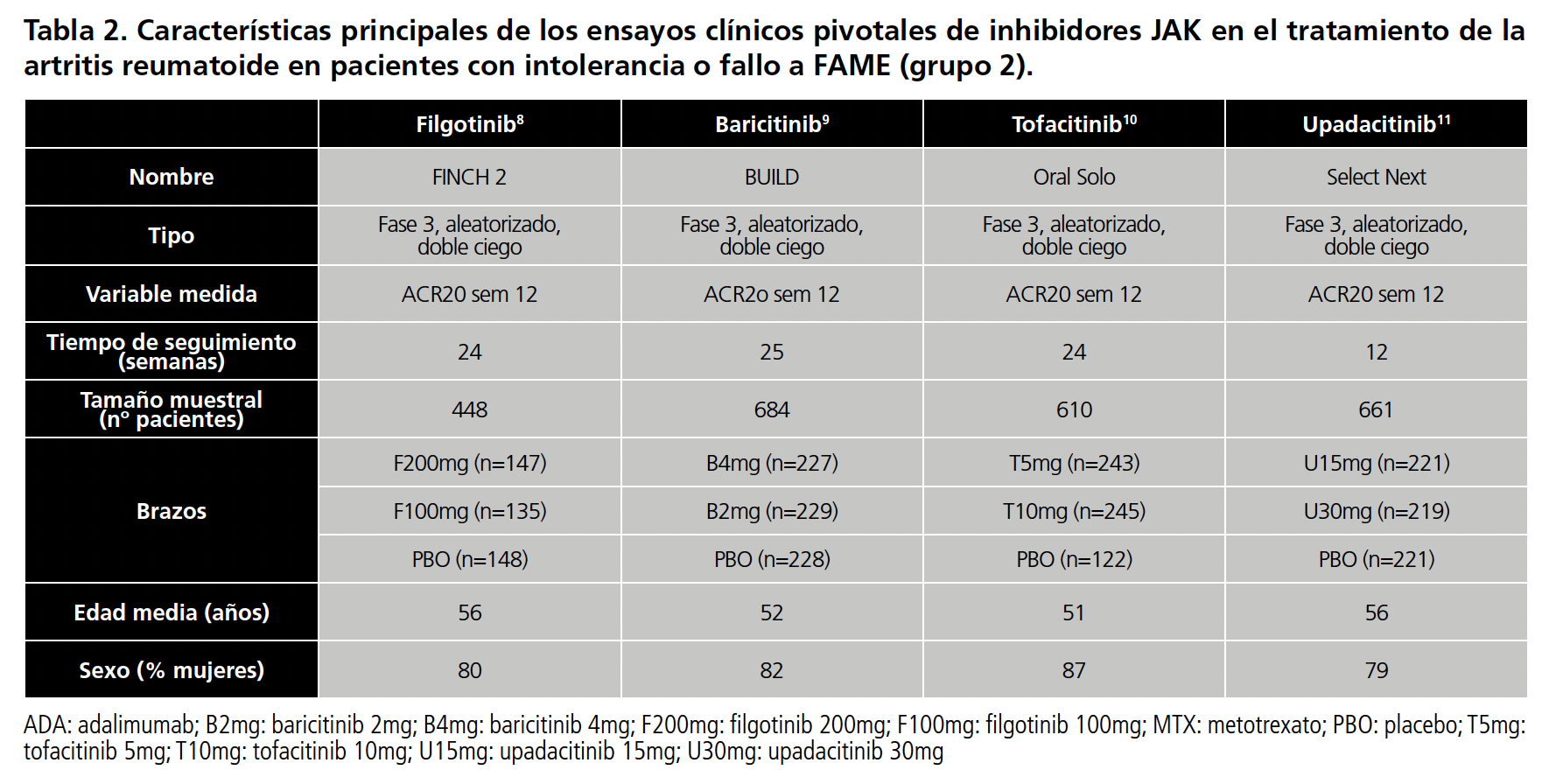
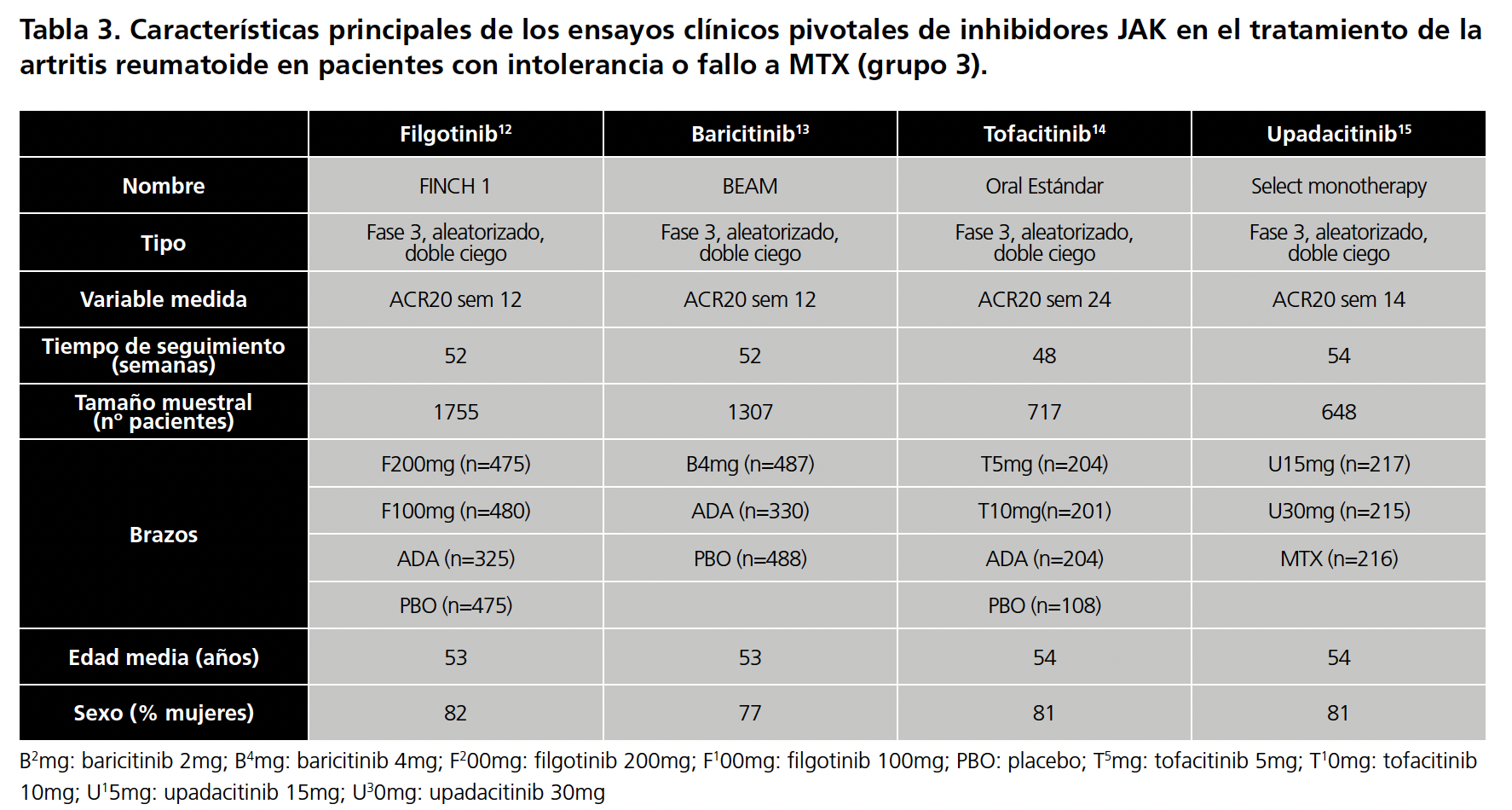
Se realizó una búsqueda en Pubmed de los ensayos clínicos (EC) pivotales de filgotinib (200mg/24h, 100mg/24h), baricitinib (2mg/24h, 4mg/24h), tofacitinib (5mg/24h, 10mg/24h) y upadacitinib (15mg/24h, 30mg/24h) para la artritis reumatoide. Las palabras clave utilizadas fueron: Rheumatoid Arthritis, filgotinib, baricitinib, tofacitinib, upadacitinib. Se recopilaron las características principales de cada ensayo (características del ensayo, aleatorización, tiempo de seguimiento, brazos de cada ensayo, número de pacientes, edad media, sexo, variable de eficacia medida) y se evaluó si había diferencias importantes entre ellos.
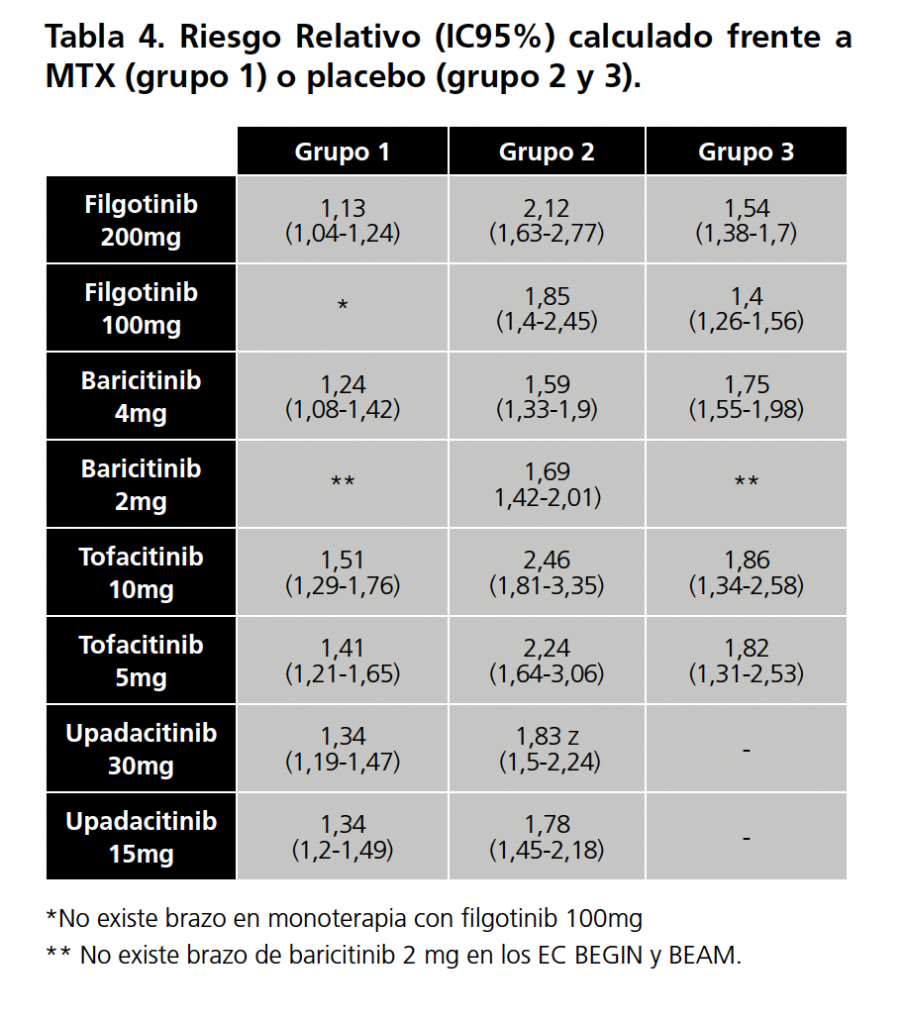
Como variable para la comparación se tomaron los resultados del ACR20 (American College of Rheumatology con respuesta del 20%) en la semana 12-24 (según los datos disponibles en el EC) tras el inicio del tratamiento. Con los resultados del ACR20 (en %) se calculó el riesgo relativo (RR) respecto a placebo. Finalmente, con estos valores se realizó una CI de estos fármacos mediante el método de Bucher (calculadora ITC, Indirect Treatment Comparisons, de la Agencia Canadiense de Evaluación de Tecnologías Sanitarias meter). Se compararon entre sí las dosis menores de los 4 fármacos (filgotinib 100mg, baricitinib 2mg, tofacitinib 5mg, upadacitinib 15mg) y las dosis mayores entre ellas (filgotinib 200mg, baricitinib 4mg, tofacitinib 10mg, upadacitinib 30mg), tanto en pacientes naive (grupo 1), en intolerantes o con fallo a FAME (grupo 2) como en intolerantes o con fallo a metotrexato (MTX) (grupo 3). Se analizaron los resultados, viendo si había diferencias estadísticamente significativas entre estos tres fármacos.
Resultados
Se encontraron 12 EC, uno para para fármaco y grupo de estudio. En el grupo 1 los EC utilizaron MTX como brazo control, por lo que se tomó como comparador común. En los otros dos grupos, los EC utilizaron placebo por lo que este fue el comparador común. Las características principales de todos los EC vienen resumidas en la tabla 1 (pacientes naive)4,5,6,7, tabla 2 (intolerantes o con fallo a FAME)8,9,10,11 y tabla 3 ( intolerantes o con fallo a MTX)12,13,14,15.
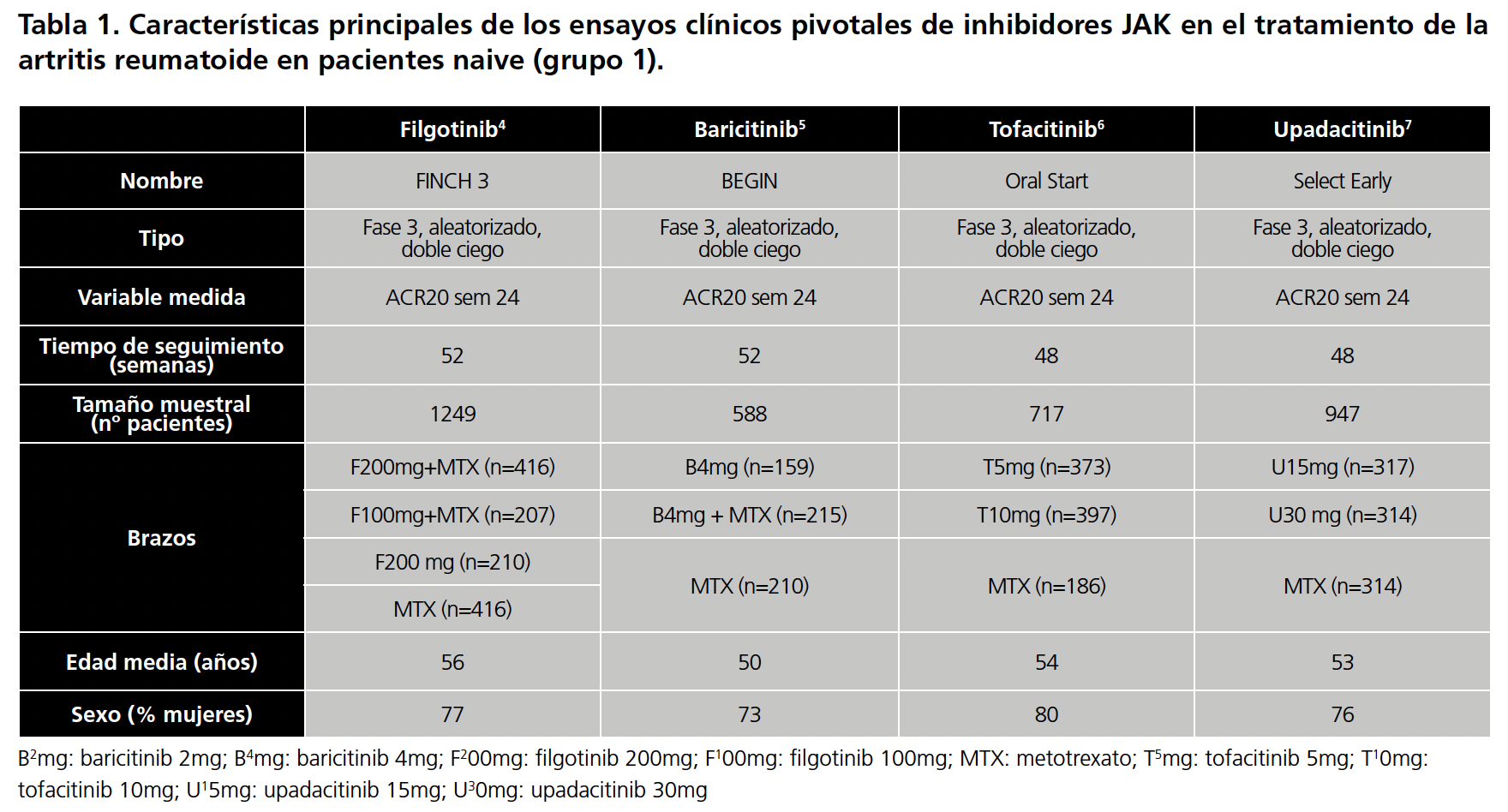
Respecto a los EC en pacientes naive al tratamiento biológico, todos los estudios presentaron una metodología similar (diseño, características de la población a estudio, criterios de inclusión, variable principal). Sin embargo, el tamaño muestral varía entre los diferentes EC, sobre todo entre el del filgotinib4 (FINCH3) que incluyó a 1249 y el del baricitinib5 (BEGIN) que fue alrededor de la mitad respecto al del filgotinib. No obstante, el número de pacientes en cada brazo en ambos EC fueron similares.
En cuanto a los pacientes con intolerancia o fracaso a FAME, los EC son similares y con poca variabilidad en el tamaño muestral. Aún así, el tiempo de seguimiento en el EC del upadacitinib11 (Select Next) fue menor que en el resto.
En cuanto a los EC en los pacientes intolerantes o no respondedores a MTX, también presentaron metodología similar. No obstante, existe cierta variabilidad en la semana a medir el ACR20 pues en el EC del tofacitinib14 (Oral Estandar) fue a la semana 24, en el del upadacitinib15 (Select monotherapy) a la semana 14 y en los otros dos fármacos en la semana 12. Además, también existen diferencias en el tamaño muestral (los EC del filgotinib12 y baricitinib13 incluyen aproximadamente el doble de pacientes que los de tofacitinib14 y upadacitinib15). Por otra parte, todos los EC tienen un grupo placebo como grupo control, menos el del upadacitinib, que es MTX.
Una vez analizadas las limitaciones para los tres escenarios, se aceptaron para la CI y se procedió al cálculo del RR respecto a placebo/MTX (según el grupo de estudio) de cada fármaco en los 12 EC, cuyo resultado se resume en la tabla 4. Con estos valores de RR, y tras aplicar el método Butcher, se obtuvieron los valores de Odds Ratio (OR), que quedan resumidos en la tabla 5.

Los datos de upadacitinib en pacientes intolerantes o con fallo a MTX fueron excluidos para la CI por falta de un comparador común, al igual que los del adalimumab del ensayo FINCH1 por no tratarse de un inhibidor del JAK. Por ello, no se ha calculado el RR del upadacitinib en pacientes del grupo 3.
Ningún resultado de las CI obtuvo diferencias estadísticamente significativas, excepto en la comparación de filgotinib 200mg (FINCH3) frente a upadacitinib 30mg (Select Early) y tofacitinib 10mg (Oral Start) en pacientes naive, a favor de filgotinib.
Conclusiones
Según los resultados obtenidos, dado que no se han establecido diferencias estadísticamente significativas entre los diferentes fármacos en cuanto a eficacia, la elección de uno u otro para el tratamiento de la artritis reumatoide debería basarse en criterios de seguridad y eficiencia.
Respecto a los resultados obtenidos en las CI de los EC en pacientes naive, podría ser que filgotinib 200mg tuviera un beneficio más modesto que upadacitinib 30 mg y tofacitinib 10mg por mostrar diferencia estadísticamente significativa. No obstante, habría que valorar si esta diferencia es clínicamente relevante. Esto, unido a las limitaciones descritas respecto a las diferencias entre los EC pivotales, hace que estos resultados deban de tomarse con cautela y adaptar de manera individualizada el medicamento a cada paciente según perfil de interacciones, efectos adversos y coste.
Por todo ello, sería de especial interés disponer de una comparación directa de estos fármacos para confirmar la equivalencia.
Conflictos de intereses: Los autores declaran no tener conflictos de intereses.
Bibliografía
- Grupo GUIPCAR de trabajo de la GPC para el manejo de pacientes con Artritis Reumatoide. Sociedad Española de Reumatología. Guía de práctica clínica para el manejo de pacientes con Artritis Reumatoide. 2019 [consultado 15/10/2020]. Disponible en: https://www.ser.es/wp-content/uploads/2018/09/Gu%C3%ADa-dePr%C3%A1ctica-Cl%C3%ADnica-para-elManejo-de-Pacientes-con-ArtritisReumatoide.pdf
- MásterSER en enfermedades reumáticas mediadas por el sistema inmune. Módulo 1 y 3. Universidad Rey Juan Carlos y la SER.
- Silva-Fernández L, Macía-Villa C, Seoane-Mato D, Cortés-Verdú R, Romero-Pérez A, Quevedo-Vila V, et al. The prevalence of rheumatoid arthritis in Spain. Sci Rep. 2020;10(1):1-9.
- Westhovens R, Rigby WFC, van der Heijde D, Ching D, Stohl,W, Kay J, et al. Filgotinib in combination with methotrexate or as monotherapy versus methotrexate monotherapy in patients with active rheumatoid arthritis and limited or no prior exposure to methotrexate: the phase 3, randomised controlled FINCH 3 trialAnn Rheum Dis 2021;80:727–738.
- Fleischmann R, Schiff M, van der Heijde D, Ramos-Remus C, Spindler A, Stanislav M,et al. Baricitinib, Methotrexate, or Combination in Patients With Rheumatoid Arthritis and No or Limited Prior Disease-Modifying Antirheumatic Drug Treatment. Arthritis Rheumatol. 2017 Mar;69(3):506-517.
- Lee EB, Fleischmann R, Hall S, Wilkinson B, Bradley JD, Gruben D, et al. Tofacitinib versus methotrexate in rheumatoid arthritis. N Engl J Med. 2014 Jun 19;370(25):2377-86.
- van Vollenhoven R, Takeuchi T, Pangan AL, Friedman A, Mohamed MF, Chen S, et al. Efficacy and Safety of Upadacitinib Monotherapy in Methotrexate-Naive Patients With Moderately-to-Severely Active Rheumatoid Arthritis (SELECT-EARLY): A Multicenter, Multi-Country, Randomized, Double-Blind, Active Comparator-Controlled Trial. Arthritis Rheumatol. 2020 Oct;72(10):1607-1620.
- Genovese MC, Kalunian K, Gottenberg JE, Mozaffarian N, Bartok B, Matzkies F, et al. Effect of Filgotinib vs Placebo on Clinical Response in Patients With Moderate to Severe Rheumatoid Arthritis Refractory to Disease-Modifying Antirheumatic Drug Therapy: The FINCH 2 Randomized Clinical Trial. JAMA. 2019 Jul 23;322(4):315-325.
- Dougados M, van der Heijde D, Chen YC, Greenwald M, Drescher E, Liu J, et al. Baricitinib in patients with inadequate response or intolerance to conventional synthetic DMARDs: results from the RA-BUILD study. Ann Rheum Dis. 2017 Jan;76(1):88-95.
- Fleischmann R, Kremer J, Cush J, Schulze-Koops H, Connell CA, Bradley JD, et al. Placebo-controlled trial of tofacitinib monotherapy in rheumatoid arthritis. N Engl J Med. 2012 Aug 9;367(6):495-507.
- Burmester GR, Kremer JM, Van den Bosch F, Kivitz A, Bessette L, Li Y, et al. Safety and efficacy of upadacitinib in patients with rheumatoid arthritis and inadequate response to conventional synthetic disease-modifying anti-rheumatic drugs (SELECT-NEXT): a randomised, double-blind, placebo-controlled phase 3 trial. Lancet. 2018 Jun 23;391(10139):2503-2512.
- Combe B, Kivitz A, Tanaka Y, van der Heijde D, Simon JA, Baraf HSB, et al. Filgotinib versus placebo or adalimumab in patients with rheumatoid arthritis and inadequate response to methotrexate: a phase III randomised clinical trial. Ann Rheum Dis. 2021 Jul;80(7):848-858.
- Taylor PC, Keystone EC, van der Heijde D, Weinblatt ME, Del Carmen Morales L, Reyes Gonzaga J, et al. Baricitinib versus Placebo or Adalimumab in Rheumatoid Arthritis. N Engl J Med. 2017 Feb 16;376(7):652-662.
- van Vollenhoven RF, Fleischmann R, Cohen S, Lee EB, García Meijide JA, Wagner S, et al. Tofacitinib or adalimumab versus placebo in rheumatoid arthritis. N Engl J Med. 2012 Aug 9;367(6):508-19.
- Smolen JS, Pangan AL, Emery P, Rigby W, Tanaka Y, Vargas JI, Zet al. Upadacitinib as monotherapy in patients with active rheumatoid arthritis and inadequate response to methotrexate (SELECT-MONOTHERAPY): a randomised, placebo-controlled, double-blind phase 3 study. Lancet. 2019 Jun 8;393(10188):2303-2311.
____