Gómez-de Rueda F1, Gordon-Santiago MM2, Tena-Sempere ME3
1 UGC-Farmacia Hospitalaria. Complejo Hospitalario de Jaén. Jaén (España)
2 UGC-Oncología Médica. Hospital General Universitario Jerez. Jerez de la Frontera. Cádiz (España)
3 UGC-Oftalmología. Hospital SJD Aljarafe-Bormujos. Sevilla (España)
_____
Rev. OFIL 2017, 27;1:23-29
Fecha de recepción: 15/03/2016 – Fecha de aceptación: 28/05/2016
____
Correspondencia:
Félix Gómez de Rueda
Complejo Hospitalario de Jaén
Avda. del Ejército Español, 10
23007 Jaén
Correo electrónico: felixj.gomez.sspa@juntadeandalucia.es
____
Resumen
Introducción: El cáncer epitelial de ovario representa un infausto panorama dentro de las neoplasias malignas ginecológicas. Lamentablemente su elevada prevalencia y en ocasiones, el diagnóstico tardío, determinan el pronóstico de la enfermedad. Por ello en los últimos años, se ha investigado en el desarrollo de nuevos marcadores tumorales capaces de aproximarnos a un diagnóstico más preciso y temprano.
Objetivo: Comparar el comportamiento sérico de HE4 y CA125 durante el diagnóstico y tratamiento del cáncer ovárico epitelial y su relación con potenciales recaídas.
Material y método: Estudio retrospectivo y observacional de una serie de casos de doce pacientes diagnosticadas con cáncer de ovario, a las cuales se les dio seguimiento durante 21 meses, revisando historias clínicas y aplicaciones corporativas de salud.
Resultados: Los niveles resultantes de los marcadores estudiados, resultaron acordes con la evolución clínica de las pacientes durante las intervenciones realizadas. El aumento de los niveles plasmáticos fue congruente en el 78% de las recaídas.
Palabras clave: CA125, cáncer ovárico epitelial, HE4, marcadores tumorales.
____
Introducción
En países en desarrollo, el cáncer epitelial de ovario sigue constituyendo el peor de los pronósticos de las neoplasias ginecológicas1,2. El cáncer epitelial es la segunda neoplasia del aparato genital femenino en frecuencia tras el cáncer de endometrio. Sin embargo es la principal causa de mortalidad por cáncer ginecológico, debido a que la mayoría de pacientes (70-80%) se diagnostican en una etapa avanzada de la enfermedad3.
Para todos los tipos de cáncer de ovario, la supervivencia relativa a cinco años es del 45%. Las mujeres menores de 65 años que son diagnosticadas con este cáncer tienen un mejor pronóstico que las mujeres de mayor edad. Si se encuentra el cáncer (y es tratado) antes de que se haya propagado fuera del ovario (etapas IA y IB), la tasa relativa de supervivencia a 5 años es del 92%. Sin embargo, sólo el 15% de todos los casos de cáncer de ovario se detecta en esta etapa temprana4.
En la actualidad es considerado el segundo tumor ginecológico más frecuente5.
Desde que en 20076 se publicó la primera guía de tratamiento en cáncer de ovario, hemos podido presenciar importantes avances en el tratamiento y diagnóstico de esta enfermedad, utilizando para ello pruebas diagnósticas complementarias a la definitiva anatomía patológica, como es la determinación sérica de marcadores tumorales, especialmente CA125 (antígeno carbohidrato 125) y más recientemente HE4 (proteína epididimal humana 4).
Aunque CA125 no es específico para COE (cáncer ovario epitelial), goza de elevada sensibilidad y es el marcador tumoral más frecuentemente solicitado en el proceso de diagnóstico de una masa ovárica7. Se eleva en el 83% de las mujeres con COE y en el 50% de las personas con enfermedad en estadio I. En presencia de carcinomatosis, una proporción de CA125/CEA >25 sugiere origen de cáncer de ovario y el resultado contrario, tumor intestinal.
Además en la mujer joven (≤35 años), deben determinarse marcadores tumorales adicionales como inhibina, alfa-fetoproteína (AFP) o gonadotropina coriónica humana tipo beta (B-hCG), si dispone de indicación clínica8,9.
Por otro lado, se ha sugerido que los valores séricos de HE4 y CA125 junto con el algoritmo de ROMA (algoritmo riesgo de neoplasia maligna ovárica) pueden ser útiles para determinar si una masa pélvica es maligna o benigna, aunque un trabajo reciente confirma que la técnica de ultrasonidos transvaginales, se muestra superior a ROMA y RMI (riesgo de índice de malignidad) a la hora de discriminar masas malignas de benignas10.
El CA125 es una proteína de elevado peso molecular que puede detectarse en el suero11,12 de un alto porcentaje de pacientes con tumores ováricos no mucinosos de origen epitelial13. Sin embargo, no está presente en el epitelio de superficie de ovarios normales adultos y fetales, aunque se pueden encontrar valores elevados en diferentes tumores ginecológicos benignos como quistes ováricos, endometriosis, miomatosis uterina, cervicitis y tumores malignos de endometrio, mama y tracto gastrointestinal. Además pueden registrarse ligeros aumentos del marcador en la primera fase del embarazo y en diferentes enfermedades benignas como pancreatitis aguda y crónica, afecciones gastrointestinales benignas, insuficiencia renal y enfermedades autoinmunes.
No obstante y a pesar de su inespecificidad14-18, constituye uno de los marcadores más sensible e importante en el seguimiento y evolución de los carcinomas ováricos serosos. También cabe destacar que cuanto más avanzado se encuentra el estadio del tumor, tanto mayor es la concentración de CA12519.
Por otro lado, la proteína epididimal humana 4 (HE4 o WFDC2) que fue identificada por primera vez en el epitelio del epidídimo distal20, tiene una baja expresión en el epitelio de los tejidos respiratorio y reproductivo –incluyendo el tejido ovárico–, pero elevada en tejido del cáncer ovárico. Asimismo se han detectado elevadas concentraciones de HE4 en el suero de pacientes con cáncer ovárico21.
En su trabajo, Drapkin et al. (2005) confirmaron niveles elevados de HE4 en el 100% de tumores endometriales y en el 93% de los carcinomas serosos de ovario, concluyendo que HE4 está presente en circulación sistémica además de otros fluidos corporales22.
Por tanto, la determinación conjunta de HE4 (alta especificidad) junto a CA125 (elevada sensibilidad), podría constituir una herramienta útil para estimar el riesgo de aparición o recaída de un cáncer epitelial de ovario con una masa pélvica. En la actualidad, se dispone de diversos trabajos, como el de Romagnolo et al.23(2016), en el que concluye que HE4 parece ser un marcador sérico más eficiente que CA125, inclusive en estadios tempranos de la enfermedad, tanto en mujeres pre como postmenopáusicas. Estudios recientes sugieren la superioridad de HE4 vs. CA125 como marcador de cáncer de ovario24, al igual que Angioli et al.25 (2013) sugieren la superioridad de HE4 en la estratificación del riesgo previo a la cirugía.
El uso combinado de CA125 y HE4 parece haber mejorado la sensibilidad en comparación con cualquier marcador de forma individual, resultados que han sido corroborados por otros investigadores26.
Así pues, HE4 ha demostrado mayor sensibilidad para detectar el cáncer ovárico, especialmente en la fase I de la enfermedad que es la fase asintomática. La sensibilidad más alta (76,4%) –con una especificidad del 95%– se ha conseguido al combinar la determinación simultánea de HE4 con CA125. Además, HE4 es más sensible que CA125 en la detección precoz del cáncer de endometrio, hasta el punto que la obtención de resultados normales de CA125, pero elevados niveles séricos de HE4, sugiere la presencia de un cáncer ovárico o endometrial27,28.
El principal objetivo de este trabajo fue comparar la correlación entre el valor sérico de HE4 y CA125 de 12 pacientes diagnosticadas de COE, analizando a la vez, su valor potencial como predictores de respuesta al tratamiento del cáncer epitelial de ovario y/o recaída de la enfermedad.
Además se evaluó si existía correlación entre la estadificación de la masa tumoral y los niveles séricos de HE4 y CA125.
Método
Diseño y ámbito del estudio
Se trata de un estudio retrospectivo y observacional de una serie de casos de doce pacientes, diagnosticados de COE entre septiembre de 2013 y julio de 2014 en un hospital general de especialidades del sur de España, cuya duración ha sido de 21 meses.
De las 12 pacientes estudiadas, la edad media fue de 58,7 años con un rango de (39-74).
Variables analizadas
En él, fueron analizados variables como estirpe celular, estadio, cirugía primaria y cirugía de intervalo con resultado “óptimo” o “subóptimo” según criterio quirúrgico, esquemas de quimioterapia y valores de los marcadores plasmáticos HE4 y CA125.
El resultado quirúrgico óptimo consistió en la limpieza completa de la masa tumoral, mientras que el resultado subóptimo, implicó infiltraciones en tejidos anexos que impidieron la completa resección, es decir, enfermedad macroscópica residual.
Para la recopilación de la información, recurrimos al programa DAE (Diraya Atención Especializada) propiedad del Servicio Andaluz de Salud, de donde fueron recopilados todos los datos analizados, incluidos los de laboratorio. A todos los pacientes se les solicitó consentimiento informado para recopilar de forma anónima los datos necesarios para el estudio, sin tener ningún caso motivado negativamente.
Respecto a la histología, los tumores fueron clasificados en cuatro tipos:
– Carcinoma papilar seroso.
– Adenocarcinoma endometrioide alto grado.
– Adenocarcinoma seroso alto grado.
– Tumor de células Müllerianas.
En cuanto a los esquemas terapéuticos y siguiendo los protocolos recomendados por la SEOM (Sociedad Española de Oncología Médica), todos ellos fueron llevados a cabo con carboplatino/paclitaxel intravenoso, (paclitaxel 175 mg/m2 y carboplatino con área bajo la curva (AUC) de 6 µg.h/ml, calculada según fórmula de Calvert29, oscilando su administración entre cinco y ocho ciclos.
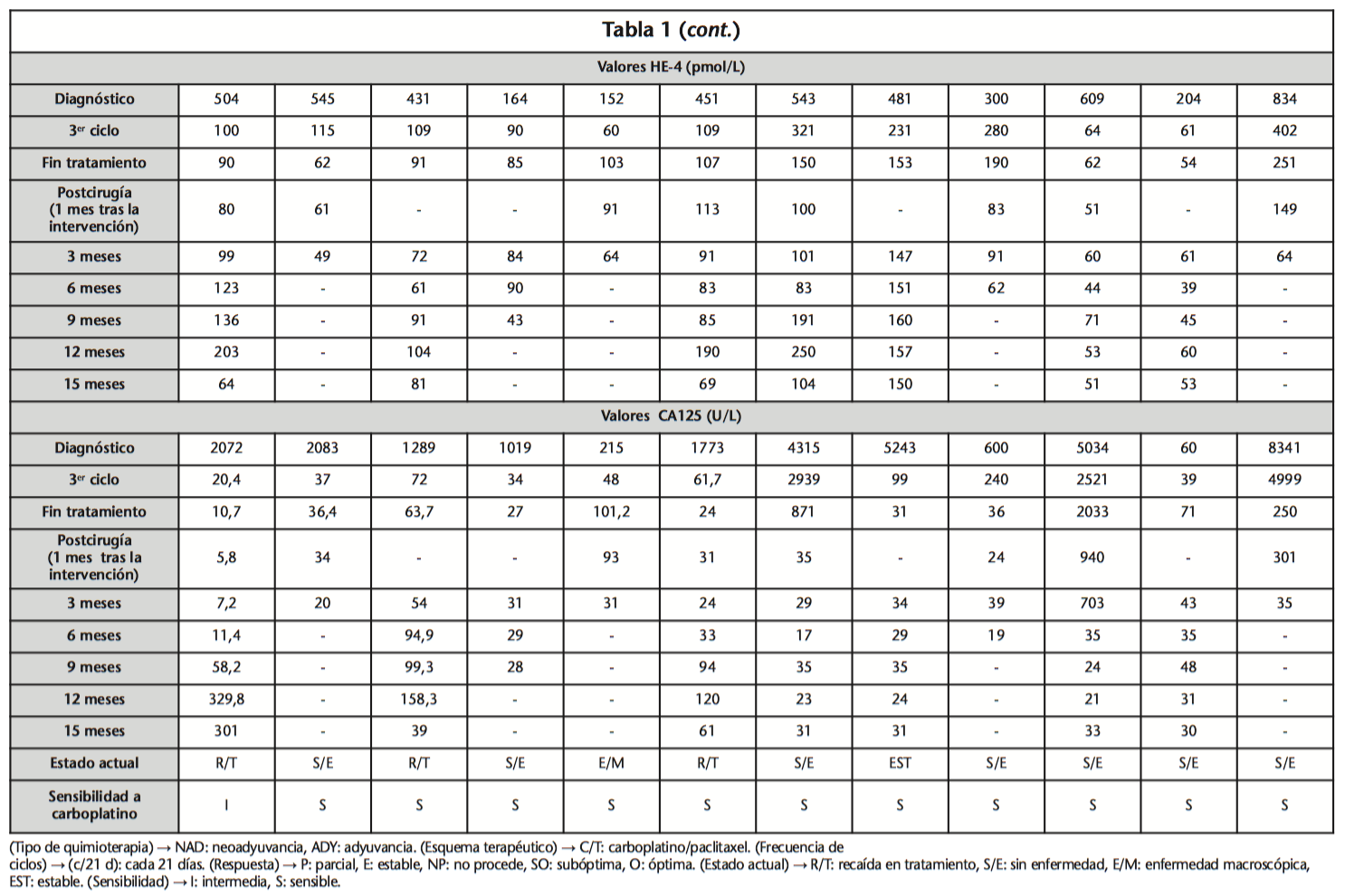
Finalmente se procedió a clasificar los tumores por estadio y la evolución de los valores analíticos de HE4 y CA125 al diagnóstico, tercer ciclo, fin de tratamiento, postcirugía de intervalo (si la hubo) y tres, seis, nueve, 12 y 15 meses posteriores a ésta. Los valores de HE4 dada su elevada especificidad, solo se les solicitó a aquellas mujeres en tratamiento quimioterápico. Para el resto solo CA125.
Para la determinación y cuantificación de los marcadores HE4 y CA125, se utilizaron los analizadores Elecsys 2010 y Cobas e (Roche Diagnostics©) para ambos, mientras que para la calibración del método para cuantificar CA125 se utilizó el Enzymun Test CA 125 II y EIA (enzimoinmunoanálisis) de Fujirebio Diagnostics, Inc. para HE4.
Los valores de referencia para la determinación sérica de HE4 y CA125 respectivamente durante el periodo de estudio fueron:
– CA125: 0-35 U/L; valores >35 U/L son sugestivos de recaída.
– HE4 premenopáusicas: <150 pmol/L.
– HE4 postmenopáusicas: <90 pmol/L.
Para HE4, valores superiores a 90 y 150 pmol/L, son indicadores de reactivación.
Resultados y discusión
Aunque la incidencia de este tipo de tumores en nuestro centro es de 20-25 casos/año, solo pudimos revisar 15, de los cuales tres de ellos no disponían de datos analíticos completos a lo largo de todo el periodo, puesto que el marcador HE-4 solo se solicitó a aquellas mujeres bajo tratamiento antineoplásico.
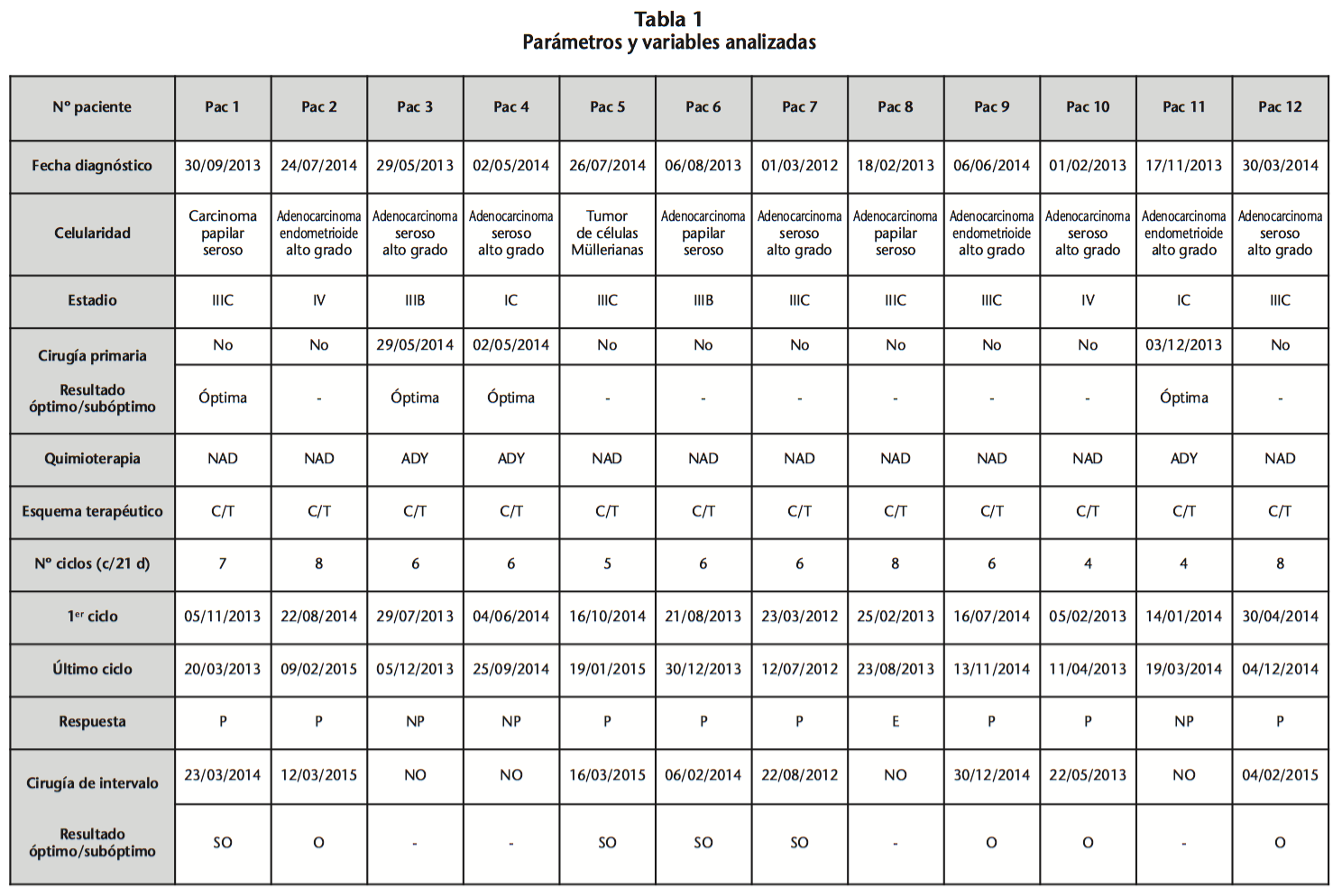
La distribución de parámetros analizados y resultados se recoge en la tabla 1.
De las 12 pacientes, solo tres pudieron ser intervenidas mediante cirugía primaria, las mismas que recibieron posteriormente quimioterapia adyuvante. El 75% restante comenzó con quimioterapia neoadyuvante.
El número de ciclos de quimioterapia (QT) osciló entre cuatro y ocho según las recomendaciones actuales, y las pacientes fueron sometidas a cirugía en el momento que fue posible. El 66,7% de las pacientes que recibieron neoadyuvancia tuvieron respuesta parcial, por lo que pudieron ser sometidas a cirugía de intervalo, consiguiendo un resultado quirúrgico subóptimo en el 83,3% de los casos.
En cuanto a los marcadores objeto de estudio, en el caso de HE4, los niveles plasmáticos fueron paulatinamente en aumento tras cirugía en aquellas pacientes que finalmente presentaron recaída de la enfermedad. La determinación de niveles, fue realizada al mes de la misma.
Para CA125, una vez se hubo alcanzado la disminución de niveles (30-50 U/L), estos se mantuvieron bajos a lo largo del periodo de estudio o hasta fin de tratamiento, más homogéneamente.
Para HE4 la disminución numérica de valores (<150 pmol/L) fue gradual desde el diagnóstico hasta la cirugía en la mayoría de los casos, mientras que CA125 sufrió una caída más contundente en torno al tercer ciclo.
Además los valores séricos globales de CA125 al diagnóstico, fueron del orden de cuatro veces los de HE4 en las mismas condiciones, lo que podría justificar la sensibilidad de este marcador.
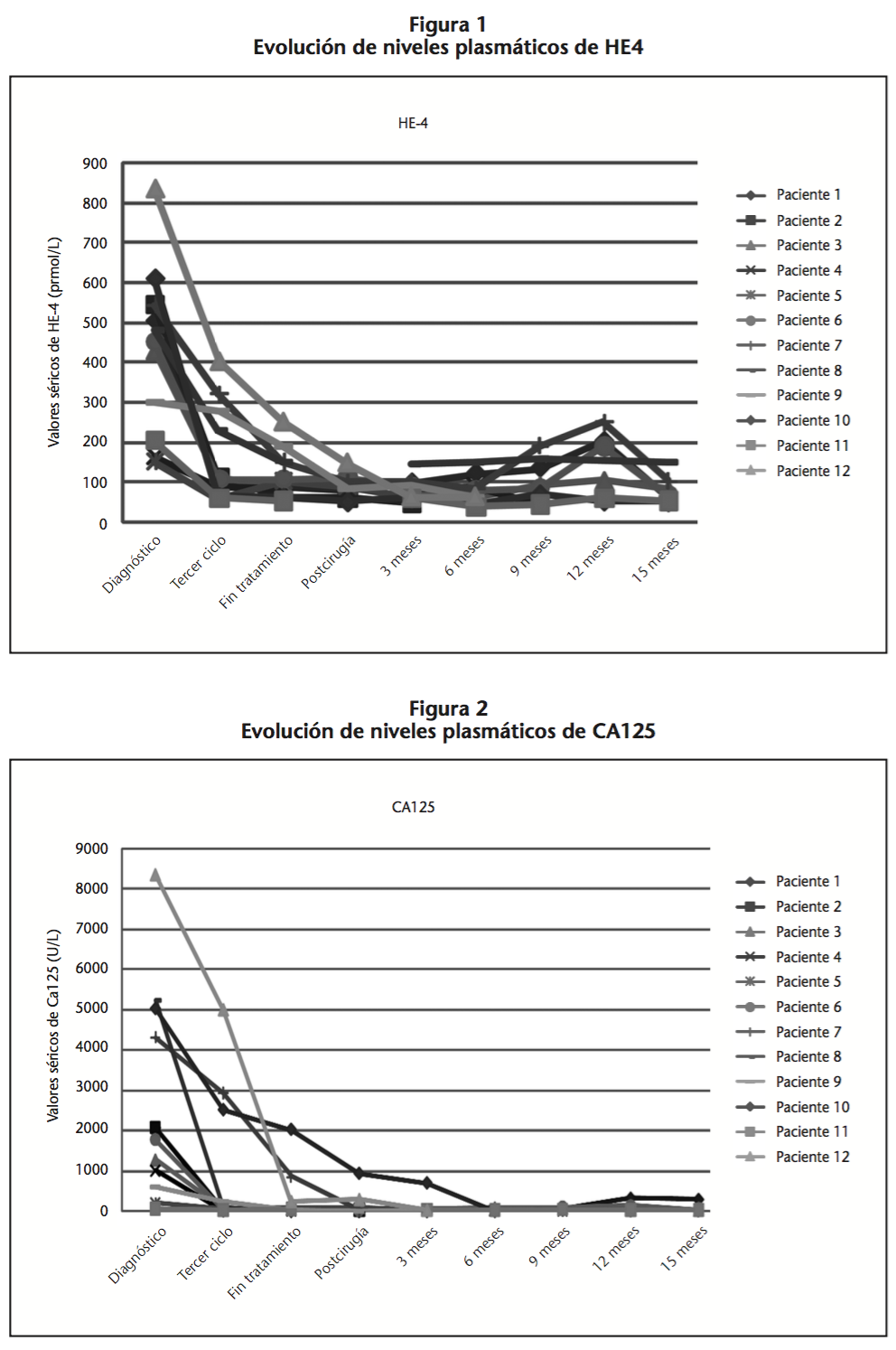
Las determinaciones tanto de HE4 como de CA125, fueron disminuyendo tras inicio del tratamiento hasta cirugía (Tabla 1), aumentando lentamente tras la intervención quirúrgica y sugiriendo reactivación de la enfermedad. Esta situación fue confirmada mediante pruebas de imagen (Figuras 1 y 2).
Finalmente, pudimos observar y corroborar la relación entre los niveles séricos de los marcadores y el estadio de la enfermedad, que aunque eran tanto mayores a mayor estadificación, no se cumplió en el 22% de los casos.
El tipo de tumor que mayor valor plasmático proporcionó fue el endometrioide y seroso alto grado y el que menos, el de células Müllerianas.
Conclusiones
– El rango en el que aumenta el marcador CA125 es mucho mayor que HE4, a pesar de tener un intervalo de valores no patológicos notablemente menor. La elevación de éstos, confirma la rápida y nefasta evolución de estas neoplasias, teniendo valor predictor positivo.
– El incremento en el valor de CA125 y HE4 tras cirugía, es gradual y proporcional a las mediciones trimestrales. Además valores elevados de ambos, en especial de CA125 por su elevada sensibilidad, confirman el estado definitivo de cada una de las pacientes.
– La determinación conjunta de ambos marcadores, parece aportar una mayor certeza en la confirmación del estado de una paciente con cáncer de ovario debido a su efecto sinérgico. Sin embargo en nuestro trabajo, no hemos podido confirmarlo respecto a la determinación individual, probablemente por la dilatada evolución temporal de la enfermedad y por el pequeño tamaño muestral. Sería por tanto necesaria la realización de estudios de mayor población.
Conflicto de intereses: Los autores declaran no tener conflictos de intereses.
Financiación: Los autores no han recibido financiación alguna durante la preparación de este manuscrito.
Bibliografía
1. Pickle LW, Hao Y, Jemal A, et al. A new method of estimating United States and state-level cancer incidence counts for the current calendar year. Cancer J Clin. 2007;57:30-42.
2. Cancer Mondial Statistical Information System. Disponible en: http://www-dep.iarc.fr/
3. Sociedad Española de Oncología Médica (SEOM). [consultado 14-Mayo-2016]. Disponible URL: http:// www.seom.org/en/informacion-sobre-el-cancer/info-tipos-cancer/ginecologico/ovario?start=1.
4. National Cancer Institute.[consultado 14-Mayo-2016]. Disponible URL: http://www.cancer.org/espanol/cancer/ovario/guiadetallada/cancer-de-ovario-early-survival-rates.
5. Shuai Zhen, Li Hong Bian, Li Li Chang, Xin Gao. Comparison of serum human epididymis protein 4 and carbohydrate antigen 125 as markers in ovarian cancer: A meta analysis. Mol Clin Oncol. 2014;2:559-566.
6. Poveda Velasco A, Casado Herráez A, Cervantes Ruipérez A, Gallardo Rincón D, García García E, González Martín A. GEICO Group. Treatment guidelines in ovarian cancer. Clin Transl Oncol. 2007;9(5):308-316.
7. González Martín A, Redondo M, Jurado A, De Juan I, Romero I, Bover JM y col. Clin Transl Oncol. 2013;15:5 09-525.
8. Khan AR, Khan S, Zimmerman V, Baddour LM, Tleyjeh IM. Quality and strength of evidence of the Infectious Diseases Society of America clinical practice guidelines. Clin Infect Dis. 2010;51(10):1147-1156.
9. Gentry-Maharaj A, Menon U. Screening for ovarian cancer in the general population. Best Pract Res Clin Obstet Gynaecol. 2012; 26(2):243-256.
10. Van Gorp T, Veldman J, Van Calster B, Cadron I, Leunen K, Amant F, et al. Subjective assessment by ultrasound is superior to the risk of malignancy index (RMI) or the risk of ovarian malignancy algorithm (ROMA) in discriminating benign from malignant adnexal masses. Eur J Cancer. 2012;48(11):1649-1656.
11. Bast RC, Klug TL, St. John E, et al. A radioimmunoassay using a monoclonal antibody to monitor the course of epithelial ovarian cancer. N Engl J Med. 1983;309: 883-887.
12. Klug TL, Bast RC Jr, Niloff JM, et al. Monoclonal antibody immunoradiometric assay for an antigenic determinant (CA 125) associated with human epithelial ovarian carcinomas. Cancer Res. 1984;44:1048-1053.
13. Kabawat SE, Bast RC Jr, Knapp RC, et al. Immunopathologic characterization of a monoclonal antibody that recognizes common surface antigens of human ovarian tumors of serous, endometroid and clear cell types. Am J Clin Pathol. 1983;79:98-104.
14. Daoud E, Bodor G, Weaver Ch, et al. CA-125 Concentrations in Malignant and Nonmalignant Disease. Clin Chem. 1991;37(11):1968-1974.
15. Kenemans P, Bon GG, Kessler A, et al. Multicenter Technical and Clinical Evaluation of a Fully Automated Enzyme Immunoassay for CA 125. Clin Chem. 1992;38(8):1466-1471.
16. Hasholzner U, Stieber P, Baumgartner L, et al. Methodological and Clinical Evaluation of Three Automatized CA 125 Assays Compared with CA 125 II RIA. Tumordiagn Ther. 1994;15:114-117.
17. Ruibal A, Encabo G, Martinez-Miralles E, et al. CA 125 seric levels in nonmalignant pathologies. Bull Cancer. 1984;71(2):145-146.
18. Zahner J, Schmitz FJ, Schmitz G, et al. CA 125 – ein Tumormarker in der Inneren Medizin? Lab Med. 1995; 19:185-188.
19. Stieber P, Fateh-Moghadam A. Sensible Use of Tumormarkers. Dtsch: Tumormarker und ihr sinnvoller Einsatz. ISBN 3-926725-07-9 dtsch/engl. Juergen Hartmann Verlag Marloffstein-Rathsberg (1993).
20. Kirchhoff C. Molecular characterization of epididymal proteins. Rev Reprod. 1998;3:86-95.
21. Hellström I, Raycraft J, Hayden-Ledbetter M, et al. The HE4 (WFDC2) protein is a biomarker for ovarian carcinoma. Cancer Res. 2003;63:3695-3700.
22. R. Drapkin, H.H. von Horsten, Y. Lin, S.C. Mok, C.P. Crum, W.R. Welch, et al. Human epididymis protein 4 (HE4) is a secreted glycoprotein that is overexpressed by serous and endometrioid ovarian carcinomas. Cancer Res. 2005;65:2162-2169.
23. C. Romagnolo et al. HE4, CA125 and risk of ovarian malignancy algorithm (ROMA) as diagnostic tools for ovarian cancer in patients with a pelvic mass: An Italian multicenter study. Gynecol Oncol. 2016;141:303-311.
24. Moore RG, Brown AK, Miller MC, Skates S, Allard W, Verch T, et al. The use of multiple novel tumor biomarkers for the detection of ovarian carcinoma in patient with a pelvic mass. Gynecol Oncol. 2008;108:402-408.
25. Angioli et al. The role of novel biomarker HE4 in endometrial cancer: a case control prospective study. Tumor Biol. (2013)34:571-576.
26. Hellstrom I, Raycraft J, Hayden-Ledbetter M, Ledbetter JA, Schummer M, McIntosh M et al. The HE4 (WFDC2) protein is a biomarker for ovarian carcinoma. Cancer Res. 2003;63:3695-3700.
27. Moore RG, Brown AK, Miller MC, et al. The use of multiple novel tumor biomarkers for the detection of ovarian carcinoma in patients with a pelvic mass. Gynecol Oncol. 2008;108:402-408.
28. Moore RG, Brown AK, Miller MC, et al. Utility of a novel serum tumor biomarker HE4 in patients with endometrioid adenocarcinoma of the uterus. Gynecol Oncol. 2008;110:196-201.
29. Calvert AH, Newell DR, Gumbrell LA et al. Carboplatin dosage: prospective evaluation of a simple formula based on renal function. J Clin Oncol. 1989; 7:1748-1756. Disponible en: http://www.globalrph.com/carboplatin.htm.
____
Descargar archivo PDF: Comparación del comportamiento sérico de HE4 y CA125 como marcadores tumorales de cáncer epitelial ovárico. Análisis de doce casos clínicos
