Corregidor Luna L1, Díaz Gómez E1, Requena Rodríguez MJ2, García Díaz B1
1 Servicio de Farmacia
2 Servicio de Hematología
Hospital Universitario Severo Ochoa. Leganés. Madrid (España)
Fecha de recepción: 31/10/2018 – Fecha de aceptación: 27/12/2018
Correspondencia: Laura Corregidor Luna – Hospital Universitario Severo Ochoa (Servicio de Farmacia) – Avda. Orellana, s/n – 28911 Leganés. Madrid (España)
lcorregidorluna@gmail.com
____
Resumen
La anemia aplásica o aplasia medular (AM) es una insuficiencia medular que cursa con síndrome anémico, infeccioso y hemorrágico. Según los algoritmos de tratamiento, si se descarta el trasplante de progenitores hematopoyéticos (TPH), debe iniciarse tratamiento inmunosupresor con timoglobulina y ciclosporina A (CSA), ajustando la posología según concentraciones plasmáticas (Cp). Se presenta el caso de una mujer de 28 años diagnosticada de AM moderada con necesidades transfusionales. En el transcurso del tratamiento se prescribe posaconazol como profilaxis antifúngica y etinilestradiol/drospirenona como anticonceptivo oral continuo que suprime la menstruación y evita mayor trombopenia. Se monitorizan las Cp de CSA, siendo complicado el control de las mismas y presentando niveles elevados en sucesivas ocasiones que hacen necesarias continuas modificaciones en la dosis. Las altas Cp se relacionan posiblemente con interacciones con el tratamiento concomitante (lo que obliga a suspenderlo temporalmente) y dan lugar a insuficiencia renal aguda (IRA) y hepatotoxicidad y en un segundo episodio a un cuadro de hiponatremia hipotónica con probable síndrome de secreción inadecuada de hormona antidiurética (SIADH). Por falta de control es necesario suspender CSA e iniciar un segundo inmunosupresor (tacrolimus), que es mal tolerado y obliga a interrumpir de nuevo el tratamiento. Se reanuda CSA, alcanzando esta vez respuesta completa con función renal estable.
Palabras clave: Aplasia, medular, ciclosporina, posaconazol, etinilestradiol, drospirenona, insuficiencia, renal, hepatotoxicidad.
Complexity in the monitoring and management of interactions and toxicities by cyclosporin A in aplastic anemia
Summary
Aplastic anemia or medullary aplasia (AA) is a medullar insufficiency which consist in anemic, infectious and hemorrhagic syndrome. According to the treatment algorithms, if hematopoietic progenitors transplantation (HPT) is ruled out, immunosuppressive therapy should be initiated with thymoglobulin and cyclosporin A (CSA), adjusting the dosage according to plasma concentrations (Pc). We present the case of a 28-year-old woman diagnosed with moderate AA with transfusion needs. During the course of treatment, posaconazole is prescribed as antifungal prophylaxis and ethinylestradiol/drospirenone as a continuous oral contraceptive that suppresses menstruation and prevents further thrombocytopenia. The Pc of CSA are monitored, presenting high levels in successive occasions that make necessary continuous dose modifications. High Pc are possibly associated with interactions with concomitant treatment (which requires temporary suspension) and lead to acute renal failure, hepatotoxicity and a hypotonic hyponatremia with probable syndrome of inappropriate secretion of antidiuretic hormone (SIADH) in a second episode. Due to lack of control, it is necessary to suspend CSA and initiate a second immunosuppressant (tacrolimus), which is poorly tolerated and requires interrupting the treatment again. CSA is restarted, reaching this time complete response with stable renal function.
Key Words: Aplastic, anemia, cyclosporin, posaconazole, ethinylestradiol, drospirenone, renal, failure, hepatotoxicity.
____
Introducción
La anemia aplásica o aplasia medular (AM) es una insuficiencia medular caracterizada por un síndrome anémico, infeccioso y hemorrágico, originada por la desaparición de precursores hematopoyéticos. Se estima una incidencia europea de 2 casos/año/millón de habitantes con picos de edad de 10-25 años y a partir de 601,2.
Según algoritmos de tratamiento, excluidos agentes causales, en menores de 40 años con AM grave, muy grave o menos grave con necesidades transfusionales, sangrados o infecciones, es de elección el trasplante de progenitores hematopoyéticos (TPH) de un hermano HLA idéntico. En caso de no tenerlo, se iniciaría tratamiento inmunosupresor con timoglobulina y ciclosporina A (CSA) a 5 mg/Kg/día. Ésta debe ajustarse según concentraciones plasmáticas (Cp) previas a una administración (nivel valle)1,3.
Descripción del caso
Mujer de 28 años acude a urgencias por astenia progresiva, hipermenorrea y epistaxis leve autolimitada.
Al ingreso presenta pancitopenia: hemoglobina 6,60 g/dL (12-16), hematocrito 18,70% (37-47), plaquetas 21.000/mcL (130.000-400.000), leucocitos 3.410/mcL (4.800-10.800), neutrófilos 0,77/mm3 (1,9-8) y reticulocitos 35.200/mm3 (40.000-90.000).
Se diagnostica AM moderada con necesidades transfusionales. Se plantea TPH, pero el estudio HLA de la paciente y su hermano muestra más de una diferencia HLA (haploidénticos), por lo que no es candidata a TPH en primera línea y se inicia tratamiento inmunosupresor.
Se prescribe posaconazol 300 mg/24h vía oral como profilaxis antifúngica y CSA intravenosa 112 mg/12h (posteriormente oral). El día +5 de tratamiento se prescribe etinilestradiol/drospirenona como anticonceptivo oral continuo para suprimir la menstruación y evitar mayor trombopenia. Las Cp de CSA se pueden ver en la Tabla 1.
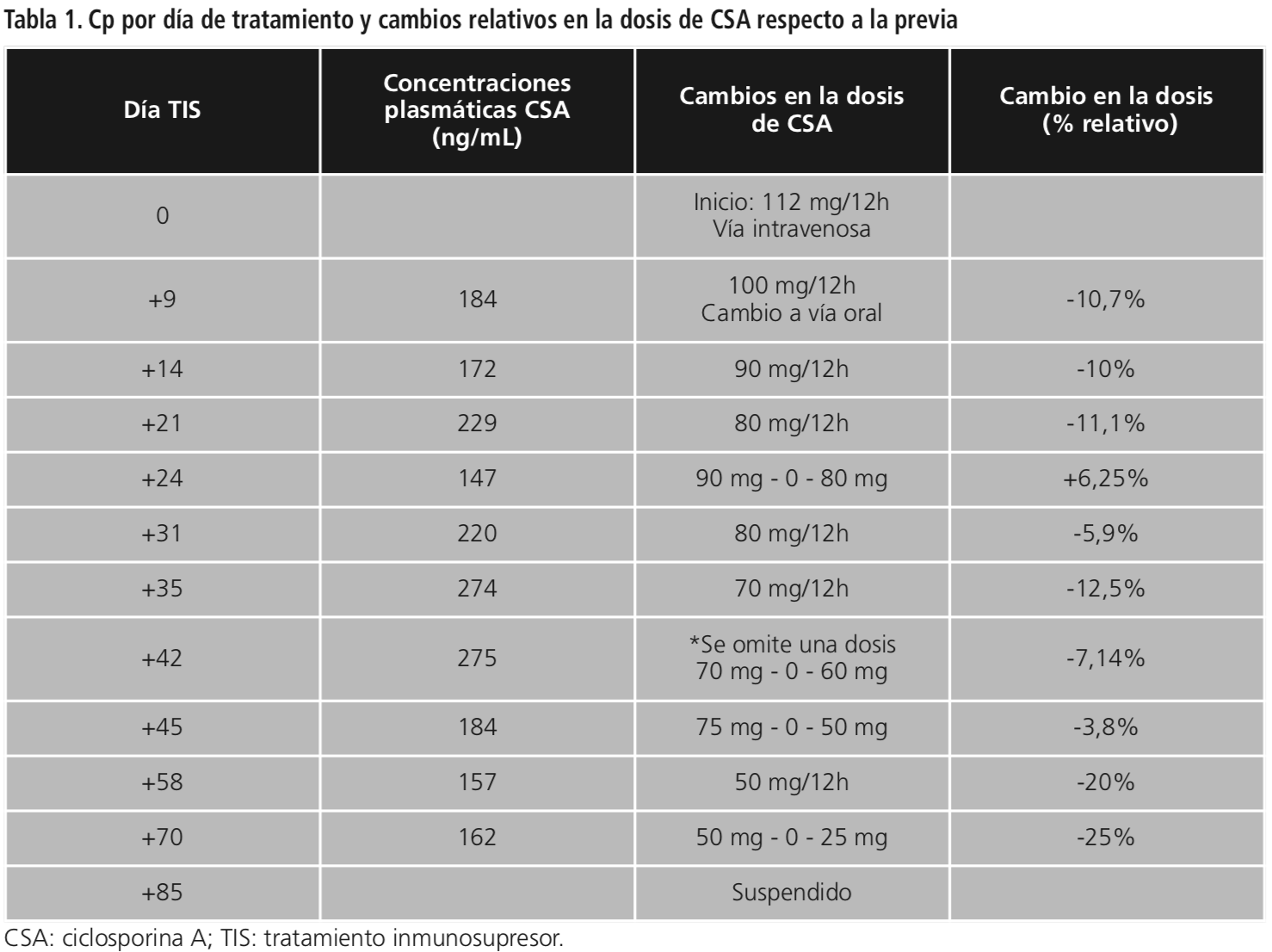
Durante el ingreso, desde el área de farmacocinética se monitorizan las Cp de CSA, informando de las posibles interacciones y su repercusión sobre las Cp. Son necesarias sucesivas reducciones de dosis por toxicidad y por Cp elevadas.
La primera reducción por toxicidad se realiza el día +9, por insuficiencia renal aguda (IRA), con creatinina sérica (Cr) 1,42 mg/dL y bilirrubina 1,4 mg/dL. Se reduce un 10%, mejorando la función renal (Cr 1,18 mg/dL), aunque con empeoramiento hepático (LDH 336 U/L (135-225), bilirrubina total 1,6 mg/mL (0-1,2), AST 55 U/L (0-32), ALT 112 U/L (0-33), GGT 33 U/L (7-32) FA 42 U/L (45-104)). Se suspende el anticonceptivo oral y el posaconazol, atribuyendo a este último la hepatotoxicidad. Una vez normalizada la analítica, se reintroduce el posaconazol. Se reinicia el anticonceptivo el día +27 debido a la trombopenia por menstruación (plaquetas 20.000/mcL).
El día +36 presenta hiperpotasemia leve e hiponatremia, con baja osmolalidad en suero y orina, sodio 31 mmol/L y potasio 11 mmol/L en orina, compatible con hiponatremia hipotónica y probable SIADH, que se resuelve en días.
La paciente recibe el alta y es controlada ambulatoriamente. Durante el seguimiento empeora la función renal (Cr 1,86 mg/dL, hiperpotasemia leve, hiponatremia y Cp 157 mcg/mL). Confirmada la toxicidad tubular distal, se disminuye CSA a 75mg/24h. Posteriormente presenta niveles bajos de CSA. El día +85 debido a la imposibilidad de mantener niveles adecuados con función renal aceptable, se decide cambio a tacrolimus 1mg/12h. En ese momento está en remisión parcial y sin necesidades transfusionales. Una semana después se suspende posaconazol por nuevo empeoramiento renal (Cr 2,11 mg/dL).
Tras 10 días con tacrolimus se suspende por intolerancia digestiva, con niveles de 10,5 ng/mL (IT=5-10 mcg/L) y se reinicia CSA 50mg/12h.
Actualmente mantiene tratamiento con CSA con función renal prácticamente normalizada y respuesta completa (hemoglobina 12,8 g/dL, plaquetas 161.000/mcL, neutrófilos 1,8/mm3, leucocitos 4.460/mcL). La duración prevista del tratamiento se estima en dos años, según recomendaciones del Grupo Español de Trasplante Hematopoyético y Terapia Celular (GETH)4.
Discusión
Según guías británicas, en AM con neutropenia grave, se aconseja profilaxis antifúngica con azoles, ya que las infecciones fúngicas invasivas suponen un problema de alta morbi-mortalidad3,5.
Los azoles inhiben el isoenzima 3A4 del citocromo P450. Todo ello genera interacciones con inmunosupresores como CSA y tacrolimus, elevando sus Cp.
También pudo existir interacción entre CSA y etinilestradiol, incrementándose los niveles de CSA. Dicha interacción es conocida, aunque no su mecanismo. Además, la drospirenona puede producir hiperkalemia por sinergismo farmacodinámico con CSA6.
La toxicidad renal y hepática está descrita como reacción adversa en la ficha técnica de CSA. La hepatotoxicidad también consta como reacción adversa frecuente a posaconazol.
Por ello, desde el Servicio de Farmacia es fundamental reconocer las interacciones para monitorizar niveles y recomendar ajustes posológicos.
Existen estudios con azoles donde se han requerido reducciones en porcentaje variable en la dosis de CSA cuando se administran concomitantemente3,7.
Sánchez Ortega et al. recomiendan monitorización de CSA en trasplante alogénico de médula ósea tras evaluar el efecto de posaconazol en los niveles y el ajuste posológico de CSA. Concluyen que la variación en las Cp puede detectarse en la primera semana de tratamiento concomitante, aunque no sea clínicamente significativo. La reducción de dosis fue del 50% en el día 14. Recomiendan monitorizar desde el inicio realizando tres niveles semanales3.
En el presente caso, durante el ingreso se determinó el primer nivel al tercer día de tratamiento con CSA (en estado estacionario según semivida de eliminación), aunque la primera reducción de dosis fue el día +9. Las Cp de CSA oscilaron entre 90-275 mcg/mL. Fueron necesarias 8 reducciones de dosis: cuatro por altas Cp (184-275 mcg/mL) y cuatro por toxicidad a pesar de Cp en el IT. Las reducciones fueron cuantitativamente mayores por toxicidad (10-25% respecto a la dosis previa) que por altas Cp (3,8%-12,5%).
Existe una dificultad añadida en la monitorización y toxicidades de CSA, ya que según la fuente bibliográfica, puede variar el IT de referencia. Teramura et al. y Passweg et al. toman como IT 150-250 ng/mL, mientras que Schrezenmeier et al. 75-200 ng/mL. En el centro en el que se realizó el seguimiento, se toma de 150-200 ng/mL8-10.
Pese a las dificultades presentadas, en este caso fue necesario reanudar CSA, alcanzando finalmente respuesta completa y función renal estable.
Basándose en el algoritmo de imputabilidad de Karch-Lasagna modificado, la reacción adversa con ciclosporina quedaría clasificada como probable según la secuencia temporal, el conocimiento previo de la misma y su posible mecanismo de acción, la mejoría tras la interrupción del tratamiento y la no existencia de posibles causas alternativas.
Este caso se ha notificado al Centro de Farmacovigilancia correspondiente.
Conflicto de intereses: Los autores declaran no tener conflicto de intereses.
BIBLIOGRAFÍA
1. Aplasia Medular [Internet]. Hematosalamanca.es. 2018 [cited 23 May 2018]. Available from: http://www.hematosalamanca.es/index.php/pacientes-y-familiares/enfermedades/58-aplasia-medular.
2. Brodsky R, Jones R. Aplastic anaemia. The Lancet. 2005;365(9471):1647-1656.
3. Sánchez-Ortega I, Vázquez L, Montes C, Patiño B, Arnan M, Bermúdez A, et al. Effect of Posaconazole on Cyclosporine Blood Levels and Dose Adjustment in Allogeneic Blood and Marrow Transplant Recipients. Antimicrobial Agents and Chemotherapy. 2012;56(12):6422-6424.
4. Aplasia Medular [Internet]. Geth.es. 2018 [cited 23 July 2018]. Available from: http://www.geth.es/pacientes/173-pacientes/hemopatias/325-aplasia-medular.
5. Killick S, Bown N, Cavenagh J, Dokal I, Foukaneli T, Hill A, et al. Guidelines for the diagnosis and management of adult aplastic anaemia. British Journal of Haematology. 2015;172(2):187-207.
6. Multi-Drug Interaction Checker [Internet]. Reference.medscape.com. 2018 [cited 23 May 2018]. Available from: https://reference.medscape.com/drug-interactionchecker.
7. Sansone-Parsons A, Krishna G, Martinho M, Kantesaria B, Gelone S, Mant T. Effect of Oral Posaconazole on the Pharmacokinetics of Cyclosporine and Tacrolimus. Pharmacotherapy. 2007;27(6):825-834.
8. Teramura M, Kimura A, Iwase S, Yonemura Y, Nakao S, Urabe A, et al. Treatment of severe aplastic anemia with antithymocyte globulin and cyclosporin A with or without G-CSF in adults: a multicenter randomized study in Japan. Blood. 2007;110(6):1756-1761.
9. Passweg J, Marsh J. Aplastic Anemia: First-line Treatment by Immunosuppression and Sibling Marrow Transplantation. Hematology. 2010;2010(1):36-42.
10. Marsh J, Schrezenmeier H, Marin P, Ilhan O, Ljungman P, McCann S, et al. Prospective Randomized Multicenter Study Comparing Cyclosporin Alone Versus the Combination of Antithymocyte Globulin and Cyclosporin for Treatment of Patients With Nonsevere Aplastic Anemia: A Report From the European Blood and Marrow Transplant (EBMT) Severe Aplastic Anaemia Working Party. Blood. 1999 Apr 1;93(7):2191-5.
____
