Garro Rodríguez A1, Escutia Gutiérrez R2
1 Regente Farmacéutica en Preparaciones Magistrales Farmacéuticas PREMAFARMA. San José (Costa Rica)
2 Jefe del Depto. de Vinculación. Instituto Jalisciense de Salud Mental. Secretaria de Salud Jalisco (México)
Lectora Dra. Ana Violeta Ovares de la Peña. Regente Farmacéutica en Preparaciones Magistrales Farmacéuticas PREMAFARMA
____
Resumen
Objetivo: Exponer el panorama actual en cuanto a la necesidad de regulación de las “compounding pharmacies” o farmacias de preparaciones dado las pérdidas humanas que ha ocasionado el incumplimiento de las medidas de asepsia requeridas, específicamente en las farmacias hospitalarias de los Estados Unidos de Norteamérica.
Método: Se realizó un análisis descriptivo sobre los artículos –“Safety, sanitary problems prompt many drug recalls” publicado en el periódico USA Today; “Texas compounding pharmacy recalls drugs after 15 infections” anunciado por CBS News y “Texas compounding pharmacy recalls all sterile product” divulgado en Medscape Medical News– y se contrastó a la luz de la normativa vigente en la Ley Federal de Alimentos, Medicamentos y Cosméticos de Estados Unidos de Norteamérica. Por otra parte, se aplicó un análisis comparativo-deductivo en cuanto a la regulación existente para el caso de Costa Rica. Producto de lo anterior se obtuvo una serie de conclusiones que se aportan a fin de contribuir con la discusión de este tema de actualidad.
Resultados: Las “compounding pharmacies” han emitido más de 50 retiros de fármacos del mercado en los últimos dos años –dos tercios de estos retiros involucraban medicamentos estériles–, en donde en una muestra de la mitad de los casos se encontró que el 20% pertenecía a la clasificación de “peligroso o producto defectuoso”. Además, desde 2012 la FDA ha realizado 148 inspecciones y sus evaluadores han reportado condiciones inaceptables de seguridad en 9 de cada 10 establecimientos. Finalmente, en el último año la FDA ha emitido 28 notificaciones de advertencia más que en los últimos cinco años combinados.
Conclusiones: La FDA debe ir más allá y atender la problemática existente ocasionada por la brecha regulatoria de las “compounding pharmacies”; tomando para ello las acciones correctivas necesarias que permitan establecer regulaciones de carácter obligatorio que coadyuven a proteger más puntualmente la salud de los pacientes que requieren sus servicios. Es necesario que la FDA asuma un rol de carácter más preventivo, y no que su supervisión y regulación se limite a responder a eventos que tienen serias repercusiones en la salud de pública. En los Estados Unidos de Norteamérica la norma de preparaciones magistrales establece que éstas deben prepararse para un paciente en particular de acuerdo a lo indicado por el médico prescriptor, al igual que en Costa Rica. Sin embargo, algunas farmacias magistrales de ese país iniciaron la preparación de lotes de medicamentos para la venta al público, irrespetando la regulación establecida. En Costa Rica, existe una escasa regulación de dicha actividad, por lo que resulta imperativo que el Ministerio de Salud tome acciones que permitan garantizar la seguridad de las preparaciones magistrales-especialmente estériles e incluyendo todos los establecimientos que las preparen tanto privados como hospitalarios, y así proteger la salud pública.
Palabras clave: Compounding pharmacies, preparaciones magistrales, salud pública, medicamentos estériles, asepsia.
Compounding pharmacies: need to control due to threats to public Elath
SUMMARY
Aims: The present study aspired to expose the current situation regarding the need of regulation of compounding pharmacies due to the human losses that non-aseptic practices have occasioned, specifically in hospital pharmacies in the United States of America.
Method: In this descriptive analysis, it was necessary to study the following main articles –“Safety, sanitary problems prompt many drug recalls” published in USA Today; “Texas compounding pharmacy recalls drugs after 15 infections” available in CBS News and “Texas compounding pharmacy recalls all sterile product” announced in Medscape Medical News– and contrasted with current legislation in The United States Federal Food, Drug, and Cosmetic Act.
Besides, a comparative-deductive analysis was applied regarding the regulation of this activity in Costa Rica; from which conclusions were provided in order to contribute to the argument of this topic of particular interest.
Results: Compounding pharmacies have issued more than 50 drug recalls in the past two years and in a sampling of half the cases it was found that 20% involved the most serious recall classification “dangerous or defective product”. In addition, since 2012, the FDA has conducted 148 inspections and evaluators have reported unacceptable security conditions in 9 out of 10 facilities. Finally, in the last year, the FDA has issued 28 warning letters more than in the last five years combined.
Conclusions: The FDA must go further and address the existing problems caused by the regulatory gap of «compounding pharmacies»; applying all the necessary enforcement actions to establish mandatory regulations to protect public health. The FDA must assume a more preventive role, rather than its supervision and regulation is limited as a response to events that have serious implications for public health. According to present laws in the United States, compounded preparations are made for a particular patient as indicated by the prescribing physician, as well as in Costa Rica. However, certain compounding pharmacies prepared batches for sale to the public or health care centers, disrespecting current regulations. In Costa Rica, there is scarce regulation of this activity, so it’s imperative that the Ministry of Health take actions to ensure the safety of compounded preparations, especially sterile- and protect public health.
Key Words: Compounding pharmacies, compounded preparations, public health, sterile drugs, aseptic.
_____
Introducción
Desde tiempos antiguos, las formulaciones magistrales han formado parte esencial del quehacer farmacéutico. Con una prescripción médica de por medio, los tradicionales boticarios dominaban este arte de crear con sus manos la solución ante una necesidad posológica individual1.
En Estados Unidos de Norteamérica, las llamadas “compounding pharmacies” han sido objeto de continua polémica debido a recientes hallazgos de contaminaciones exógenas en medicamentos supuestamente estériles que han afectado gravemente la salud de cientos de estadounidenses.
Según la Asociación Americana de Farmacéuticos (APhA) el acto de “compounding” se refiere a la creación de una preparación farmacéutica por parte de un farmacéutico autorizado –de acuerdo a especificaciones en una receta médica– para satisfacer las necesidades únicas de un paciente en particular, cuando los medicamentos disponibles en el mercado no cumplen con esas necesidades. Por ejemplo, en caso de que un paciente sea alérgico a cierto componente no esencial que pueda ser excluido de la formulación, ajustar dosis o cambiar la forma farmacéutica en caso que el paciente no sea capaz de tomar el medicamento disponible comercialmente2.
Sin embargo, estas preparaciones conllevan una gran responsabilidad, en donde resulta indispensable seguir estrictos protocolos de asepsia en su preparación y conservación.
De acuerdo con la “International Academy of Compounding Pharmacist”, entre un 1% y un 3% de todas las prescripciones de los Estados Unidos de Norteamérica son “preparadas o combinadas”.
Es importante agregar que estas “compounding pharmacies” no solo combinan o preparan medicamentos para pacientes específicos, sino también lotes de fármacos que venden a hospitales y centros de salud. Además, se encuentran reguladas en teoría por sus correspondientes Boards of Pharmacies según el estado en el que se ubiquen, lo que sería equivalente a un Colegio Profesional en Costa Rica. Fue necesario que la FDA interviniera estos establecimientos ante las muertes y pacientes afectados dada la inacción de los Boards of Pharmacies; así como el incumplimiento de las normas establecidas por parte de los profesionales.
En septiembre del año 2012, salió a la luz pública que un brote de meningitis fúngica había afectado a 750 pacientes en 20 diferentes estados, dejando un saldo de 63 muertes. Esto fue vinculado al uso de esteroides contaminados –más de 17.600 dosis de acetato de metilprednisolona– la cual fue aplicada en inyecciones epidurales lumbares o periarticulares. Estos lotes contaminados provenían de la farmacia magistral llamada: “The New England Compounding Center” en Framingham, Massachussets, en donde inspectores de la FDA (Food and Drug Administration) hallaron moho y contaminación fúngica en los viales del medicamento y en áreas utilizadas para preparar fármacos estériles3,4.
Más tarde en el año 2013, otra farmacia magistral denominada: “Abrams Royal Compounding Pharmacy” ubicada en Dallas, Texas, anunció que retiraba del mercado todos sus productos debido a una falta de garantía en su esterilidad. Los productos involucrados incluían medicamentos inyectables –vía intravenosa–, gotas y ungüentos oftálmicos, implantes “pellets”, aerosoles nasales y soluciones para inhalación que se distribuyeron entre el 17 de junio 2013 y el 17 de diciembre de 2013. La FDA informó que un paciente que recibió una solución intravenosa preparada por Abrams fue ingresado en el Hospital de California, en donde sus hemocultivos resultaron positivos para la bacteria gram-negativa Stenotrophomonas maltophilia5.
En este caso resulta curioso que las autoridades se limitaron a efectuar únicamente un hemocultivo y no realizaron las pruebas oficiales para determinar la esterilidad del sitio de preparación, para lo cual se utilizan dos medios de cultivo específicos: soja caseína y Sabouraud dextrosa.
Ese mismo año, la farmacia magistral llamada “Specialty Compounding” ubicada en Texas, anunció que retiraba del mercado todos los lotes de medicamentos estériles que se distribuyeron a partir del 9 de mayo del 2013. La FDA indicó que había recibido información en relación con 15 pacientes en dos hospitales texanos que habían desarrollado infecciones sanguíneas provocadas por la bacteria Rhodococcus equi –luego de haber recibido una solución de gluconato de calcio vía intravenosa– suministrada por Specialty Compounding6.
En marzo, justo antes de este retiro voluntario, investigadores de la FDA visitaron estas instalaciones y determinaron que existían prácticas cuestionables y falta de algunos procedimientos para determinar la esterilidad de las drogas.
Asimismo se detectaron una serie de malas prácticas, por ejemplo un farmacéutico que no cambió sus guantes mientras buscaba objetos –apoyando sus manos y rodillas en el piso– en el área de preparación de medicamentos. También técnicos que limpiaban sus rostros y no se cambiaron los guantes mientras preparaban fármacos estériles.
Objetivo
Exponer el panorama actual en cuanto a la necesidad de regulación de las “compounding pharmacies” o farmacias de preparaciones dado las pérdidas humanas que ha ocasionado el incumplimiento de las medidas de asepsia requeridas, específicamente en las farmacias hospitalarias de los Estados Unidos de Norteamérica.
Metodología
Se realizó un estudio descriptivo sobre los artículos –“Safety, sanitary problems prompt many drug recalls” publicado en el periódico USA Today; “Texas compounding pharmacy recalls drugs after 15 infections” transmitido por CBS News y “Texas compounding pharmacy recalls all sterile product” divulgado en Medscape Medical News– y se contrastó a la luz de la normativa vigente en la Ley Federal de Alimentos, Medicamentos y Cosméticos de los Estados Unidos de Norteamérica. Por otra parte, se aplicó un análisis comparativo-deductivo en cuanto a la regulación de esta actividad en Costa Rica. Producto de lo anterior se obtuvo una serie de conclusiones que se aportan a fin de contribuir con la discusión de este tema de actualidad.
Resultados
Según el artículo “Safety, sanitary problems prompt many drug recalls”, después del brote de meningitis fúngica ocurrido en el año 2012, la FDA lanzó una ofensiva regulatoria que ha generado una oleada sin precedentes de retiro de medicamentos por parte de las farmacias magistrales.
Los siguientes datos fueron obtenidos del artículo mencionado anteriormente:
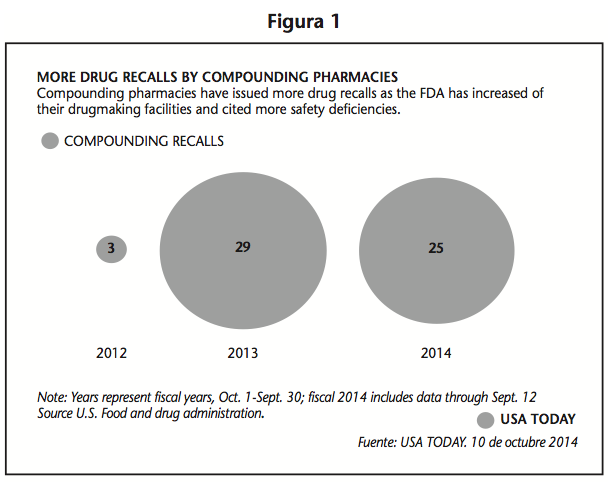
- A la fecha las farmacias magistrales han emitido más de 50 retiros de fármacos del mercado en los últimos dos años, en donde en una muestra de la mitad de los casos se encontró que el 20% pertenecía a la clasificación de “peligroso o producto defectuoso que podrían causar serios daños en la salud o incluso muerte”.
- Dos tercios de estos retiros involucraban medicamentos estériles.
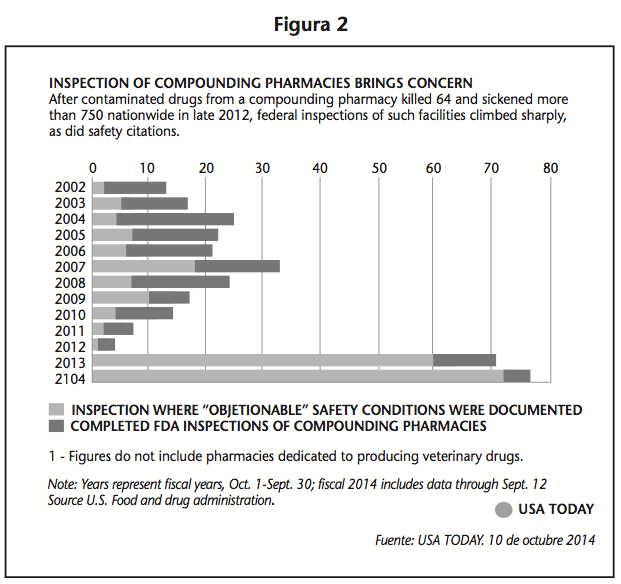
- Desde 2002 hasta octubre del 2012, la FDA realizó 197 inspecciones a farmacias magistrales y documentó condiciones indeseables en un tercio de ellas.
- En los siguientes dos años, la agencia ha realizado 148 inspecciones y sus evaluadores han reportado condiciones inaceptables de seguridad en 9 de cada 10 establecimientos.
- Si las violaciones son serias, la FDA emite cartas de advertencia que amenazan con la toma de acciones correctivas. En el último año, la FDA ha emitido 28 de ellas más que en los últimos cinco años combinados7.
En la figura 1 se muestra claramente como luego del brote de meningitis en 2012, la FDA redobló esfuerzos para supervisar más estrictamente las instalaciones que fabrican medicamentos “combinados”.
Desde octubre de 2012 hasta septiembre del presente año, (Figura 2) la FDA ha realizado cerca de 150 inspecciones en farmacias magistrales en donde en el 90% de éstas los inspectores han encontrado condiciones “objetables” de sanidad y seguridad que requerían de medidas correctivas.
Llama la atención que a pesar de los reiterados hallazgos de la FDA se ha limitado a reportarlos y no han tomado medidas concretas de carácter obligatorio que permitan regular más adecuadamente las farmacias magistrales.
Discusión
En noviembre del 2013, el presidente de los Estados Unidos Barack Obama, firmó la Ley de Seguridad y Calidad de Medicamentos (Drug Quality and Security Act) la cual –en su Título 1– elimina ciertas disposiciones de la sección 503A de la Ley Federal de Alimentos, Medicamentos y Cosméticos (FDCA) que en el año 2002 resultaron ser inconstitucionales según la Corte Suprema de los Estados Unidos.
Esta sección (503A) describe las condiciones en las que determinados medicamentos “combinados” pueden estar exentos de tres requerimientos de la FDCA: 1) Cumplimiento de Buenas Prácticas de Manufactura; 2) Etiquetado con instrucciones de uso; y 3) Aprobación de la FDA antes de su comercialización8.
Además, esta nueva ley crea una nueva sección en la FDCA –la 503 B– en donde un “compounder” puede convertirse en una “outsourcing facility”. Ésta se define como una instalación en una ubicación geográfica o dirección determinada que se dedica a la combinación o preparación de medicamentos estériles; ha elegido registrarse como una “outsourcing facility” y cumple con todos los requisitos de la sección 503 B9.
Esta nueva clasificación de establecimientos puede calificar para las exenciones mencionadas anteriormente en los puntos 2 y 3, pero no están exentos del cumplimiento de las Buenas Prácticas de Manufactura.
Las “outsourcing facilities” deben cumplir con: 1) Buenas Prácticas de Manufactura; 2) Inspecciones por parte de la FDA; y 3) Presentar informes de efectos adversos y proveerle información a la FDA acerca de los productos que componen, incluyendo una lista de todos los productos compuestos en los últimos seis meses y el origen de los principios activos utilizados10.
En síntesis, si los “compounders” se registran ante la FDA como “outsourcing facilities”; estos pueden fabricar medicamentos para hospitales y centros de salud –que estén sujetos a Buenas Prácticas de Manufactura y supervisión federal– medida que contribuiría a salvaguardar la salud de los pacientes y garantizarles medicamentos seguros y de calidad.
De lo contrario, es decir si un “compounder” decide no registrarse ante la FDA, aún puede calificar para las exenciones de la sección 503 A; de lo contrario estará sujeto a todos los requerimientos de la Ley Federal de Alimentos, Medicamentos y Cosméticos que deben cumplir los fabricantes convencionales de medicamentos.
La posición de los “compounders” es que estos cambios regulatorios han provocado que la FDA aplique normas mucho más estrictas, las cuales según su criterio, son injustas e innecesarias; poniendo en peligro una industria que provee a miles de pacientes de fármacos que en razón de sus particularidades no es posible acceder a través de los fabricantes comerciales. Además, alegan que algunas farmacias magistrales se han visto obligadas a recortar servicios debido a que no pueden cumplir con protocolos y estándares más rigurosos destinados a la producción de fármacos a gran escala.
Por otra parte, el escenario en Costa Rica es distinto por cuanto si bien es cierto existen establecimientos que preparan formulaciones magistrales contra receta del médico prescriptor, no existe venta de lotes de medicamentos al público.
Destaca el caso de PREMAFARMA; única farmacia en el país dedicada exclusivamente a las preparaciones magistrales quienes cuentan con licencia PCCA (Pharmaceutical Compounding Centers of America) lo cual garantiza el acatamiento estricto de los lineamientos establecidos en la Farmacopea Estadounidense –USP <797>– la cual hace referencia específicamente a los lineamientos, procedimientos y requisitos para la preparación de medicamentos estériles11.
No obstante, actualmente en Costa Rica existe un vacío regulatorio en la legislación en cuanto a la implementación de esta actividad. Si bien el Ministerio de Salud de Costa Rica es la entidad que regula que los establecimientos dedicados a la manufactura de medicamentos cumplan con Buenas Prácticas de Manufactura, las preparaciones magistrales no califican en esta categoría, por preparar medicamentos hechos a la medida de cada paciente según el criterio del prescriptor a cargo del tratamiento; por lo que no se fabrican ni manufacturan medicamentos.
De acuerdo con el Manual de Normas para la Habilitación de Farmacias del Ministerio de Salud, únicamente existen dos incisos que se refieren concretamente a las preparaciones magistrales, las cuales son sumamente básicas: “4.2.2.15 Cubículo aislado y separado para la formulación y preparación de magistrales, cuando sea pertinente” y “4.3.8 Debe contar con el equipo y los instrumentos necesarios de acuerdo a la complejidad de las preparaciones magistrales que se realicen según ANEXO B.”
El ANEXO B, al que nos refiere el inciso 4.3.8, indica que el equipo mínimo necesario para preparaciones en farmacias son: “Espátula, mortero, pistilo, probeta, goteros, balanza y pesas granataria, beaker.”
De lo anterior resulta evidente que existe una insuficiente regulación de los establecimientos que preparan formulaciones magistrales, la cual se limita a aspectos sumamente básicos y poco rigurosos; dejando de lado elementos de vital importancia como lo son las medidas de asepsia, condiciones de esterilidad y controles de calidad tanto del proceso de preparación como del producto final, entre otros.
Conclusiones
- Con base en la legislación vigente en los Estados Unidos de Norteamérica, los medicamentos “combinados” a la fecha no requieren ser aprobados previamente por la FDA y consecuentemente no existe un protocolo establecido para fiscalizar las preparaciones realizadas y la seguridad del producto final. Asimismo, tampoco se corrobora la calidad del proceso de preparación antes de que los medicamentos se comercialicen.
- Según la APha se entiende por “compounding” al acto de elaborar una preparación farmacéutica de acuerdo a especificaciones de una receta médica. A pesar de ello muchas veces en la práctica las farmacias magistrales manufacturan medicamentos. De manera que al elaborar lotes y venderlos a centros de salud, hacen funciones propias de un fabricante por lo que obligatoriamente deben cumplir con las Buenas Prácticas de Manufactura.
- Existe un vacío en la regulación de las farmacias magistrales debido a que no son farmacias tradicionales –supervisadas por el Estado–, ni tampoco fabricantes de medicamentos convencionales –supervisados por la FDA–; a pesar de que manufacturan medicamentos por volumen.
- La FDA debe ir más allá y atender la problemática existente ocasionada por la brecha regulatoria de las “compounding pharmacies”; tomando para ello las acciones correctivas necesarias que permitan establecer regulaciones de carácter obligatorio que coadyuven a proteger más puntualmente la salud de los pacientes que requieren sus servicios.
- Es necesario que la FDA asuma un rol de carácter más preventivo, y no que su supervisión y regulación se limite a responder a eventos que tienen serias repercusiones en la salud de pública.
- Si bien es cierto el Congreso Estadounidense creó una nueva clasificación de farmacias, llamada “Outsourcing Facilities”; al ser voluntario para las “compounding pharmacies” el optar por dicha clasificación, el someterse a sus disposiciones queda a su libre decisión, lo cual no contribuye con el propósito fundamental de salvaguardar la salud pública.
- En razón del notable incremento en los casos de negligencia en la manufactura de fármacos, específicamente por la inobservancia de las medidas de asepsia- por parte de las “compounding pharmacies”, resulta urgente que se regule en forma más rigurosa el funcionamiento de ese tipo de establecimientos, en donde predomine la salud de los pacientes sobre los costos de mantenimiento o intereses económicos.
- En los Estados Unidos de Norteamérica la norma de preparaciones magistrales establece que éstas deben prepararse para un paciente en particular de acuerdo a lo indicado por el médico prescriptor, al igual que en Costa Rica. Sin embargo, ciertas farmacias magistrales de ese país iniciaron la preparación de lotes de medicamentos para la venta al público, irrespetando la regulación establecida. En Costa Rica, existe una escasa regulación de dicha actividad, por lo que resulta imperativo que el Ministerio de Salud tome acciones que permitan garantizar la seguridad de las preparaciones magistrales –especialmente estériles e incluyendo todos los establecimientos que las preparen tanto privados como hospitalarios– y así proteger la salud pública.
Conflicto de intereses: Los autores declaran no tener conflictos de intereses.
Bibliografía
- Castillo, A. Estudio de la Formulación Magistral en Oficina de Farmacia desde 1985 a 2000 y su Legislación Correspondiente. Madrid: Universidad Complutense de Madrid; 2004. Disponible en: http://biblioteca. ucm.es/ tesis/far/ucm-t27966.pdf. Consultado el 28 de octubre, 2014.
- American Pharmacist Association. Disponible en: http://www.pharmacist.com/frequently-asked-questions-about-pharmaceutical-compounding. Consultado el 30 de octubre, 2014.
- Jaslow R. Texas compounding pharmacy recalls drugs after 15 infections. CBS News. 12 de agosto, 2013. Disponible en: http://www.cbsnews.com/news/texas-compounding-pharmacy-recalls-drugs-after-15-infections/. Consultado el 30 de octubre, 2014.
- Multistate outbreak of fungal meningitis and other infections. Food and Drug Administration. Disponible en: http://www.fda.gov/Drugs/DrugSafety/FungalMeningitis/default.htm. Consultado el 6 de noviembre, 2014.
- Brooks M. Texas compounding pharmacy recalls all sterile product. Medscape Medical News. 23 de diciembre, 2013. Disponible en: http://www.medscape.com/ viewarticle/818265. Consultado el 30 de octubre, 2014.
- Nuestra América News. Anuncian retiro del mercado de productos de farmacia de Texas por riesgo de infección. 13 de agosto 2013. Disponible en: http://www.nuestramericanews.com/consumidor-y-salud/anuncian-retiro-del-mercado-de-productos-de-farmacia-de-texas-por-riesgo-de-infeccion . Consultado el 29 de octubre, 2014.
- Eisler P, Schnaars C. Safety, sanitary problems prompt many drug recalls. USA Today. 10 de octubre, 2014. Disponible en: http://www.usatoday.com/story/news/ nation/2014/10/07/compounding-pharmacy-recalls-inspections-contamination/16472741/. Consultado el 6 de noviembre, 2014.
- Compounding Quality Act. Food and Drug Administration. Disponible en: http://www.fda.gov/drugs/GuidanceComplianceRegulatoryInformation/PharmacyCompounding/. Consultado el 5 de noviembre, 2014.
- Compounding and the FDA: Questions and Answers. Food and Drug Administration. Disponible en: http:// www.fda.gov/Drugs/GuidanceComplianceRegulatoryInformation/PharmacyCompounding/ucm339764.htm Consultado el 5 de noviembre, 2014.
- FDA Implementation of the Compounding Quality Act. Food and Drug Administration Disponible en: http:// www.fda.gov/Drugs/GuidanceComplianceRegulatoryInformation/PharmacyCompounding/ucm375804.htm. Consultado el 5 de noviembre, 2014.
- Entrevista: Dra Ana Violeta Ovares de la Peña. Regente Farmacéutica en Preparaciones Magistrales Farmacéuticas PREMAFARMA. 4 de diciembre, 2014.
____