Jiménez Madrid JH, Lucumí Moreno A
Investigador asociado y profesor titular. Laboratorio de Genética y Biología Molecular. Área de Ciencias Básicas. Facultad de Ciencias de la Salud. Universidad Libre. Seccional Cali (Colombia)
Fecha de recepción: 19/06/2019 – Fecha de aceptación: 03/09/2019
Correspondencia: Armando Lucumí Moreno – Carrera 15ª #19-70 Jamundí (Colombia)
arlumo3@gmail.com
____
RESUMEN
Objetivo: Determinar los daños citogenéticos generados por el uso de metrotrexate para tratamiento de artritis reumatoidea.
Metodología: Nuestra experiencia en el uso del metotrexate para sincronización celular como retardante del ciclo celular en fase “S” y su posterior inhibición por competencia con la bromodeoxiuridina en la obtención de cromosomas con bandas “R” de replicación, nos indujo a realizar este estudio citogenético utilizando linfocitos de sangre periférica cultivados en medio PB-Max durante 72 horas, provenientes de una paciente de 46 años de edad, con diagnóstico médico de artritis reumatoidea, tratada con metotrexate durante un mes.
Resultados: Clínicamente la paciente presentó inflamación de las articulaciones de los dedos de las manos y hombro izquierdo, con impedimento para flexionar el dedo anular de la mano derecha, además de dolor que impide el movimiento de las mismas articulaciones, en ocasiones y debido al dolor no se puede levantar sin ayuda de su lecho.
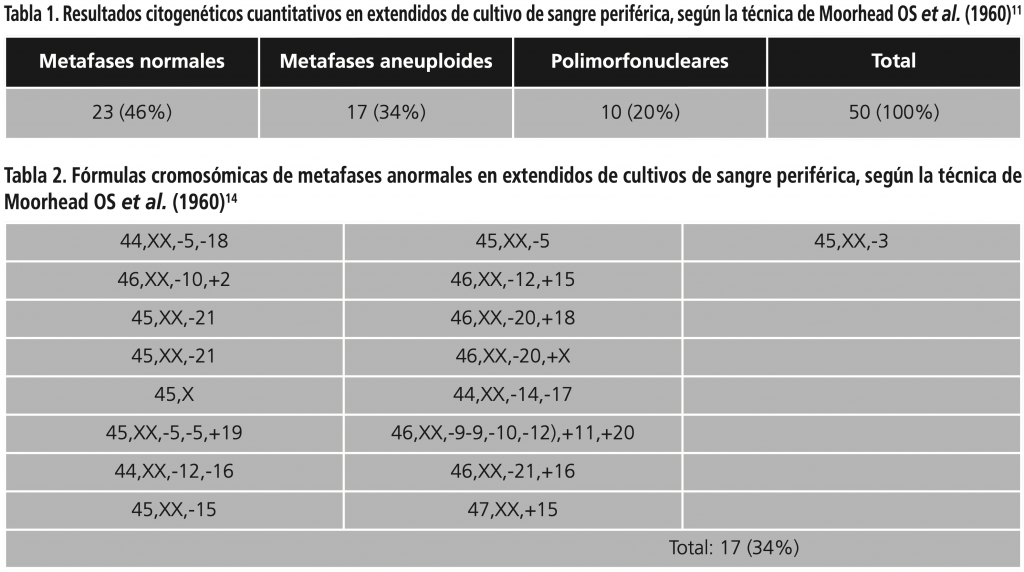
El resultado del análisis citogenético convencional, indicó que de 50 células analizadas, 23 (46%) presentaron cariotipo normal; 17 (34%) muestran aneuploidías de los diferentes grupos cromosómicos del cariotipo humano incluido el (X) y 10 (20%) de polimorfonucleares anormales.
Se discute la etiología génica del control molecular del ciclo celular, pensando en que los hallazgos mencionados, estarían más direccionados a los ciclos aberrantes de duplicación del centrosoma y del huso mitótico en general, así como a la alteración parcial de la síntesis del ADN y el ARN, causados probablemente por la acción del metotrexate, lo cual se ve reflejado en que los hallazgos aneuploídicos en el cariotipo son al azar, sin comprometer en particular cromosomas de un grupo determinado.
Conclusiones: Se sugiere a los médicos tratantes tener en cuenta alguna directriz en el protocolo terapéutico, relacionada con la cronicidad y el monitoreo citogenético durante el tratamiento con este medicamento.
Palabras clave: Artritis reumatoidea, metotrexate, aneuploidías, polimorfonucleares, centrosomas, proteosomas, microtúbulos, grupos cromosómicos.
Cytogenetic damage generated by the use of methotrexate for the treatment of rheumatoid arthritis
SUMMARY
Objective: To determine the cytogenetic damages generated by the use of methotrexate for the treatment of rheumatoid arthritis.
Methods: Our experience in the use of methotrexate for cell synchronization as a retarder of the “S” phase cell cycle and its subsequent inhibition by competition with bromodeoxyuridine in obtaining chromosomes with “R” bands of replication, induced us to perform this cytogenetic study using peripheral blood lymphocytes cultured in PB-Max medium for 72 hours, from a 46-year-old patient, with a medical diagnosis of rheumatoid arthritis, treated with methotrexate for one month.
Results: Clinically the patient presented inflammation articulations of left hand fingers and left shoulder, with impediment flex of the annular finger right hand, besides she has pain that prevent the movement of the same articulations, in occasions and because of this problem she cannot get up without help.
The conventionally cytogenetic analysis, shows that of the 50 analyzed cells, 23 (46%) presents normal karyotype; 17 (34%) presents aneuploidies of the chromosomic different groups including de (X) chromosome, and 10 (20%) of abnormal polymorphonuclear.
We discuss the genetic etiology of the biology cellular control, keep in mind that mentioned findings are preferentially directed due to aberrant cycles of centrosome duplication and mitotic spindle in general, as well as the partial disturbance of the ADN and ARN synthesis, probably caused by methotrexate action, this fact that is reflected in the aneuploidy findings in the karyotype are to random, without compromise of any particular chromosome of the determined group.
Conclusions: It is suggested to the treating doctor should really take implement some rule in the therapeutic protocol of corresponding management, relationed with the chronicity and cytogenetic monitoring during the treatment with this medicine.
Key Words: Rheumatoid arthritis, methotrexate, aneuploidies, polymorphonuclear, centrosome, proteasome, microtubules, chromosomic group.
____
ANTECEDENTES
La proliferación celular es el resultado de la activación del ciclo celular y la entrada en él no es un proceso autónomo, sino que requiere de la puesta en marcha de una serie de mecanismos específicos. Así, Smith KA (1990)1 establece que existe también una regulación extracelular liderada por proteínas que se unen a receptores de membrana con actividad de tirosina-quinasa. Bos JL (1997)2 agrega que las proteínas codificadas por el gen RAS (11p15.5) se localizan en la cara interna de la membrana celular y se diferencian entre sí principalmente por la secuencia aminoacídica de su región hipervariable c-terminal. Rodriguez Fragoso L et al. (2004)3 publicaron que en un ciclo la célula se divide en dos y cada una de las células formadas cuenta con los elementos estructurales y funcionales que le permiten repetir el proceso de crecimiento y división. Sin embargo, para que esto suceda se necesita la replicación del genoma, la distribución equitativa de la masa celular y una segregación precisa de los cromosomas. Estos autores refirieron además que las células normales tienen la capacidad de interrumpir el ciclo celular cuando ocurre un daño y se afecta la maquinaria bio- química o la información genética involucrada en el ciclo, tales interrupciones pueden ocurrir en las fases G1, S, G2 y M.
Visser K et al. (2009)4 establecieron que el metotrexate es el fármaco modificador de la enfermedad más usado en la ar- tritis reumatoidea y el de primera elección. Restrepo LF et al. (2016)5, publican que el metotrexate es un análogo del ácido fólico, diseñado originalmente para inhibir la actividad de la enzima dihidrofolato reductasa encargada de convertir dihidrofolatos a tetrahidrofolatos, implicados en la transferencia de un átomo de carbono en las vías metabólicas intracelulares, tales como la síntesis de novo de purinas, pirimidinas y poliaminas, así como también de la transmetilación de fosfolípidos y proteínas. Este ácido débil tenía además propiedades inmunosupresoras y antiinflamatorias. Respecto a la actividad in- munosupresora, inhibía la proliferación de linfocitos CD3-CD4 y otras células inmunocompetentes, como los monocitos, ma- crófagos y neutrófilos polimorfonucleares.El metotrexate también modula citosinas como interleucinas 4 (IL-4), e interleucinas 10 (IL-10), interferón alfa y la interleucina 2 (IL-2), ge- nerando acciones antiinflamatorias e inmunoreguladoras. Jensen MK, Nyfors A (1979)6 informaron que estudios citogenéticos realizados a 22 pacientes tratados con metotrexate, en algunos se estudiaron las metafases tanto de médula ósea como de sangre periférica. En las preparaciones de médula ósea se observó un aumento del número de aberraciones cromosómicas estructurales, mientras no se observaron anomalías en las metafases de sangre periférica.
Pincus T (1995)7 publicó que la artritis reumatoidea era una enfermedad crónica de origen autoinmune, caracterizada por la inflamación de múltiples articulaciones, que con el tiempo llevaba a grados variables de destrucción del cartílago articular y del hueso yuxtaarticular, generando defor- midad progresiva y con ello discapacidad, alteración de la calidad de vida y disminución de la expectativa de vida. Weyand CM et al. (1992)8 habían asociado la artritis con la presencia de HLA-DR4 (6p21.32) y/o epítopo reumatoide a un daño estructural mayor y Weyand CM et al. (1995)9 afirmaron que la homozigosidad para el epítopo, especialmente en los alelos DR0401 y DR0404 se asocia con una gravedad mayor de la enfermedad tanto articular como extraarticular. Harrison B et al. (1996)10 establecieron que la participación de un número importante de articulaciones, se relacionaría con una evolución más grave; por el contrario aquellos pacientes con pocas articulaciones inflamadas y de pequeño tamaño tendrían mejor pronóstico.
En nuestro Laboratorio de Biología Molecular y Genética prestamos el servicio de diagnóstico y consejería genética en problemas especiales derivados de la interconsulta con los departamentos de Medicina Interna, Gineco-obstetricia y Pediatría. Este caso motivó nuestra curiosidad científica debido a que en la labor rutinaria para la obtención de bandas “R“ de replicación utilizamos el metotrexate para sincronización celular como retardante del ciclo celular en fase “S” y su posterior inhibición por competencia con la bromodeoxiuridina, lo cual nos indujo a postular que un alargamiento en términos de tiempo de la mencionada fase, como es el caso de esta paciente, podría reflejarse en daños citogenéticos.
METODOLOGÍA
Datos clínicos
Mujer de 46 años de edad, con diagnóstico médico de artritis reumatoidea quien presenta inflamación en las articulaciones de los dedos de las manos y del hombro izquierdo, con impedimento para flexionar el dedo anular de la mano derecha, además de dolor que impide el movimiento de las mismas. Relata también que en ocasiones debido al dolor, no se puede levantar sin ayuda de su lecho. Como tratamiento médico previo al metotrexate recibió acetaminofen (analgésico), naproxen (antiinflamatorio), cloroquina (immunimodulador) y ácido fólico (vitamina B9 hidrosoluble). Suspendida la medicación anterior, recibió metotrexate de 25 mg, cada 8 dias, por vía intramuscular durante 1 mes, el cual fue suspendido porque era muy “horrible”, le producía mucho malestar y deseos de vomitar, y ello la llevó a un estado parcial de inapetencia. También recibió ácido fólico de 1 mg por día; sulfasalasina (analgésico y antiinlamatorio) de 250 mg por día y acetaminofen de 500 mg por día.
Estudio citogenético
Se realizó el cultivo de sangre periférica, SEGÚN la técnica de Moorhead OS et al. (1960)11, con medio PB-MAX, se analiza- ron 50 NÚCLEOS en división directamente al microscopio Zeizz Axioscop 40, 10×100, y teñidos con colorante de Giemsa.
Cariotipo
Los cariotipos se realizaron siguiendo los parámetros establecidos en la Conferencia de Chicago 1966.
RESULTADOS
Estudio citogenético
De las 50 células linfoides analizadas, 23 metafases presen- taron un número modal de 46 cromosomas, fórmula 46,XX; 17 metafases con diferentes aneuploidías y 10 presentaron anomalías polimorfonucleares que incluían micronúcleo, binúcleo y trinúcleo (Tabla 1).
Cariotipos y aneuploidías
Con respecto a las 17 (34%) metafases, con aneuploidías en los diferentes grupos cromosómicos que constituyen el cariotipo humano, se encontraron diferentes variantes, especialmente hipodisomías en el grupo A(-3); B(-5); C(-9,-10,-12); D(-14,-15); E(-16,-17,-18); F(-20), hiperdisomías en el grupo A(+2); C(+11); D(+15); E(+16,+18); F(+19,+20); G(+21) y monosomía X (Tabla 2 y Figura 1).
Los cariotipos que aparecen en la Figura 1 son una muestra de los diferentes hallazgos citogénticos aneuploidicos en cada uno de los grupos cromosómicos (Cariotipos No: 1, 2, 3, 4).

Formas polimorfonucleares
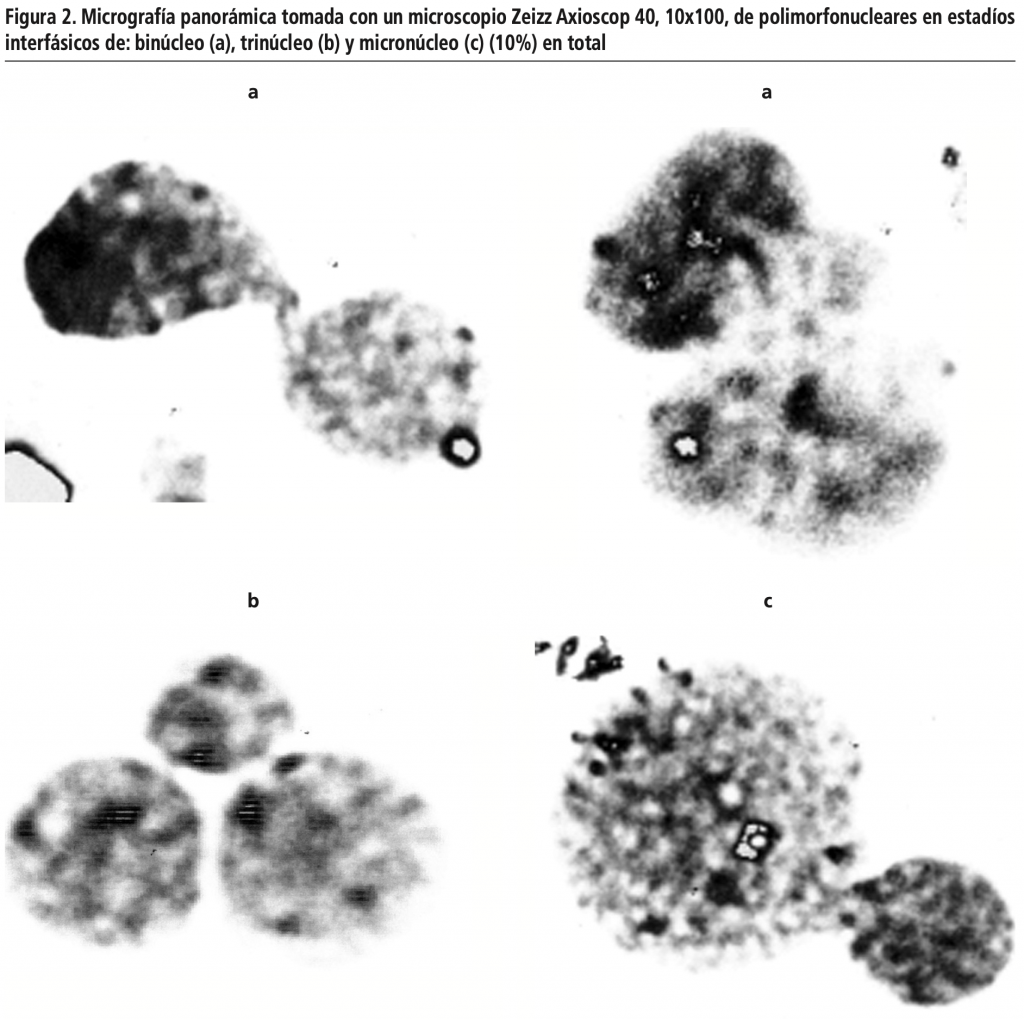
Se encontraron diferentes anomalías a nivel de los núcleos celulares como fueron núcleos binucleadas, trinucleadas y con micronúcleos para un total de anomalías de núcleos interfásicos de un 20% (Figura 2).
Consideraciones éticas
El estudio fue realizado en cumplimiento con la Declaración de Helsinki y se sometió para aprobación por el Comité de Ética Humana de la Universidad Libre Seccional Cali. La persona donante de las células linfoides para el estudio leyó y firmó el consentimiento informado antes de ser incluida en el estudio.
DISCUSIÓN
Mitelman F (1995)12, definió pérdida al azar de un cromo- soma, como la pérdida del mismo cromosoma, en no más de dos metafases. La pérdida de un cromosoma particular ha sido considerada altamente significativa si es encontrada en tres o más células. La American College of Medical Genetics. Standars and Guidelines (1993)13, establecieron que en un análisis cromosómico de rutina se deben contar veinte metafases y cariotipar dos de ellas. Nosotros analizamos 50 células linfoides y encontramos 17 (34%) metafases aneuplóidicas y 10 (20%) de polimorfonucleares anormales, lo que da un total de células con núcleos anormales en división del (54%), resultado altamente significativo.
Altamirano EM et al. (2004)14, mencionaron que la depleción de folatos reducidos (FH4), que ocasionan la inhibición de la enzima DFR (dihidrofolato reductasa), determina una interrupción de la síntesis del ADN y ARN. Al mismo tiempo, interfería con la capacidad celular para reparar los daños de las cadenas de ADN, llevando este mecanismo a una ruptura de las mismas. Oosteron N et al. (2018)15 hipotetizaron que el metrotexate inhibe la metilación del ADN, es decir, impide su transcripción. Shaikh N et al. (2018)16, informaron teniendo como norte sus propias vivencias ca- suísticas y con el ánimo de crear conciencia, que la toxicidad del metotrexate podría ser fatal. Relacionado con las drogas que intervienen en la síntesis y daño del ADN y las que in- hiben la función del huso mitótico y los microtúbulos, se hace necesario tener en cuenta las apreciaciones de los diferentes autores así, Vogt E et al. (2008)17, indicaron que el ensamblaje del punto de control del huso monitorea la unión de los microtúbulos y la tensión sobre los cromosomas en mitosis y meiosis II. Dicho ensamblaje representa un mecanismo de control que detiene las células en fase M, en presencia de un cromosoma suelto asociado con acumula- ción de componentes de puntos de control, en particular Mad20 (5q14.3) en los quinetocoros. Un complejo entre el factor ciclosoma (APC/C) promotor de anafase y su proteína accesoria cdc/20 (1p34.2) y proteínas de la SAC patrocinan un APC inactivo, usualmente hasta que los cromosomas están propiamente ensamblados en el ecuador del huso bajo tensión de las fibras del huso. Una vez liberado de SAC, el APC/C puede impactar proteínas como la ciclina B y la securina para su degradación por el proteosoma. Klebig C et al. (2009)18, postularon que el gen Bub1 (2q13) tiene dos funciones diferentes durante la mitosis, por un lado es esen- cial en la señalización del punto de control del huso y por el otro en el correcto alineamiento de los cromosomas en la placa ecuatorial. Tooley J, Stukenberg PT (2011)19, afirmaron que el complejo NDc80, es una maquinaria proteica grande, ubicada en el corazón del quinetocoro, que segu- ramente segrega los cromosomas durante la división celular. De Boer RM et al. (2011)20, indicaron que las mutaciones de los genes BUB1 Y BUB3 causan mosaicos aneuploidicos diversificados. Piloto Ferrer J, Sanchez-Lamart A (2016)21, escribieron una adaptación del artículo publicado por Bharadwaj R, Yu H (2004)22, que un control severo de la mitosis garantiza una segregación exacta de las cromátides hermanas en la división celular y que las células eucarióticas poseen mecanismos sofisticados para supervisar la progresión de la mitosis, para prevenir la no disyunción cromosómica que trae como resultado aneuploidías, poliploidías o células hijas binucleadas. Esta vía de transducción de señales es conocida como punto de control de ensamblaje del huso (SAC) que inhibe la entrada en anafase hasta que los quinetocoros están unidos adecuadamente a los microtúbulos del huso y los cromosomas son alineados correctamente en la placa metafásica. Mencionaron además que cuando esto no ocurre, SAC es activado por el reclutamiento de Mad2, Bub3 y BubR1, ocasionando la inhibición del complejo promotor de anafase (APC), una ubiquitín ligasa E3, que marca la degradación proteosomal. En el estudio en mención se afirmó también, que los sustratos de APC son la securina que activa la separasa. La separasa rompe la subunidad Scc1 de la cohesina, permitiendo la segregación cromosómica, en respuesta las cromátides hermanas unidas inadecuada- mente al huso mitótico promueven el complejo de proteínas promotoras de SAC, que inhiben la actividad del APC permitiendo la estabilización de la securina, preservando la cohesión de las cromátides hermanas, retrasando así la en- trada en anafase mitótica. Recientemente Vitiello E et al. (2019)23 indican que la presencia de un número aberrante de centriolos es una causa reconocida de aneuploidías, por lo tanto, la duplicación del centriolo debe estar estrictamente regulada. Se ha propuesto que la separación del centriolo limita la duplicación del centrosoma. En su trabajo proponen que las fuerzas generadas por actina regulan la separación del centriolo, ellos pudieron demostrar que los arreglos precisos de fuerza de miosina controlan la direc- ción, la distancia y el tiempo de separación del centriolo. En consecuencia, la inhibición de la contractilidad de acto-miosina altera la separación del centriolo y les permitió sugerir que las fuerzas de acto-miosina podrían actuar en mecanismos fundamentales de prevención de aneuploidías.
CONCLUSIONES
El hecho de no haber encontrado en este estudio de manera constante daños cromosómicos estructurales en metafase, podría eventualmente indicar que la acción del metotrexate está más direccionada a los ciclos aberrantes de duplicación del centrosoma que dan como resultado más de cuatro centriolos y del huso mitótico en general, así como a la alteración parcial de la síntesis del ADN y el ARN. Evidentemente, los genes que controlan estrictamente la división celular mitótica cuando por agresiones medio ambientales en núcleos en interfase y en división, como es el presente caso, pueden fallar en el proceso de contactar mecánicamente los centrómeros por parte de los microtúbulos (Mts) del huso acromático, en la alineación de los cromosomas en la placa ecuatorial y en la segregación exacta durante la anafase de las cromátides hermanas, originando de esa manera aneuploidías de los diferentes pares cromosómicos tanto de los autosomas como del cromosoma X. El Colegio Americano de Reumatología (2016)24 ha propuesto recomendaciones como el monitoreo del cuadro hematológico completo. Ellos han sugerido que pacientes tratados con metotrexate necesitaban pruebas regulares de laboratorio para monitorear la función renal, la función hepática y el conteo celular sanguíneo. Además, concluyeron que el metotrexate aunque es una droga empleada frecuentemente en el tratamiento de la artritis inflamatoria, aun empleada en dosis bajas, puede ser fatal en presencia de una insuficiencia renal. Finalmente pensamos que los médicos tratantes de esta patología deben tener en cuenta en el protocolo de manejo correspondiente, la cronicidad del tratamiento en razón de los hallazgos fenotípicos clínicos que acompañan su uso y un monitoreo citogenético dirigido a prevenir mutaciones que impidan el funcionamiento normal del ciclo celular.
Debido a lo anterior aconsejamos a los médicos tratantes de esta patología tener en cuenta en el protocolo de manejo correspondiente, la cronicidad del tratamiento en razón de los hallazgos fenotípicos clínicos que acompañan su uso, la terapéutica del medicamento, las alteraciones citogenéticas mencionadas y retrotrayendo nuestros resultados, un monitoreo que involucre entre 25-30 días después de suspendido el tratamiento, dado que la vida media del metotrexate está entre 8-15 horas; que el 80-90% se elimina después de 24 horas y el 10-20% restante se elimina entre 1-2% diarios y un tiempo de reposo celular entre 10-15 días, lo cual podría ser suficiente para la normalización del ciclo celular. Reiniciar inmediatamente el tratamiento antes que reaparezcan los efectos fenotípicos causados por el metotrexate.
Agradecimientos: Los autores agradecen al Centro de Investigaciones en Salud de la Facultad de Salud de Universidad Libre Seccional Cali por la financiación de este trabajo y a la Sra. Eddy Johana Diaz Mellizo por su valiosa colabo- ración como soporte técnico.
Conflicto de intereses: Los autores declaran no tener conflicto de intereses.
BIBLIOGRAFÍA
1. Smith KA. Interleukin-2. Scientific American. 1990;262:50-57.
2. Bos JH. Ras-like GTasas. Biochim Byophys Acta. 1997;1333(2):M19-M31.
3. Rodriguez Fragoso L, Hernández Baltasar E, Reyes Esparza JA. El ciclo ce- lular: características, regulación e importancia en el cáncer. Biotecnología apli- cada. 2004;21:606.
4. Visser k, Katchamart W, Loza E, Martínez-López JA, Salliot C, Trudeau J, et al. Multinational evidence-based recomendations for the use of methotrexate in rheumatic disorders with a focus on rheumatoid arthritis integrating siste- matic literatura research and expert opinión of a broad international panel of rheumatologists in the 3B iniciative. Ann Rhreum Dis. 2009;68:1086-1089.
5. Restrepo LF, Giraldo R, Londoño J, Pinzón C, Cortes A, et al. Farmacogenética del metotrexate en artritis reumatoidea. Revisión sistemátic. Revista Colom- biana de Reumatología. 2016;23(2):102-114.
6. Jensen MK, Nyfors A. Cytogenetic effects of MT on human cells in vivo: compa- rison between results obtained by chromosome studies on bone-marrow cells and blood lymphocytes and by the micronucleus test. Mutat Res. 1979; 64(5):339-343.
7. Pincus D. Assessment of long-term outcomes of rheumatoid arthritis. How choices of measures and study designs may lead to apparently different con- clusions. Rheum Dis Clin North Am. 1995;21:619-654.
8. Weyand CM, Hicock KC, Conn DL, Goronzy JJ, et al. The influence of HLA- DRB1 genes on disease severity in rhreumatoid arthritis. Ann Inter Med. 1992; 117:801-806.
9. Weyand CM, McCarthy TG, Goronzy JJ, et al. Correlation between disease phenotype and genetic heterogeneity in rheumatic arthritis. J Clin Invest. 1995; 95;2120-2126.
10. Harrison B, Symmons DP, Brennan P, Barret T, Silman AJ. Natural remission in inflamatory polyarthritis issues of definition and prediction. Br J Rheumatol. 1996;35:1096-1001.
11. Moorhead OS, Nowell PC, Mellman WJ, Battips DM, Hungerford DA. Chro- mosomes preparations of lynfocytes cultured from human peripheral blood. Exptl Cell Res. 1960;20:613-616.
12. Mitelman F. An international system for human citogenetic nomenclature. Bazel, Switzerland: S. Karger. 1995.
13. American College of Medical Genetics. Standars and Guidelines: Clinical Genetics Laboratories. Bethesda, MD: American College of Medical Genetics. 1993.
14. Altamirano EM, Dreizzen E, Corrons FJ, Gonzalez PH, Spinelli OM. Apoptosis: el metotrexate y sus efectos como agente inductor. Revista de la Facultad de Ciencias Médicas. 2004;1(2):42-46.
15. Oosterom N, Griffioen P, den Hoed MAH, Pleters R, de Jonge R, Tissing WJE, et al. Global methylation in relation to methothrexate-induced oral mucositis in children with acute Lymphoblastic leukemia. PLoSONE. 2018;13(7): Eo199574.
16. Shaikh N, Sardar M, Raj R, Jariwala P. A rapidly fatal case of low-dose me- thothrexate toxicity. Case repor in Medicine. 2018;(2):1-4.
17. Vogt E, Kirsch-Volders M, Parry J, Eichenlaub-Ritter U. Spindle phormation, chromosome segregation and the spindle checkpoint in mammalian oocytes, and susceptibility to meiotic error. Mutat Res. 2008;12:651(1-2):14-29.
18. Klebig C, Koringth D, Meraldi P. BUB1 regulates chromosome segregation in a kinetochore-independent manner. J Cell Biol. 2009;(5):841-858.
19. Tooley J, Stukenberg PT. the Ndc80 complex: integrating kinetochore s many movements. Chromosome Res. 2011;19(3):377-391.
20. De Boer RM, Van Kessel AG, Weren RDA, Ligtenberg MJL, Smeets D, Fu Y, et al. Germine mutations in the spindle assembly check point genes BUB1 and BUB3 are risk factors for colorectal cancer. Gastroenterology. 2013;145:544-547.
21. Piloto Ferrer J, Sánchez-Lamart A. Blancos mitóticos de drogas naturales y nuevas estrategias para la terapia anticáncer. Revista Cubana de Ciencias Bio- lógicas. 2016;4(3):3-15.
22. Bharadwaj R, Yu H. The spindle checkpoint aneuploidy and cáncer. Onco- gene. 2004;23(11):2016-2027.
23. Vitiello E, Moreau P, Nunes V, Mettouchi A, Maiato H, Ferreira JC, et al. Acto- myosin force organization modulates centriole separation and PLK4 recruitment to ensure centriole fidelity. Nat Commun. 2019;10(1):52. Doi: 10.1038/s41467- 018-07965-6.
24. Artritis Reumatoide. Guía Práctica Clínica (GPC). 2016. Ministerio de Salud Pública del Ecuador. Dirección Nacional de Normatización ISBN 9789942220974.
____