Alonso Domínguez MT, Alonso Herreros JM, Abellón Ruiz J
Servicio de Farmacia. Hospital General Universitario Los Arcos del Mar Menor. Pozo Aledo. Murcia (España)
Fecha de recepción: 11/10/2018 – Fecha de aceptación: 27/12/2018
Correspondencia
Mª Teresa Alonso Domínguez – Hospital General Universitario Los Arcos del Mar Menor (Servicio de Farmacia) – Paraje Torre Octavio, 54 – 30739 Pozo Aledo, Murcia (España)
Teresaldo87@gmail.com
____
Resumen
Objetivo: Estudiar los distintos desarrollos legislativos por las CCAA en referencia a las normas de correcta fabricación (RD 175/2001) y analizarlos desde la perspectiva de la Farmacia Hospitalaria; seguridad del paciente y la eficiencia del sistema.
Material y métodos: Se realizó una búsqueda de la legislación autonómica del desarrollo del RD 175/2001 en las bases de datos “El Derecho”, “Difusión Jurídica” e “Indret”. Para aquellas instrucciones que no aparecían en estos recursos bibliográficos se solicitó información a los Colegios Oficiales de Farmacéuticos, a las Sociedades Autonómicas de Farmacia Hospitalaria y a las diversas vocalías autonómicas de la Sociedad Española de Farmacia Hospitalaria.
Resultados: El RD 175/2001 ha sido desarrollado con distinto rango legal en cada comunidad. Asturias, Andalucía, Baleares, Canarias, Madrid, y Valencia desarrollaron decretos; en Castilla-La Mancha, Castilla y León, Navarra, Galicia y Aragón, se aprobaron órdenes de las correspondientes Consejerías de Sanidad y en Murcia y La Rioja, emitieron resoluciones. Estas normas presentan importantes divergencias en aspectos técnicos como los requisitos de los locales, los niveles de elaboración o las normas de fabricación a terceros.
Conclusiones: El RD175/2001 supuso un cambio importante en las funciones básicas de las oficinas de farmacia y servicios de farmacia, incorporando un punto interesante como es la elaboración a terceros. A pesar de ello, el distinto desarrollo de cada CCAA, ha generado la no homogenización de las normas de correcta fabricación, lo que puede afectar a la equidad y a la calidad asistencial.
Palabras clave: Fórmulas magistrales, normas correcta elaboración, legislación.
____
Autonomic development of the rules of correct manufacture and its influence in the Hospital Pharmacy
Summary
Objective: To study the different regulatory developments by the Autonomous Communities in reference to the Good Manufacturing Practices (RD 175/2001) and analyze them from the perspective of the Hospital Pharmacy; patient safety and system efficiency.
Material and methods: A search of the autonomous development legislation of RD 175/2001 was made in the databases «El Derecho», «Difusión Jurídica» and «Indret». For those instructions that did not appear in these bibliographic resources, information was requested from the Pharmaceutical Societies, the local Societies of Hospital Pharmacy and the various autonomic spokesmen of the Spanish Society of Hospital Pharmacy.
Results: RD 175/2001 has been developed with different legal rank in every community. Asturias, Andalusia, the Balearic Islands, the Canary Islands, Madrid and Valencia have developed decrees; in Castilla-La Mancha, Castilla y León, Navarra, Galicia and Aragón, ordenances were approved by the respective Autonomous Community Government while in Murcia and La Rioja were issued curt ordenance. These standards show important divergences in technical aspects such as the requirements of the premises, the levels of elaboration or the manufacturing rules to third parties.
Conclusions: RD175/2001 represented an important change in the basic functions of the community pharmacy and Hospital Pharmacy departments, incorporating an interesting point such as elaboration to third parties. In spite of this, the different development of each Autonomous Community has generated the non-homogenization of the Good Manufacturing Practices which may affect equity and quality of care.
Key Words: Individualized compounded formulation, good manufacturing practices, legislation.
____
Introducción
Los requisitos sanitarios que deben cumplir las fórmulas magistrales y los preparados oficinales que se elaboren en las oficinas y servicios de farmacias que dispongan de los medios necesarios fueron establecidos en los artículos 35 y 36 de la Ley 25/19901 del Medicamento. En el artículo 55 de esta misma Ley, y en el artículo 1 del Real Decreto 294/19952, por el que se regula la Real Farmacopea Española, el Formulario Nacional y los órganos consultivos del Ministerio de Sanidad y Consumo en esta materia, definen el Formulario Nacional como el libro oficial que contiene, en forma de monografías, las fórmulas magistrales tipificadas y los preparados oficinales reconocidos como medicamentos, sus categorías, indicaciones y materias primas que intervienen en su composición o preparación, así como las normas de correcta elaboración y control de aquéllos. La primera edición del Formulario Nacional fue aprobada por Orden SCO/3262/20033, 18 noviembre, por la que se aprueba el Formulario Nacional.
Posteriormente la Ley 24/20014 permitió la posibilidad, cuando no se dispusieran de los medios necesarios, de encomendar a terceros, la elaboración y/o control, de una o varias fases, de fórmulas magistrales o preparados oficinales, tal y como se cita en el artículo 35.2:
“Las fórmulas magistrales se elaborarán en las oficinas de farmacia y servicios farmacéuticos legalmente establecidos que dispongan de los medios necesarios para su preparación de acuerdo con las exigencias establecidas en el Formulario Nacional. No obstante, las oficinas de farmacia y servicios farmacéuticos que no dispongan de los medios necesarios, excepcionalmente y sin perjuicio de lo establecido en el artículo 76.2, podrán encomendar a una entidad legalmente autorizada para tal fin por la Administración Sanitaria competente, la realización de una o varias fases de la elaboración y/o control de fórmulas magistrales”.
Todos estos aspectos se mantienen en la Ley de Garantías y Uso Racional de los Medicamentos y Productos Sanitarios aprobado por Real Decreto Legislativo 1/20155, de 24 de julio que dispone en su artículo 42 que las fórmulas magistrales se elaborarán en las oficinas de farmacia y servicios farmacéuticos legalmente establecidos que dispongan de los medios necesarios para su preparación de acuerdo con las exigencias establecidas en el Formulario Nacional. No obstante, las oficinas de farmacia y servicios farmacéuticos que no dispongan de los medios necesarios, excepcionalmente y sin perjuicio de lo establecido en el artículo 66.2, podrán encomendar a una entidad de las previstas en esta Ley, autorizada por la Administración sanitaria competente, la realización de una o varias fases de la elaboración y/o control de fórmulas magistrales.
Las normas de correcta elaboración y control de la calidad de las fórmulas magistrales y preparados oficinales fueron aprobados por el Real Decreto 175/20016, el 23 de febrero. En el mismo, se desarrollan los artículos mencionados anteriormente, estableciendo requisitos específicos que deben cumplir las oficinas de farmacia y los servicios farmacéuticos, en cuanto al personal, locales, materias primas, utillajes, materiales de acondicionamiento, y documentación, de tal forma que se garantice la calidad de la elaboración y dispensación de estos preparados.
Este RD ha sido desarrollado por las diferentes CCAA en función de sus competencias en materia de ordenación farmacéutica, generando diferencias entre los requisitos exigidos para estas preparaciones.
Por otro lado, desde la publicación del RD 175/2001 hasta la fecha se han publicado al menos dos documentos a nivel nacional que tienen influencia directa en la actividad de los laboratorios de los servicios de Farmacia Hospitalaria: La Guía de Buenas Prácticas (GBPP)7 y el Documento sobre Medicamentos Peligrosos (MPP) del INSHT8. Ambos se desarrollaron siguiendo documentos y normas internacionales9,10 con una clara intención de armonización en los procesos de elaboración de medicamentos (PIC/S)11.
Objetivos
Estudiar los distintos desarrollos legislativos por las CCAA en referencia al RD 175/2001 e intentar analizarlos desde la perspectiva de la Farmacia Hospitalaria, la seguridad del paciente y la eficiencia del sistema.
Material y métodos
Se realizó una búsqueda de la legislación autonómica referente al desarrollo del RD 175/2001 en las bases de datos “El Derecho”, “Difusión Jurídica” e “Indret”. Para aquellas instrucciones que no aparecían en estos recursos bibliográficos se solicitó información a los Colegios Oficiales de Farmacéuticos, a las Sociedades Autonómicas de Farmacia Hospitalaria y a las diversas vocalías autonómicas de la SEFH.
Resultados
El RD 175/2001 ha sido desarrollado con distinto rango legal en cada comunidad: decretos, órdenes o simples resoluciones.
Las comunidades de Asturias12, Andalucía13, Baleares14, Canarias15, Madrid16, y Valencia17 desarrollaron decretos para su desarrollo a nivel autonómico. En Castilla-La Mancha18, Castilla y León19, Navarra20, Galicia21 y Aragón22, se aprobaron ordenes de las correspondientes Consejerías de Sanidad por la que se regula la aplicación de normas contenidas en el RD 175/2001. Por último, en la Región de Murcia23 y La Rioja24, emitieron sendas resoluciones, para aprobar el protocolo de aplicación del mismo.
Dado que las exigencias en locales, utillaje y procesos de elaboración, se establecen en función de la forma galénica y tipo de preparación a elaborar, las CCAA consideraron adecuado establecer niveles de elaboración para acreditar a los servicios farmacéuticos y oficinas de farmacia.
Tal y como se refleja en la Tabla 1, estos niveles oscilan desde el nivel más sencillo de elaboración, como las fórmulas tópicas, el proceso de etiquetado o incluso, la no elaboración, hasta el más complejo, con la elaboración de estériles y/o liofilizados. A excepción de Canarias, donde incluyen en un mismo nivel 2, de máxima elaboración, los papelillos, obleas, pastas con las tisanas vegetales. Un caso similar ocurre en Baleares, donde el nivel 4 engloba la compleja elaboración de preparados estériles junto a la preparación de gránulos homeopáticos.
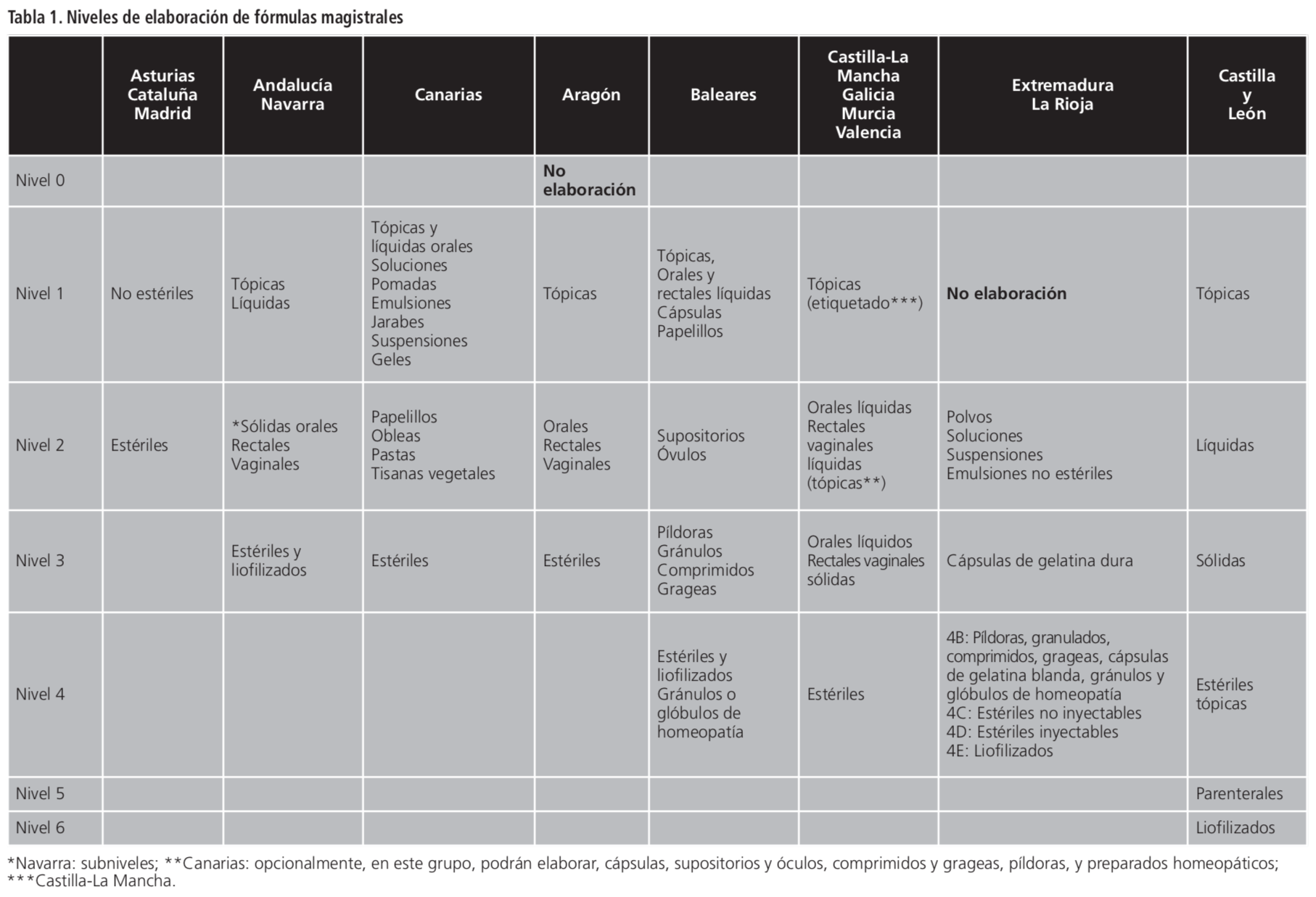
En las comunidades de Aragón, Castilla-La Mancha, Extremadura, Murcia, Navarra y Valencia los niveles de acreditación son acumulativos. La inclusión en un determinado nivel de acreditación implica el cumplimiento de los requisitos establecidos para los niveles anteriores. En el caso de La Rioja, a excepción de los subniveles 4, los niveles del 1 al 3 son acumulativos. De este modo las oficinas de farmacia y servicios farmacéuticos que se incluyan en uno de ellos, deberán cumplir los requisitos exigibles para los niveles de elaboración, pero no los requisitos establecidos para el resto de los subniveles que pertenezcan a su propio nivel. En Castilla-La Mancha, la adscripción de los niveles 1 y 2 serán completos; pero en los niveles 3 y 4 se podrá optar por la elaboración de una o más formas farmacéuticas dentro del mismo nivel.
En Navarra, dentro del nivel 2, encontramos distintos subniveles: 2.1: papelillos, 2.2: cápsulas, 2.3: supositorios, 2.4: óvulos, 2.5: píldoras y gránulos, 2.6: comprimidos, 2:7 grageas y 2.8: gránulos o glóbulos de homeopatía. Dentro del nivel 2, requerirán nueva acreditación los cambios hacia un subnivel superior al 2.4. Para el resto de cambios de subniveles, sólo será necesario efectuar una comunicación al Departamento de Salud.
En Canarias, dentro del nivel 2, las oficinas de farmacia y servicios farmacéuticos podrán elaborar, además de las formas farmacéuticas antes señaladas, fórmulas magistrales y preparados oficinales en las siguientes formas farmacéuticas: cápsulas; supositorios y óvulos; comprimidos y grageas; píldoras y preparados homeopáticos.
No todas las comunidades tienen obligada elaboración de fórmulas. En el caso de Baleares, Murcia y Valencia tienen como mínimo, la obligación de adscribirse al nivel 1. Excepcionalmente, en Valencia, las oficinas de farmacia únicas de municipios de menos de 1.500 habitantes, o de superficie igual o inferior a 50 metros cuadrados, deberán realizar inexcusablemente, como mínimo, las operaciones de etiquetado. En el caso de Castilla-La Mancha, aquellas oficinas de farmacia o servicios farmacéuticos que no soliciten su adscripción a un nivel se entenderá que desean adscribirse al nivel 1 (etiquetado).
En Andalucía, se podrán autorizar uno o varios de los niveles previstos. Asimismo, en las autorizaciones del nivel 2 y 3 se podrán incluir alguna o todas las formas farmacéuticas. La acreditación en el nivel 0 (no elaboración) se realizará por simple comunicación al Servicio Provincial de Salud y Consumo de la provincia en la que se encuentre ubicada la oficina de farmacia o servicio de farmacia. Para los niveles 1, 2 y 3, se realizará a través de la solicitud de acreditación.
En relación al periodo de validez de la autorización, también existen discordancias entre comunidades. En el caso de Madrid, Aragón, Asturias y Extremadura la renovación de la autorización hay que realizarla a los 5 años. Esta renovación será automática en Valencia, mientras que en Madrid, habrá que solicitarla 6 meses antes de la fecha de cesión. En el caso de Asturias y Extremadura tendrá que realizarse 3 meses antes; en Castilla y León en dos y en Navarra en uno. En La Rioja, el cambio de nivel o subnivel de elaboración se podrá efectuar en el último trimestre del año, pasado el primer año de permanencia obligatoria y a su vez, obligará a la oficina de farmacia o servicio farmacéutico a mantener el nuevo nivel solicitado durante el siguiente año, pasado el cual, se prorrogará tácitamente por años naturales. En Baleares, la adscripción a un determinado nivel tendrá una vigencia de un año, salvo la del nivel 1 que será indefinida. Transcurrido el año de vigencia se podrá solicitar el cambio a otro nivel.
En el resto de las comunidades, las oficinas de farmacia y/o servicios farmacéuticos, que no se acogen a ningún nivel de elaboración, se entiende que se inclinan por la opción de elaboración a “terceros”, para la elaboración de una o varias fases.
Con objeto de garantizar el control de la elaboración a terceros, siempre que resulte posible, la solicitud deberá realizarse entre oficinas de farmacia y servicios farmacéuticos de la propia comunidad. Excepcionalmente, cuando en la comunidad autónoma en la que está instalada la oficina de farmacia o servicio farmacéutico demandante no exista ninguna autorización para elaborar a terceros se podrá recurrir a la solicitud a una de fuera de la comunidad que esté habilitada para ello.
En Baleares, las oficinas de farmacia adscritas a un nivel de elaboración, no pueden concertar con otras oficinas de farmacia, la elaboración de ninguna fase correspondiente a las fórmulas magistrales o preparados oficinales pertenecientes a su nivel, excepto la fase de etiquetado e información al paciente, que en todo caso, tiene que realizar la oficina de farmacia dispensadora.
En el caso de Valencia, no se considerará elaboración a terceros aquellas fórmulas magistrales y/o preparados oficinales solicitados, entre sí, por centros dependientes de la Agencia Valenciana de Salud.
En lo que se refiere a la fabricación a terceros, conviene destacar que sólo se acepta como posibles fabricantes a terceros, a las oficinas de farmacia y servicios farmacéuticos, tal y como se queda reflejado en el recurso contencioso-administrativo que interpuso el Colegio Oficial de Farmacéuticos de la provincia de Valencia contra la Orden 14/2010, de la Consellería de Sanidad, por la que se regula el procedimiento de autorización y funcionamiento de las unidades farmacéuticas de adaptación de dosis. En el preámbulo de la ley se señala que lo que se pretende es: “crear unas estructuras especializadas (…) con las que podrían contratar los hospitales y centros sociosanitarios, a través de sus Servicios Farmacéuticos, de tal forma que supusiera una mejora en la seguridad y, por tanto, en la calidad, de esta actividad de soporte, de la atención farmacéutica que desarrollan”. El tribunal procedió a estimar el recurso contencioso administrativo. Ya que la norma prevé regular una actividad que, siendo de preparación de medicamentos, no se lleva a cabo en farmacias ni en hospitales, lo que, a su juicio, “no encuentra cabida en las disposiciones contempladas en la Ley 29/2006 (…) puesto que la citada ley, sólo contempla como posibles fabricantes de medicamentos a los laboratorios farmacéuticos y a los servicios de Farmacia Hospitalaria y oficinas de farmacia“25.
En referencia a las características generales del local de preparación, en el RD 175/2001, se recogen una serie de consideraciones que deben de cumplir. El mismo, debe tratarse de un local, o en una zona diferenciada, llamada zona de «preparación». Los requisitos específicos de los locales y/o zonas de preparación serán distintos, en función de los niveles de elaboración. Si se elaboran preparaciones estériles, será necesario que la zona se encuentre aislada, siendo posible la limpieza con agentes antisépticos, y con los mecanismos de filtración adecuados. En el caso de Murcia, se especifica que el laboratorio de elaboración debe estar en el interior de la oficina de farmacia o servicio de farmacia, y en Baleares, Castilla-La Mancha, Asturias y Andalucía además tiene que estar separada físicamente de las otras zonas. En Madrid la zona de preparación de estériles tiene que contar con una superficie aislada, con antecámara.
Respecto a las superficie mínima de los locales, en el RD 175/2001, no se especifican tales dimensiones, mientras que el de Canarias, es el único que especifica que se deberá disponer de una zona diferenciada dentro de dichos establecimientos, con una superficie útil mínima de 4 metros cuadrados, en el caso de elaborar formas farmacéuticas tópicas y líquidas orales (grupo A); y de 5 metros cuadrados para la elaboración de los preparados correspondientes al nivel básico del grupo B, incrementándose en un 10% de dicho valor por cada uno de los grupos de formas farmacéuticas opcionales del grupo B que se pretendan elaborar. En el caso de elaborar preparados estériles del grupo C, se deberá disponer de un área específica asilada del resto del establecimiento, y con una superficie mínima útil de 12 metros cuadrados. En relación al material de la superficie, el RD 175/2001 establece que tiene que ser de material liso e impermeable, fácil de limpiar y desinfectar, inerte a colorantes y sustancias agresivas. En Murcia, en el caso de existir previamente alicatado, toda su superficie o como mínimo las juntas deberán recubrirse con pintura plástica.
En lo referente a la utilización de especialidades farmacéuticas en formulación, sólo Andalucía intentó legislarlo mediante el artículo 13 de la Ley 22/2007 de Farmacia de Andalucía. Este artículo fue anulado por el Tribunal Constitucional pues consideró que la Comunidad Autónoma no tenía competencias para regular estos aspectos de la elaboración de los medicamentos, sin que entrase a valorar el contenido de artículo o si existe o no contradicción entre la regulación autonómica y la Ley estatal 29/200626, pues “la reproducción de normas estatales por leyes autonómicas, incurre en inconstitucionalidad cuando esa reproducción normativa se concreta en normas relativas a materias en las que la Comunidad Autónoma carece de competencia”27.
Discusión
La publicación del Real Decreto 175/2001, en el que se desarrolla la Ley del Medicamento, en lo que a formulación magistral se refiere, supuso un cambio importante en una de las funciones básicas de las oficinas de farmacia y servicios de farmacia.
Lo que en un principio, parecía que iba a ser la solución para normalizar la elaboración de las fórmulas y conseguir unos mínimos de calidad en estos medicamentos y una armonización de las mismas en todo el territorio nacional ha generado el efecto contrario por el desarrollo legal de las CCAA.
Ante la imposibilidad de ajustar a lo establecido en el RD, las CCAA, han creado decretos, órdenes y resoluciones por las que se regulan los procedimientos de certificación de fórmulas magistrales y preparados oficinales y de autorización para la elaboración a terceros, generando distintos grados de responsabilidad. En los mismos se han establecidos distintos niveles de elaboración, adaptaciones a los locales, obligado cumplimiento o no de la elaboración de los mismos, entre otros.
Una de las facetas más interesantes del RD 175/2001, es la elaboración a terceros, que da la posibilidad de que una farmacia, que no tiene los medios necesarios para la elaboración de fórmulas magistrales, pueda ofrecer este servicio al paciente.
No obstante, la elaboración a terceros, ha resultado polémica y está lejos de estar armonizada entre las distintas CCAA. En principio se debería entender que estos terceros, son oficinas de farmacia, o en su defecto servicios farmacéuticos, mientras que la Comunidad Valenciana, lo define como “entidad legalmente autorizada”, en la que engloba, oficina de farmacia, servicio farmacéutico o laboratorio de formulación y control del Colegio Oficial de Farmacéuticos.
En el caso de Valencia, junto al de Aragón, los colegios de farmacéuticos están autorizados para la elaboración a terceros, tanto a oficinas de farmacia como servicios farmacéuticos. En el caso de recibir una solicitud de elaboración de fuera de la comunidad, se podrá elaborar dicha fórmula, de forma excepcional. Por lo que la elaboración de las mismas, dejaría de ser competencia exclusiva de las oficinas de farmacia y/o servicios farmacéuticos, como habitualmente llevaba siendo. Como caso a destacar, en la Comunidad Valenciana, no se considerará elaboración para terceros aquellas fórmulas magistrales y/o preparados oficinales solicitados, entre sí, por centros dependientes de la Agencia Valenciana de Salud.
Aunque no fuese objetivo del presente trabajo es de destacar la diversidad existente entre la cantidad de principios activos financiados entre las distintas CCAA (entre 71 y 497) que –junto a la diversidad de requisitos técnicos– sin duda afecta a la equidad y a la calidad asistencial de los pacientes que necesitan estos preparados28.
Un tema controvertido, es el uso de especialidades farmacéuticas para formulación y que solo Andalucía intentó introducir en su legislación. A nivel hospitalario esta cuestión queda relativizada por el desarrollo de la GBPP7 y el RD 1050/200929 por el que se regula la disponibilidad de medicamentos en situaciones especiales, pero constituye un vacío legal en atención primaria y que afecta a la continuidad asistencial de los pacientes que necesitan estos preparados.
Es de señalar que existe una corriente para armonizar y unificar criterios de elaboración a nivel internacional (PICS) que ha influido en el desarrollo de los dos últimos documentos a nivel nacional que pueden influir en la elaboración de estos productos. Sería necesario asegurar que el desarrollo tanto de la GBPP como del tema de MPP8 no siguiese el mismo camino que el RD175/2001.
Conflicto de intereses: Los autores declaran no tener conflicto de intereses.
Bibliografía
1. Ley 25/1990 del medicamento, de 20 de diciembre, BOE del 22.
2. Real Decreto 294/1995, de 24 de febrero, por el que se regula la Real Farmacopea Española, el formulario nacional y los órganos consultivos del Ministerio de Sanidad y Consumo en esta materia.
3. Orden SCO/3262/2003, de 18 de noviembre, BOE del 26, por la que se aprueba el Formulario Nacional.
4. Ley 24/2001, de 27 de diciembre, de Medidas Fiscales, Administrativas y del Orden Social.
5. Real Decreto Legislativo 1/2015, de 24 de julio, por el que se aprueba el texto refundido de la Ley de garantías y uso racional de los medicamentos y productos sanitarios.
6. Real Decreto 175/2001, de 23 de febrero, por el que se aprueban las normas de correcta elaboración y control de calidad de fórmulas magistrales y preparados oficinales. BOE número 065-2001 de 16/03/2001:9746-55.
7. Guía para la aplicación de las normas contenidas en el Real Decreto 175/2001, de normas 6de correcta fabricación de fórmulas magistrales y preparados oficinales.
8. Instituto Nacional de Seguridad e Higiene en el Trabajo (INSHT). Medicamentos peligrosos. Medidas de prevención para su preparación y administración. 1ª ed. Barcelona: INSHT; 2016.
9. General Chapter <797> Pharmaceutical Compounding – Sterile Preparations http://www.usp797.org/.
10. NIOSH List of Antineoplastic and Other Hazardous Drugs in Healthcare Settings, 2016 https://www.cdc.gov/niosh/docs/2016-161/default.html.
11. PIC/S: Guide To Good Manufacturing Practice For Medicinal Products.
12. Decreto 51/2004, de 3 de junio, por el que se regula el procedimiento de acreditación, autorización y registro de las oficinas de farmacia y servicios farmacéuticos en relación con la elaboración y control de fórmulas magistrales y preparados oficinales. Conserjería de Salud y servicios Sanitarios. Principado de Asturias.
13. Decreto 155/2016, de 27 de septiembre, por el que se regulan los requisitos técnico-sanitarios, de espacios, de señalización e identificación de las oficinas de farmacia, así como los procedimientos de autorización de las mismas para la elaboración de fórmulas magistrales y preparados oficinales. Consejería de Salid. Andalucía.
14. Decreto 93/2004, de día 5 de noviembre, sobre fórmulas magistrales y preparados oficinales. Consejería de Salud y Consumo. Comunidad Autónoma Islas Baleares.
15. Decreto 226/2005, de 13 de diciembre, por el que se regula el procedimiento de verificación del cumplimiento por parte de las oficinas de farmacia y de los servicios farmacéuticos de los requisitos necesarios para la elaboración de fórmulas magistrales y preparados oficinales, así como el procedimiento de autorización de la elaboración por terceros. Consejería de Sanidad. Boletín oficial de Canarias Número 249.
16. Decreto 65/2009, de 9 de julio, del Consejo de Gobierno, por el que se regulan los procedimientos de certificación de las oficinas de farmacia y servicios de farmacia que elaboren fórmulas magistrales y preparados oficinales y de autorización para la elaboración a terceros, y se crea el Registro correspondiente. Comunidad de Madrid.
17. Decreto 14/2006, de 20 de enero, del Consell de la Generalitat, por el que se establece la normativa para la aplicación en la Comunidad Valenciana del Real Decreto 175/2001, de 23 de febrero, por el que se aprobaron las normas de correcta elaboración y control de calidad de fórmulas magistrales y preparados oficinales. Diario Oficial de la Generalitat Valenciana Número 5183.
18. Orden de 10-03-2004, de la Consejería de Sanidad, por la que se regula la aplicación de normas contenidas en el Real Decreto 175/2001, de 23 de febrero, por el que se aprueban las normas de correcta elaboración y control de calidad de fórmulas magistrales y preparados oficinales. Diario Oficial de Castilla-La Mancha Número 45.
19. Orden SAN/844/2004, de 28 de mayo, por la que se regula la autorización y acreditación para la elaboración de fórmulas magistrales y preparados oficinales en Castilla y León.
20. Orden Foral 142/2003, de 12 de diciembre, de la Consejera de Salud, por la que se regula el procedimiento de acreditación de las oficinas de farmacia y servicios de farmacia para la elaboración de fórmulas magistrales y preparados oficinales, así como la autorización para la elaboración a terceros. Boletín Oficial de Navarra Número 7.
21. Decreto 443/2003, de 11 de diciembre, de regulación de las actividades de elaboración y control de calidad de fórmulas magistrales y preparados oficinales. Consellería de Sanidad. Xunta de Galicia.
22. Orden de 16 de diciembre de 2003, del Departamento de Salud y Consumo, por la que se regula la autorización y acreditación de los servicios de farmacia y oficinas de farmacia que elaboran fórmulas magistrales y preparados oficinales. Departamento de Salud y Consumo. Aragón.
23. Resolución de la Dirección General de Ordenación, Acreditación e Inspección Sanitaria por la que se aprueba la Guía Práctica para el cumplimiento y adaptación inmediata de las oficinas y servicios de farmacia de la Región de Murcia al Real Decreto 175/2001, de 23 de febrero, por el que se aprueban las normas de correcta elaboración y control de calidad de fórmulas magistrales y preparados oficinales.
24. Resolución, de 29 de diciembre de 2003, por la que se aprueba el Protocolo de aplicación del Real Decreto 175/2001, de 23 de febrero, a las Oficinas de Farmacia y Servicios Farmacéuticos autorizados. Gobierno de la Rioja.
25. Sentencia 4379/2014, de 16 de octubre de 2017. Recurso contencioso administrativo contra la Orden 14/2010, de 1 de septiembre, de la Consejería de Sanidad, por la que se regula el procedimiento de autorización y funcionamiento de las unidades farmacéuticas de adaptación de dosis (UFAD).
26. Ley 29/2006, de 26 de julio, de garantías y uso racional de los medicamentos y productos sanitarios.
27. Sentencia 181/2014, de 6 de noviembre de 2014. Recurso de inconstitucionalidad 321-2008. Interpuesto por más de cincuenta Diputados en relación con diversos preceptos de la Ley 22/2007, de 18 de diciembre, de farmacia de Andalucía.
28. Revista del Consejo General de Colegios Oficiales de Farmacéuticos – N.º 428 – Julio-Agosto 2017.
29. Real Decreto 1015/2009, de 19 de junio, por el que se regula la disponibilidad de medicamentos en situaciones especiales.
____
