Fecha de recepción: 04/11/2017 – Fecha de aceptación: 15/01/2018
Cortell Fuster C1, Moya-Gil A1, Royo Peiró A2, Vicent Verge JM2, Bosch Roig CE2, Climente Martí M1
1 Servicio de Farmacia
2 Servicio de Oncología Médica
Hospital Universitario Dr. Peset. Valencia (España)
____
Correspondencia:
Clara Cortell Fuster
Hospital Universitario Dr. Peset
(Servicio de Farmacia)
Avda. Gaspar Aguilar, 90
Valencia 46017
Correo electrónico: cortell_cla@gva.es
____
RESUMEN
Objetivo: Evaluar la eficiencia del dose banding de levofolinato cálcico como herramienta Lean en pacientes con cáncer colo-rectal metastásico.
Métodos: Estudio de cohortes ambispectivo de 16 meses de duración, con 12 semanas de seguimiento en cada grupo. Fase control retrospectiva: dosis administrada de levofolinato cálcico según dosis prescrita por superficie corporal. Fase intervención prospectiva: dosis administrada de levofolinato cálcico según dose banding. Se elaboraron 4 lotes de levofolinato cálcico para el dose banding: 175 mg y 350 mg en 100 ml y 250 ml de suero glucosado 5%. Se excluyeron los pacientes que presentaron una diferencia >10% entre dosis prescrita y dosis dose banding. Variables de eficiencia: reducción de tiempos y costes en acondicionamiento/preparación según retribuciones del personal del Servicio de Farmacia. Variables de efectividad: respuesta global y supervivencia libre de progresión a las 12 semanas. Variables de seguridad: efectos adversos asociados al tratamiento con 5-fluorouracilo. El análisis estadístico se realizó con STATA v13.1.
Resultados: Se incluyeron 32 pacientes (16 en cada grupo), 188 pacientes-día. El dose banding permitió un descenso de 10 min en la mediana de tiempo de acondicionamiento/preparación. Se estimó un ahorro anual de 2.007 €. No hubo diferencias significativas en respuesta global y supervivencia libre de progresión entre grupos intervención y control (p=1,00 en ambos casos). Los efectos adversos más comunes fueron diarrea y astenia sin diferencias entre grupos (p=1,00 y 0,72, respectivamente).
Conclusiones: El dose banding de levofolinato cálcico en el proceso de preparación de quimioterapia es una herramienta Lean eficiente sin comprometer la efectividad y seguridad del tratamiento antineoplásico.
Palabras clave: Dosis fijas, intervalo de dosis, dosis estandarizadas, estandarización, levofolinato cálcico, cáncer colo-rectal, Lean.
____
INTRODUCCIÓN
La farmacoterapia antineoplásica incluye un grupo de medicamentos considerados de alto riesgo1, por lo que varias asociaciones y sociedades científicas internacionales y nacionales2-4, y entre ellas, el Grupo Español para el Desarrollo de la Farmacia Oncológica (GEDEFO) perteneciente a la Sociedad Española de Farmacia Hospitalaria, promueven la centralización de la preparación del tratamiento antineoplásico y de soporte en los Servicios de Farmacia. Esta estrategia tiene como objetivo principal la prevención de errores de medicación en el paciente onco-hematológico4,5 garantizando, así, la seguridad del proceso farmacoterapéutico antineoplásico integral.
Otra recomendación para minimizar los riesgos y mejorar la calidad de los servicios prestados es la disponibilidad de programas de Gestión de la Calidad Asistencial. En el Hospital Universitario Dr. Peset, donde se ha desarrollado este estudio, la Unidad de Oncología Médica y la Unidad de Oncología Farmacéutica del Servicio de Farmacia se certificaron por primera vez en el Sistema de Gestión de Calidad Norma ISO 9001:2008, acción consolidada hasta hoy6. Además, a finales de 2012 se implantó la metodología Lean Seis Sigma (Lean: reducción de tiempos; Seis Sigma: reducción de variabilidad, precursora de errores) para la mejora continua de la microgestión del proceso farmacoterapéutico del paciente onco-hematológico. En ambas acciones, el objetivo fundamental es ofrecer al cliente el mayor valor añadido, mediante una mejora sistemática de la calidad, los costes, los tiempos de respuesta, minimizar la variabilidad y alcanzar mayores niveles de satisfacción en los pacientes.
Los fármacos en terapia antineoplásica son dosificados de manera individualizada, según la superficie corporal (SC), el peso o la función renal del paciente junto al área bajo la curva (AUC) objetivo7 como es el caso del carboplatino. Son excepciones a esta norma la preparación de dosis estandarizadas y dosis fijas en fármacos como los inhibidores de tirosina-kinasa o el rituximab o trastuzumab subcutáneo. La individualización posológica se traduce, por tanto, en una preparación única y exclusiva para cada paciente, generalmente de manera inmediata previa a la administración. Esto conlleva un incremento de la demanda siendo mayor la presión asistencial para el Servicio de Farmacia8. Como consecuencia, la dilatación del tiempo de espera de los pacientes y los errores de prescripción, preparación y administración propiciados por la individualización de la terapia, establecen la necesidad de búsqueda de nuevos métodos de trabajo para así optimizar los recursos.
En este contexto surge el concepto de dose banding (DB), que según la NECN (North of England Cancer Network), se define como un sistema en el que las dosis de los fármacos citotóxicos se redondean hacia valores inferiores o superiores con el fin de obtener dosis estandarizadas9. Así, la máxima variabilidad permitida en el ajuste entre la dosis prescrita y la dosis administrada no debe ser superior al 5% para fármacos antineoplásicos, límite aceptado, asimismo, en el control de calidad por gravimetría en la robotización de la preparación de estos tratamientos10,11. Por otra parte, se ha establecido un 10% máximo en discrepancia de dosis para fármacos de soporte y anticuerpos monoclonales12.
Las etapas para la implantación de la estandarización de dosis en antineoplásicos comprenden el consenso con el equipo asistencial y las sociedades científicas, la selección de moléculas candidatas a estandarización, análisis de consumo y definición de intervalos de dosis, adaptación de los sistemas de información, tecnologías y análisis de los resultados13.
Los fármacos candidatos a preparación por DB son aquellos que se prescriben con mayor frecuencia, que disponen de una estabilidad adecuada tras su reconstitución y dilución (mínimo 14 días)14 o que cuentan con al menos un 60% de prescripciones cubiertas por 5 bandas o menos15. En consecuencia, el DB constituye una oportunidad de ahorro siendo especialmente significativa para aquellos fármacos de elevado coste que suponen una innovación terapéutica16. Según la NECN cumplen criterios, por condiciones óptimas de estabilidad: 5-fluorouracilo, ciclofosfamida, doxorubicina, epirubicina, gemcitabina, metotrexato, carboplatino y oxaliplatino. También se han implantado las dosis fijas para anticuerpos monoclonales como rituximab y trastuzumab, siendo posible la utilización incluso para formas farmacéuticas orales como capecitabina17. Baker y Jones publicaron las primeras experiencias de DB para ciclofofamida, metotrexato y 5-fluorouracilo18, con un porcentaje de variación entre dosis prescrita y administrada menor o igual al 5%, que se tradujo en una reducción de costes y una mejora integral del proceso farmacoterapéutico. Adicionalmente, se introdujo el DB en fármacos citostáticos diferentes de los propuestos por la NECN, como es el caso de las camptotecinas, el pemetrexed o el paclitaxel16,19, proponiendo algunos autores la dosificación por DB también para fármacos de soporte, como el levofolinato cálcico (LC)7.
La validación clínica del uso del DB en fármacos antineoplásicos, en términos de efectividad y/o seguridad, es limitada en la bibliografía. E. Chatelut19 utilizó parámetros farmacocinéticos como la distribución del AUC o la concentración plasmática como variables principales para demostrar la ausencia de diferencias significativas en efectividad entre el DB, las dosis fijas y la dosificación por SC. Bonet E. et al.20 establecieron un DB de carboplatino para un porcentaje concreto de la población estimado mediante un modelo farmacocinético bicompartimental. En relación a la seguridad, Jenkins y Wallis21 mostraron que no existían diferencias entre el DB y la dosificación por SC para 5-fluorouracilo, epirubicina y ciclofosfamida en cuanto a efectos adversos hematológicos. Por otro lado, Field et al.22 se centraron exclusivamente en evaluar el impacto de la reducción de costes, concluyendo que se obtenía un ahorro significativo con el DB de oxaliplatino en comparación con la dosificación por SC en cáncer colo-rectal metastásico.
La opinión de facultativos prescriptores respecto a la posible estandarización de dosis en quimioterapia antineoplásica ha sido evaluada en diferentes estudios. Según una encuesta realizada entre oncólogos españoles23, el 76% apoyaría su utilización en su ámbito de trabajo, aceptando, en su mayoría, un porcentaje de variación de dosis del 5% para tratamiento radical y entre el 5-10% para tratamientos paliativos. Kaestner y Sewell24, observaron, asimismo, un apoyo casi generalizado al DB, existiendo discrepancia de opiniones en relación a la máxima desviación aceptada entre dosis, poniendo de manifiesto la necesidad de realizar nuevos estudios clínicos que justifiquen la seguridad y efectividad del DB.
En este contexto se planteó este estudio, con el objetivo principal de evaluar la eficiencia del DB de LC como herramienta Lean para la optimización del proceso farmacoterapéutico onco-hematológico en pacientes con cáncer colo-rectal metastásico. Como objetivo secundario, se evaluó la efectividad y la seguridad del DB comparado con dosis individualizada de LC.
MATERIAL Y MÉTODOS
Descripción y fases
En el entorno de un hospital general universitario donde la preparación del tratamiento antineoplásico se asume íntegramente por la Unidad de Oncología Farmacéutica del Servicio de Farmacia con un total de 1.155 pacientes y 11.019 pacientes-día onco-hematológicos durante el año 2015, se desarrolló un estudio de cohortes ambispectivo con grupo control retrospectivo (grupo SC) y grupo intervención prospectivo (grupo DB). Este proyecto de investigación fue aprobado por el Comité Ético de Investigación Clínica del correspondiente Departamento de Salud.
El periodo de estudio fue de 16 meses, considerando 5 meses de inclusión de pacientes y 12 semanas de seguimiento desde el inicio del tratamiento antineoplásico para ambos grupos. El estudio se compuso de dos fases bien diferenciadas: a) fase retrospectiva (enero a agosto de 2015) en la que la dosis de LC fue individualizada por SC, y b) fase prospectiva (septiembre de 2015 a abril de 2016), en la que la dosis administrada de LC fue seleccionada según los intervalos de dosis definidos en el DB, excluyéndose aquellos pacientes que presentaban una diferencia >10% entre dosis prescrita y dosis DB.
Se incluyeron pacientes mayores de 18 años con cáncer colo-rectal metastásico que iniciaron tratamiento con LC según esquemas antineoplásticos intravenosos FOLFOX/FOLFIRI acompañados o no de fármacos antiangiogénicos (anti factor de crecimiento del endotelio vascular -antiVEGF- o anti receptor del factor de crecimiento epidérmico -antiEGFR-) en primera línea o posteriores. Se excluyeron aquellos pacientes que a las 12 semanas del seguimiento no disponían de valoración de la enfermedad.
Dose banding de levofolinato cálcico
En el tratamiento del cáncer colo-rectal metastástico, el papel del LC es clave en la modulación bioquímica del 5-fluorouracilo (5-FU). De este modo, el LC potencia la inhibición sobre la timidilato sintetasa, lo que permite aumentar la eficacia del 5-FU.
En los esquemas quimioterápicos intravenosos FOLFOX y FOLFIRI, el LC se ha dosificado tradicionalmente según SC (100 ó 200 mg/m2). Para el DB se elaboraron 4 lotes de LC: 175 mg en 100 ml y 250 ml de suero glucosado 5% (SG5), y 350 mg en 100 ml y 250 ml de SG5. Se asignó una estabilidad en dilución de 9 días a todas las preparaciones (estabilidad microbiológica según Farmacopea Americana – USP Chapter 797)14, a pesar de la estabilidad físico-química de 14 días especificada en la ficha técnica de LC25.
Los lotes de 175 mg y 350 mg fueron destinados a aquellos pacientes que debían recibir dosis de 100 mg/m2 y 200 mg/m2 respectivamente. Teóricamente, los pacientes candidatos a tratarse con DB de LC serían aquellos cuya SC (real o ajustada por peso ideal) estuviera comprendida entre 1,59 y 1,95 m2 (Tabla 1).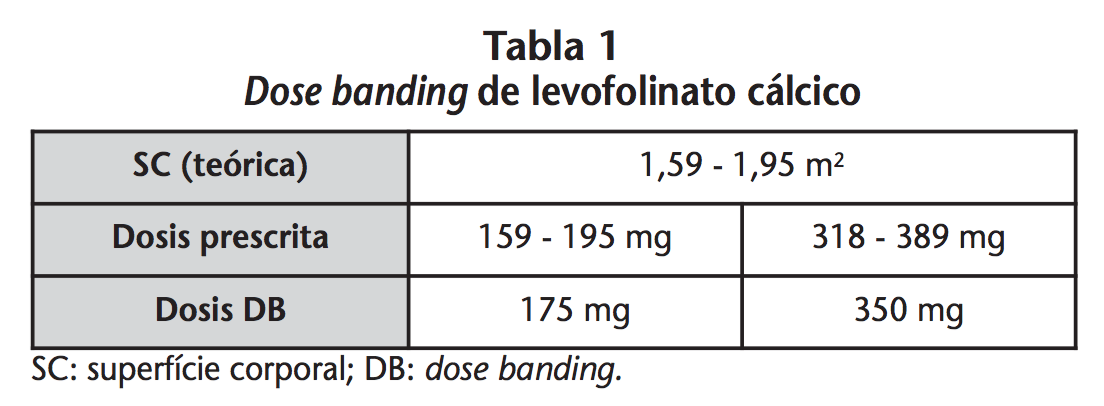 Sin embargo, independientemente de la SC real de los pacientes, aquellos que, por redondeos y/o reducciones de dosis del esquema antineoplásico, presentaron una diferencia ≤10% entre dosis prescrita y dosis DB, también fueron seleccionados para recibir DB.
Sin embargo, independientemente de la SC real de los pacientes, aquellos que, por redondeos y/o reducciones de dosis del esquema antineoplásico, presentaron una diferencia ≤10% entre dosis prescrita y dosis DB, también fueron seleccionados para recibir DB.
La organización y gestión de los lotes de LC se optimizó mediante las tarjetas Kanban26, diseñadas según consumos, estabilidad química y microbiológica, compatibilidad física y definición de intervalos de dosis.
Variables y análisis estadístico
Se recogieron 4 tipos de variables: variables relacionadas con el paciente y/o enfermedad, variables de efectividad, variables de seguridad y variables de eficiencia.
En cuanto a las variables relacionadas con el paciente y/o enfermedad, se registraron variables demográficas (edad, sexo y SC), diagnóstico (cáncer de colon o recto), performance status (PS), indicación de tratamiento (diferenciando entre adyuvancia, primera línea y segunda línea o sucesivas de enfermedad metastásica) y esquema antineoplásico (según asociación o no de fármacos antiangiogénicos a los esquemas considerados de similar efectividad FOLFOX y FOLFIRI).
Se denominaron variables de eficiencia (variables Lean) a aquellas relacionadas con el ahorro en tiempo y la estimación de costes evitados. Se midieron los tiempos de acondicionamiento/preparación de los esquemas antineoplásicos de colon-recto que contuvieran preparaciones con LC durante los años 2016 (pacientes que recibieron DB de LC) y 2015 (pacientes que recibieron LC dosificado por SC). Estos tiempos se obtuvieron a través del aplicativo Farmis Oncofarm®. Se calculó la reducción de tiempos y costes según retribuciones del personal implicado en el acondicionamiento (auxiliar de clínica) y la preparación (enfermería)27.
Las variables de efectividad fueron principalmente la respuesta global (RG) y supervivencia libre de progresión (SLP) a las 12 semanas del inicio del tratamiento, siendo respondedores aquellos pacientes con respuesta parcial o completa confirmada según última prueba de imagen (TAC) e información registrada por el oncólogo en historia clínica electrónica (Orion Clinic®). Como variable secundaria de efectividad se calculó el porcentaje de disminución del marcador tumoral antígeno carcino-embrionario (CEA) para cada paciente, desde el inicio del tratamiento hasta el fin de seguimiento.
Se consideraron como variables de seguridad, la presencia o ausencia de efectos adversos (EA) asociados al tratamiento con 5-FU (diarrea, vómitos, astenia, mucositis y/o estomatitis), según información registrada por el oncólogo en la historia clínica electrónica (Orion Clinic®).
Para el análisis estadístico se empleó el aplicativo STATA (versión 13.1). La normalidad se estudió aplicando la prueba de Shapiro-Wilk para variables cuantitativas continuas. Los resultados se obtuvieron con la prueba no paramétrica U de Mann-Whitney (para aquellas variables que vulneraron la normalidad), tablas de contingencia Ji-cuadrado y prueba t de Student de comparación de medias (cuando variables cuantitativas continuas siguieron la ley Normal).
RESULTADOS
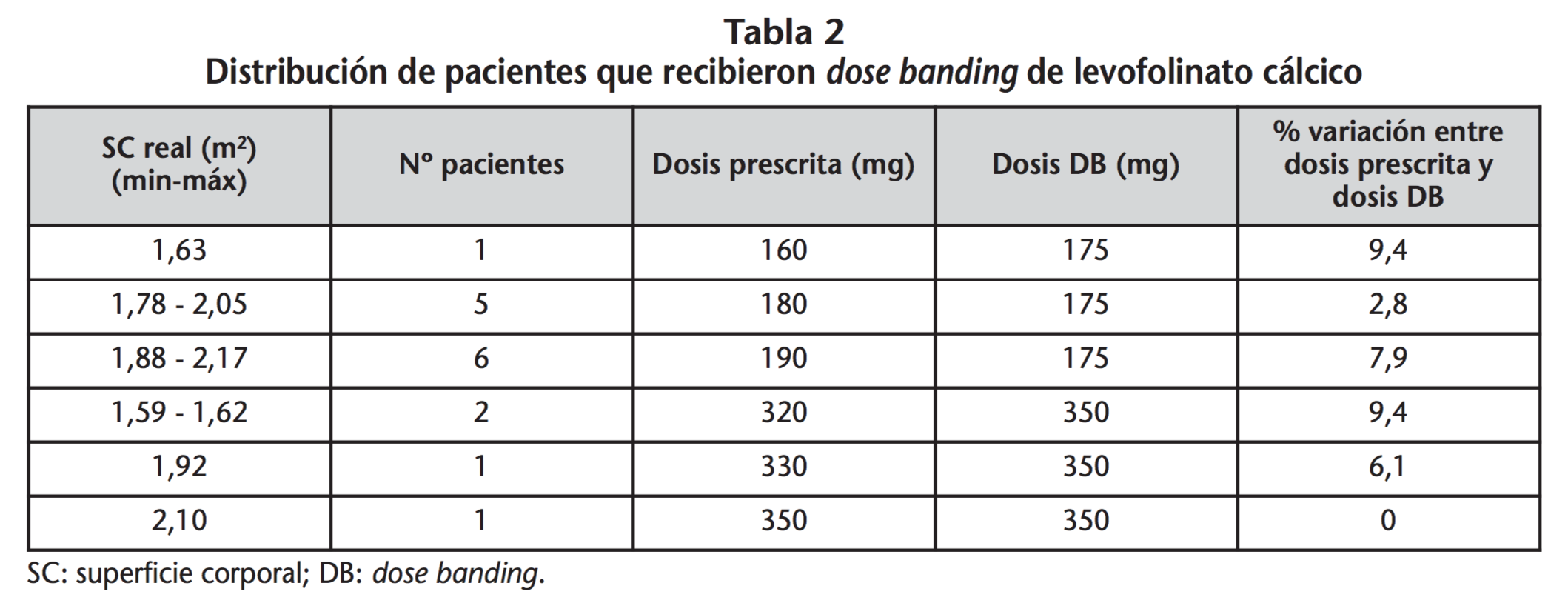
En el periodo de estudio se trataron 213 pacientes con los esquemas antineoplásicos seleccionados, el 66% (n=140) con SC adecuada para la administración según DB. Según criterios de inclusión, fueron estudiados 32 pacientes que iniciaron tratamiento: 16 en el grupo intervención (grupo DB) y 16 en el grupo control (grupo SC), equivalentes a un total de 188 pacientes-día. Los pacientes incluidos en el grupo SC presentaron una mediana de SC de 1,78 (amplitud intercuartílica=1,45-1,99 m2) y fueron tratados con dosis de LC comprendidas entre 160 y 350 mg. En la tabla 2 se muestra la distribución de pacientes que recibieron DB de LC.
Variables relacionadas con el paciente y/o enfermedad
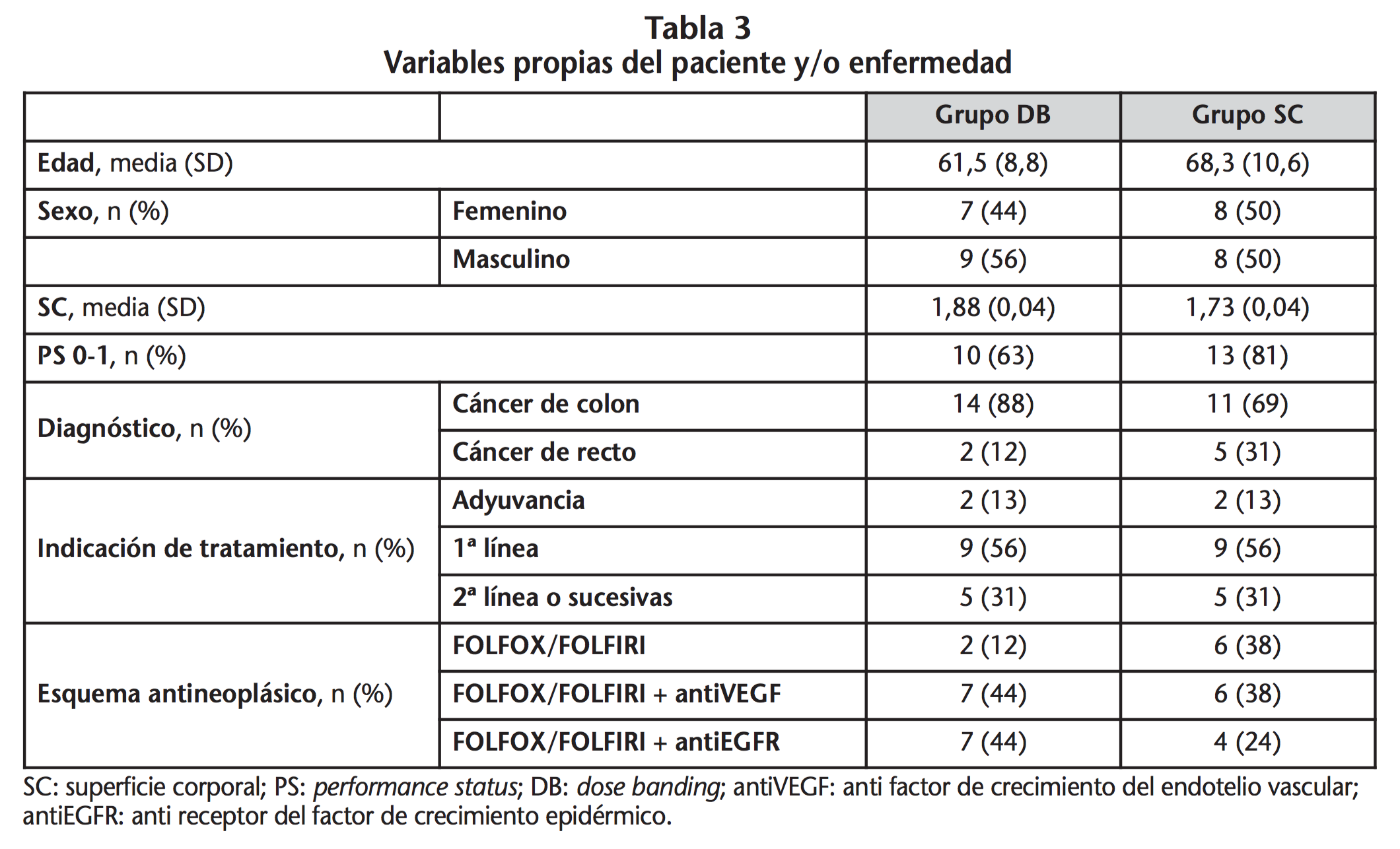
Las características demográficas y variables propias de la enfermedad fueron de magnitud similar entre grupo DB y grupo SC (Tabla 3). En relación a los esquemas terapéuticos FOLFOX y FOLFIRI, la mayoría de los pacientes en ambos grupos recibieron el esquema FOLFOX (11/16 y 12/16 en grupos DB y SC, respectivamente).
Variables de eficiencia
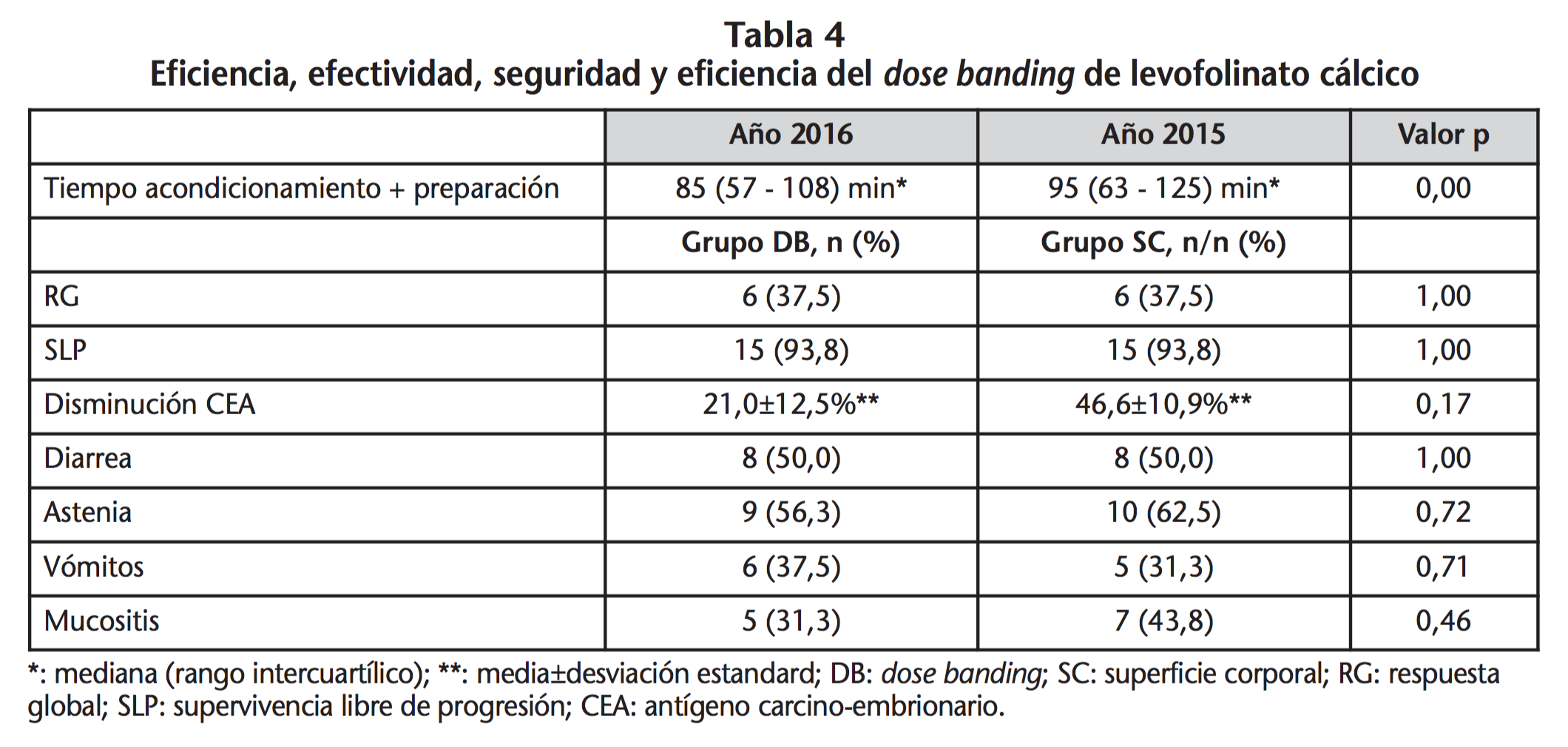
La mediana de tiempo de acondicionamiento/preparación del esquema antineoplásico completo por paciente y día fue de 85 min (rango intercuartílico=57-108 min) durante el año 2016 (pacientes que recibieron DB de LC: 1.383 preparaciones) y 95 min (rango intercuartílico=63-125 min) durante el año 2015 (pacientes que recibieron LC dosificado por SC: 2.390 preparaciones), siendo significativa esta diferencia de tiempos a favor del DB de LC (10 min; p=0,00) (Tabla 4).
Considerando un descenso en mediana de tiempo de acondicionamiento/preparación de 10,0 min y un total de 912 preparaciones susceptibles de DB de LC en 2016, se estimó un ahorro anual de 2.007 € según retribuciones del personal auxiliar de clínica y enfermería27.
Variables de efectividad
No hubo diferencias estadísticamente significativas entre grupo DB y grupo SC, en relación a efectividad del tratamiento antineoplásico. En cuanto a la variable respuesta global, respondieron al tratamiento antineoplásico durante el periodo de seguimiento un 37,5% en el grupo DB frente a la misma proporción en el grupo SC (p=1,00). En ambos grupos, el 93,8% de los pacientes completaron el tiempo de estudio sin progresión del proceso tumoral (p=1,00), no encontrando diferencias en relación a supervivencia libre de progresión. El CEA disminuyó en promedio un 21,0±12,5% en el grupo DB frente a un 46,6±10,9% en el grupo SC, no encontrando evidencia de significación estadística para esta diferencia (p=0,17) (Tabla 4).
Variables de seguridad
No se observaron diferencias estadísticamente significativas en cuanto a la seguridad entre grupos DB y grupo SC. Los EA más comunes fueron diarrea y astenia. Ningún paciente presentó estomatitis.
En ambos grupos, el 50,0% de los pacientes tuvo diarrea en algún momento durante el seguimiento (p=1,00). En el grupo DB el 56,3% de los pacientes presentó astenia frente al 62,5% en el grupo SC (p=0,72) (Tabla 4). Otros EA minoritarios fueron vómitos y mucositis. La proporción de pacientes con vómitos fue de 37,5% en grupo DB frente a 31,3% en grupo SC (p=0,71) y presentaron mucositis un 31,3% frente a un 43,8% (p=0,46) respectivamente (Tabla 4).
DISCUSIÓN Y CONCLUSIONES
A través de este estudio, el DB de LC demostró ser una alternativa eficiente sin diferencias en la efectividad y la seguridad de estos tratamientos antineoplásicos.
Las mejoras y beneficios observados en el proceso farmacoterapéutico con la implantación del DB de LC incluyeron, de manera significativa, una disminución en el tiempo de preparación traduciéndose en la reducción del tiempo de espera de los pacientes y, adicionalmente, en un ahorro económico anual a considerar.
Tras valorar la satisfacción del paciente onco-hematológico mediante una encuesta voluntaria y anónima en nuestro centro (tasa de respuesta 68%, n=141), se concluyó que, a pesar de que la satisfacción global era buena o muy buena (94%), el tiempo de demora en el tratamiento era el criterio peor valorado (27% insatisfecho o muy insatisfecho)28.
Así pues, la preparación anticipada y la planificación mediante tarjetas Kanban para disponer just in time del DB de LC, supuso una reducción de 10 minutos en el tiempo de preparación del tratamiento antineoplásico integral en aquellos pacientes susceptibles de beneficiarse del DB. El sistema Kanban, como herramienta Lean, optimiza tiempos y puede prevenir potenciales errores al plantear una estrategia de simplificación y planificación. Medidas como ésta en la microgestión Lean Manufacturing (disminuir tiempos), siguiendo el Espíritu Kaizen, maximizan el valor de la organización mediante la consecución de una mayor satisfacción del cliente, la reducción de costes, la mejora de la calidad y la velocidad del proceso obteniéndose mejores resultados en efectividad y eficiencia29. Desde el año 2000, existe una tendencia emergente en la implantación de esta metodología en el ámbito sanitario, reportando alguna de estas mejoras beneficios de hasta 100.000 €30. También existen experiencias en Farmacia Hospitalaria donde la implantación de Lean Seis Sigma disminuyó en un 50% los errores y permitió la reducción de tiempos31,32.
El actual estudio presentó la limitación de implantar ambos DB de LC, 175 mg y 350 mg, progresivamente durante 3 meses, lo que pudo influir en los resultados de eficiencia.
Adicionalmente, la efectividad y la seguridad no se vieron comprometidas al confirmarse que la proporción de pacientes respondedores al tratamiento y la incidencia de EA en ambos grupos resultó de magnitud similar, sin encontrar diferencias estadísticamente significativas como se observó en el estudio de E. Chatelut et al.19. En este sentido, Plumridge et al. ya pusieron de manifiesto el valor añadido del DB de este fármaco de soporte con la preparación de dosis estandarizadas en jeringas7.
Además, la preparación por lotes posibilita la disminución de potenciales errores de medicación, así como la opción de aprovechamiento de mezclas devueltas al Servicio de Farmacia, cumpliendo las recomendaciones para el control de calidad de formulación magistral según la Farmacopea Europea33 (pues la diferencia entre dosis administrada y dosis prescrita no supera el 10% de variación).
Diferentes grupos de expertos34,35 avalan esta práctica posicionando al DB como la actitud terapéutica del futuro. En Escocia36 el 60-70% de todas las dosis preparadas en los Servicios de Farmacia son estandarizadas, siendo más de 100 los hospitales británicos que utilizan esta práctica. Paralelamente, el Sistema Nacional de Salud Británico (NHS England) prevé la estandarización de dosis para el 90% de los antineoplásicos en 2018 estimando un ahorro anual que asciende a 1,4 billones de libras37. La primera comercialización del dose banding de gemcitabina evidencia esta estrategia, así como la reciente comercialización de dosis fijas de anticuerpos monoclonales como rituximab y trastuzumab vía subcutánea.
Con todo ello, podemos concluir que el DB de LC es una herramienta Lean eficiente en el proceso de preparación de quimioterapia sin comprometer la efectividad y seguridad del tratamiento antineoplásico.
Sin embargo, el éxito en la implementación del DB en Oncología Farmacéutica supone un gran reto. Aunque la eficiencia de este sistema de dosificación ha sido demostrada en algunas publicaciones, queda un largo camino por recorrer por que la confianza en el DB y las dosis fijas sea unánime en la totalidad de la comunidad científica y los profesionales sanitarios.
LIMITACIONES DEL ESTUDIO
Los autores son totalmente conscientes de la existencia de ciertas limitaciones en el estudio como son:
1. La limitación del tamaño muestral, disponiendo de 32 pacientes (16 en cada grupo). Debido a los criterios de inclusión establecidos, no fue posible obtener un tamaño de muestra mayor. No obstante, se aplicaron las pruebas de normalidad y pruebas estadísticas adecuadas considerando el tamaño muestral disponible.
2. El periodo de seguimiento se estableció en 12 semanas, correspondiendo a 6 ciclos completos administrados para cada paciente, periodo de seguimiento establecido y consensuado entre los Servicios de Farmacia y Oncología.
3. Al tratarse de un estudio ambispectivo podrían existir sesgos de información o medición. No obstante, entre fases retrospectiva y prospectiva no existió tal limitación, pues, en ambos grupos, los datos de efectividad y seguridad se recogieron a través de la historia clínica electrónica (Orion Clinic®), así como el registro de tiempos de acondicionamiento/preparación se obtuvo a través del aplicativo Farmis Oncofarm® en el caso de resultados de eficiencia.
4. El análisis de seguridad no discriminó entre esquemas FOLFOX y FOLFIRI, los cuales son equivalentes en efectividad, pero con un perfil de seguridad diferente. El tamaño muestral limitó este aspecto, no permitiendo esta comparativa. Destacar, adicionalmente, que la mayoría de pacientes en ambos grupos recibieron esquema FOLFOX con o sin anticuerpo monoclonal.
Conflicto de intereses: Los autores declaran no tener conflicto de intereses.
BIBLIOGRAFÍA
1. Relación de medicamentos de alto riesgo en hospitales, actualizada por el ISMP en 2012. Disponible en: http://www.ismp-espana.org/ficheros/Medicamentos%20alto%20riesgo%202012.pdf.
2. Chatelut E, White-Koning M, Mathijssen HJ, Baker SD, Sparreboom A. Recommendation of dose banding of cytotoxics according to pharmacokinetic criteria. J Clin Oncol 30, 2012 ASCO Annual Meeting, abstract 2549. Disponible en: http://meetinglibrary.asco.org/record/ 72908/abstract.
3. International Society of Oncology Pharmacy Practitioners. Disponible en: http://www.isopp.org/.
4. Grupo Español para el desarrollo de la Farmacia Oncológica (GEDEFO). Documento de consenso para la prevención para la utilización de medicamentos en la modalidad de uso compasivo en la terapéutica onco/hematológica. Mayo 2002. Disponible en: http://gruposdetrabajo.sefh.es/gedefo/images/stories/documentos/Web_Doc_con_Compasivo.pdf.
5. Grupo Español para el desarrollo de la Farmacia Oncológica (GEDEFO). Documento consenso. Antineoplásicos orales. [Internet]. Octubre 2009. [actualizado Oct 2009; citado 4 Dic 2016]. Disponible en: http://www. sefh.es/gedefo/documentos/consenso_gedefo_antineoplasicos_orales.pdf.
6. López-Montenegro MA, Albert A, Jiménez NV. Medida de la mejora continua en la seguridad del paciente oncológico. Farm Hosp. 2013;37(2):143-150.
7. Plumridge RJ, Sewell GJ. Dose-banding of cytotoxic drugs: a new concept in cancer chemotherapy. Am J Health Syst Pharm. 2001;58:1760-4.
8. Pérez P, Cueto M, Escobar P, Borrell C, Albert A, López E, et al. Dose banding aplicado a la elaboración de antineoplásicos: una revisión narrativa de la literatura. Farm Hosp. 2015;39(4):210-216
9. Guidelines for the dose banding of cancer chemotherapy. Cancer Network. National Health System. [Internet]. February 2009. [actualizado Jul 2013; citado 6 Ago 2017]. Dispongible en: http://www.nescn.nhs.uk/ wp-content/uploads/2012/11/NECN-dose-banding-guidelines-version-1_5.pdf.
10. Pacheco MP, Arenaza AE, Santiago A, Bilbao C, Zamora MD, Arias ML. Implantación de un robot para la elaboración de antineoplásicos. Farm Hosp. 2015;39(3):137-146.
11. Hernández M, Porta B, Climente M, Moya A, Guglieri B, Gómez S. Implantación de un sistema de trazabilidad y control de calidad tecnológico en la preparación de antineoplásicos parenterales. El farmacéutico hospitales. 2014;204:4-14.
12. Francis SM, Heyliger A, Miyares MA, Viera M. Potential cost savings associated with dose rounding antineoplastic monoclonal agents. J Oncol Pharm Practice. 2015,21(4)280-284.
13. Pouliquen AL. Toolkit: How to Implement Dose banding of Chemotherapy. International Journal of Clinical Pharmacy. 2011. Disponible en: http://www.bopadev.co.uk/ contentimages/publications/Toolkit_Ver_3.0_FINAL.pdf.
14. Chapter 797. Pharmaceutical compounding: sterile preparations. [Internet]. USP31–NF26. The United States Pharmacopeia (USP). The ASHP Discussion Guide on USP Chapter for compounding: sterile preparation. June 2008. Disponible en: http://www.ashp.org/doclibrary/ policy/compounding/discguide797-2008.pdf. Pharmaceutical compounding: sterile preparations. Chapter 797. The United States Pharmacopeia (USP). 2015.
15. Faure S, Noirez V. Préparations hospitalières de médicaments anticancéreux à doses standardisées ou «dose-banding». Tech Hosp Med Soc Sanit. 2010;719:27-34.
16. Pouliquen AL, Escalup L, Jourdan N, Cottu P, Faure P, Madelaine-Chambrin I. Dose standardisation of anticancer drugs. Int J Clin Pharm. 2011;33:221-8.
17. Rudek MA, Connolly RM, Hoskins JM, Garrett-Mayer E, Jeter SC, Armstrong DK et al. Fixed-dose capecitabine is feasible: results from a pharmacokinetic and pharmacogenetic study in metastatic breast cancer. Breast Cancer Res Treat. 2013;139(1):135-43.
18. Baker JP, Jones SE. Rationalisation of chemotherapy services in the University Hospital Birmingham National Health Science Trust. J Oncol Pharm Pract. 1998;4(1):10-4.
19. Chatelut E, White-Koning ML, Mathijssen RH, Puisset F, Baker SD, Sparreboom A. Dose banding as an alternative to body surface area-based dosing of chemotherapeutic agents. Br J Cancer. 2012;107(7):1100-6.
20. Bonet E, Rodríguez FJ, Porta B, Merino M, Albert A, Jiménez NV. A carboplatin pharmacokinetic model to establish dose-banding schemes. XI International Symposium on Oncology Pharmacy Practice (ISOPP 2008), Anaheim, California.
21. Jenkins P, Wallis R. Dose-rounding of adjuvant chemotherapy for breast cancer: an audit of toxicity. J Oncol Pharm Pract. 2010;16(4):251-5.
22. Field K, Zelenko A, Kosmider S, Court K, Ng L, Hibbert M, et al. Dose rounding of chemotherapy in colorectal cancer: an analysis of clinician attitudes and the potential impact on treatment costs. Asia Pac J Clin Oncol. 2010;6(3)203-209.
23. Royo MA, Moya A, Porta B, Albert A, Maestu I, Climente M. Opinión de los oncólogos médicos sobre estandarización de dosis en antineoplásicos. 2016. 4º Congreso de Oncología Médica y Farmacia Oncológica.
24. Kaestner SA, Sewell GJ. A National Survey Investigating UK Prescribers’ Opinions on Chemotherapy Dosing and “Dose-Banding.” Clin Oncol. 2009;21:320-8.
25. Ficha Técnica del Medicamento: Levofolinato cálcico 175 mg vial. Disponible en: https://www.aemps.gob. es/cima/fichasTecnicas.do?metodo=detalleForm.
26. Mitka E. Application of Kanban System on a hospital pharmacy. Hell J Nucl Med. 2015;18 Suppl 1:4-10.
27. Tablas retributivas de 2016 para personal sanitario de la Comunidad Valenciana. Disponible en http://www. san.gva.es/web/dgrhs/retribuciones-personal-iiss.
28. Moya A, Hernández M, Climente M, Porta B, Tallón M, Almenar D. Satisfacción de los pacientes onco-hematológicos atendidos en el nuevo Hospital de Día. Libro de Comunicaciones XXXI Congreso Nacional de la Sociedad Española de Calidad Asistencial y I Congreso de la Sociedad Valenciana de Calidad Asistencial. Sociedad Española de Calidad Asistencial. 1ª ed. Valencia; octubre 2013. Disponible en: http://calidadasistencial.es/congresos/2013/galeria-de-imagenes/LIBRO_COMUNICACIONES_ORALES_DEFINITIVO.pdf.
29. Fundación Hospital Calahorra. Fundación Hospital de Calahorra está implantando desde 2004 el Lean como estrategia para mejora de los procesos. [Internet] 2009. [actualizado 2009; citado 12 Dic 2016]. Disponible en: http://www.fhcalahorra.com/noticias/43-fundacion-hospital-calahorra-esta-implantando-desde-2004-el-lean-como-estrategia-para-la-mejora-de-los-procesos.
30. ManMohan S, Sodhi, Navdeep S, Sodhi. Fix the Handful of U.S. Hospitals Responsible for Out-of-Control Costs. [Internet]. Harvar Busines Review. 2013. [actualizado Nov 2013; citado 12 Dic 2016]. Disponible en: https:// hbr.org/2013/11/fix-the-handful-of-u-s-hospitals-responsible-for-out-of-control-costs/.
31. Cuéllar MJ, Reig J, Font I, Poveda JL. Reducción de la fatiga por alertas en un sistema de prescripción electrónica asistida, mediante la metodología Lean Six Sigma. Farm Hosp. 2017;41(1):14-30.
32. Moro-Agud M, González-Fernández MA, Moreno-Ramos F, Jiménez-Nácher I, de Sebastián-Rueda M, Herrero-Ambrosio A. Aplicación de Lean Seis Sigma en la mejora de la calidad del proceso de Atención Farmacéutica a Pacientes Externos. Rev. OFIL 2016, 26;2:87-93.
33. Norme di Buona Preparazione dei Medicinali in Farmacia. Farmacopea Ufficiale. X Edizione; Gennaio 2004. Disponible en: http://www.fog.it/fogliani/giancarlo/ normebp.htm.
34. Vigneron J, Astier A, Trittler R, Hecq JD, Daouphars M, Larsson I, et al. SFPO and ESOP recommendations for the practical stability of anticancer drugs: An update. Annales Pharmaceutiques Françaises. 2013;71,376-389.
35. Farmacotecnia boletín informativo SEFH. Volumen 4. Nº 2 mayo – agosto 2014. Disponible en http:// gruposdetrabajo.sefh.es/farmacotecnia/images/stories/Boletines/BOLETIN_2_2014_final.pdf.
36. NHS England. Servicio Nacional de Salud de Reino Unido. Disponible en: http://www.nhs.uk/pages/ home.aspx.
37. The Pharmaceutical Journal, PJ May 2016 online. DOI: 10.1211/PJ.2016.20201231. Chemotherapy dose banding to be rolled out across England.
____
Descargar artículo en PDF: Dose banding de levofolinato cálcico en cáncer colo-rectal metastásico como herramienta Lean para el proceso farmacoterapéutico oncológico
