1 Servicio de Farmacia
2 Servicio de Medicina Intensiva
Hospital General Universitario de Ciudad Real (España)
Fecha de recepción: 19/04/2021 – Fecha de aceptación: 11/05/2021
Correspondencia: Abraham David Sánchez Cadena – Hospital General Universitario de Ciudad Real (Servicio de Farmacia) – Calle Obispo Rafael Torija, s/n – 13005 Ciudad Real (España)
asancad@gmail.com
_____
Resumen
Introducción: El objetivo principal del estudio fue evaluar la necesidad de ajuste posológico de ceftriaxona en pacientes críticos hipoproteinémicos.
Pacientes y métodos: Estudio observacional y retrospectivo, llevado a cabo en la unidad de cuidados intensivos (UCI) del Hospital General Universitario de Ciudad Real (médico-quirúrgica de 21 camas), en el que se incluyeron pacientes tratados con ceftriaxona en la UCI desde enero de 2014 a diciembre de 2019 y se clasificaron en dos grupos al inicio del tratamiento: pacientes normoproteinémicos (proteínas totales >5,5g/dl) e hipoproteinémicos (proteínas totales ≤5,5g/dl).
Variables principales: Edad, sexo, APACHE II, diagnóstico-localización del foco infeccioso, estancia en UCI, dosis de ceftriaxona, pauta posológica, tratamiento antibiótico concomitante, empírico o dirigido, necesidad de cambio de tratamiento, días de antibioterapia y mortalidad.
Resultados: Se incluyeron 98 pacientes (44 normoproteinémicos y 54 hipoproteinémicos).
No se obtuvieron diferencias estadísticamente significativas entre las características basales de ambos grupos, exceptuando la localización del foco, siendo respiratorio con mayor frecuencia en el grupo de pacientes normoproteinémicos (p=0,044).
Se obtuvieron diferencias estadísticamente significativas a favor del grupo de pacientes normoproteinémicos para: estancia en UCI (p=0,001), necesidad de cambio de tratamiento antibiótico (p=0,004), días de antibioterapia (p=0,007) y mortalidad (p=0,046).
Conclusión: Los resultados terapéuticos obtenidos en el grupo de pacientes críticos hipoproteinémicos tratados con ceftriaxona ponen en evidencia la necesidad de considerar la hipoproteinemia como un factor que podría condicionar dicho resultado si se emplean las pautas posológicas de tratamiento habituales.
Palabras clave: Ceftriaxona, hipoproteinemia, unión a proteínas plasmáticas, dosificación, monitorización, farmacocinética.
Dosage of ceftriaxone in the critical hypoproteinemic patient: another factor to take into account
Summary
Introduction: The main objective of the study was to evaluate the need for posologic adjustment of ceftriaxone in critical hypoproteinemic patients.
Patients and methods: Observational and retrospective study, carried out in the intensive care unit (ICU) of the General University Hospital of Ciudad Real (21-bed medical-surgical), which included patients treated with ceftriaxone in the ICU from January 2014 to December 2019 and classified into two groups at the beginning of treatment: normoproteinemic (total proteins >5.5 g/dl) and hypoproteinemic (total proteins ≤5.5g/dl) patients.
Main variables: Age, sex, APACHE II, diagnosis-location of the infectious site, ICU stay, ceftriaxone dose, dosage regimen, concomitant antibiotic treatment, empirical or targeted antibiotic treatment, need to change treatment, days of antibiotic therapy and mortality.
Results: 98 patients were included (44 normoproteinemics and 54 hypoproteinemics).
No statistically significant differences were obtained between the basal characteristics of both groups, except for the location of the infectious site, being respiratory more frequently in the group of normoproteinemic patients (p=0.044).
Statistically significant differences were obtained in favour of the group of normoproteinemic patients for: stay in ICU (p=0.001), need for change of antibiotic treatment (p=0.004), days of antibiotherapy (p=0.007) and mortality (p=0.046).
Conclusion: The therapeutic results obtained in the group of critical hypoproteinemic patients treated with ceftriaxone show the need to consider hypoproteinemia as a factor that could condition such result if the usual treatment dosage guidelines are used.
Key words: Ceftriaxone, hypoproteinaemia, plasma protein binding, dosage, therapeutic drug monitoring, pharmacokinetics.
____
INTRODUCCIÓN
La escasez de innovación científica en el ámbito de los tratamientos antimicrobianos sumado al impacto social actualmente generado en torno a los mismos, ha motivado la creación de programas de optimización de este grupo de medicamentos (grupos PROA, proyecto resistencia zero, neumonía zero, plan nacional de resistencias…) en el seno de equipos multidisciplinares, con la intención de mejorar el manejo de las infecciones. En este sentido se han orientado estudios actuales que rescatan terapias antimicrobianas menos empleadas (fosfomicina, ácido fusídico…) y comparan diferentes pautas posológicas y formas de administración en la búsqueda de la más adecuada, con el fin de mejorar la efectividad y reservar tratamientos con mayor espectro (Ej: carbapenémicos)1-4.
La ceftriaxona, antibiótico perteneciente a las cefalosporinas de tercera generación, es una molécula hidrofílica y con elevada vida media (8,5 h), atribuido a su elevado porcentaje de unión a proteínas plasmáticas (85-95%), lo que hace que pueda ser administrada una única vez al día5. Como todo β-lactámico, es el porcentaje de tiempo que su concentración plasmática permanece por encima de la CMI (concentración mínima inhibitoria) del microorganismo en el intervalo entre dos dosis el parámetro PK-PD (Pharmacokinetic-pharmacodynamic) que mejor define su eficacia6. Sin embargo, determinadas situaciones clínicas podrían alterar sus propiedades farmacocinéticas.
En el paciente crítico, factores fisiopatológicos como la sepsis grave o el shock séptico, la hipoalbuminemia, los grandes quemados, leucemias… además de factores iatrogénicos como la sobrecarga de fluidos, el empleo de técnicas de reemplazo renal y/o drogas vasoactivas podrían alterar las propiedades farmacocinéticas de determinados antibióticos, alterando principalmente parámetros como el volumen de distribución y el aclaramiento plasmático, pudiendo por ende condicionar la efectividad del tratamiento7,8.
Puesto que es la concentración de fármaco libre en plasma, no unida a proteínas plasmáticas, la que es distribuida y eliminada del organismo, la hipoproteinemia, habitualmente presente en el paciente crítico, se presume como un factor que podría condicionar el resultado terapéutico de fármacos con un elevado porcentaje de unión a las mismas, como es el caso de la ceftriaxona9. Las fichas técnicas no recogen recomendaciones específicas y es habitual que no se haga ajuste posológico en pacientes críticos con hipoproteinemia, pero ¿será suficiente con emplear las pautas posológicas habituales de ceftriaxona en estas situaciones?10,11.
Se plantea realizar un estudio para evaluar la necesidad de ajuste posológico de ceftriaxona en pacientes críticos hipoproteinémicos.
PACIENTES Y MÉTODOS
Estudio retrospectivo y observacional, en el que se reclutaron pacientes desde enero de 2014 a diciembre de 2019 y se clasificaron en dos grupos: pacientes normoproteinémicos (grupo 1) y pacientes hipoproteinémicos (grupo 2). Se definió hipoproteinemia como un valor de proteínas totales igual o inferior a 5,5 g/dl en el momento de inicio de tratamiento con ceftriaxona.
Criterios de inclusión: todos los pacientes que ingresan en UCI e inician tratamiento antibiótico con ceftriaxona y que además cuenten con analíticas con valores de proteínas totales determinadas entre 48-72 h antes de dicho inicio de tratamiento.
Criterios de exclusión: pacientes con una duración de tratamiento con ceftriaxona inferior a 48 horas y pacientes que recibieron otro tratamiento antibiótico en las 48 horas previas al inicio con ceftriaxona.
Variables del estudio: sexo, edad, APACHE II al ingreso, diagnóstico-localización del foco infeccioso para el que fue indicado el tratamiento con ceftriaxona, días de estancia en UCI, dosis diaria de ceftriaxona, pauta posológica, monoterapia o tratamiento combinado con otro antibiótico, tratamiento antibiótico empírico o dirigido, necesidad cambio a otro antibiótico y motivo del cambio, días de tratamiento antibiótico completo (incluyendo días de ceftriaxona y otros antibióticos añadidos posteriormente) y tasa de mortalidad.
En la variable cambio a otro tratamiento antibiótico no se consideraron como cambios a aquellos que iban dirigidos a agentes infecciosos aislados posteriormente al inicio del tratamiento con ceftriaxona y/o a los ajustes del tratamiento a resultados de antibiogramas.
Análisis estadístico: se llevó a cabo un análisis empleando la prueba estadística de Chi cuadrado para las variables categóricas y la T de student para muestras independientes en el caso de las variables cuantitativas, considerándose la significación estadística a un p valor inferior a 0,05 y, por tanto, un intervalo de confianza del 95%.
RESULTADOS
En el periodo de estudio se analizaron un total de 475 pacientes, de los cuales se incluyeron un 98: 44 en el grupo 1 y 54 en el grupo 2.
Los resultados de las variables analizadas se muestran en la tabla 1.
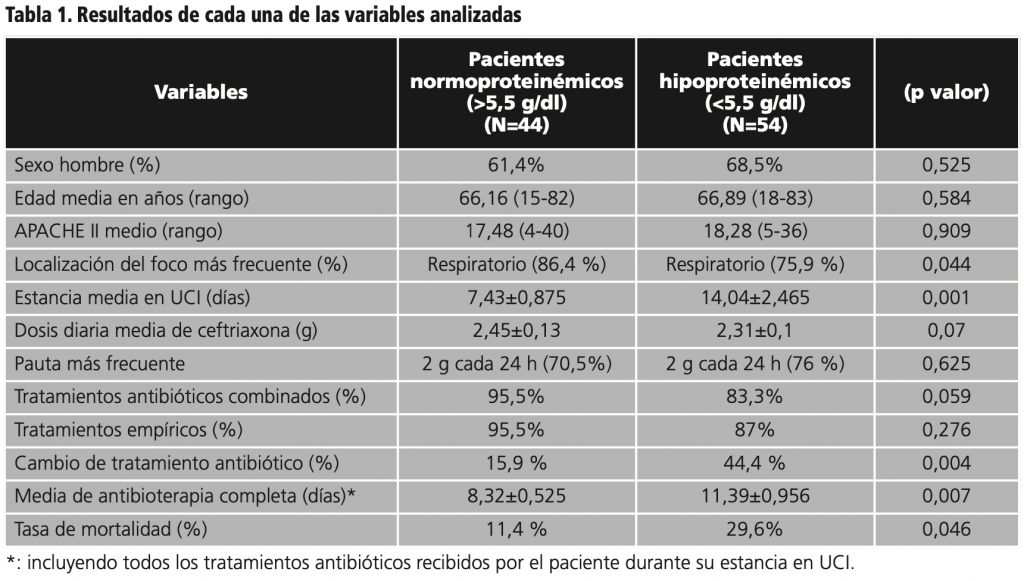
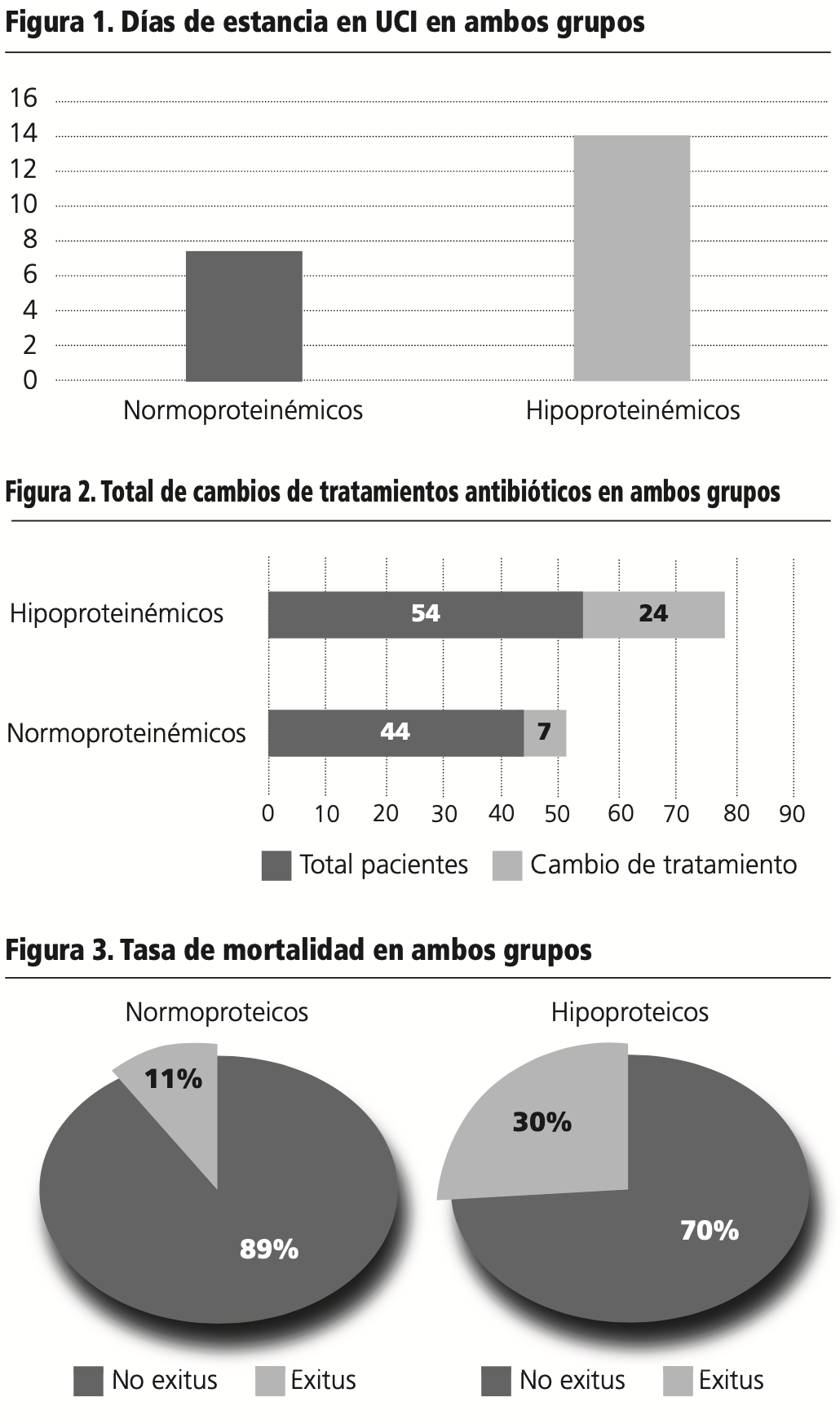
Grupo 1: 61,4% eran hombres, edad media de 66,16 años, APACHE II medio de 17,48 (4-40), diagnóstico-localización del foco infeccioso más frecuente para el que fue indicado el tratamiento con ceftriaxona fue respiratorio en el 86,4% de los casos, la media de días de estancia en UCI fue de 7,43, la dosis diaria media de ceftriaxona fue de 2,45 g, la pauta más frecuente fue 2g cada 24h en el 70,5%, fueron tratamientos antibióticos combinados el 95,5% de los casos, fueron tratamientos empíricos el 95,5%, el 15,9% de los pacientes requirieron cambios de tratamiento antibiótico, la media de días de antibioterapia fue de 8,32 y la tasa de mortalidad fue del 11,4%.
Grupo 2: 68,5% eran hombres, edad media de 66,89 años, APACHE II medio de 18,28 (4-40), diagnóstico-localización del foco infeccioso más frecuente para el que fue indicado el tratamiento con ceftriaxona fue respiratorio en el 75,9% de los casos, la media de días de estancia en UCI fue de 14,04, la dosis diaria media de ceftriaxona fue de 2,31 g, la pauta más frecuente fue 2g cada 24h en el 76%, fueron tratamientos antibióticos combinados el 83,3% de los casos, fueron tratamientos empíricos el 87%, el 44,4% de los pacientes requirieron cambios de tratamiento antibiótico, la media de días de antibioterapia fue de 11,39 y la tasa de mortalidad fue del 29,6%.
Exceptuando el foco infeccioso, respiratorio como localización más frecuente en ambos grupos, aunque más en el grupo de pacientes normoproteinémicos, no se obtuvieron diferencias estadísticamente significativas en cuanto a las características basales de ambos grupos (tabla 1).
Se obtuvieron diferencias estadísticamente significativas en las variables relacionadas con la efectividad del tratamiento con ceftriaxona, a favor del grupo de pacientes normoproteinémicos, como: los días de estancia en UCI; p=0,001 (figura1), el porcentaje de cambios de tratamiento antibiótico; p=0,004 (figura 2), los días de tratamiento antibiótico; p=0,007 y la tasa de mortalidad; p=0,046 (figura 3).
DISCUSIÓN
Algún metaanálisis publicado concluye que las diferentes características fisiopatológicas anteriormente mencionadas presentes en los pacientes críticos, sumado al uso de farmacoterapia como las drogas vasoactivas, fluidoterapia y diferentes técnicas de reemplazo renal, podrían alterar la farmacocinética y farmacodinámica de diferentes antimicrobianos, aumentando las probabilidades de infradosificación, la selección de cepas de microorganismos multirresistentes, cada vez más frecuentes en las unidades de cuidados intensivos, y por tanto afectando a la efectividad del tratamiento12. Nuestro estudio sugiere unos peores resultados clínicos en el caso de pacientes críticos hipoproteinémicos tratados con ceftriaxona comparado con pacientes con proteínas totales normales, siendo la gravedad inicial (APACHE II) similar en ambos grupos.
En el caso particular de los antibióticos betalactámicos, el porcentaje de tiempo que las concentraciones plasmáticas deben encontrarse por encima de la CMI del microorganismo en el intervalo entre dos dosis debe ser mínimo del 50%. Aunque ensayos clínicos como el estudio DALI sugieren que, para garantizar un mejor resultado terapéutico en el paciente crítico, dicho porcentaje debería situarse en el 100%13. Existen diferentes estrategias para alcanzar este objetivo, las más empleadas son modificar la dosis, añadir dosis de carga, acortar los intervalos de administración y modificar las formas de administración habituales de estos medicamentos con perfusiones continuas o perfusiones extendidas14,17. Nuestro estudio pone de manifiesto que, a pesar de las ventajas teóricas de administrar ceftriaxona en pacientes con proteínas bajas con intervalos posológicos más cortos, esto no se aplica, probablemente debido a falta de estudios en estos pacientes, a la falta de recomendaciones en guías y fichas técnicas y a la dificultad de poder contar con las técnicas e instrumental adecuados que nos permita medir niveles plasmáticos de fármaco en la práctica clínica habitual.
Por otro lado, en situaciones de aclaramientos de creatinina aumentados, presentes en determinadas fases de un proceso séptico grave, se ha observado que, para aquellos antibióticos en los que predomina la eliminación por vía renal, como es el caso de los antibióticos betalactámicos, podría no alcanzarse el objetivo terapéutico deseado18. Esta situación también podría darse en el paciente crítico hipoproteinémico para antibióticos con un alto porcentaje de unión a proteínas plasmáticas como la ceftriaxona, puesto que es la fracción libre de fármaco en el organismo, no unida a proteínas plasmáticas, la que se elimina del mismo19. Estas situaciones exponen al paciente crítico a una mayor variabilidad intra e interindividual en las concentraciones plasmáticas de estos antimicrobianos20.
El interés suscitado en la monitorización farmacocinética de los antimicrobianos ha sido clásicamente justificado para aquellos con una mayor tasa de incidencia de efectos adversos graves como aminoglucósidos y glicopéptidos. Sin embargo, para antibióticos con baja incidencia de efectos adversos como los betalactámicos, ésta no ha llegado a adquirir a día de hoy el impacto suficiente como para ser instaurada en los protocolos habituales intrahospitalarios. Aunque la evidencia actualmente disponible cada vez apoya más la necesidad de realizar monitorización farmacocinética, no sólo para evitar efectos tóxicos, sino también para poder garantizar la efectividad terapéutica21. En este sentido se ha puesto en marcha un ensayo clínico aleatorizado multicéntrico cuyo protocolo ha sido recientemente publicado, el estudio Dolphin, el cual pretende aclarar el beneficio de la monitorización farmacocinética de betalactámicos y fluorquinolonas en el paciente crítico22.
Aunque algunos estudios ponen en duda pautas posológicas de ceftriaxona previamente establecidas como válidas para el paciente crítico23. En nuestro caso, se necesitarían estudios para poder responder a la pregunta de si podría establecerse una pauta óptima o por el contrario sería necesaria la monitorización de niveles plasmáticos en los pacientes críticos hipoproteinémicos tratados con ceftriaxona.
A pesar de los resultados obtenidos, este estudio presenta una serie de limitaciones: se trata de un estudio retrospectivo, unicéntrico y de cohorte limitada de pacientes. Al no haberse medido niveles plasmáticos de ceftriaxona no se pudo correlacionar una baja concentración de la misma con esa aparente falta de efectividad del tratamiento en el grupo de pacientes hipoproteinémicos. Aunque para la hipoproteinemia se consideraron valores de proteínas totales por debajo de las cuales suele predominar la hipoalbuminemia, no se midió concentración plasmática de albúmina.
CONCLUSIÓN
Este es el primer estudio que pretende relacionar el resultado terapéutico de un tratamiento antibiótico con alto porcentaje de unión a proteínas plasmáticas, como es el caso de la ceftriaxona, con la presencia de una baja concentración plasmática de las mismas al inicio del tratamiento.
Los resultados obtenidos sugieren que la hipoproteinemia podría ser un factor determinante en el resultado terapéutico del tratamiento con ceftriaxona del paciente crítico hipoproteinémico, factor que se suma a esa variabilidad interindividual de parámetros farmacocinéticos directamente dependientes de las características fisiopatológicas del paciente crítico. Hecho que sumaría valor, junto con el resto de evidencia publicada, a la necesidad de monitorización de las concentraciones plasmáticas para individualizar las dosis administradas y establecer las formas de administración más adecuadas necesarias para alcanzar el objetivo terapéutico en este grupo de pacientes.
Estos resultados abren paso a nuevas líneas de investigación que nos ayuden a responder preguntas como: ¿sería necesario protocolizar la medición de proteínas totales y/o concentraciones plasmáticas de albúmina al ingreso en UCI de todos los pacientes críticos tratados con ceftriaxona? ¿qué pasa con el resto de antibióticos con alto porcentaje de unión a proteínas plasmáticas? Debido al buen perfil de seguridad de los antibióticos betalactámicos, ¿se podría considerar el aumento empírico, sin monitorización de concentraciones plasmáticas de fármaco? ¿qué papel juega la monitorización farmacocinética de los antibióticos betalactámicos en este grupo de pacientes?
Conflicto de intereses: Los autores declaran no tener conflicto de intereses.
BIBLIOGRAFÍA
1. Dyar OJ, Huttner B, Schouten J, Pulcini C. What is antimicrobial stewardship? Clin Microbiol Infect. 2017;23(11):793-798.
2. De Waele JJ, Akova M, Antonelli M, Canton R, Carlet J, De Backer D, et al. Antimicrobial resistance and antibiotic stewardship programs in the ICU: insistence and persistence in the fight against resistance. A position statement from ESICM/ESCMID/WAAAR round table on multi-drug resistance. Intensive Care Med. 2018;44(2):189-196.
3. Grabein B, Graninger W, Rodríguez Baño J, Dinh A, Liesenfeld DB. Intravenous fosfomycin-back to the future. Systematic review and meta-analysis of the clinical literature Clin Microbiol Infect. 2017;23(6):363-372.
4. Dimopoulos G, Koulenti D, Parker SL, Roberts JA, Arvaniti K, Poulakou G. Intravenous fosfomycin for the treatment of multidrug-resistant pathogens: what is the evidence on dosing regimens? Expert Rev Anti Infect Ther. 2019; 17(3):201-210.
5. Lexicomp®. Ceftriaxone Lexi-Drugs Multinational. Consultado el 5 de noviembre de 2020. Disponible en: https://online.lexi.com/lco/action/doc/retrieve/docid/multinat_f/4668918?cesid=0m8wPRkGCJU&searchUrl=%2Flco%2Faction%2Fsearch%3Fq%3Dceftriaxona%26t%3Dname%26va%3Dceftriaxona#pha.
6. Cotta MO, Roberts JA, Lipman J. Antibiotic dose optimization in critically ill patients. Med Intensiva. 2015; 39(9):563-72.
7. Pea F. Plasma Pharmacokinetics of Antimicrobial Agents in Critically Ill Patients. Curr Clin Pharmacol. 2013;8(1):5-12.
8. Trotman RL, Williamson JC, Shoemaker DM, Salzer WL. Antibiotic dosing in critically ill adult patients receiving continuous renal replacement therapy. Clin Infect Dis. 2005;41(8):1159-66.
9. Ulldemolins M, Roberts JA, Rello J, Paterson DL, Lipman J. The effects of hypoalbuminaemia on optimizing antibacterial dosing in critically ill patients. Clin Pharmacokinet. 2011; 50(2):99-110.
10. Joynt GM, Lipman J, Gomersall CD, Young RJ, Wong ELY, Gin T. The pharmacokinetics of once-daily dosing of ceftriaxone in critically ill patients. J Antimicrob Chemother. 2001;47(4):421-9.
11. Ficha técnica de ceftriaxona. Consultado el 5 de noviembre de 2020. Disponible en: https://cima.aemps.es/cima/dochtml/ft/64539/FT_64539.html.
12. Veiga RP, Paiva JA. Pharmacokinetics–pharmacodynamics issues relevant for the clinical use of beta-lactam antibiotics in critically ill patients. Crit Care. 2018; 22(1):233.
13. Roberts JA, Paul SK, Akova M, Bassetti M, De Waele JJ, Dimopoulos G, et al. DALI: Defining antibiotic levels in intensive care unit patients: Are current ß-lactam antibiotic doses sufficient for critically ill patients? Clin Infect Dis. 2014; 58(8):1072-83.
14. Berthoin K, Le Duff CS, Marchand-Brynaert J, Carryn S, Tulkens PM. Stability of meropenem and doripenem solutions for administration by continuous infusion. J Antimicrob Chemother. 2010; 65(5):1073-5.
15. Roberts JA, Abdul-Aziz MH, Davis JS, Dulhunty JM, Cotta MO, Myburgh J, et al. Continuous versus intermittent β-lactam infusion in severe sepsis: A meta-analysis of individual patient data from randomized trials. Am J Respir Crit Care Med. 2016;194(6):681-91.
16. Dulhunty JM, Roberts JA, Davis JS, Webb SAR, Bellomo R, Gomersall C, et al. Continuous infusion of beta-lactam antibiotics in severe sepsis: A multicenter double-blind, randomized controlled trial. Clin Infect Dis. 2013;56(2):236-44.
17. Leegwater E, Kraaijenbrink BVC, Moes DJAR, Purmer IM, Wilms EB. Population pharmacokinetics of ceftriaxone administered as continuous or intermittent infusion in critically ill patients. J Antimicrob Chemother. 2020; 75(6):1554-1558.
18. Ollivier J, Carrié C, d’Houdain N, Djabarouti S, Petit L, Xuereb F, et al. Are standard dosing regimens of ceftriaxone adapted for critically ill patients with augmented creatinine clearance? Antimicrob Agents Chemother. 2019; 63(3):e02134-18.
19. Schleibinger M, Steinbach CL, Töpper C, Kratzer A, Liebchen U, Kees F, et al. Protein binding characteristics and pharmacokinetics of ceftriaxone in intensive care unit patients. Br J Clin Pharmacol. 2015;80(3):525-33.
20. Roberts JA, Pea F, Lipman J. The clinical relevance of plasma protein binding changes. Clin Pharmacokinet. 2013;52(1):1-8.
21. Hayashi Y, Lipman J, Udy AA, Ng M, McWhinney B, Ungerer J, et al. β-Lactam therapeutic drug monitoring in the critically ill: Optimising drug exposure in patients with fluctuating renal function and hypoalbuminaemia. Int J Antimicrob Agents. 2013;41(2):162-6.
22. Abdulla A, Ewoldt TMJ, Hunfeld NGM, Muller AE, Rietdijk WJR, Polinder S, et al. The effect of therapeutic drug monitoring of beta-lactam and fluoroquinolones on clinical outcome in critically ill patients: The DOLPHIN trial protocol of a multi-centre randomised controlled trial. BMC Infect Dis. 2020;20(1):57.
23. Sime FB, Roberts MS, Peake SL, Lipman J, Roberts JA. Does beta-lactam pharmacokinetic variability in critically III patients justify therapeutic drug monitoring? A systematic review. Ann Intensive Care. 2012; 2(1):35.
____