Navarro Pardo I1, Agustín Ferrández MJ2, Santander Lobera C3, Escolano Pueyo A1, Galindo Allugama M1, Abad Sazatornil MR4
1 Farmacéutico Interno Residente
2 Farmacéutico Especialista en Farmacia Hospitalaria. Adjunto
3 Médico Especialista en Oncología Médica. Adjunto
4 Farmacéutico Especialista en Farmacia Hospitalaria. Jefe de Servicio
Hospital Universitario Miguel Servet. Zaragoza (España)
____
Rev. OFIL 2016, 26;3:185-192
Fecha de recepción: 11/05/2015 – Fecha de aceptación: 28/07/2015
____
Resumen
Objetivo: Analizar la efectividad y seguridad de cabazitaxel y abiraterona post-docetaxel en pacientes con cáncer de próstata metastásico resistente a castración (CPRCm), seleccionados según el protocolo de uso de Abiraterona/Cabazitaxel de la Comunidad Autónoma.
Métodos: Estudio observacional retrospectivo de los pacientes que iniciaron tratamiento con cabazitaxel y abiraterona entre enero-2011 y mayo-2014, finalizando el seguimiento en febrero-2015. La efectividad se analizó mediante: supervivencia global (SG) y supervivencia libre de progresión (SLP). Para evaluar la seguridad se registraron los eventos adversos y su gravedad.
Resultados: Se incluyeron 17 pacientes tratados con abiraterona, 17 con cabazitaxel, 4 recibieron terapia secuencial con cabazitaxel y abiraterona. La mediana de SG y SLP fue 16,90 y 6,50 meses para cabazitaxel y 16,90 y 5,27 meses para abiraterona. Un mayor porcentaje de pacientes ≥75 años recibió tratamiento con abiraterona frente a cabazitaxel (33,3% vs. 5,9%). Respecto a la duración de la hormonoterapia (HT) previa, la mediana de SG y SLP fue mayor para los que habían recibido HT ≥16 meses frente a aquellos que recibieron <16 meses (SG 19,00 vs. 10,23 meses, p=0,029, y SLP 6,03 vs. 2,80 meses, p=0,007, respectivamente). Los efectos adversos más frecuentes fueron grado 1-2.
Conclusiones: La inclusión de estos fármacos en el arsenal terapéutico ha demostrado prolongar la supervivencia de los pacientes con CPRCm post-docetaxel. Se pone de manifiesto la importancia de protocolizar su uso para conseguir el máximo beneficio.
Palabras clave: Abiraterona, cabazitaxel, cáncer de próstata metastásico resistente a castración, post-docetaxel, efectividad, seguridad.
____
Introducción
El cáncer de próstata (CP) supone un importante problema de salud pública, siendo el segundo cáncer más frecuente y la quinta causa de muerte por cáncer en hombres a nivel mundial, con una incidencia estimada de 1,1 millones de casos y 307.000 muertes en 20121. El CP es más común en varones de edad avanzada, con mayor incidencia en hombres entre 60-70 años2.
El tratamiento estándar del CP avanzado consiste en la supresión androgénica, bien mediante castración quirúrgica o farmacológica (análogos de hormona liberadora de la hormona luteinizante y antiandrógenos)3. A pesar de la presencia de bajos niveles séricos de testosterona alcanzados, el tumor progresa finalmente hacia un estado denominado cáncer de próstata metastásico resistente a castración (CPRCm), de mal pronóstico y baja supervivencia3. Docetaxel fue el primer fármaco que demostró mejorar la supervivencia y calidad de vida en pacientes con CPRCm frente a mitoxantrona (supervivencia global (SG) 18,9 meses frente a 16,5 meses, respectivamente)4. Durante los últimos 4 años se han desarrollado fármacos que han demostrado prolongar la supervivencia de pacientes con CPRCm tras progresión con docetaxel3-5. De ellos, durante el periodo del estudio, cabazitaxel y acetato de abiraterona son los que han estado disponibles en nuestro hospital.
Cabazitaxel es un agente antineoplásico de la familia de los taxanos que se une y estabiliza la tubulina, inhibiendo la despolimerización de los microtúbulos y con ello la división mitótica de las células7. Con mecanismo de acción diferente, acetato de abiraterona inhibe selectivamente la enzima que participa en la biosíntesis de andrógenos, 17-α-hidroxilasa/C17,20-liasa (CYP17), tanto en los tejidos testiculares como suprarrenales y tejidos prostáticos tumorales, dando lugar a una reducción de los niveles de andrógenos por debajo de los niveles obtenidos con la terapia de supresión androgénica convencional8.
Dada la falta de estudios comparativos directos y guías terapéuticas que establezcan criterios para seleccionar el tratamiento post-docetaxel más adecuado en pacientes con CPRCm, y teniendo en cuenta el diferente mecanismo de acción y perfil de toxicidad de ambos fármacos, se elaboró a nivel autonómico un Protocolo de uso de Abiraterona/Cabazitaxel9 en diciembre de 2012, basado en los ensayos clínicos, considerando además estudios no aleatorizados, retrospectivos, análisis de subgrupos y consensos de expertos.
El objetivo de nuestro estudio es analizar la efectividad y seguridad del uso de cabazitaxel y abiraterona en hombres con CPRCm post-docetaxel, seleccionados según los criterios del protocolo establecido.
Material y métodos
Estudio descriptivo observacional, retrospectivo, unicéntrico, en pacientes con CPRCm que han iniciado tratamiento con cabazitaxel y/o abiraterona en el periodo comprendido entre enero de 2011 hasta mayo de 2014, finalizando el seguimiento en febrero de 2015. Se incluyeron todos los pacientes varones mayores de 18 años con confirmación histológica de CP que habían recibido hormonoterapia (HT) previa y que iniciaron tratamiento con cabazitaxel y/o abiraterona tras progresión a la terapia con docetaxel. Se excluyeron del estudio aquellos pacientes que habían recibido tratamiento con cabazitaxel o abiraterona previo a docetaxel.
La información recogida se obtuvo del programa de dispensación de medicamentos, Farmatools®, programa de prescripción y validación de citostáticos, Oncowin®, y de la revisión sistemática de historias clínicas disponibles en el Servicio de Archivos del hospital, así como de la historia clínica electrónica.
Se recogieron variables demográficas (edad), clínicas (escala tumoral Gleason, estado funcional ECOG y localización de metástasis al inicio del tratamiento), analíticas (concentración sérica de antígeno prostático específico (PSA) al inicio, durante y fin de tratamiento) y terapéuticas (terapia antitumoral recibida previamente, duración HT previa, duración del tratamiento, dosis total y número de ciclos).
El objetivo principal de efectividad fue la mediana de SG. Los objetivos secundarios incluyen la mediana de SLP, definida como progresión por PSA, clínica, radiológica o muerte, según los criterios del grupo Prostate Cancer Working Group 2 (PCWG2)10 y la respuesta bioquímica o por PSA, definida como disminución de la concentración sérica de PSA ≥50%10.
La seguridad se evaluó mediante el registro de efectos adversos (EA), clasificados en función de su gravedad según criterios Common Terminology Criteria of Adverse Events versión 4.02 (CTCAE), interrupción de tratamiento, retraso de ciclos, modificación posológica y tratamiento/profilaxis con factores estimulantes de colonias granulocíticas (G-CSF).
El análisis de los datos se realizó mediante el paquete estadístico SPSS v.19.0. Para la estadística descriptiva se calculó la media y desviación estándar de las variables cuantitativas de distribución normal, y la mediana y rango del resto de variables cuantitativas, así como las frecuencias absolutas y relativas de las variables cualitativas. Se utilizó el test de Shapiro-Wilk para estudiar la distribución de las variables cuantitativas. El análisis de supervivencia se realizó mediante el método de Kaplan-Meier, y los test Log-rank y Tarone-Ware para analizar las diferencias según los factores. El estudio fue diseñado para un nivel de confianza del 95%.
Resultados
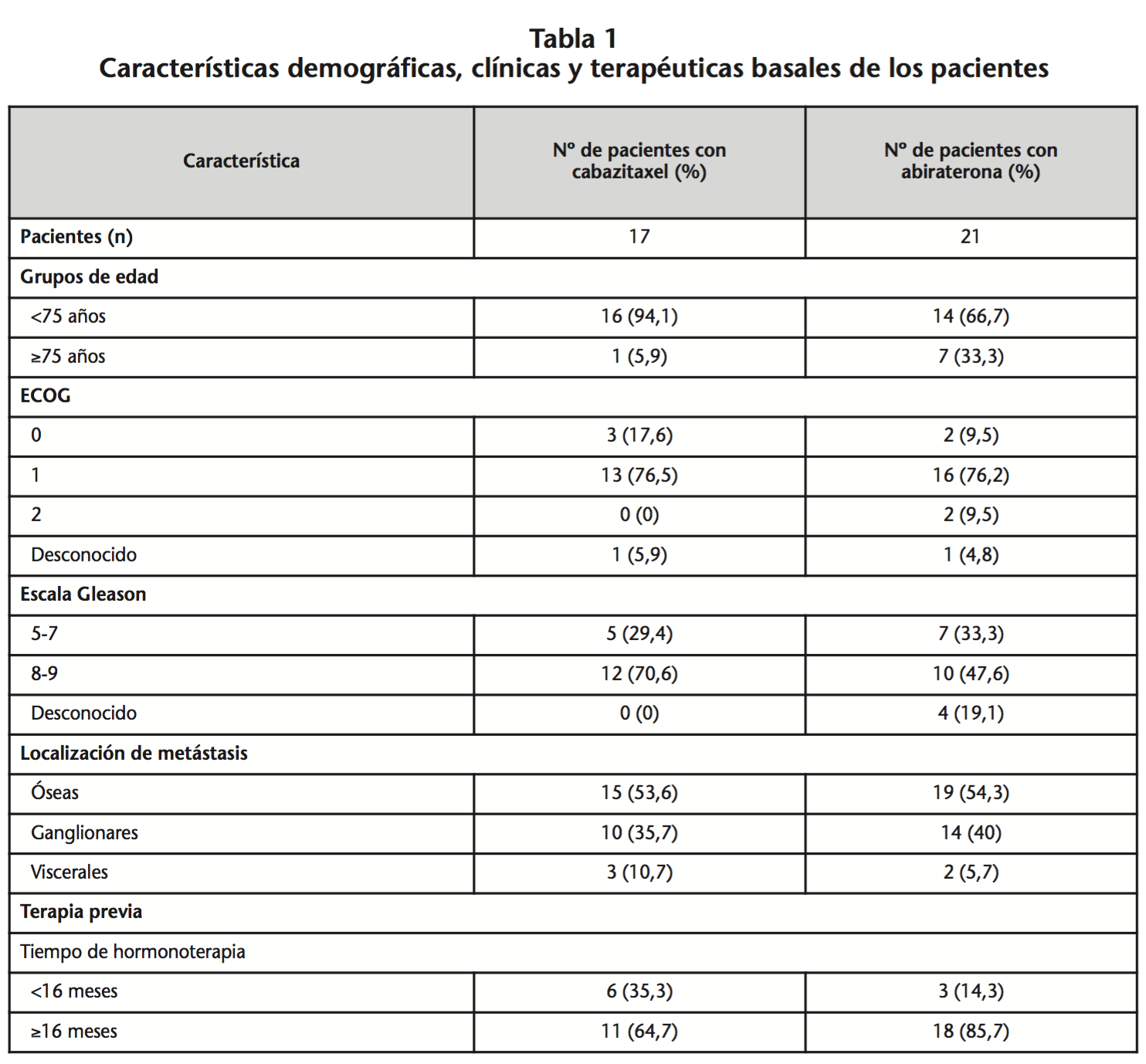
Se incluyeron 34 pacientes con CPRCm, 17 iniciaron tratamiento con abiraterona y 17 con cabazitaxel, de los cuales 4 recibieron terapia secuencial con cabazitaxel y, posteriormente, abiraterona (Figura 1). La mediana de edad de inicio de tratamiento fue 67,66 años (rango 39-77) y 71 años (rango 39-84) para cabazitaxel y abiraterona, respectivamente. Las características demográficas, clínicas y terapéuticas basales se muestran en la tabla 1.
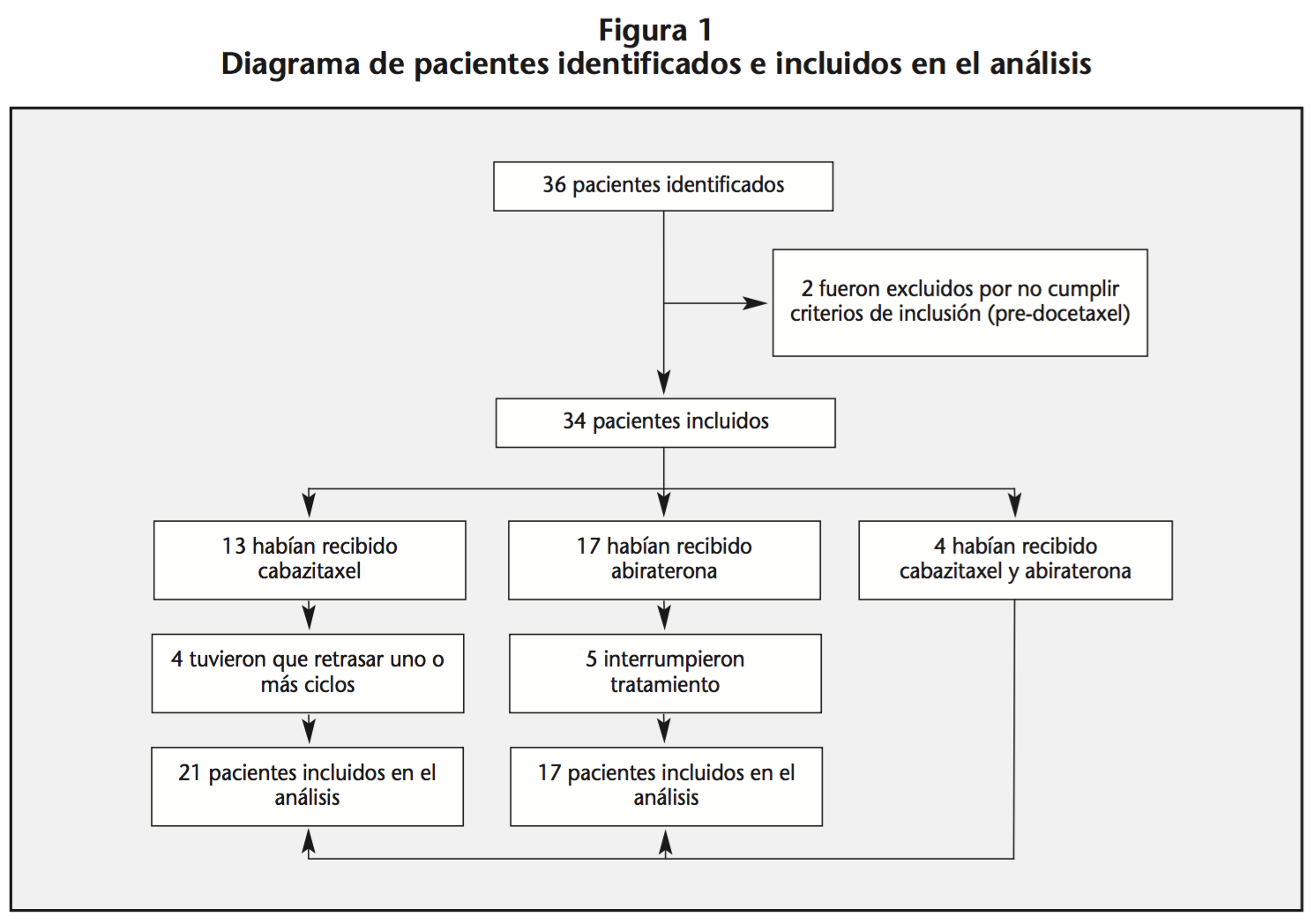
En cuanto a la terapia objeto del estudio, los pacientes recibieron una media de 5,53±2,38 ciclos de cabazitaxel intravenoso 25 mg/m2 cada 21 días, siendo la dosis media 274,77±126,377 mg, junto con prednisona oral 10 mg/día. Los pacientes que recibieron abiraterona por vía oral a dosis diaria de 1.000 mg junto con prednisona oral 10 mg/día, fueron tratados durante una mediana de 5,27 (1,03-15,63) meses.
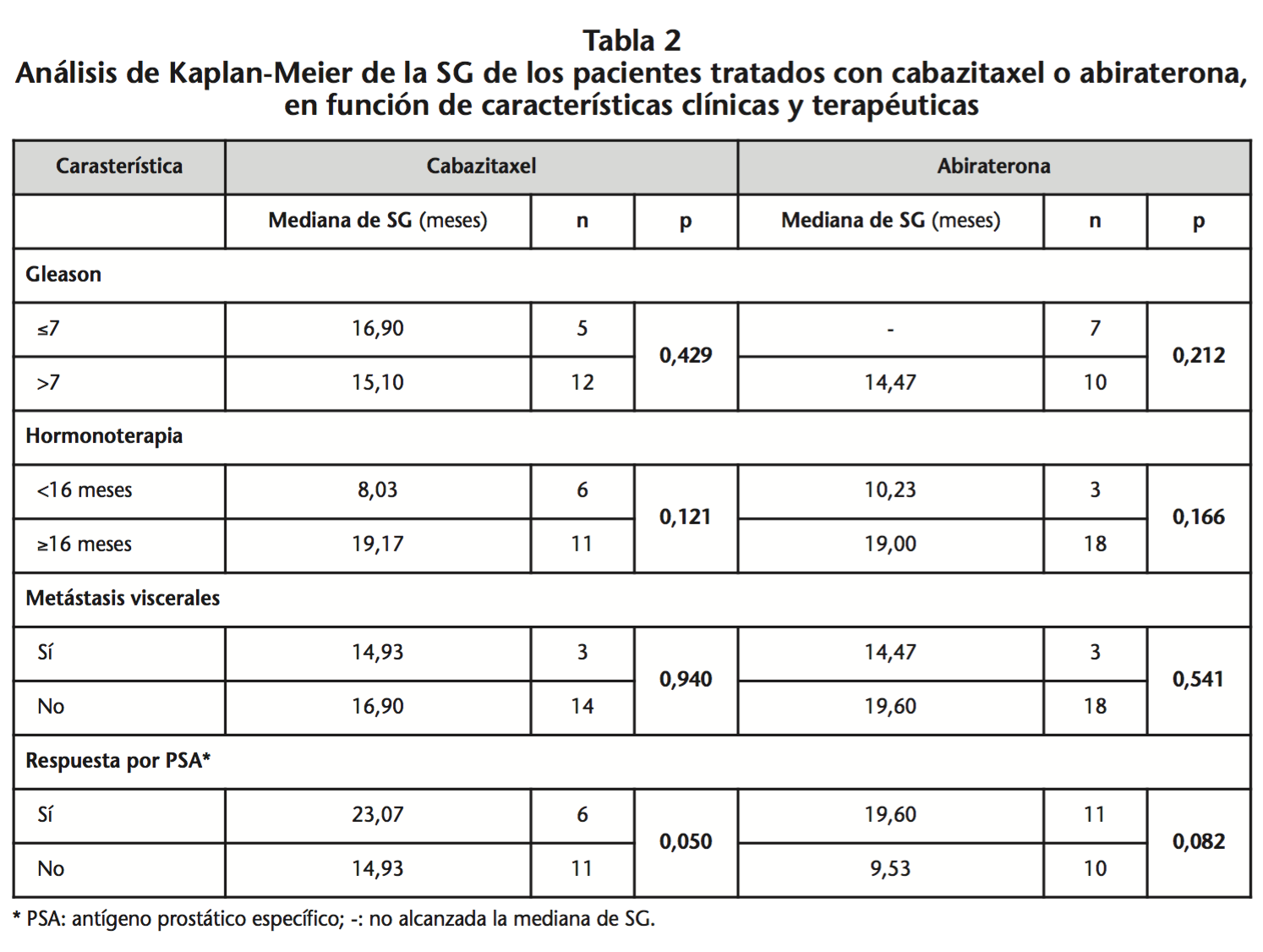
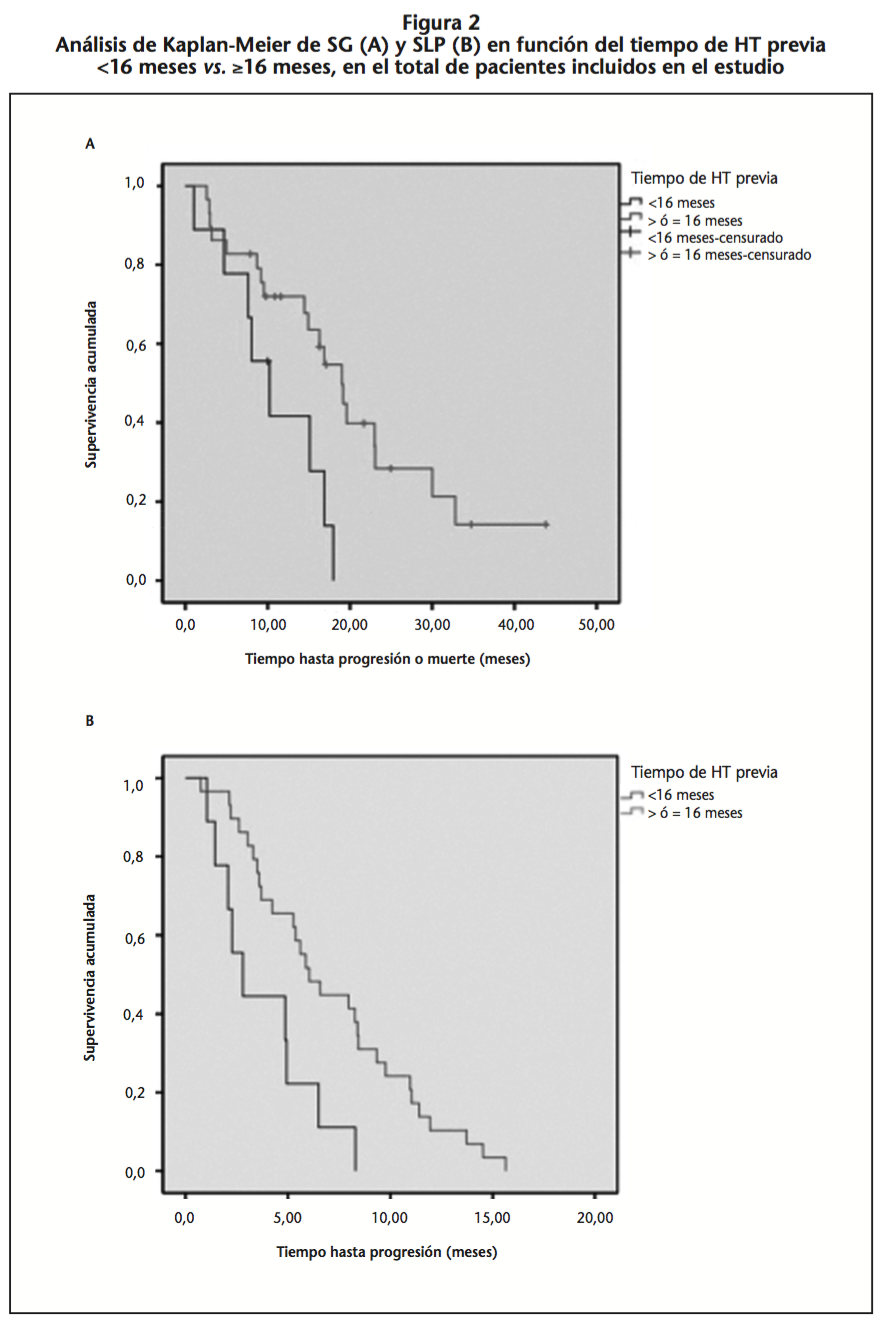
Los resultados del análisis de efectividad se recogen en las tablas 2 y 3. Al finalizar el periodo de seguimiento, la mediana de SG fue 16,90 meses (IC95% 13,47-20,33) y 16,90 meses (IC95% 11,43-22,37) (p=0,690) para los pacientes tratados con cabazitaxel y abiraterona, respectivamente. En el análisis de la SG del total de pacientes en función del tiempo de HT previa, la mediana de SG fue mayor para el grupo que había recibido ≥16 meses de HT previa en comparación con el grupo que recibió <16 meses (19,00 meses, IC95% 15,06-22,94 vs. 10,23 meses, IC95% 4,87-15,60; p=0,029) (Figura 2.A).
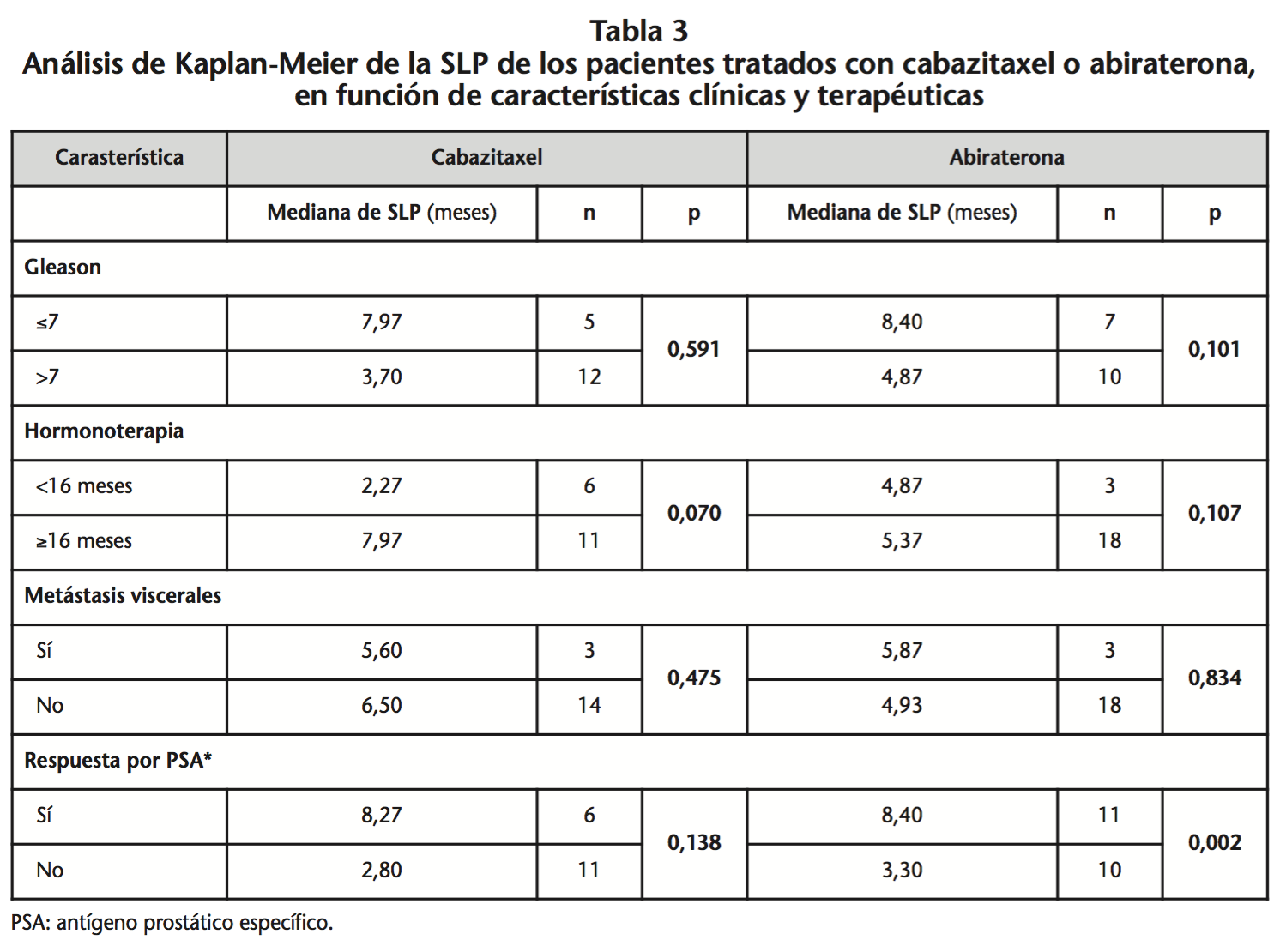
La mediana de SLP fue 6,50 meses (IC95% 2,65-10,35) y 5,27 meses (IC95% 4,52-6,01) (p=0,806) para el grupo de cabazitaxel y abiraterona, respectivamente. Mediante el análisis de la SLP en función del tiempo de HT previa del total de pacientes, observamos que la mediana de SLP es 6,03 meses (IC95% 4,33-7,33) para aquellos que habían recibido ≥16 meses de HT frente a de 2,80 meses (IC95% 1,24-4,36) para los que habían recibido <16 meses (p=0,007) (Figura 2.B).
El 35,3% y 52,4% de los pacientes tratados con cabazitaxel y abiraterona presentaron respuesta bioquímica, respectivamente. La respuesta bioquímica influyó de forma significativa en la mediana de SG para el grupo de cabazitaxel (p=0,050) y en la mediana de SLP para el grupo de abiraterona (p=0,002).
En relación con la seguridad, los EA más frecuentes con cabazitaxel fueron hematológicos: anemia (100%) y trombocitopenia (29,4%), y no hematológicos: astenia (76,5% grado 1-2 y 11,8% grado ≥3), diarrea (41,2%) y neurotoxicidad (23,5%). Se registró neutropenia en 2 pacientes (11,8%), de los cuales uno fue grado ≥3, y otro presentó neutropenia febril (5,9%). El 88,2% recibió G-CSF, incluyendo profilaxis y tratamiento. Fue necesario reducir la dosis en un paciente por neutropenia y retrasar uno o más ciclos en 4 pacientes.
Los pacientes con abiraterona presentaron como EA más frecuentes astenia (47,6% grado 1-2 y 23,8% grado ≥3), retención de fluidos y edema (33,3%) e hipertensión arterial (38,1% grado 1-2 y 4,8% grado ≥3), y fue necesario interrumpir el tratamiento en 5 pacientes.
Discusión
En el análisis de nuestra experiencia de uso con cabazitaxel y abiraterona hemos observado beneficios similares en SG con ambos fármacos, seleccionados de acuerdo al protocolo establecido9 siendo esta mediana de SG ligeramente superior a la de los ensayos clínicos pivotales 15,1 meses (IC95% 14,1-16,3)5 y 14,8 meses (IC95% 14,3-15,6)6, aunque se encuentra dentro del intervalo de confianza. En relación a los objetivos secundarios, la mediana de SLP para el grupo de abiraterona fue concordante con el ensayo pivotal (5,27 meses, IC95% 4,52-6,01 vs. 5,7 meses, IC95% 5,63-6,40)6, mientras que para el grupo de cabazitaxel fue superior a la obtenida en el ensayo (6,50 meses, IC95% 2,65-10,35 vs. 2,8 meses, IC95% 2,4-3,0)5. Uno de los factores contribuyentes a esta diferencia podría ser la distinta definición de progresión empleada. En el ensayo COU-AA-3016 se definió progresión incluyendo progresión radiológica, sintomática/clínica y por PSA, mientras que en el ensayo TROPIC5 se definió progresión cuando aparecía uno de estos tipos. Sabiendo que el nivel de PSA generalmente precede 2-3 meses a la progresión tumoral, esta definición daría lugar a menor SLP11. En nuestro estudio donde la progresión se ha medido igual para los dos fármacos, la SLP es similar para las dos terapias, al igual que la SG.
En el protocolo de uso de Abiraterona/Cabazitaxel9 se establecen 4 grupos de criterios de selección de la terapia post-docetaxel: estado general del paciente, características del tumor, aspectos bioquímicos y resultados de tratamientos previos.
El primero considera el estado general del paciente, incluyendo la edad y comorbilidades. Observamos un mayor porcentaje de pacientes de edad ≥75 años en el grupo tratado con abiraterona en comparación con el de cabazitaxel (33,3% vs. 5,9%), hecho concordante con los ensayos clínicos (28%6 vs. 18%5). Esta diferencia se podría explicar por el diferente perfil de toxicidad. En el estudio de Malik et al.12, la incidencia de neutropenia grado ≥3 fue mayor en pacientes >75 años que en los ≤75 años tratados con cabazitaxel (25,8% vs. 17,0%). De forma similar, Heidenreich et al.13 identificaron la edad ≥75 años como factor predictivo independiente de neutropenia grado ≥3, en pacientes que recibieron cabazitaxel (HR=1,66, p=0,018).
Otro factor considerado es el estado funcional ECOG. En el análisis por subgrupos de los ensayos pivotales5,6 se observó que los pacientes con ECOG 2 no se beneficiaban de ningún tratamiento. Dada la falta de experiencia clínica, cabazitaxel no se empleó en este subgrupo y sólo dos pacientes con ECOG 2 recibieron abiraterona. Estos dos últimos pacientes habían recibido ≥16 meses de HT previa. Uno de ellos presentó respuesta por PSA y una SG de 14,47 meses, mientras que el otro no presentó respuesta bioquímica y la SG fue de 3 meses. En cuanto a la seguridad, no se registraron EA grado ≥3 en estos pacientes.
El segundo grupo considera las características del tumor. La presencia de Gleason >7 y metástasis viscerales se asocia con enfermedad más agresiva, hecho que condicionó a que en nuestro protocolo se priorizase cabazitaxel en este grupo de pacientes. De los pacientes tratados con cabazitaxel, 70,6% presentaba Gleason >7. En el estudio de Azria et al.14 y de Armstong et al.15 el valor elevado de Gleason se identificó como factor predictivo independiente de peor respuesta en pacientes tratados con abiraterona. Aunque en nuestro estudio no se encontraron diferencias significativas en la SG y SLP en función del valor Gleason, hecho que podría deberse al escaso número de pacientes incluidos.
En cuanto a la presencia de enfermedad visceral, en los ensayos clínicos observamos un mayor número de pacientes con metástasis viscerales tratados con cabazitaxel (25%5 vs. 11%6, con cabazitaxel y abiraterona, respectivamente), no encontrándose diferencias en nuestro estudio. De los 5 pacientes que presentaron metástasis viscerales, 1 fue tratado con ambos fármacos, 2 con cabazitaxel y otros 2 con abiraterona, posiblemente debido a la valoración de otros factores como la edad o tiempo de HT previa que favorecerían la elección de abiraterona.
El tercer grupo considera los aspectos bioquímicos de la enfermedad, concluyendo que no existe ningún dato en relación con las cifras de PSA que nos permita seleccionar el tratamiento.
Por otro lado, sí que se ha observado con cabazitaxel que la mediana de SG fue mayor en los pacientes que habían presentado respuesta medida a través de PSA (p=0,050). Este hecho podría ser útil como factor predictivo de respuesta, puesto que la respuesta por PSA podría predecir la respuesta a cabazitaxel de forma precoz y evitar su uso prolongado sin obtener beneficio clínico y aumentando el riesgo de toxicidad. Para el grupo de abiraterona, se encontraron diferencias en la SLP en función de la respuesta por PSA (p=0,002). Caffo et al.16 observaron que los pacientes tratados con abiraterona que respondieron por PSA en el primer mes de tratamiento, presentaban mayor SG y SLP frente a aquellos que no habían respondido (17 vs. 7 meses, p<0,0009 y 9 vs. 2 meses, p<0,0001, respectivamente). Por tanto, un método simple y rápido para identificar a los pacientes que presentarán resistencia con abiraterona podría ser la determinación del nivel de PSA en el primer mes.
Por último se consideran los resultados de tratamientos previos administrados. Loriot et al.17 identificaron el tiempo de HT previa ≥ ó <16 meses como factor predictivo de eficacia de las terapias hormonales posteriores. De los pacientes tratados con abiraterona, la amplia mayoría (85,7%) había recibido HT previa durante ≥16 meses. Los resultados de efectividad demostraron que, independientemente del tratamiento recibido posteriormente, los pacientes que progresaron antes de 16 meses de HT tuvieron peor pronóstico que aquellos que progresaron tras 16 o más meses de HT (SG 10,23 meses vs. 19,00 meses, p=0,029 y SLP 2,80 meses vs. 6,03 meses, p=0,007, respectivamente). Las diferencias en la mediana de SG en función de HT para el grupo de abiraterona no fueron significativas, posiblemente debido al reducido número de pacientes que recibieron <16 meses de HT previa (n=3).
Se ha realizado el análisis multi- y bivariante para determinar la asociación entre la SG y SLP de cada fármaco y las variables estudiadas pero no se ha podido obtener resultados significativos, dado el bajo número de pacientes del estudio.
En cuanto a la toxicidad con cabazitaxel, la frecuencia de anemia fue elevada de forma similar al ensayo pivotal (94%)5. Sólo uno de los pacientes (5,9%) presentó neutropenia febril, porcentaje relativamente bajo, similar también al obtenido en el ensayo pivotal (8%)5. Sin embargo, un menor porcentaje de pacientes presentó neutropenia en comparación con el ensayo (11,8% vs. 94%)5. En la práctica habitual, la frecuencia de neutropenia con cabazitaxel es menor porque en el ensayo no se permitía inicialmente la profilaxis primaria con G-CSF, datos concordantes con la bibliografía13. En el grupo de abiraterona, los EA más frecuentes fueron similares a los observados en el ensayo clínico6. Sólo uno de los pacientes presentó elevación de los valores de transaminasas y bilirrubina respecto a sus niveles basales previos al tratamiento.
Entre las limitaciones del estudio cabe destacar el reducido número de pacientes tratados con estas terapias, que dificulta obtener diferencias estadísticamente significativas. También las limitaciones propias del diseño retrospectivo, ocasionando la pérdida de datos no recogidos. Además, los pacientes que han recibido una segunda línea de tratamiento con cabazitaxel o abiraterona no están representados en los ensayos clínicos, por lo que no se aconseja su tratamiento. Sin embargo, 4 de los pacientes de nuestro estudio recibieron tratamiento secuencial con cabazitaxel y, posteriormente, abiraterona, que podría estar justificado por la agresividad del tumor y falta de respuesta que presentaban estos pacientes jóvenes, a los que se trató con todas las opciones disponibles. Además, la mediana de SG no fue alcanzada en el grupo de abiraterona que presentaba Gleason ≤7, lo que podría deberse a un insuficiente periodo de seguimiento.
A pesar de no ser concluyentes, los resultados podrían confirmar factores predictivos identificados en estudios previos, para ser utilizados como criterio de decisión en el algoritmo terapéutico del CPRCm post-docetaxel, si bien son necesarios estudios con mayor número de pacientes para su confirmación.
Conclusiones
La inclusión de cabazitaxel y abiraterona en el arsenal terapéutico del CPRCm post-docetaxel ha demostrado prolongar la supervivencia de los pacientes de nuestro hospital, con resultados similares a los obtenidos en los ensayos clínicos pivotales. Atendiendo a los resultados de efectividad y seguridad, se ha puesto de manifiesto la importancia de protocolizar e individualizar el uso de estos fármacos para conseguir el máximo beneficio.
Conflicto de intereses: Los autores declaran no tener conflictos de intereses.
Bibliografía
1. Globocan 2012. Estimated Cancer Incidence, Mortality and Prevalence Worldwide in 2012 (acceso 8/01/2014). Disponible en: http://globocan.iarc.fr.
2. Mortalidad por cáncer y otras causas en España. Año 2012. Área de Epidemiología Ambiental y Cáncer. Centro Nacional de Epidemiología. ISCIII (acceso 8/01/2014). Disponible en: http://www.isciii.es/ISCIII/es/contenidos/fd-servicios-cientifico-tecnicos/fd-vigilancias-alertas/fd-epidemiologia-ambiental-y-cancer/Mortal2012.pdf.
3. Carles J, Castellano D, Climent MA, Maroto P, Medina R, Alcaraz A. Castration-resistant metastatic prostate cancer: current status and treatment possibilities. Clin Transl Oncol. 2012;14(3):169-76.
4. Tannock IF, De Wit R, Berry WR, Horti J, Pluzanska A, Chi KN, et al. Docetaxel plus prednisone or mitoxantrone plus prednisone for advanced prostate cancer. N Engl J Med. 2004;351(15):1502-12.
5. De Bono JS, Oudard S, Ozguroglu M, Hansen S, Machiels JP, Kocak I, et al. Prednisone plus cabazitaxel or mitoxantrone for metastatic castration-resistant prostate cancer progressing after docetaxel treatment: a randomized open-label trial. Lancet 2010; 376(9747):1147-1154.
6. De Bono JS, Logothetis CJ, Molina Am, Fizazi K, North S, Chu L, et al. Abiraterone and increased survival in metastatic prostate cáncer. N Engl J Med. 2011;364(21): 1995-2005.
7. Afroz Abidi. Cabazitaxel: A novel taxane for metastatic castration-resistant prostate cancer-current implications and future prospects. J Pharmacol Pharmacother. 2013;4(4):230-237
8. Ang JE, Olmos D and De Bono JS. CY17 Blockade by abiraterone: further evidence for frequent continued hormone-dependence in castration-resistant prostate cancer. Br J Cancer. 2009;100(5):671-675.
9. Protocolo de uso de Abiraterona/Cabazitaxel en el cáncer de próstata metastásico. Aprobado por la Comisión de Evaluación del medicamento de los hospitales del Sistema Sanitario de Aragón. 19/12/2012.
10. Scher HI, Halabi S, Tannock I, Morris M, Sternberg CN, Carducci MA, et al. Design and End Points of Clinical Trials for Patients With Progressive Prostate Cancer and Castrate Levels of Testosterone: Recommendations of Prostate Cancer Clinical Trials Working Group. J Clin Oncol. 2008;26(7):1148-59.
11. Heidenreich A., Pfister D. Treatment Decisions for Metastatic Castration-resistant Prostate Cancer Progressing After Docetaxel Chemotherapy: The Role of Cabazitaxel in the Continuum of Care. Eur Urol. 2012;62(6):1201-4.
12. Malik Z, di Lorenzo G, Bracarda S, Ardavanis A, Basaran M, Parente P, et al. Cohort compassionate-use program (CUP) and early access program (EAP) with cabazitaxel (Cbz) plus prednisone (P; Cbz + P) in patients (pts) with metastatic castration-resistant prostate cancer (mCRPC) previously treated with docetaxel (D): Analysis by age group. J Clin Oncol 32, 2014 (suppl 4; abstr 109).
13. Heidenreich A, Bracarda S, Mason M, Ozen H, Sengelov L, Van Oort I, et al. Safety of cabazitaxel in senior adults with metastatic castration-resistant prostate cancer: Results of the European compassionate-use programme. Eur J Cancer. 2014;50(6):1090-9.
14. Azria D, Massard C, Tosi D, Houede N, Joly F, Gravis G, et al. An ambispective observational study in the safety and efficacy of abiraterone acetate in the French temporary authorizations for use (ATU): Predictive parameters of response. J Clin Oncol. 2012;30 (suppl 5;abstr 149).
15. Armstrong AJ, Garrett-Mayer ES, Yang YC, De Wit R, Tannock IF, Eisenberger M. A contemporary prognostic nomogram for men with hormone-refractory metastatic prostate cancer (HRPC). Clin Cancer Res. 2007; 13(21):6396-6403.
16. Caffo O, Veccia A, Maines F, Bonetta A, Spizzo G, Galligioni E. Potencial Value of Rapid Prostate-specific Antigen Decline in Identifying Primary Resistance to Abiraterone Acetate and Enzalutamide. Future Oncol. 2014;10(6):985-993.
17. Loriot Y, Massard C, Albiges A, di Palma M, Blanchard P, Bossi A, et al. Peronalizing treatment in patients with castrate-resistant prostate cáncer: A study of predictive factors for secondary endocrine therapies activity. J Clin Oncol. 2012; 30 (suppl 5;abstr 213).
____
Descargar archivo PDF: Efectividad y seguridad de los tratamientos post-docetaxel en cáncer de próstata metastásico resistente a castración
