Cidoncha Muñoz I1, Pérez Abánades M1, García Buey LC1, Ortega Hernández-Agero T2, Morell Baladrón A1
1 Hospital Universitario de La Princesa. Madrid (España)
2 Facultad de Farmacia. Universidad Complutense de Madrid (España)
Fecha de recepción: 10/04/2019 – Fecha de aceptación: 02/05/2019
Correspondencia: Isabel Cidoncha Muñoz – Hospital Universitario de La Princesa – C/Diego de León, 62 – 28006 Madrid (España)
isabel.cidoncha@salud.madrid.org
____
Resumen
Objetivo: Evaluar efectividad y seguridad de antivirales de acción directa (AADs) en el tratamiento de la hepatitis C crónica (HCC) en pacientes genotipos no-1, y mejoría clínica al año postratamiento.
Pacientes y métodos: Estudio observacional retrospectivo en pacientes con HCC genotipos no-1 no co-infectados con VIH que iniciaron AADs entre abril-diciembre 2015. Variables recogidas: demográficas, diagnósticas, terapéuticas y clínicas. Se evaluó la efectividad según respuesta viral sostenida (RVS) en semana 12 postratamiento. Se registraron efectos adversos (EA), y complicaciones al año postratamiento.
Resultados: 46 pacientes. Edad media: 58 (9,9) años. 28 (60,9%) genotipo 3, 12 (26,1%) genotipo 4, 5 (10,9%) genotipo 2 y 1 (2,2%) genotipo 5. Pacientes naive 27 (57,4%), 19 (41,3%) recibieron biterapia previa y 1 (2%) AADs previos. Al iniciar tratamiento 29 (63%) presentaban F4. Mediana GOT 62,5 U/L (IQR 41,7-96,5) y GPT 79 U/L (IQR 46-108,2). Media fibroScan: 18 (12,5) kPa. RVS: 91,5%. 38 (80,8%) pacientes presentaron algún EA: astenia (56,5%), cefaleas (41,3%), molestias gastrointestinales (32,6%), e insomnio (17,4%). Al año postratamiento 10 (21,7%) presentaban F4. Mediana GOT 21 U/L (IQR 18-26,2) y GPT 19 U/L (IQR 16-25,7). Fibroscan: 8,08 kPa. 5 (10,9%) desarrollaron tumores malignos: 1 reactivación de cáncer de vejiga, 2 hepatocarcinoma de novo, 1 cáncer colorrectal de novo y 1 cáncer de mama.
Conclusiones: Los AADs presentan efectividad y seguridad muy elevadas en la práctica clínica, que ha supuesto mejoría clínica en los pacientes. Según nuestros resultados, podría existir relación entre AADs y desarrollo de tumores; son necesarios más datos a largo plazo para confirmarlo.
Palabras clave: Antivirales, hepatitis, complicaciones.
Long-term effectiveness and safety of direct-acting antivirals for the treatment of hepatitis C virus infection non-1 genotypes
Summary
Objectives: To analyze the effectiveness and safety of direct-acting antivirals (DAAs) for the treatment of hepatitis C virus (HCV) infection non-1 genotypes.
Patients and methods: Retrospective observational study of patients with HCV non-1 genotypes non-coinfected who initiated DAAs since April 2015 to December 2015. Demographic, diagnostic, therapeutic and clinical variables were collected. The effectiveness was evaluated according to sustained viral responde (SVR) at week 12 after treatment. All side effects (SE) secondary to treatment, and long-term complications were reported.
Results: 46 patients were included, with a median age of 58 (9.9) years. 28 (60.9%) patients with genotype 3, 12 (26.1%) with genotype 4, 5 (10.9%) with genotype 2 y 1 (2.2%) with genotype 5. 27 (57.4%) patients were naive, 19 (41.3%) patients received previous bitherapy and 1 (2.2%) received previous DAAs. At the start of therapy, 29 (63%) patients were cirrhotics (F4). The median GOT was 62.5 U/L (IQR 41.7-96.5) and GPT was 79 U/L (IQR 46-108.2). The median liver stiffness values using fibroScan was 18 (12.5) kPa. The sustained viral responde (SVR) was 91.5%. 38 (80.8%) patients have experienced at least one SE: asthenia (56.5%), headache (41.3%), gastrointestinal complaints (32.6%), e insomnia (17.4%). A year after treatment 10 (21.7%) patients were cirrhotics (F4). The median GOT was 21 U/L (IQR 18-26.2) and GPT was 19 U/L (IQR 16-25.7). The median liver stiffness values using fibroScan was 8.08 kPa. 5 (10.6%) patients developed malignant tumors: 1 patients developed reactivation of bladder cancer, 2 patients developed de novo hepatocellular carcinoma, 1 patient developed de novo colorectal carcinoma and 1 patient developed breast cancer.
Conclusions: Second generation of direct-acting antivirals is effective and safe in clinical practice, marked a clinical improvement in the patients. According to our preliminary results, there might be a link between DAAs and development of tumors; more long-term data are required for confirm it.
Key Words: Antivirals, hepatitis, complications.
____
Introducción
La hepatitis crónica por virus de la hepatitis C (VHC) constituye un problema de salud de primer nivel, con 71 millones de personas afectadas, responsable de una importante morbimortalidad hepática y extrahepática, siendo previsible que en nuestro país alcanzará su máximo impacto sanitario en el año 20301,2. La infección por el VHC puede progresar a enfermedad hepática avanzada, cirrosis y carcinoma hepatocelular (CHC)3,4, un tumor primario del hígado proveniente de los hepatocitos que en España constituye la séptima causa de muerte por cáncer y en EE.UU. la novena5,6.
Inicialmente, el tratamiento para el VHC consistía en una combinación de interferón pegilado y ribavirina, independientemente del genotipo viral, aunque la duración del tratamiento variaba mucho en función del genotipo. Sin embargo, la efectividad de esta combinación fue baja (45% en el caso de pacientes con genotipo 1 y 80% en genotipos 2 y 3) y muchos efectos adversos fueron reportados3,7. Por ello, en abril del 2015 fue aprobado el Plan Estratégico Nacional para el abordaje de la hepatitis C8, permitiendo así el acceso de los sujetos infectados con fibrosis significativa (F2-F4) a las diferentes combinaciones antivirales de acción directa (AADs) aprobadas por la EMA y FDA, basadas en asociaciones de antivirales orales muy potentes, con escasos efectos secundarios y alta eficacia terapéutica, incluso en cirrosis avanzada. Entre los inhibidores de la proteasa NS3/4a (IP) están simeprevir, paritaprevir, grazoprevir, glecaprevir y voxilaprevir, como inhibidores de la NS5a están ombitasvir, daclatasvir, ledipasvir, elbasvir, velpatasvir y pibrentasvir, y como inhibidores de la NS5b están sofosbuvir y dasabuvir, en diferentes combinaciones según las guías de la Asociación Española para el Estudio del Hígado (AEHH)9 y las Guías de la Asociación Europea para el Estudio del Hígado (EASL)10. La introducción de los tratamientos con AADs ha revolucionado el tratamiento de la infección por VHC, consiguiéndose tasas de curación de la infección superiores al 95% con tratamientos de corta duración, de tolerancia excelente y aplicable a la práctica totalidad de los pacientes infectados.
Después del tratamiento con AADs se espera la erradicación del virus y la mejora de la función hepática, grado de fibrosis y disminución de riesgo de desarrollo de CHC. Pero, ¿cuál es el verdadero efecto de estos antivirales directos sobre el CHC en pacientes con VHC? No existen muchos datos disponibles sobre el papel que juegan estos fármacos en la erradicación del CHC. Reig et al.11 demostraron que, a pesar de conseguir altas tasas de RVS después del tratamiento con AADs, un número elevado de pacientes experimentaron recidiva de CHC. En particular, ellos incluyeron 55 pacientes con RVS después del tratamiento con AADs, con respuesta completa radiológica después de una historia previa de CHC, y comprobaron que 16 (27,6%) pacientes experimentaron una recaída del tumor a nivel radiológico. Observaron que transcurría un corto periodo de tiempo entre la toma de AADs y la aparición de recaídas (mediana de tiempo 3,5 meses). Según ellos, estos datos obligan a plantearse la ventaja de tratar con AADs a pacientes con historia previa de CHC. Otro estudio realizado por Conti et al.12 detectó, durante un periodo de seguimiento de 24 semanas, CHC en 26 de 344 pacientes (7,6%). Concretamente se diagnosticó CHC de novo en 9 de los 285 pacientes incluídos en el estudio sin historia previa del tumor (3,2%) y recidiva de CHC en 17 de los 59 pacientes con historia previa (28,81%), observando mayor agresividad en dicha recidiva. En ambos estudios se obtuvo una alta tasa de RVS, confirmando la verdadera eficacia de los AADs. Cuando Conti et al.12 comparararon estos resultados con la recurrencia de CHC en población no tratada con AADs, encontraron una tasa de desarrollo de CHC similar, sugiriendo que no es posible afirmar que el tratamiento con AADs esté involucrado en el desarrollo de CHC. Además, la recurrencia de CHC encontrada por Conti et al.12 es similar a la encontrada en un estudio italiano, en el que los autores indican que la recurrencia de CHC después de 1 año desde la resección quirúrgica del tumor es del 20%13.
Una de las preocupaciones más importantes en este momento es entender por qué una repentina recurrencia de CHC es observada después del tratamiento con AADs. Todavía no existe explicación, pero una de las principales hipótesis barajadas es que después del tratamiento con AADs ocurre una perturbación del sistema inmune. De hecho, se ha supuesto que los cambios en las señales pro y anti tumorales después del tratamiento con AADs pueden hacer impacto en la recaída de CHC. Por ejemplo, la RVS inducida por el tratamiento con AADs puede causar una reducción en los niveles de células natural killer (NK) y, por tanto, en su papel de vigilancia inmune, favoreciendo así el crecimiento del tumor no detectado previamente, hecho que sería improbable en pacientes tratados con interferón, debido al efecto inmunomodulador y antiproliferativo que éste ejerce sobre el sistema inmune14,15.
De acuerdo con esta hipótesis, un estudio italiano especula que los AADs podrían inducir la recurrencia de CHC por medio de un incremento en la diseminación de células tumorales. En particular, Villani et al.16 observaron un incremento en los niveles del factor de crecimiento del endotelio vascular (VEGF) durante el tratamiento con AADs, niveles que se normalizaban 12 semanas después de finalizar el tratamiento. VEGF es un factor crítico en la angiogénesis, proceso responsable de la diseminación de las células tumorales, al inducir el crecimiento capilar en el tumor y proveer los nutrientes que el tumor necesita para crecer, y que parece correlacionarse con un rápido desarrollo y recurrencia de CHC17.
Aunque el hígado es la principal diana del VHC, es bien conocido que este patógeno también puede provocar manifestaciones extrahepáticas. De acuerdo con los datos disponibles, existe una clara correlación entre regiones de alta prevalencia de VHC y el riesgo de desarrollo de tumores extrahepáticos de tipos y subtipos histológicos concretos. En particular, la infección por VHC ha sido asociada con alta incidencia de algunos tipos de linfoma No-Hodgkin de células B (10%), incremento en el riesgo de desarrollar colangiocarcinoma intrahepático y aumento en la prevalencia de tumores pancreáticos18. El VHC también se asocia con el desarrollo de tumores no orofaríngeos (excepto nasofaríngeos) y tumores de cabeza y cuello asociados a infección por el virus del papiloma humano19,20. La estimulación crónica por antígenos del VHC promueve la expansión clonal de linfocitos B, con la consiguiente producción y liberación de anticuerpos mono y policlonales y generación de complejos inmunes. La deposición de estos complejos en pequeños vasos sanguíneos y paredes capilares induce la activación del complemento y, como consecuencia, el daño tisular21.
El objetivo de nuestro estudio fue evaluar efectividad y seguridad de los antivirales de acción directa (AADs) en el tratamiento de la hepatitis C crónica (HCC) en pacientes con genotipo no-1, así como la mejoría clínica y las complicaciones acontecidas al año de finalizar tratamiento.
PACIENTES Y MÉTODOS
Estudio observacional retrospectivo de pacientes diagnosticados de HCC genotipos no-1 no co-infectados con VIH que iniciaron tratamiento con AADs entre abril y diciembre de 2015, realizando su seguimiento durante 1 año. Para la identificación de los pacientes y la recogida de datos se utilizó el programa de dispensación a pacientes externos Dominion® y la historia clínica Hygeia®. Variables clínico-demográficas recogidas: edad, sexo, medida en elastografía transicional (Fibroscan), grado de fibrosis hepática (F0-F4), puntuación Child-Pugh, puntuación MELD, INR, niveles de creatinina, plaquetas, hemoglobina, leucocitos, linfocitos, neutrófilos, bilirrubina total, albúmina, transaminasas GOT, GPT y GGT, genotipo viral, carga viral y si los pacientes eran naive o previamente tratados con biterapia, IPs u otros AADs. Estas variables fueron determinadas al inicio de tratamiento, al finalizar tratamiento y al año de finalizar el mismo. En los 6 meses previos al inicio eran sometidos a una ecografía abdominal, valorándose la existencia de esteatosis hepática, existencia de LOES hepáticas y la presencia de signos de hipertensión portal (esplenomegalia, ascitis y/o varices esófago-gástricas mediante gastroscopia). Estos pacientes fueron tratados de acuerdo al Plan Estratégico Nacional para el Abordaje de la Hepatitis C de 20158. El estudio fue aprobado por el Comité Ético de Investigación Clínica, respetándose en todo momento las directrices y normas establecidas en el Código Ético de la OMS (Declaración de Helsinki). La eficacia del tratamiento se evaluó con la tasa de RVS, considerándose pacientes respondedores aquellos con carga viral del VHC indetectable 12 semanas después de finalizar el tratamiento. Para evaluar la seguridad se registraron todos los efectos secundarios recogidos en la historia clínica de los pacientes según los estándares de la Common Terminology Criteria for Adverse Events versión 4.0 (CTCAE), así como las complicaciones y descompensaciones acontecidas postratamiento. El análisis estadístico se realizó mediante el programa informático SPSS versión 15.0 (Statistical Product and Service Solutions).
RESULTADOS
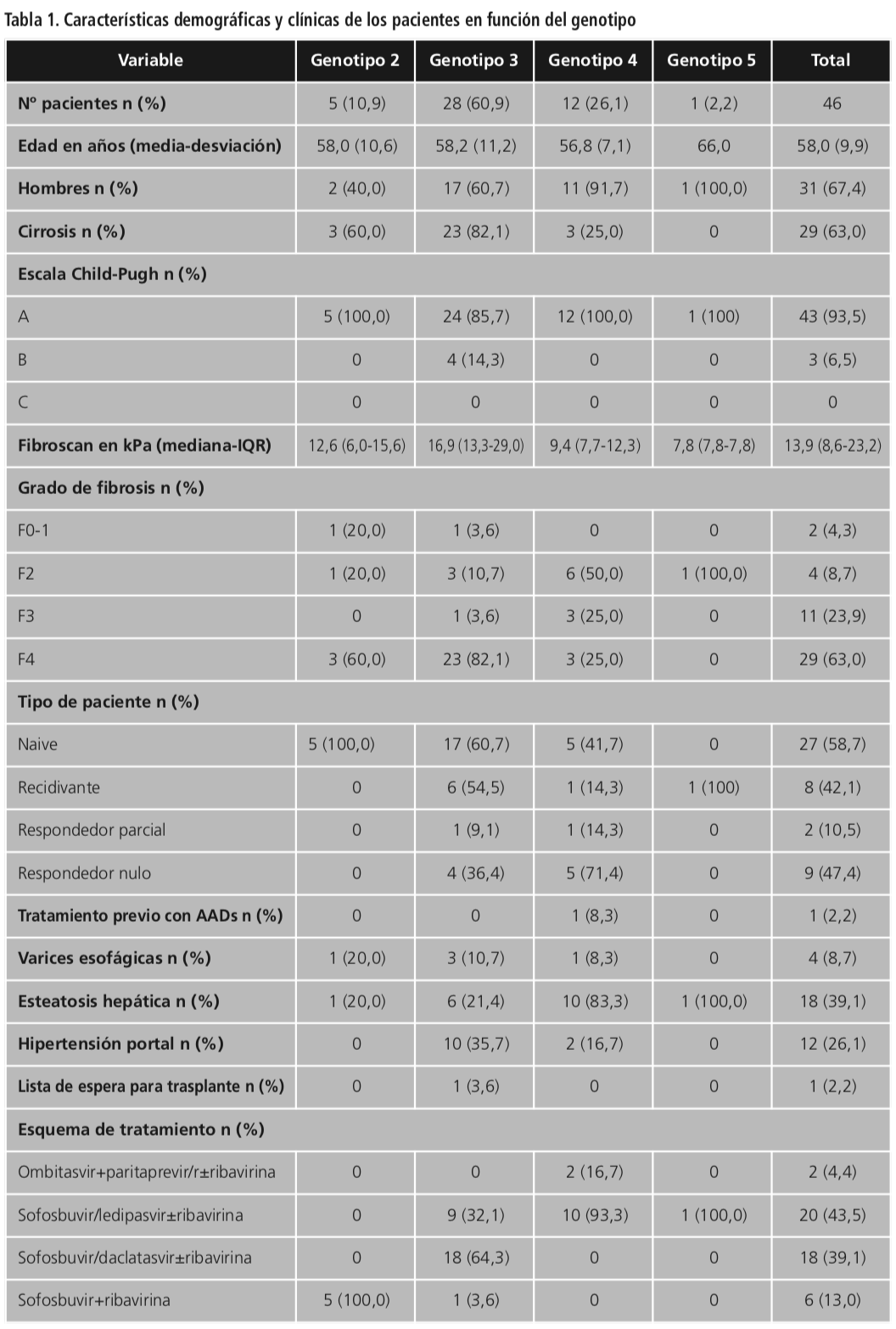
Se incluyeron 46 pacientes con infección por el VHC con una edad media de 58,0 (9,9) años, 31 (67,4%) eran hombres y 15 (32,6%) eran mujeres. En cuanto al genotipo viral, 28 (60,9%) pacientes presentaban genotipo 3, 12 (26,1%) genotipo 4, 5 (10,9%) genotipo 2 y 1 (2,2%) genotipo 5. Tenían antecedentes oncológicos 9 (19,6%) pacientes: uno presentó carcinoma urotelial de vejiga 1 año antes de iniciar tratamiento, otra paciente fue diagnosticada de cáncer de cérvix en 2003 y posteriormente sufrió LNH tipo MALT en 2010, otro paciente tuvo cáncer de próstata en 2006, dos pacientes desarrollaron colangiocarcinoma intrahepático y neoplasia cólica en ciego en 2000 y 2002 respectivamente, dos pacientes desarrollaron cáncer de mama en 2008 y 2012 respectivamente, otro paciente fue diagnosticado de leucemia linfoide aguda (LLA) en 2008 y una paciente sufrió cáncer de pulmón en 2005, todos ellos en remisión completa al iniciar tratamiento con AADs.
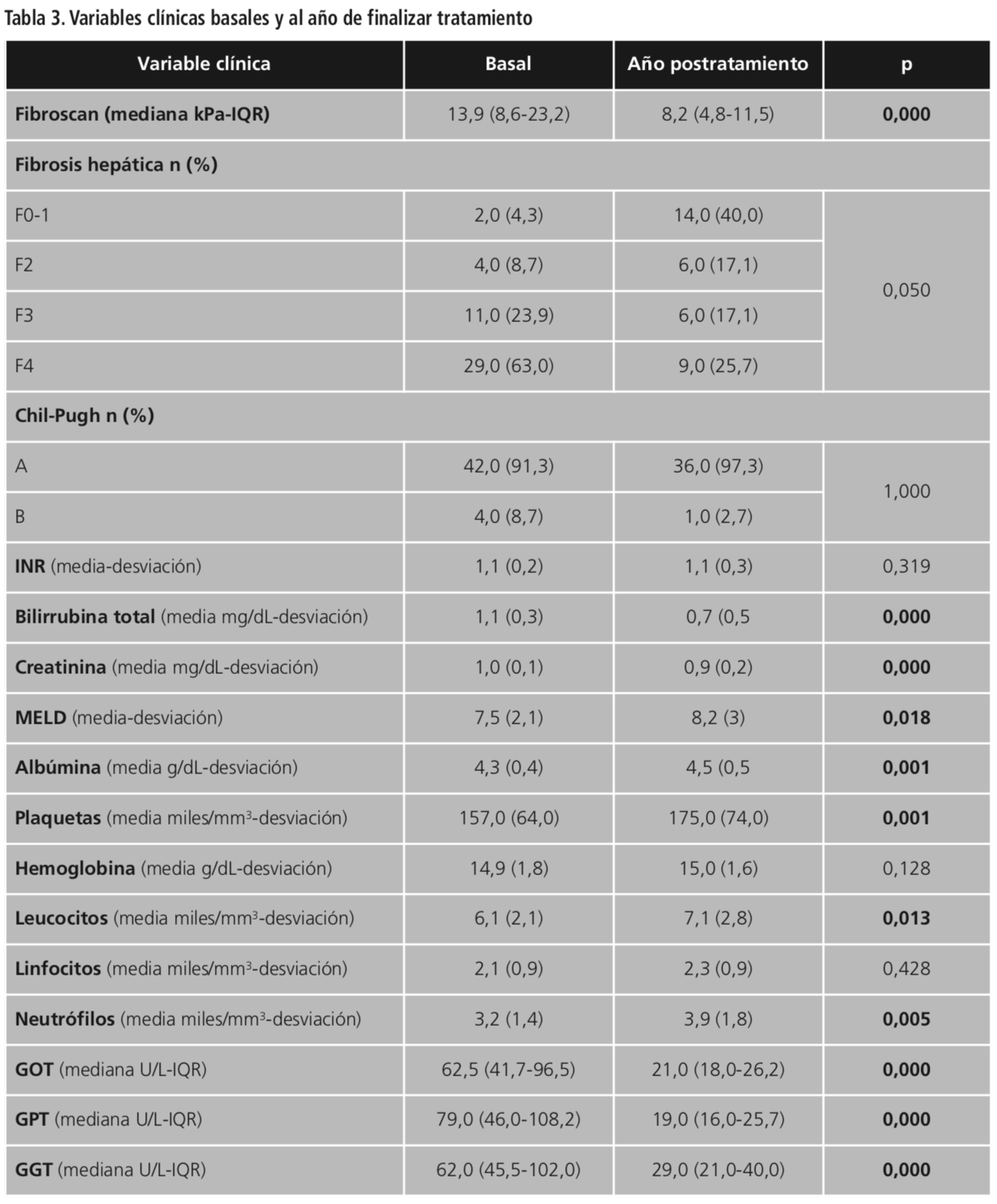
Las variables analíticas basales se encuentran descritas en la Tabla 3.
En cuanto a los tratamientos previos, 27 (58,7%) pacientes eran naive, 19 (41,3%) recibieron biterapia previa, de los cuales 9 (47,4%) fueron respondedores nulos, 8 (42,1%) fueron recidivantes y 2 (10,5%) fueron respondedores parciales. 1 (2%) paciente recibió AADs previos, siendo respondedor nulo.
Las características demográficas y clínicas de los pacientes en función del genotipo se encuentran descritas en la Tabla 1.
Con sofosbuvir/ledipasvir ± ribavirina fueron tratados 20 (43,5%) pacientes, con sofosbuvir/daclatasvir ± ribavirina 18 (39,1%), con sofosbuvir + ribavirina 6 (13,0%), y con ombitasvir/paritaprevir/r ± ribavirina 2 (4,4%). 28 (60,9%) pacientes fueron tratados durante 24 semanas, 16 (34,8%) pacientes durante 12 semanas, 1 (2,2%) paciente tenía previsto tratarse durante 12 semanas pero finalmente fue tratado durante 8, no completando el tratamiento y 1 (2,2%) paciente fue tratado durante 4 semanas por fracaso virológico, aunque en principio estaban previstas 24 semanas de tratamiento.
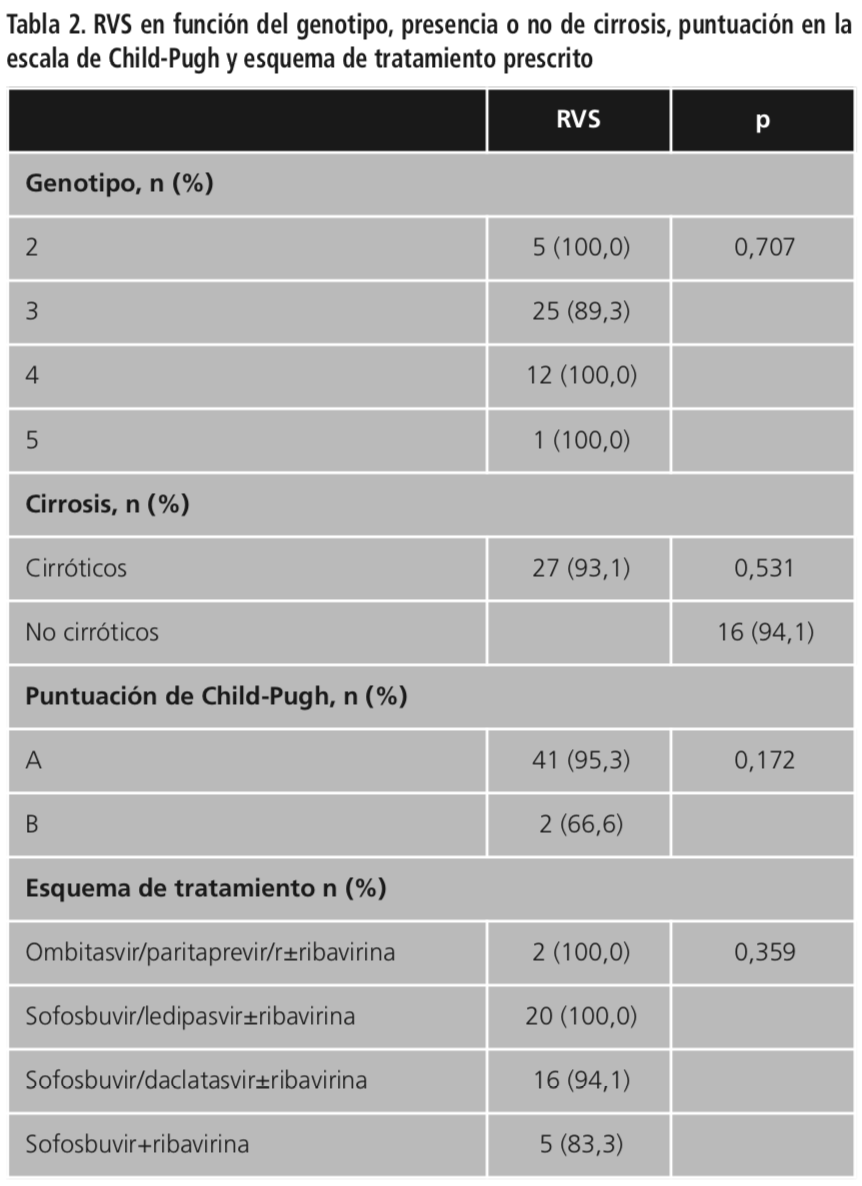
La tasa de respuesta viral sostenida (RVS) fue del 95,6%, encontrándose diferencias no estadísticamente significativas en función del genotipo viral, paciente cirrótico o no cirrótico, puntuación en la escala de Child-Pugh y esquema de tratamiento prescrito (Tabla 2). En 38 (80,8%) pacientes se describió al menos un EA. Entre los más frecuentes destacan astenia (56,5%), cefalea (41,3%), molestias gastrointestinales (34,8%), e insomnio (17,4%); todos estos EA fueron considerados leves y el tratamiento no fue suspendido en ningún caso.
Las variables analíticas al año de finalizar tratamiento se encuentran descritas en la Tabla 3.
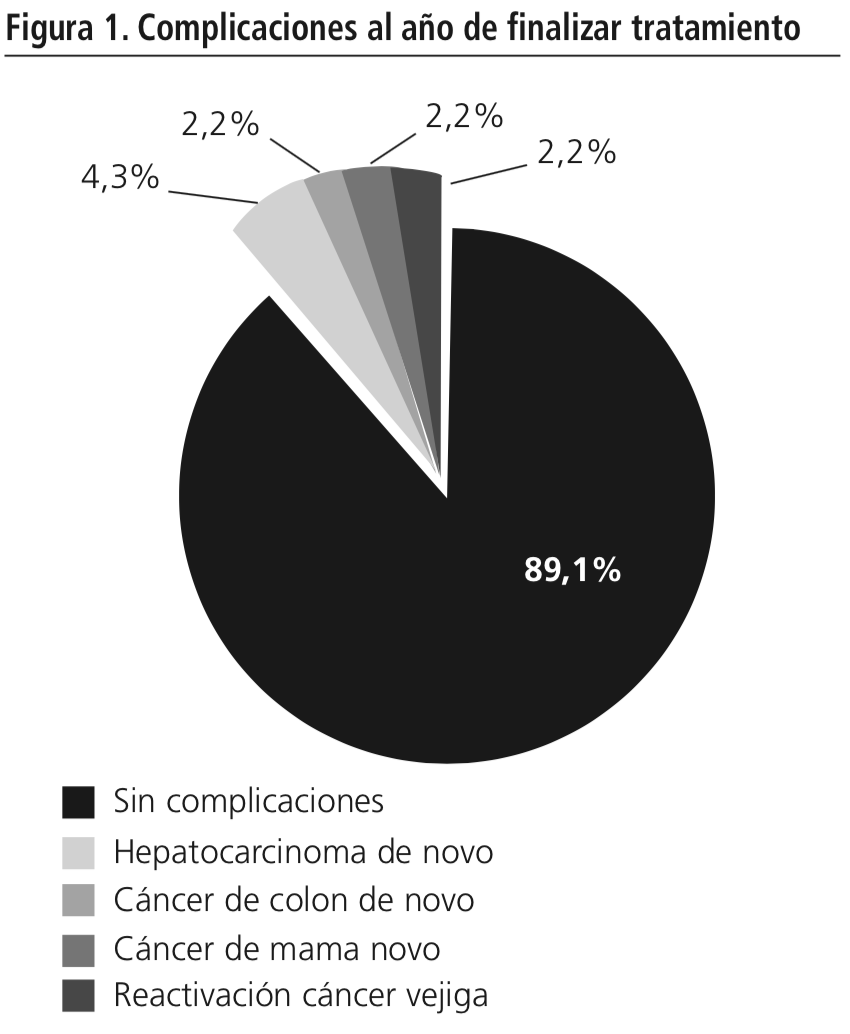
5 (10,9%) pacientes desarrollaron tumores malignos (Figura 1): 1 (2,2%) presentó reactivación de cáncer de vejiga 30 semanas después de finalizar el tratamiento, 2 (4,3%) pacientes desarrollaron hepatocarcinoma de novo, 12 y 52 semanas postratamiento, respectivamente, 1 (2,2%) paciente desarrolló cáncer de colon de novo 12 semanas postratamiento, y 1 (2,2%) cáncer de mama 48 semanas postratamiento, teniendo como antecedente cáncer de pulmón en remisión completa.
DISCUSIÓN
Los resultados obtenidos en nuestra serie, en práctica real, y a pesar de estar limitada por su pequeño tamaño muestral debido a la exclusión de pacientes con genotipo 1, ponen de manifiesto la alta efectividad y seguridad de los nuevos AADs, tanto en sujetos no cirróticos como cirróticos compensados y descompensados, obteniéndose una alta tasa de curación (95,6%), correlacionándose con los datos de eficacia de los ensayos clínicos de registro, que oscilan entre el 80 y el 95% según el genotipo viral, presencia de cirrosis y el esquema de tratamiento utilizado22.
Según el estudio Gehep 005 de epidemiología molecular de VHC en España 2010-2015, un trabajo presentado por la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica (Seimc), se constata que, excluyendo al genotipo 1 diagnosticado en el 70% de los pacientes españoles infectados por el VHC y sin ser objeto de nuestro estudio, el genotipo no-1 más frecuente en España es el 3 (16%), siendo, además, el más difícil de tratar, seguido del genotipo 4 (12%) y del genotipo 2 (2,7%)23. Según la Seimc, el resto de genotipos son muy poco prevalentes. Estos datos son similares a los obtenidos en nuestro estudio, reclutando 28 (60,9%) pacientes con genotipo 3, seguidos de 12 (26,1%) pacientes con genotipo 4, 5 (10,9%) pacientes con genotipo 2 y solo 1 (2,2%) paciente con genotipo 5. También se observan diferencias en cuanto a la tasa de RVS, siendo más baja en genotipo 3 que en el resto de genotipos. Según estudios publicados, las tasas de RVS son peores cuando el paciente está descompensado (B/C de Child-Pugh), presenta signos de hipertensión portal o es genotipo 314,24. Estos datos concuerdan con los observados en nuestro estudio (Tabla 2).
En pacientes tratados con sofosbuvir/daclatasvir ± ribavirina, Sulkowski et al.25 reportaron tasas de RVS del 86-93%. Los resultados obtenidos en nuestra cohorte de pacientes están en línea con los reportados, ya que para este esquema de tratamiento hemos obtenido tasas de RVS del 80-92,3%.
Si comparamos los valores analíticos basales con los obtenidos al año de finalizar el tratamiento se observa una bajada estadísticamente significativa en el valor de fibroscan, así como en los niveles de bilirrubina, en el grado de fibrosis hepática y en los niveles de transaminasas GOT y GPT, datos que coinciden con la bibliografía publicada. El valor de creatinina disminuye ligeramente al año de finalizar tratamiento, que coincide con el estudio publicado por Sise et al.26, en el que se puede observar una relación directa entre la toma de AADs y el aumento en los niveles séricos de creatinina. Los niveles de células mononucleares de sangre periférica, leucocitos y neutrófilos, aumentan tras la finalización del tratamiento con AADs, ya que son considerados reservorios de replicación del VHC, por lo que sus niveles estarían disminuidos durante la existencia del mismo y una vez que es erradicado se produce recuperación en los niveles de estas células.
En nuestra serie, la incidencia de RA leves (80,8%) es similar a la obtenida en los ensayos clínicos y estudios de práctica clínica (66-82%)27. La inexistencia de RA graves y suspensión de tratamiento, similares a los resultados obtenidos en los ensayos clínicos, como en el estudio ION-428, en el que solo un 2,4% de los pacientes sufrieron RA graves, demuestran la seguridad y buen perfil de tolerabilidad de la segunda generación de AADs.
De los 46 pacientes, 2 (4,3%) desarrollaron CHC de novo, 12 y 52 semanas postratamiento, respectivamente. Este dato está en consonacia con lo observado por Conti et al.12, estudio en el que la tasa de desarrollo de CHC de novo fue del 3,2%. Además de los casos de CHC, 3 pacientes desarrollaron tumores extrahepáticos al poco tiempo de finalizar el tratamiento. La incidencia observada de estas enfermedades extrahepáticas en nuestro estudio fue superior a la esperada para la población general: la incidencia de carcinoma de colon y recto en varones en la población general española fue de 108,7:100.000 habitantes (0,0011%) en 2015 y en nuestro estudio es de 2,17%, de cáncer de vejiga en hombres fue de 76,5:100.000 (0,0008%) y en nuestro estudio es de 2,17%, de HCC en mujeres fue de 6,8:100.000 (0,000068%) y en nuestro estudio es de 4,35% y de cáncer de mama en mujeres fue de 117,5:100.000 (0,0012%) y en nuestro estudio es de 2,17%29. Además, antes del tratamiento estos pacientes no presentaban ningún síntoma ni signo clínico relevante y, tanto las pruebas de laboratorio como las pruebas de imagen estaban dentro de la normalidad. La rápida aparición de estas enfermedades malignas, la agresividad de los tumores y la alta incidencia comparada con la población general hacen pensar en una posible relación con el tratamiento AADs; no obstante, antes de iniciar tratamiento con AADs 9 pacientes habían tenido antecedentes oncológicos aunque ya estaban todos en remisión completa. Es sabido que el desarrollo de estas enfermedades malignas requiere tiempo, lo que hace suponer que el tratamiento con AADs no es la principal razón de su aparición. Es más lógico atribuirlo a que los AADs acelerarían la progresión de tumores ya existentes previamente, pero no diagnosticados. Es posible que los AADs puedan condicionar inmunosupresión al hacer desaparecer el VHC y cambiar el balance a favor de la progresión tumoral. Otra posibilidad es que los AADs ejerzan un efecto directo sobre las células displásicas y malignas, potenciando la agresividad de estos tumores, pero esto es tan solo una especulación.
Entre las limitaciones del presente estudio cabe destacar que se trata de un estudio retrospectivo y no siempre es factible disponer de toda la información necesaria para el análisis.
CONCLUSIONES
Con las limitaciones propias de una heterogénea serie de casos, pero con la ventaja de mostrar la práctica clínica habitual fuera del contexto sobreprotegido de los ensayos clínicos, los nuevos AADs se presentan en nuestra serie como una terapia muy efectiva y con buen perfil de seguridad. Aunque este estudio no puede demostrar una relación causal entre el tratamiento con AADs y el desarrollo de tumores, surgen importantes dudas sobre la posible asociación entre ellos. Si finalmente se confirma la existencia de una relación causal entre la terapia con AADs y el desarrollo de tumores hepáticos y extrahepáticos, será importante definir los factores de riesgo para el desarrollo de estas enfermedades malignas, y establecer pautas de tratamiento y protocolos de detección precoz.
Financiación: La presente investigación no ha recibido ninguna beca específica de agencias de los sectores público, comercial, o sin ánimo de lucro.
Conflicto de intereses: Los autores declaran no tener conflicto de intereses.
BIBLIOGRAFÍA
1. Bruggmann P, Berg T, Øvrehus AL, et al. Historical epidemiology of hepatitis C virus (HCV) in selected countries. J Viral Hepat. 2014;21Suppl1:5-33. https://doi.org/10.1111/jvh.12247.
2. Abozeid M, Alsebaey A, Abdelsameea E, et al. High efficacy of generic and brand direct acting antivirals in treatment of chronic hepatitis C. Int J Infect Dis. 2018; 75:109-114. https://doi.org/10.1016/j.ijid.2018.07.025.
3. Cheng EY, Saab S, Holt CD, et al. Paritaprevir/ritonavir/ ombitasvir and dasabuvir for the treatment of chronic hepatitis C virus infection. Expert Opin Pharmacother. 2015;16:2835-2848. https://doi.org/10.1517/14656566.2015.1114099.
4. Younossi ZM, Singer ME, Mir HM, et al. Impact of interferón free regimens on clinical and cost outcomes for chronic hepatitis C genotype 1 patients. J Hepatol. 2014; 60:530-537. https://doi.org/10.1016/j.jhep.2013.11.009.
5. Chacko S, Samanta S. Hepatocellular carcinoma: A life-threatening disease. Biomed Pharmacotherapy. 2016; 84: 1679-88. https://doi.org/10.1016/j.biopha.2016.10.078.
6. Balogh J, Victor D III, Asham EH, et al. Hepatocellular carcinoma: A review. J Hepatocell Carcinoma. 2016; 3: 41-53. https://doi.org/10.2147/JHC.S61146.
7. Liang TJ, Ghany MG. Current and future therapies for hepatitis C virus infection. N Engl J Med. 2013;368:1907-1917. https://doi.org/10.1056/nejmc1307589.
8. Ministerio de Sanidad, Servicios Sociales e Igualdad. Plan Estratégico para el abordaje de la hepatitis C en el Sistema Nacional de Salud [consultado 10 de Diciembre 2018]. Disponible en: http://www.msssi.gob.es/ciudadanos/enfLesiones/enfTransmisibles/docs/planestrategicohepatitis C.pdf.
9. Asociación Española para el Estudio del Hígado. AEEH Guía de Práctica Clínica: Guía AEEH de tratamiento de la infección por virus de la Hepatitis C 2018. [Consultado 10 de Diciembre 2018]. Disponible en: http://aeeh.es/wp-content/ uploads/2018/07/GUIA-DE-TRATAMIENTO-VHC-2018.pdf.
10. European Association for the Study of the Liver. EASL Clinical Practice Guidelines: EASL Recommendations on Treatment of Hepatitis C 2018. [Consultado 10 de Diciembre 2018] Disponible en: http://www.easl.eu/research/our-contributions/clinical-practice-guidelines/detail/easl-recommendations-on-treatment-of-hepatitis-c-2018.
11. Reig M, Mariño Z, Perelló C, et al. Unexpected high rate of early tumor recurrence in patients with HCV-related HCC undergoing interferonfree therapy. J Hepatol. 2016;65(4):719-26. https://doi.org/10.1016/j.jhep.2016.04.008.
12. Conti F, Buonfiglioli F, Scuteri A, et al. Early occurrence and recurrence of hepatocellular carcinoma in HCV-related cirrhosis treated with direct-acting antivirals. J Hepatol. 2016;65(4):727-33. https://doi.org/10.1016/j.jhep.2016.06.015.
13. Pompili M, Saviano A, de Matthaeis N, et al. Long-term effectiveness of resection and radiofrequency ablation for single hepatocellular carcinoma ≤3 cm. Results of a multicenter Italian survey. J Hepatol. 2013;59(1):89-97. https://doi. org/10.1016/j.jhep.2013.03.009.
14. Serti E, Park H, Keane M, et al. Rapid decrease in hepatitis C viremia by direct acting antivirals improves the natural killer cell response to IFNα. Gut. 2017; 66(4):724-35. https://doi.org/10.1136/gutjnl-2015-310033.
15. Nault J-C, Colombo M. Hepatocellular carcinoma and direct acting antiviral treatments: Controversy after the revolution. J Hepatol. 2016;65(4):663-5. https://doi.org/10.1016/j.jhep.2016.07.004.
16. Villani R, Facciorusso A, Bellanti F, et al. DAAs Rapidly Reduce Inflammation but Increase Serum VEGF Level: A Rationale for Tumor Risk during Anti-HCV Treatment. PLOS ONE. 2016;11(12), e0167934. https://doi.org/10.1371/journal.pone.0167934.
17. Zhu AX, Duda DG, Sahani DV, et al. HCC and angiogenesis: Possible targets and future directions. Nat Rev Clin Oncol. 2011;8(5):292-301. https://doi.org/ 10.1038/nrclinonc.2011.30.
18. Fiorino S, Bacchi-Reggiani L, de Biase D, et al. Possible association between hepatitis C virus and malignancies different from hepatocellular carcinoma: a systematic review. World J Gastroenterol. 2015;21:12896-12953. https://doi. org/10.3748/wjg.v21.i45.12896.
19. Pozzato G, Mazzaro C, Dal Maso L, et al. Hepatitis C virus and non-Hodgkin’s lymphomas: meta-analysis of epidemiology data and therapy options. World J Hepatol. 2016; 8:107-116. https://doi.org/10.4254/wjh.v8.i2.107.
20. Mahale P, Sturgis EM, Tweardy DJ, et al. Association between hepatitis C virus and head and neck cancers. J Natl Cancer Inst. 2016;108:8. https://doi. org/10.1093/jnci/djw035.
21. Ko HM, Hernandez-Prera JC, Zhu H, et al. Morphologic features of extrahepatic manifestations of hepatitis C virus infection. Clin Dev Immunol. 2012; 2012:740138. https://doi.org/10.1155/2012/740138.
22. Bertino G, Ardiri A, Proiti M, et al. Chronic hepatitis C: This and the new era of treatment. World J Hepatol. 2016;18;8(2):92-106. https://doi.org/ 10.4254/ wjh.v8.i2.92.
23. Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica. Barcelona: Seimc; 2016 [Consultado 10 de Diciembre 2018]. Disponible en: https://www.seimc.org/contenidos/congresosyeventos/seimcanteriores/seimc-EIMC-2016.pdf.
24. Poordad F, Schiff ER, Vierling JM, et al. Daclatasvir,sofosbuvir and ribavirin combination for HCV patients with advanced cirrhosis or posttransplant recurrence: phase 3 ALLY-1 study. J Hepatol. 2015;62:S261. https://doi.org/10.1016/ s0168-8278(15)30154-9.
25. Sulkowski MS, Gardiner DF, Rodriguez-Torres M, et al. Daclatasvir plus Sofosbuvir for Previously Treated or Untreated Chronic HCV Infection. N Engl J Med. 2014; 370(3):211-21. https://doi.org/10.1056/nejmx140011.
26. Sise ME, Wisocky J, Rosales IA, et al. Lupus-like Immune Complex-mediated Glomerulonephritis in Patients with Hepatitis C Virus Infection Treated with Oral, Interferon-free, Direct-acting Antiviral Therapy. Kidney Int Rep. 2016;1(3): 135-143. https://doi.org/10.1016/j.ekir.2016.06.006.
27. Pawlotsky JM, Aghemo A, Back D, et al. Recommendations on treatment of hepatitis C 2015. Journal of Hepatology. 2015;63:199-236. https://doi.org/ 10.1016/j.jhep.2015.03.025.
28. Naggie S, Cooper C, Saag M, et al. Ledipasvir and Sofosbuvir for HCV in Patients Coinfected with HIV-1. N Engl J Med. 2015;373:705-13. https://doi. org/10.1056/nejmoa1501315.
29. Federación de Sociedades Españolas de Oncología (FESEO). Cancer incidence in Spain, 2015. REDECAN Working Group. [Consultado 10 de Diciembre de 2018]. Disponible en: http://redecan.org/es/page.cfm?id=196&title=estimaciones-de-la-incidencia-y-la-supervivencia-del-cancer-en-espana-y-su-situacion-en-europa.
____
