Francisco Javier Salmerón Navas 1
Ester María Barreiro Fernández 2
1 Servicio de Farmacia. Hospital Valle de los Pedroches. Pozoblanco. Córdoba
(España)
2 Servicio de Farmacia. Hospital Universitario San Agustín. Linares. Jaén (España)
Fecha de recepción: 04/10/2022 – Fecha de aceptación: 26/10/2022
Correspondencia: Francisco Javier Salmerón Navas. Hospital Valle de los Pedroches (Servicio de Farmacia) – Juan del Rey Calero s/n 14400. Pozoblanco. Córdoba (España). csalnav@gmail.com
____
RESUMEN
Objetivos
El objetivo del estudio fue evaluar la efectividad y seguridad de enzalutamida como tratamiento del cáncer de próstata metastásico resistente a la castración, que hubiera o no recibido tratamiento con quimioterapia basado en taxanos.
Materiales y métodos
Estudio descriptivo retrospectivo de todos los pacientes diagnosticados de cáncer de próstata metastásico resistente a la castración en tratamiento con enzalutamida.
Se incluyeron a los pacientes según si cumplía los criterios del informe de posicionamiento terapéutico para el empleo de enzalutamida en dicho contexto, publicado en julio del 2015 por el Ministerio de Sanidad. La efectividad se evaluó midiendo la supervivencia libre de progresión y supervivencia global a partir del método Kaplan-Meier. La seguridad se evaluó mediante el número de reacciones adversas, su grado según “Common Terminology Criteria for Adverse Events” versión 5.0 y el porcentaje de reducción de dosis asociados a RAM.
Resultados
Se incluyeron 32 pacientes en el estudio. La mediana de edad fue de 75 años, con un 37,5 % de los pacientes con un valor en la escala de Gleason ≤7. La mediana de SLP para los pacientes se alcanzó a los 9,43 meses (IC95%; 3,47-15,39), mientras que el valor de la mediana de SG se alcanzó a los 22,61 meses (IC95%; 11,39-33,83). Hubo un total de 61 eventos adversos (EA) relacionados con el tratamiento, siendo los más frecuentes la astenia y la anemia.
Conclusiones
Enzalutamida ha mostrado un beneficio a nivel de efectividad con un perfil de seguridad tolerable en hombres con cáncer de próstata metastásico resistente a la castración
Palabras claves: Enzalutamida, Cáncer de próstata metastásico resistente a la castración, Efectividad, Seguridad, Análisis Kaplan-Meier, Supervivencia libre de progresión, Supervivencia global.
Effectiveness and Safety of Enzalutamide in Castration-Resistant Metastatic Prostate Cancer: Real-Life Results.
ABSTRACT
Objectives
The aim of the study was to evaluate the effectiveness and safety of enzalutamide as a treatment for metastatic castration-resistant prostate cancer that had or had not received treatment with taxane-based chemotherapy.
Material and methods
Retrospective descriptive study, including all patients diagnosed with metastatic castration-resistant prostate cancer under treatment with enzalutamide.
Patients were included according to whether they met the criteria of the therapeutic positioning report for the use of enzalutamide in this context, published in July 2015 by the Ministry of Health. Effectiveness was assessed by measuring progression-free survival and overall survival using the Kaplan-Meier method. Safety was assessed by the number of adverse reactions, their grade according to «Common Terminology Criteria for Adverse Events» version 5.0 and the percentage of dose reduction associated with ADRs.
Results
Thirty-two patients were included in the study. The median age was 75 years, with 37.5% of patients having a Gleason score ≤7. The median PFS for patients was reached at 9.43 months (95%CI; 3.47-15.39), while the median OS value was reached at 22.61 months (95%CI; 11.39-33.83). There were a total of 61 treatment-related adverse events (AEs), the most frequent being asthenia and anaemia.
Conclusion
Enzalutamide has shown an effectiveness benefit with a tolerable safety profile in men with metastatic castration-resistant prostate cancer.
Keywords: Enzalutamide, Metastatic castration-resistant prostate cancer, Effectiveness, Safety, Kaplan-Meier analysis, Progression-free survival, Overall survival.
____
Introducción
El cáncer de próstata (Cp) representa el cáncer maligno más frecuente en varones en cuanto a incidencia y el tercero en cuanto a mortalidad, después del cáncer de pulmón y colorrectal1. La incidencia aumenta a partir de los 50 años, con una mediana de edad de 70 años en el momento del diagnóstico2. Según datos de la Asociación Española Contra el Cáncer (AECC) y de Sociedad Española de Oncología Médica (SEOM) en el año 2018 se diagnosticaron en España 31.728 casos nuevos de Cp, de los cuales, 6.061 personas fallecieron por dichas causas, y se estima que hasta finales del 2022 habrá 30.884 nuevos casos de Cp1,3.
Actualmente, existen numerosas formas de clasificación del Cp, según la extensión de la enfermedad (TNM), el sistema de gradación Gleason para el grado histopatológico, el estadio clínico o patológico, o según el riesgo.
El tratamiento del Cp se basa en el estadio de la enfermedad, además de la estratificación del riesgo. Nos podemos encontrar con distintos esquemas terapéuticos, además de la intervención quirúrgica, según se trate de enfermedad localizada, localmente avanzada o enfermedad recurrente o metastásica.
El eje principal con respecto al tratamiento del Cp se baja en la inhibición de la síntesis de testosterona, ya sea mediante castración farmacológica (Hormonoterapia de primera línea con supresión androgénica con agonistas de la hormona liberadora de la hormona luteinizante (LHRH) o antagonistas) o mediante cirugía (orquiectomía). Este contexto de castración presenta una elevada efectividad, con medianas entre los 6 y 36 meses antes de la progresión. Tras progresión de esta línea, nos encontramos ante una situación de Cp resistente a la castración (CPRC)4,5,6.
A partir de entonces, el empleo de las diversas terapias sistémicas va a estar limitada por la situación clínica del paciente, la distribución de la enfermedad y por el tiempo de doblaje del antígeno prostático especifico (PSA).
Entre los diversos fármacos disponibles dentro del arsenal terapéuticos para el Cp metastásico, nos encontramos con la quimioterapia basada en taxanos (docetaxel y cabacitaxel), con los tratamientos que actúan sobre la señalización de los receptores androgénicos (enzalutamida, acetato de abiraterona y apalutamida), los radiofármacos (radio-223), la inmunoterapia (Pembrolizumab), además de otras posibles opciones7.
Enzalutamida es un inhibidor potente y competitivo de la señalización de los receptores androgénicos que bloquea varios pasos en la vía de señalización del receptor androgénico, dando lugar a una disminución del crecimiento de las células del cáncer de próstata, además de poder inducir la muerte de las células cancerosas8.
Se han desarrollado numerosos ensayos clínicos con enzalutamida en diferentes contextos de tratamiento (metastásico y no metastásico) y previo o posterior al empleo de quimioterapia.
El tratamiento con enzalutamida está aprobado por parte de la Agencia Europea del Medicamento (EMA) en los siguientes escenarios: CPRC no metastásico de alto riesgo; CPRC metastásico (CPRCm) cuya enfermedad ha progresado durante o tras el tratamiento con docetaxel; y CPRCm asintomáticos o levemente sintomáticos tras el fracaso del tratamiento de deprivación de andrógenos en los cuales la quimioterapia no está clínicamente indicada9.
Para la primera indicación, su aprobación se basó en el estudio de Hussain et als, ensayo clínico fase III, aleatorizado, doble ciego y comparado con placebo (ensayo clínico PROSPER), donde se incluyeron 1401 hombres con cáncer de próstata no metastásico resistente a la castración, aleatorizados en una proporción 2:1 para recibir enzalutamida dentro del grupo experimental o placebo para el grupo control. Los resultados de la variable supervivencia libre de progresión (SLP) fue de HR: 0,80 (IC95% 0,58 a 1,09)9.
En el estudio de Beera et al, ensayo fase III (ensayo PREVAIL), doble ciego, donde se aleatorizaron 1:1 a 1717 pacientes con CPRCm tras perdida de eficacia al tratamiento de deprivación de andrógenos, y sin recibir previamente quimioterapia, para estudiar la eficacia de enzalutamida frente a placebo. La diferencia de medianas de las variables supervivencia libre de progresión radiológica (SLPr) y supervivencia global (SG) fueron de 14,6 y 4 meses, con un HR de 0.32 (IC95% 0.28–0.36; p<0,0001) y 0.77 (IC95% 0.67–0.88; p = 0.0002) respectivamente10,11.
Del mismo modo, se estudió la eficacia de enzalutamida en pacientes con CPRCm tras tratamiento con docetaxel en el estudio de Scher et als, ensayo clínico fase III, aleatorizado, doble ciego y controlado con placebo (ensayo AFFIRM), donde se incluyeron un total de 1199 pacientes asignados en una proporción 2:1. Los resultados en las variables SG, SLPr y tiempo de progresión de la PSA fueron estadísticamente significativos, con valores de HR de 0,63 (IC95% 0,53–0,75), 0.40 (IC95% 0,35–0,47) y 0.25 (IC95% 0,20–0,30) respectivamente, al igual que una mejora en la calidad de vida de estos pacientes en comparación con aquellos en tratamiento con placebo en el grupo control12,13.
Estos resultados pueden verse afectados por posibles pseudoprogresiones a nivel óseo, pudiendo tener mejoras en los resultados de las variables SG y SLPr, evidenciados tras un análisis post-hoc en los ensayos AFFIRM y PREVAIL14.
Actualmente, enzalutamida está financiado a nivel nacional, en el contexto ce CPRCm, y su empleo frente a la alternativa con acetato de abiraterona se basa en criterios de eficiencias según las consideraciones establecidas por el informe de posicionamiento terapéutico (IPT) publicado por el Ministerio de Sanidad, Consumo y Bienestar Social4,15.
El objetivo del presente estudio es valorar la efectividad y seguridad del tratamiento con enzalutamida en pacientes con CPRCm, que hubiera o no recibido tratamiento con quimioterapia basado en taxanos.
Material y métodos
Estudio descriptivo retrospectivo, donde se incluirá a todos los pacientes diagnosticados de CPRCm en tratamiento con enzalutamida, desde agosto del 2016 hasta agosto del 2020, en un hospital de segundo nivel.
Antes de iniciar tratamiento con enzalutamida, se consensuo el tratamiento en un comité multidisciplinar formado por los servicios de farmacia, oncología, urología, anatomía patológica y radiología y además de tener que cumplir los criterios de uso establecidos en el IPT de enzalutamida, publicado en julio del 2015 por el Ministerio de Sanidad.
Los pacientes recibieron 160 mg de enzalutamida cada 24 horas junto con un análogo de la LHRH, hasta progresión de la enfermedad o la presencia de toxicidad inaceptable.
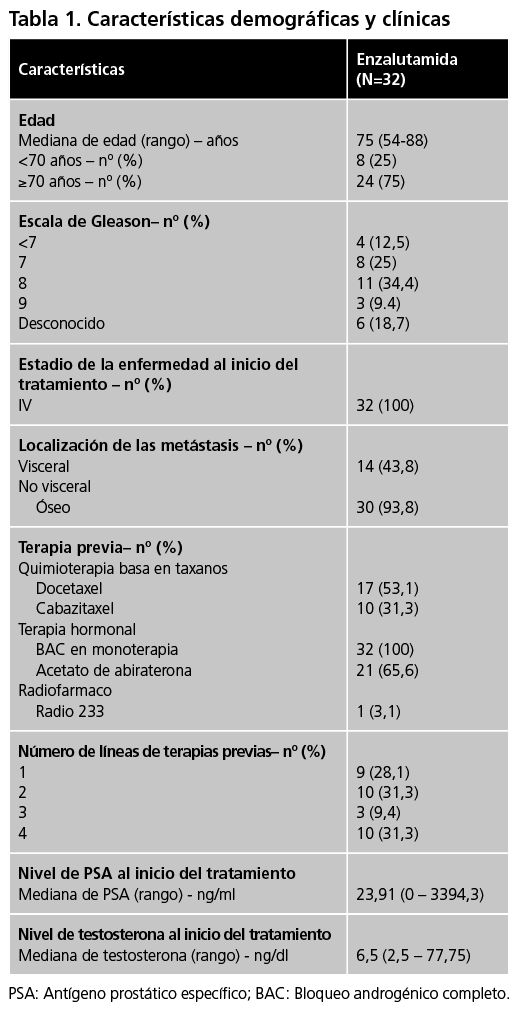
Para recoger los datos de los pacientes, se empleará la historia clínica digital (Diraya®), el programa de dispensación de pacientes externos Dominion (Farmatools®), y el programa de prescripción de quimioterapia Farmis-Oncofarm®, siendo procesados mediante el programa Microsoft Access® 2019. Se registraron las siguientes características poblacionales y clínicas de las pacientes: edad, escala Gleason, estadios al inicio del tratamiento, localización de las metástasis, terapia previa, niveles de PSA y testosterona, motivo de progresión y datos sobre seguridad.
Las variables del estudio será la SLP definida como el tiempo desde el inicio del tratamiento hasta la fecha de la primera documentación de progresión objetiva de la enfermedad o muerte debido a cualquier causa y la SG definida como el tiempo desde la fecha de inicio del tratamiento hasta la fecha de fallecimiento, debido a cualquier causa. Se empleó el programa SPSS Statistics® versión 26 para emplear el método de Kaplan- Meier. La seguridad se valorará según el número de reacciones adversas (RAM), el grado de severidad según criterios de “Common Terminology Criteria for Adverse Events” (CTCAE) versión 5.0, y el porcentaje de reducción de dosis asociados a RAM recogidas a partir de la historia clínica digital.
Resultados
Características demográficas y clínicas de los pacientes
Durante el periodo de estudio, se incluyeron un total de 32 pacientes con CPRCm. Las características basales se recogen en la tabla 1. La mediana de edad fue de 75 años, con 75% de los pacientes mayores de 70 años y con un valor en la escala de Gleason ≤7 en el 37,5% de los pacientes. La totalidad de los pacientes comenzaron el tratamiento con enzalutamida en estadio avanzado o metastásico de la enfermedad, siendo la localización de la metástasis más frecuente a nivel óseo (98,3%). En la figura 1 se representa los tratamientos previos utilizado a la terapia con enzalutamida tras el diagnóstico del carcinoma de próstata y el orden terapéutico empleado en cada uno de los casos.
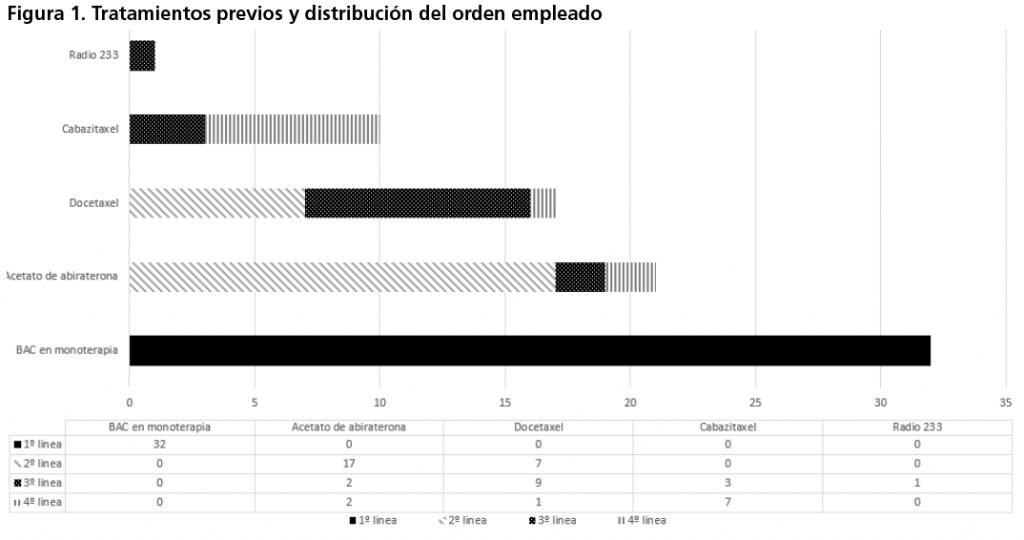
Acetato de abiraterona fue el tratamiento más empleado en segunda línea, mientras que la quimioterapia basada en taxanos fue empleado en un mayor porcentaje a partir de la tercera línea. Once pacientes (34,4%) secuenciaron el tratamiento con enzalutamida tras previo empleo de acetato de abiraterona, siendo los motivos las reacciones adversas relacionada con el tratamiento en 5 pacientes y clínicos en 6 casos. El tratamiento con enzalutamida se empleó previo uso a la quimioterapia en 12 pacientes.
Efectividad de enzalutamida
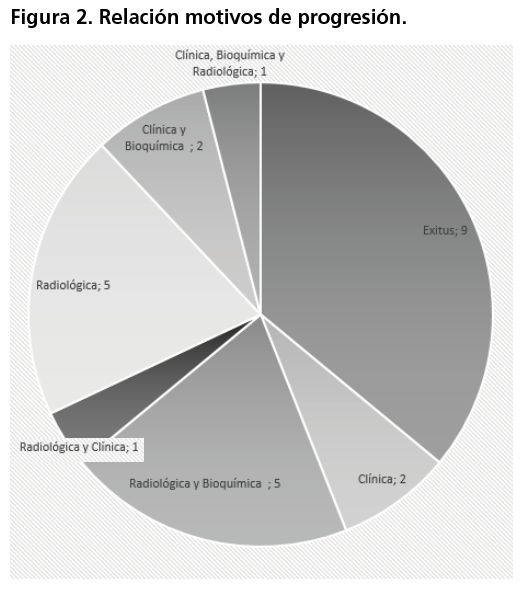
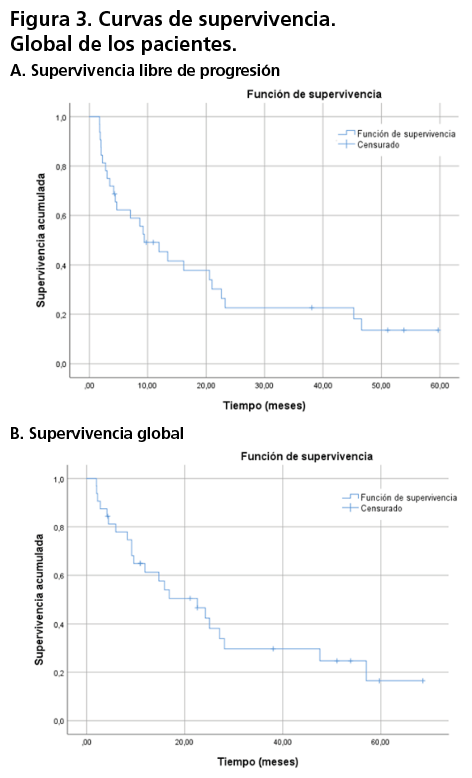
Ocurrieron un total de 25 eventos de progresión y 22 eventos de muerte para el global de las pacientes. El tiempo de seguimiento para medir la efectividad del tratamiento fue de 57 meses. El principal motivo de progresión fue el fallecimiento del paciente, seguido por la progresión radiológica y la radiológica/bioquímica (figura 2). Con respecto a la variable de SLP, la mediana se alcanzó a los 9,43 meses (IC95%; 3,47-15,39), mientras que el valor de la mediana de SG se alcanzó a los 22,61 meses (IC95%; 11,39-33,83) (figura 3A y 3B respectivamente).
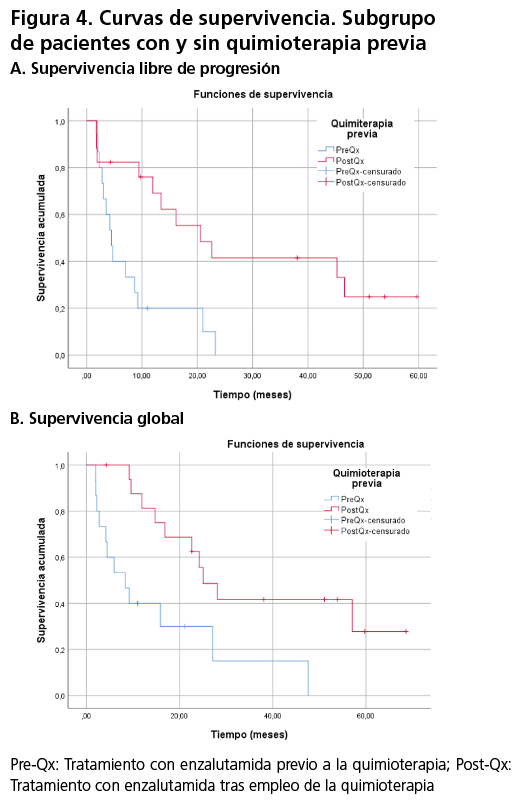
Con respecto al subgrupo de pacientes que habían recibido enzalutamida previamente a la quimioterapia la mediana de SLP y SG fueron 4,46 meses (IC95%; 2,93-5,99), y 8,36 meses (IC95%; 2,36-14,35) respectivamente, mientras que para los pacientes que recibieron enzalutamida tras la quimioterapia basada en taxanos, la mediana de SLP fue de 20,57 meses (IC95%; 8,75-32,38), y de SG fue de 25,07 (IC95%, 18,04-32,10) (figura 4).
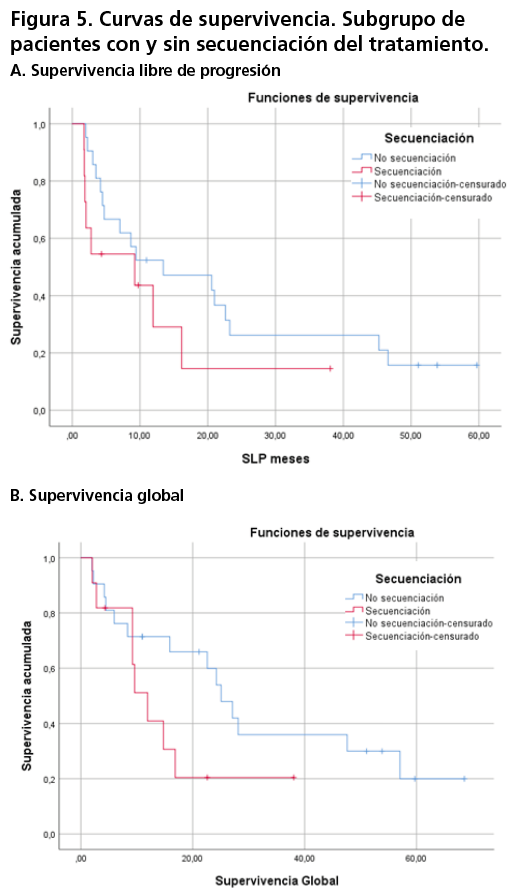
Del mismo modo, en referencia al subgrupo de pacientes que secuenciaron el tratamiento con enzalutamida tras previo empleo de acetato de abiraterona, la mediana de SLP alcanzada fue de 9,21 meses (IC95%; 0-20,10), mientras que en el subgrupo que no se secuenciaron dichos tratamientos, la mediana alcanzada fue de 13,43 meses (IC95%; 0-30,30). Por otro lado, con respecto a la variable SG la mediana se alcanzó a los 11,93 meses (IC95%; 7,87-15,98) y a los 25,07 meses (IC95%; 19,33-30,81) respectivamente (figura 5).
Seguridad
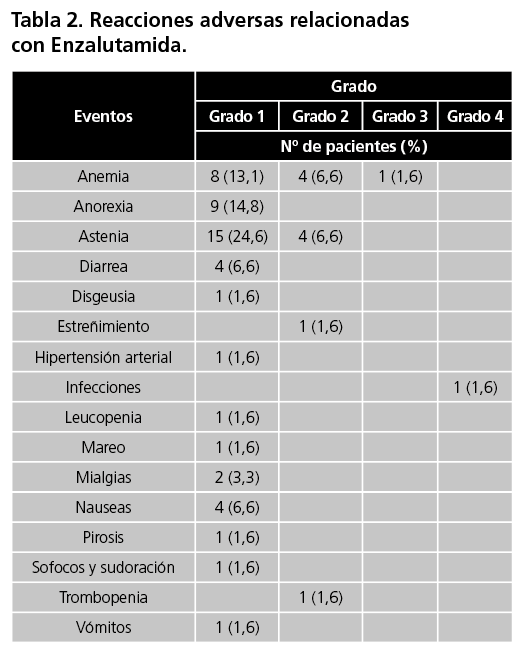
Hubo un total de 61 eventos adversos (EA) relacionados con el tratamiento de enzalutamida en 22 pacientes (tabla 2). Los eventos adversos de cualquier grado no hematológicos más frecuentes fueron la astenia (31,2%), anorexia (14,8%), diarreas (6,6%) y nauseas (6,6%). Entre las reacciones hematológica más frecuentes de cualquier grado se encuentra la anemia (22,2%), trombopenia (1,6%) y leucopenia (1,6%). El 80,33% de los eventos fueron de grado 1, mientras que hubo dos eventos de grado 3, siendo estos eventos relacionados con infección bacteriana y anemia.
Seis pacientes tuvieron que reducir la posología con enzalutamida durante el periodo de su tratamiento. Los principales motivos fueron el ajuste por insuficiencia renal durante el tratamiento (n=1) y por los eventos adversos, destacando la astenia (n=3), mialgias (n=1) y aumento de la tensión arterial (n=1).
Discusión
El tratamiento para el cáncer de próstata metastásico ha ido variando años tras años, tras la aprobación de nuevos fármacos, que permite mejorar la calidad asistencial de estos pacientes, consiguiendo aumentar la supervivencia a largo plazo.
Varios ensayos clínicos muestran una mejora en supervivencia en pacientes con cáncer de próstata metastásico en tratamiento con enzalutamida en distintos contextos, tales como los ensayos AFFIRM y PREVAIL.
En este estudio, se recopilaron los pacientes que fueron tratados con enzalutamida tras consensuar el tratamiento con un equipo multidisciplinar y según los criterios establecidos por el IPT.
Los resultados en SG permiten afirmar un claro beneficio en el uso de enzalutamida en pacientes con CPRCm, consiguiendo un valor en torno a los 2 años, con la mayoría de los pacientes ya tratados con varias líneas previas.
Este estudio hallo un resultado discordante en relación a los resultados de SG de los pacientes que no habían recibido previamente quimioterapia basada en taxanos, donde la mediana obtenida (mediana de 8,36 meses) es menor a los obtenidas en el ensayo clínico (mediana de 35,3 meses). De manera inversa, los pacientes que recibieron tratamiento con enzalutamida tras previo uso de taxanos, consiguieron medianas de SG superiores (25,07 meses) que en el obtenido en el ensayo clínico pivotal. (mediana de 18,4 meses)10,12.
En cuanto a la secuenciación de los agentes frente al receptor androgénico, los pacientes que no realizaron secuenciación del tratamiento con enzalutamida tras previo uso de acetato de abiraterona consiguieron aumentar su calidad de vida más de un año, frente a los que realizaron la secuenciación de ambos tratamientos. Este resultado es consistente con los resultados obtenidos en el estudio de Oh WK et al, donde se comprobó que, tras una primera línea con fármacos contra el receptor de andrógenos, el empleo de taxanos conseguía mejorar las tasas de respuestas en comparación con el empleo de un segundo agentes frente dichos receptores. Este suceso se podría explicar por la posible resistencia cruzadas tras el empleo secuencial de los agentes dirigidos, pudiendo minimizarse con el uso de taxanos entre ambos agentes16-18.
En relación con el perfil de seguridad, los eventos adversos más frecuentes fueron las no hematológicas, destacando la astenia y la anorexia (46%). Con respecto los eventos hematológicos, la anemia fue la reacción adversa más frecuenta (22,2%). Al mismo tiempo, la anemia grado 3 y la infección grado 4 fueron las reacciones adversas más graves descritas. En el estudio de Graff JN et al, se recopiló la información sobre los eventos adversos ocurridos en los ensayos AFFIRM y PREVAIL, siendo las más comunes la fatiga, diarrea, sofocos, dolor musculoesquelético, cefalea, estreñimiento y artralgias. En nuestro estudio, estas reacciones fueron recopiladas, aunque en una proporción menor19.
Las principales limitaciones del estudio son la falta de tamaño muestral, que no permiten tener resultados precisos, debido a la gran amplitud de los intervalos de confianza obtenidos; la falta de un comparador relevante, que permitirá valorar la magnitud del beneficio clínico obtenido con el tratamiento con enzalutamida en la práctica clínica diaria; y el registro de eventos adversos, debido a que al recogerse de la historia digital, podría dar lugar una pérdida de información, por la falta de notificación de eventos, como por los posibles sesgos de selección en la recopilación de los evento en cuestión.
Conclusiones
Enzalutamida está indicada y financiada en pacientes con CPRCm tras tratamiento con docetaxel o en pacientes asintomáticos o levemente sintomáticos tras el fracaso del tratamiento de deprivación de andrógenos en los cuales la quimioterapia no está clínicamente indicada.
Dicho tratamiento supone una terapia efectiva en pacientes con las características anteriormente indicadas, con resultados en SG de 22,61 meses. En relación, al subgrupo de pacientes que recibieron o no tratamiento previo con taxano, se obtuvo una diferencia de mediana de 17,34 meses con respecto a la variable SG (8,36 meses en pacientes sin quimioterapia previa vs 25,07 meses en pacientes con quimioterapia previa). Del mismo modo, la mediana de SG en pacientes que realizaron secuenciación de los agentes dirigidos contra el receptor androgénico, fue de 13,14 meses (11,93 meses en pacientes con secuenciación vs 25,07 meses pacientes sin secuenciación).
En cuanto al perfil de seguridad de enzalutamida, más de la mitad de los pacientes sufrieron algún tipo de eventos adverso. La toxicidad más frecuente descrita fue la astenia, seguida por la anemia. Los eventos adversos con grado ≥3 fueron la anemia y las infecciones.
Conflictos de intereses:Los autores declaran no tener conflictos de intereses.
Bibliografía
- Evolución y pronóstico del cáncer de próstata | AECC [Internet]. [Consultado el 01 Mar 2021]. Disponible en: https://www.aecc.es/es/todo-sobre-cancer/tipos-cancer/cancer-prostata/pronostico.
- Guía clínica de Cáncer de próstata [Internet]. [Consultado el 01 Mar 2021]. Disponible en: https://www.fisterra.com/guias-clinicas/cancer-prostata/#29403.
- Sociedad Española de Oncología Médica (SEOM). Las cifras del cáncer en España 2021 [Internet]. Disponible en: https://seom.org/images/LAS_CIFRAS_DEL_CANCER_EN_ESPANA_2022.pdf
- Ministerio de Sanidad, Sercicios Sociales e Igualdad. Informe de Posicionamiento Terapéutico de enzalutamida (Xtandi®). Disponible en: https://www.aemps.gob.es/medicamentosUsoHumano/informesPublicos/docs/IPT-enzalutamida-Xtandi.pdf?x42633.
- Blanco Castaño MA, Muñoz Muñoz N, Alegre del Rey E. Enzalutamida en Cáncer de próstata metastásico en progresión tras docetaxel. Informe para la Guía Farmacoterapéutica de Hospitales de Andalucía. Octubre 2013. Disponible en: http://gruposdetrabajo.sefh.es/genesis/genesis/Documents/enzalutamida_ca_prostata_final.pdf.
- Conde Estévez D, Garrido Siles M, de Juan-Garcia Torres P, Marcos Rodríguez JA, Martínez Callejo V, Parada Aradilla MA. Revisión de fármacos: cáncer de próstata y cáncer renal.Entrevista clínica y atención farmacéutica al paciente oncohematológico [Internet]. GEDEFO. 2018. Disponible en: https://gruposdetrabajo.sefh.es/gedefo/images/stories/documentos/2019/Revision_de_frmacos_-_Cncer_de_Prstata_y_Cncer_Renal.pdf.
- Aslam N, Nadeem K, Noreen R JAC. Prostate Cancer. NCCN Clin Pract Guidel Oncol (NCCN Guidel) [Internet]. 2021;27. Disponible en:: https://www.nccn.org/professionals/physician_gls/pdf/prostate_blocks.pdf9.
- Agencia Europea del Medicamento – EMA. Ficha técnica de Xtandi. Disponible en: https://www.ema.europa.eu/en/documents/product-information/zerbaxa-epar-product-information_es.pdf.
- Hussain M, Fizazi K, Saad F, Rathenborg P, Shore N, Ferreira U, et al. Enzalutamide in Men with Nonmetastatic, Castration-Resistant Prostate Cancer. N Engl J Med. 2018;378(26):2465–74.
- Beer TM, Armstrong AJ, Rathkopf D, Loriot Y, Sternberg CN, Higano CS, et al. Enzalutamide in Men with Chemotherapy-naïve Metastatic Castration-resistant Prostate Cancer: Extended Analysis of the Phase 3 PREVAIL Study. Eur Urol [Internet]. 2017;71(2):151–4.
- Beer TM, Armstrong AJ, Rathkopf DE, Loriot Y, Sternberg CN, Higano CS, et al. Enzalutamide in Metastatic Prostate Cancer before Chemotherapy. N Engl J Med. 2014;371(5):424–33.
- Scher HI, Fizazi K, Saad F, Taplin M-E, Sternberg CN, Miller K, et al. Increased Survival with Enzalutamide in Prostate Cancer after Chemotherapy. N Engl J Med. 2012;367(13):1187–97.
- Cella D, Ivanescu C, Holmstrom S, Bui CN, Spalding J, Fizazi K. Impact of enzalutamide on quality of life in men with metastatic castration-resistant prostate cancer after chemotherapy: Additional analyses from the AFFIRM randomized clinical trial. Ann Oncol. 2015;26(1):179–85.
- Armstrong AJ, Al-Adhami M, Lin P, Parli T, Sugg J, Steinberg J, et al. Association between New Unconfirmed Bone Lesions and Outcomes in Men with Metastatic Castration-Resistant Prostate Cancer Treated with Enzalutamide: Secondary Analysis of the PREVAIL and AFFIRM Randomized Clinical Trials. JAMA Oncol. 2020;6(2):217–25.
- Ministerio de Sanidad, Consumo y Bienestar Social – Profesionales de la Salud – Buscador situación financiación medicamentos [Internet]. [Consultado el 05 Mar 21]. Disponible en: https://www.mscbs.gob.es/profesionales/medicamentos.do?metodo=verDetalle&cn=719453.
- Oh WK, Miao R, Vekeman F, Sung J, Cheng WY, Gauthier-Loiselle M, Dhawan R, Duh MS. Real-world Characteristics and Outcomes of Patients With Metastatic Castration-resistant Prostate Cancer Receiving Chemotherapy Versus Androgen Receptor-targeted Therapy After Failure of First-line Androgen Receptor-targeted Therapy in the Community Setting. Clin Genitourin Cancer. 2017 Jun 19:S1558-7673(17)30170-2.
- Saito K, Fujii Y. Antitumor Activity and Safety of Enzalutamide After Abiraterone Acetate: Seeking the Optimal Treatment Sequence for Castration-resistant Prostate Cancer Patients. Eur Urol. 2018 Jul;74(1):46-47.
- Nakazawa M, Lu C, Chen Y, Paller CJ, Carducci MA, Eisenberger MA, Luo J, Antonarakis ES. Serial blood-based analysis of AR-V7 in men with advanced prostate cancer. Ann Oncol. 2015 Sep;26(9):1859-1865.
- Graff JN, Gordon MJ, Beer TM. Safety and effectiveness of enzalutamide in men with metastatic, castration-resistant prostate cancer. Expert Opin Pharmacother. 2015 Apr;16(5):749-54.
____