Fecha de recepción: 01/09/2017 – Fecha de aceptación: 31/01/2018
Cidoncha Muñoz I1, Pérez Abanades M2, Ibáñez Zurriaga A2, Ramírez Herráiz E2, Martínez Nieto C2, Morell Baladrón A2
1 Residente 4º año en Farmacia Hospitalaria
2 Especialista en Farmacia Hospitalaria. Facultativo Especialista de Área
Servicio de Farmacia. Hospital Universitario de La Princesa. Madrid (España)
____
Correspondencia:
Isabel Cidoncha Muñoz
Diego de León, 62
28006 Madrid
Correo electrónico: isabel.cidoncha@salud.madrid.org
____
Resumen
Objetivo: Evaluar la efectividad y seguridad de enzalutamida en el tratamiento del cáncer de próstata metastásico resistente a la castración (CPRCm).
Método: Estudio observacional retrospectivo de pacientes con CPRCm que iniciaron enzalutamida en cualquier línea de tratamiento entre enero 2015 y mayo 2016. Se recogieron variables demográficas, diagnósticas, terapéuticas y clínicas. Se evaluó la respuesta según la reducción del antígeno prostático específico con respecto al basal y supervivencia libre de progresión. Se registraron las reacciones adversas secundarias al tratamiento.
Resultados: 31 pacientes. Edad media: 77,68 (7,39) años. Mediana de antígeno prostático específico basal: 45,38 (16,8-153,8) ng/mL. La reducción de antígeno prostático específico fue ≥50% en 13 (43,33%) pacientes y >90% en 3 (23,07%). Se consideraron no respondedores 14 (56,66%) pacientes: 2 (14,28%) por reducción del antígeno prostático específico entre el 30-50% y 12 (85,71%) por progresión de la enfermedad, con elevación de antígeno prostático específico durante el tratamiento. La mediana de supervivencia libre de progresión fue 9 meses (IC95% 5,99-12,01). Efectos adversos más comunes: cefaleas (70,97%), fatiga (67,74%), hipertensión arterial (50,84%), eventos óseos (41,93%), de los cuales 46,15% fueron por tratamiento radioterápico para cáncer de próstata, 30,77% por compresión de la médula espinal, 15,38% por fractura ósea y 7,69% por cirugía ósea, y crisis epilépticas (16,13%), siendo el 40% de novo, 40% secundarias a ictus y 20% secundarias a lesión cerebral subyacente.
Conclusiones: Enzalutamida es un fármaco bien tolerado con actividad en pacientes con cáncer de próstata metastásico resistente a la castración. Se postula como alternativa terapéutica en dicha patología.
Palabras clave: Enzalutamida, resistente a la castración, neoplasia prostática.
____
INTRODUCCIÓN
El cáncer de próstata (CP) es la neoplasia más frecuente en la población masculina occidental1. Con respecto a la población general, se estima que en 2014 se sigue manteniendo como quinta causa de fallecimiento por cáncer en España, con 5.855 casos, con una edad media de fallecimiento de 75,06 años2.
Existe una correlación directa entre la incidencia de cáncer de próstata y la edad, de tal modo que la mayoría de los casos corresponden a varones con más de 65 años. Según los datos publicados por el Ministerio de Sanidad y Política Social (2009), la tasa de mortalidad por cáncer de próstata en hombres con edad avanzada (igual o mayor a 75 años) fue de 293,8 casos por 100.000 habitantes en el año 20073.
Estos datos reflejan la necesidad de incorporar nuevos fármacos a los esquemas terapéuticos clásicos, con el objetivo de aumentar tanto la esperanza como la calidad de vida de los pacientes diagnosticados.
Con respecto al tratamiento farmacológico, la terapia hormonal basada en el bloqueo androgénico es desde hace décadas la primera línea de tratamiento en el cáncer de próstata avanzado. Los fármacos más usados son los análogos de hormona liberadora de la hormona luteinizante (LHRH) y los antiandrógenos. En la mayoría de los pacientes dicho bloqueo consigue la disminución de la concentración del antígeno prostático específico (PSA), el alivio de los síntomas y la regresión del tumor4,5.
Cuando en estos pacientes el valor de PSA vuelve a aumentar de manera progresiva y continuada, se deben valorar otros tratamientos, ya que se considera que se ha desarrollado una resistencia a la supresión androgénica tradicional5.
Las guías clínicas de la Asociación Europea de Urología (EAU) definen el CPRC como aquel que presenta testosterona sérica en niveles de castración (<50 ng/ml o 1,7 nmol/L) y, además, uno de los siguientes criterios:
– Progresión bioquímica: tres elevaciones consecutivas de PSA, separadas por una semana, resultando en dos incrementos por encima del 50% del nadir, con un PSA final >2 ng/ml, habiendo suprimido el requisito de realizar al menos una segunda maniobra hormonal6.
– Progresión radiológica: progresión ósea por gammagrafía (dos o más lesiones) o progresión de lesiones de tejidos blandos según los criterios RECIST (Response Evaluation Criteria in Solid Tumors)7.
El conocimiento de los mecanismos implicados en el desarrollo de CPRC sigue siendo controvertido8,9. Se cree que una alteración en la señalización normal de andrógenos es fundamental para la patogénesis del CPRC.
Gracias al estudio AFFIRM, ensayo clínico en fase 3, multicéntrico, aleatorizado y controlado con placebo, la EMA aprobó en 2013 el tratamiento con enzalutamida en pacientes con CPRCm que habían recibido quimioterapia previa. Este ensayo asignó al azar 1.199 pacientes con una proporción 2:1 a enzalutamida 160 mg diarios o placebo. Los pacientes habían progresado a docetaxel de acuerdo con los criterios PCWG2. La administración de corticoides no era obligatoria pero se administró en un 30% de los pacientes. Después de una mediana de seguimiento de 14,4 meses, la mediana de supervivencia global en el grupo de enzalutamida fue de 18,4 meses frente a 13,6 en el grupo placebo (HR=0,63; p<0,001)10,11. La disminución confirmada de PSA del 50% o 90% fue del 52,5% y 23,9%, respectivamente, en los pacientes tratados con enzalutamida y del 1,5% y 0,9%, respectivamente, en los que recibieron placebo (p<0,0001). No hubo diferencias en cuanto a los efectos secundarios en ambos grupos, con una menor incidencia de efectos adversos grado 3-4 en el brazo de enzalutamida. Hubo una incidencia de convulsiones del 0,6% en el grupo de enzalutamida, no produciéndose en el grupo placebo.
El estudio PREVAIL es un ensayo clínico en fase 3 que compara enzalutamida frente a placebo en 1.717 pacientes con CPRCm asintomáticos o levemente sintomáticos que no habían recibido quimioterapia previamente12. Las variables principales fueron la supervivencia global y la supervivencia libre de progresión radiológica. La mediana de SLP no se alcanzó (IC del 95%: 13,8; no alcanzado) en el grupo tratado con enzalutamida y fue de 3,9 meses (IC del 95%: 3,7; 5,4) en el grupo tratado con placebo. El análisis definitivo de los resultados muestra un beneficio significativo de enzalutamida, frente a placebo, en la supervivencia global: 35,3 meses con enzalutamida frente a 31,3 meses con placebo (HR=0,77; p<0,0002). Los pacientes que recibieron enzalutamida demostraron una tasa de respuesta total del PSA significativamente superior (definida como una reducción ≥50% desde el inicio), en comparación con los pacientes que recibieron placebo, 78,0% frente al 3,5% (diferencia=74,5%, p<0,0001).
El estudio de Bradising y colaboradores demuestra que el porcentaje de respuestas que se obtiene administrando enzalutamida en cuarta o quinta línea (23% respondedores) en pacientes pretratados con quimioterapia diagnosticados de CPRCm es comparable con el que se obtiene administrando enzalutamida en tercera línea13.
El perfil de seguridad de enzalutamida evaluado en la indicación de pacientes expuestos a docetaxel se basó principalmente en el estudio pivotal AFFIRM (800 pacientes tratados con enzalutamida y 399 pacientes tratados con placebo). Los efectos adversos más frecuentes en el grupo de enzalutamida vs. placebo fueron fatiga (33,6% vs. 29,1%), diarrea (21,4% vs. 17,5%), sofocos (20,3% vs. 10,3%), artralgia (19% vs. 17,3%), edema periférico (15,3% vs. 13,3%), dolor musculoesquelético (14,5% vs. 11,5%), cefalea (11,6% vs. 5,5% ), disnea (9,9% vs. a 9,8%), debilidad muscular (9,3% vs. 6,8%), insomnio (8,8% vs. 6%), mareos (6,9% vs. a 5,5%), hematuria (6,5% vs. 4,5%), hipertensión (6,1% vs. 2,8%) y crisis epilépticas (0,8% vs. 0%)11.
En relación a los pacientes no expuestos a docetaxel, el estudio fase III PREVAIL es la principal fuente de datos a la hora de describir el perfil de seguridad de enzalutamida12. En este estudio la mayoría de pacientes experimentó al menos un acontecimiento adverso (97% vs. 93% enzalutamida, placebo respectivamente). No se observaron diferencias entre enzalutamida y placebo en el estudio PREVAIL en cuanto a las alucinaciones, en cambio en el estudio AFFIRM con pacientes pretratados con docetaxel sí las hubo. Tampoco se observaron diferencias en cuanto a la aparición de convulsiones (0,1% en ambos brazos del estudio), sin que tampoco puedan explicarse estas diferencias entre los dos estudios pivotales que avalan ambas indicaciones. Podría deberse a que los pacientes pudieran estar mejor identificados en el estudio PREVAIL, pero sigue siendo una reacción adversa relacionada con el medicamento teniendo en cuenta los datos preclínicos, el mecanismo de acción y una relación dosis-respuesta. Se han asociado casos de trastornos cognitivos al tratamiento con enzalutamida, si bien son poco frecuentes. Las reacciones adversas más frecuentemente descritas fueron diarrea, estreñimiento, fatiga, astenia, edema periférico, disgeusia, cefalea, sofocos e hipertensión.
El objetivo del estudio es evaluar la efectividad y seguridad de enzalutamida en el tratamiento de CPRCm.
MATERIAL Y MÉTODOS
Se realizó un estudio observacional retrospectivo en el que se incluyeron todos los pacientes diagnosticados de CPRCm que iniciaron tratamiento con enzalutamida en cualquier línea de tratamiento entre enero 2015 y mayo 2016, realizando su seguimiento hasta noviembre 2016. Para la identificación de los pacientes y la recogida de datos se utilizó el programa de dispensación a pacientes externos Dominion® y la historia clínica Hygeia®. Variables recogidas: demográficas (edad y sexo), diagnósticas (escala de Gleason en base al grado histopatológico y localización de metástasis), terapéuticas (fármacos recibidos anteriormente, línea de tratamiento al iniciar enzalutamida, duración del tratamiento y motivo de suspensión del mismo) y analíticas (grado de reducción de PSA). Con la función de objetivar la capacidad funcional de los pacientes se utilizó la escala ECOG (Eastern Cooperative Oncology Group) tanto al inicio del tratamiento como al finalizar el seguimiento. Se evaluó la respuesta, mediante los niveles de PSA total, considerándose pacientes respondedores aquellos con una reducción del PSA igual o superior al 50% con respecto al valor basal a las 12 semanas de tratamiento, y la SLP. Para evaluar la seguridad se registraron todos los efectos secundarios recogidos en la historia clínica de los pacientes según los estándares de la Common Terminology Criteria for Adverse Events versión 4.0 (CTCAE). Se consideró evento óseo el tratamiento de radioterapia o cirugía ósea para el cáncer de próstata, fractura ósea patológica o compresión de la médula espinal.
El análisis estadístico se realizó mediante el programa informático SPSS versión 15.0 (Statistical Product and Service Solutions). Para los contrastes de hipótesis e intervalos de confianza se consideró un nivel de confianza del 95%. Los datos se analizaron globalmente, además de realizarse un análisis en función de si habían recibido tratamiento previo con docetaxel o no. Para la descripción de variables cuantitativas se utilizaron la media y desviación estándar para las variables con distribución normal, y la mediana y el rango intercuartílico para las de distribución no normal. Para la descripción de variables cualitativas, se utilizaron el número y porcentaje de pacientes. Para los casos en que se debe contrastar grupos de variables se utilizó la prueba estadística t-student o ANOVA si la variable cuantitativa sigue una distribución normal. Para las variables cualitativas se empleó el test de Chi-cuadrado o la prueba exacta de Fisher según el tipo de datos. Se asumió significación estadística para valores p<0,05. Se realizó un estudio de la supervivencia libre de progresión mediante curvas de Kaplan-Meier y regresión de Cox. Para evaluar el perfil de seguridad se describieron todos los datos de tolerabilidad al tratamiento. Todos los acontecimientos adversos fueron descritos y tabulados.
RESULTADOS
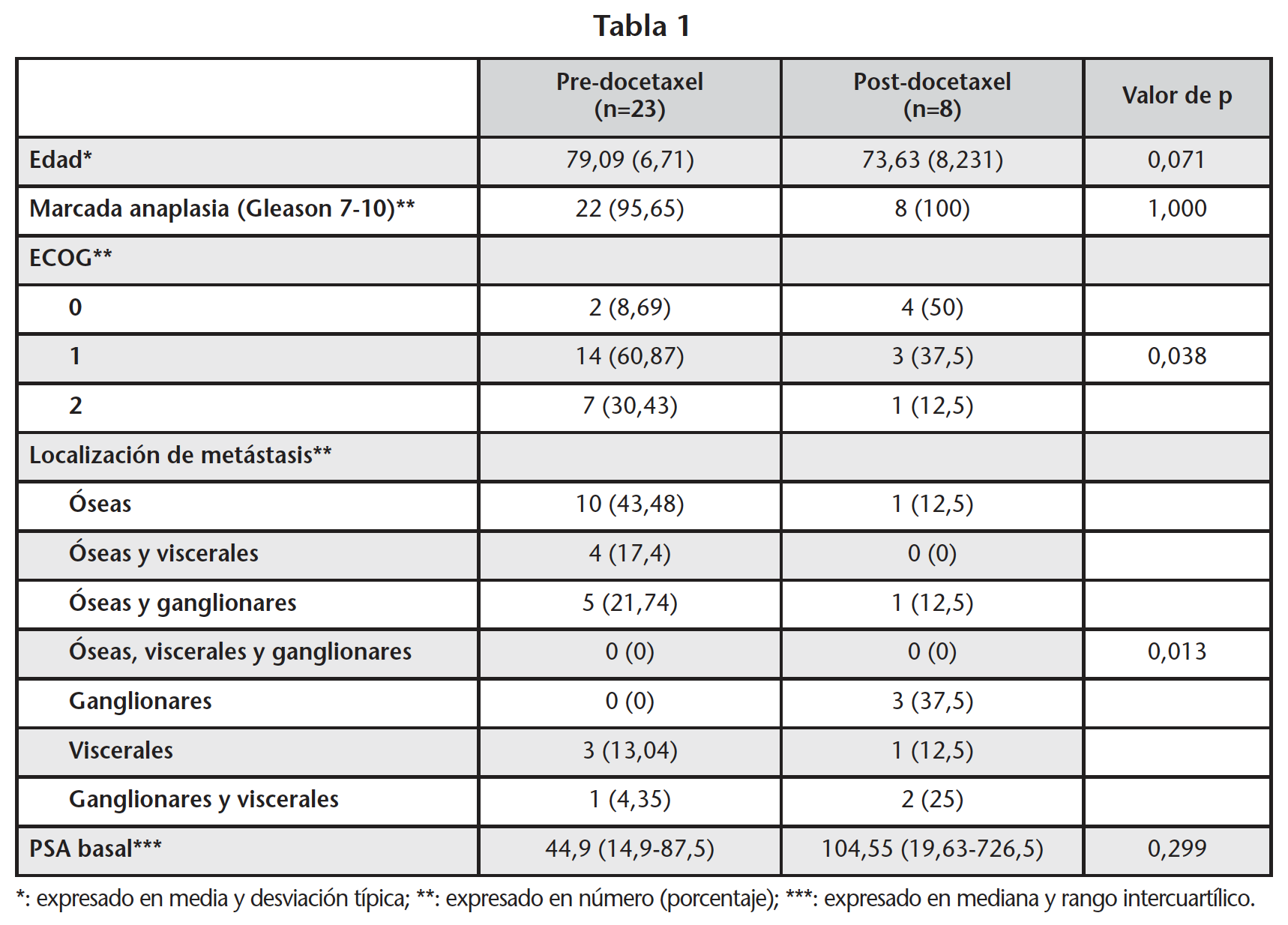
Durante el periodo de estudio recibieron enzalutamida 31 pacientes, con una media de edad de 77,68 (7,39) años, todos diagnosticados de CPRCm. Según la clasificación de Gleason, 30 (96,78%) pacientes presentaban una marcada anaplasia (Gleason 7-10). Con referencia a la localización metastásica de las lesiones, 11 (35,48%) pacientes presentaban metástasis óseas únicamente, 6 (19,35%) metástasis óseas y ganglionares, 4 (17,4%) metástasis a nivel óseo y visceral, 4 (12,9 %) metástasis viscerales, 3 (9,68%) metástasis ganglionares exclusivamente y 3 (9,68%) metástasis ganglionares y viscerales. Del total, 26 (83,87%) pacientes recibieron castración química completa con análogos de la hormona liberadora de gonadotropina (GnRH) y con un fármaco antiandrógeno y 5 (16,13%) pacientes únicamente con análogos de la GnRH. La castración quirúrgica fue una intervención realizada solo en 2 (6,45%) pacientes. La mediana de PSA basal era de 45,38 (16,8-153,8) ng/mL. En el momento de iniciar tratamiento con enzalutamida, el performance status en base a la escala ECOG era de 0 en 6 (19,35%) pacientes, de 1 en 17 (54,83%) y de 2 en los 8 (25,8%) restantes. El 25,8% recibieron tratamiento quimioterápico con taxanos como primera línea del tratamiento del CPRCm, siendo docetaxel el único fármaco utilizado (100%).
Las características basales al inicio de tratamiento en función de si habían recibido o no tratamiento previo con docetaxel se muestran en la tabla 1.
La pauta que recibieron todos los pacientes fue de 160 mg cada 24 horas. El 58,06% de los pacientes recibieron enzalutamida como primera línea de tratamiento, el 25,80% como segunda y el 16,13% como tercera línea.
Al finalizar el tratamiento, 2 (6,45%) pacientes tuvieron un ECOG 0, 12 (38,70%) un ECOG 1, 14 (45,16%) un ECOG 2, 1 (3,22%) un ECOG 3 y 2 (6,45%) fallecieron durante el tratamiento (ECOG 5).
Con respecto a la respuesta al tratamiento con enzalutamida fueron evaluables 30 (96,77%) de 31 pacientes, por no disponer de registro de los valores de PSA durante el tratamiento de uno de los pacientes. Se consiguió una reducción del PSA mayor o igual al 50% en 13 (43,33%) pacientes y superior al 90% en 3 (23,07%) pacientes. Se consideraron no respondedores 14 (46,66%) pacientes: 2 (11,76%) tuvieron una reducción del PSA entre el 30 y el 50% y 12 (85,71%) presentaron progresión de la enfermedad, con una subida de PSA durante el tratamiento con enzalutamida en comparación con el valor basal.
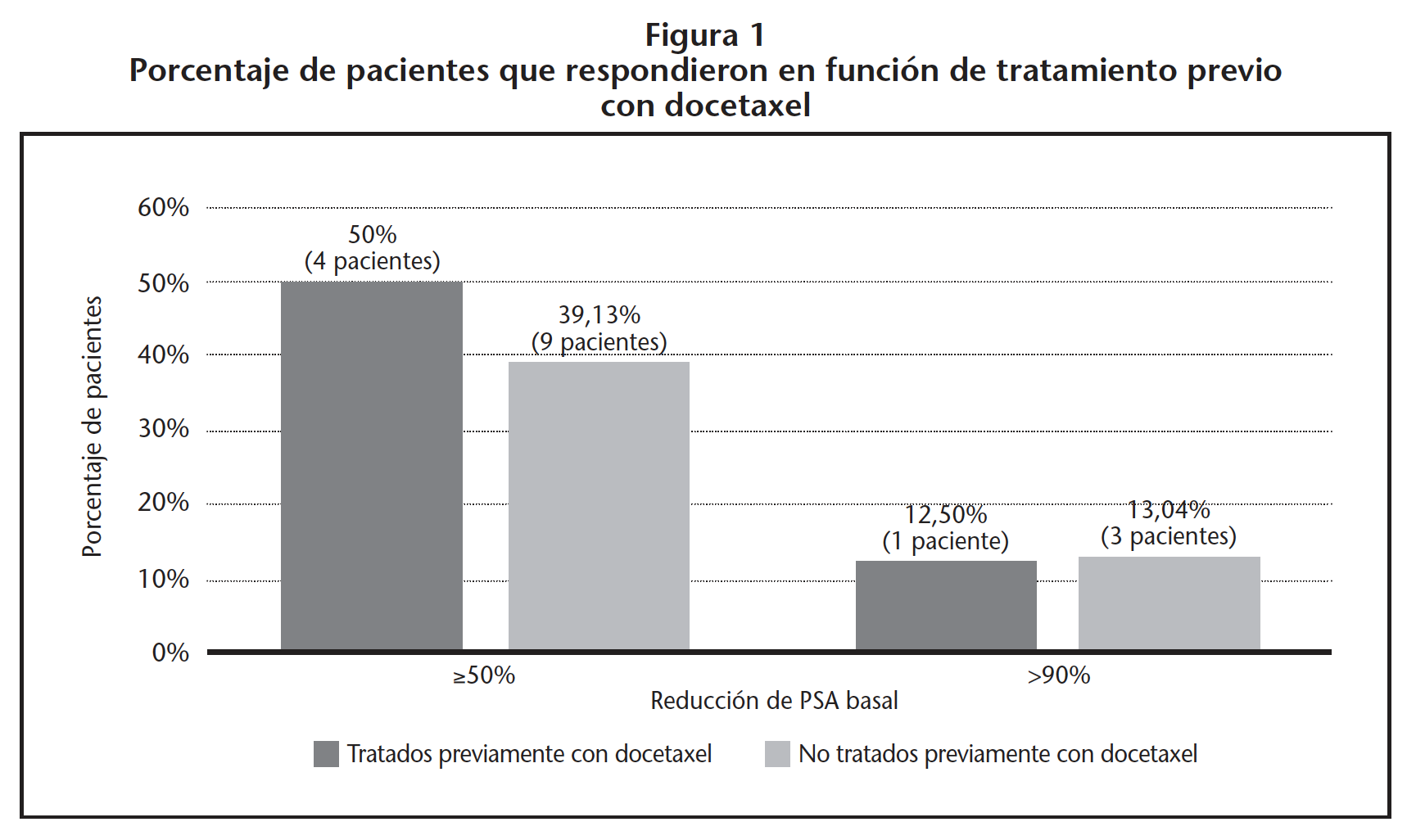
En la figura 1 se muestra el porcentaje de pacientes que respondieron en función del tratamiento previo con docetaxel, no encontrando diferencias estadísticamente significativas entre ambos grupos (p=0,657).
La mediana de SLP fue de 9 meses (IC95% 5,99-12,01). Como se observa en la figura 2, el grupo que había recibido docetaxel previo tiene una mediana de SLP de 7 meses (IC95% 0,00-15,98) y el grupo que no lo había recibido de 10 meses (IC95% 6,42-13,58), no encontrando diferencias estadísticamente significativas (HR 1,47 IC95% 0,46-4,12, p=0,522).

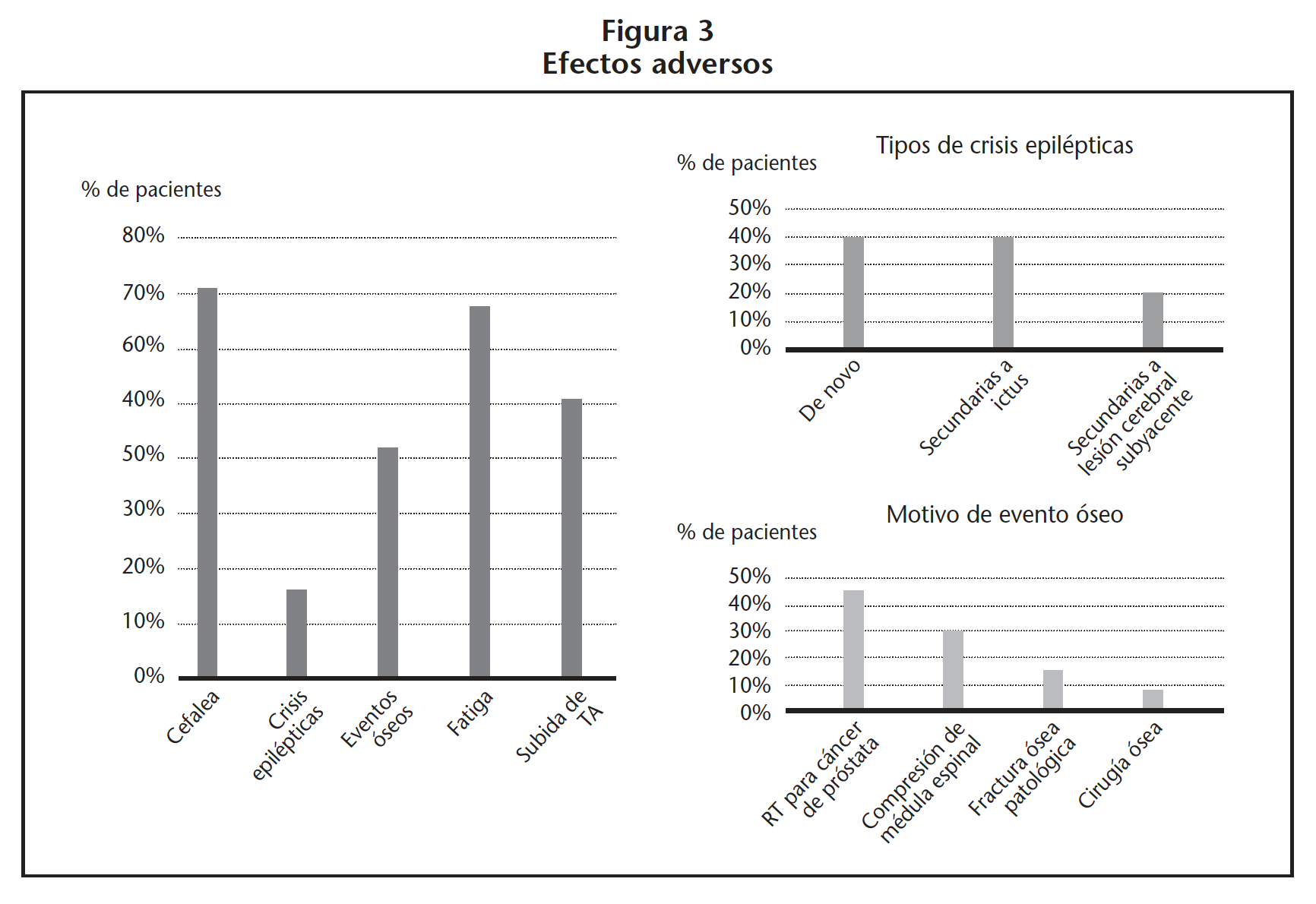
En cuanto a la evaluación de la seguridad, los efectos adversos de grado 1-2 observados fueron: cefaleas en 22 (70,97%) pacientes, fatiga en 21 (67,74%), subida de la tensión arterial en 16 (50,84%), eventos óseos en 13 (41,93%), de los cuales 46,15% fueron debidos a tratamiento de radioterapia para cáncer de próstata, 30,77% por compresión de la médula espinal, 15,38% por fractura ósea patológica y 7,69% por cirugía ósea, y crisis epilépticas en 5 (16,13%) pacientes, siendo el 40% de las mismas crisis epilépticas de novo, 40% secundarias a ictus y 20% secundarias a una lesión cerebral subyacente (Figura 3). Todas estas reacciones adversas fueron clínicamente manejables.
DISCUSIÓN
Enzalutamida está indicada en hombres adultos con CPRCm que sean asintomáticos o levemente sintomáticos tras el fracaso del tratamiento de deprivación de andrógenos en los cuales la quimioterapia no está aún clínicamente indicada, y en aquellos pacientes cuya enfermedad ha progresado durante o tras el tratamiento con docetaxel14. En nuestro estudio resultaron ser 8 pacientes tratados previamente con docetaxel y 23 que no habían recibido quimioterapia previa. El tratamiento se mantuvo hasta progresión de la enfermedad (evidencia de progresión radiológica, evento óseo o progresión clínica).
Con respecto a la capacidad funcional, el performance status al inicio de tratamiento de los pacientes incluidos fue similar al de los estudios de Bradising et al.13 y AFFIRM11; mientras que en el actual estudio el 74,19% de los pacientes tenían un ECOG entre 0 y 1, el 25,8% tenían un ECOG de 2 y ningún paciente presentó ECOG de 3, en el trabajo de Badrising et al.13 un 68% de pacientes presenta un ECOG entre 0 y 1, un 27% presenta un ECOG de 2 y un 5% de 3. En el ensayo AFFIRM, la situación funcional de acuerdo a la clasificación ECOG fue de 0-1 en el 91,5% y 2 en el 8,5% de pacientes. En el estudio PREVAIL12 se requería que todos los pacientes incluidos tuvieran un ECOG 0-1.
Con respecto a la efectividad, un 50% de los pacientes que había recibido previamente docetaxel experimentó una disminución igual o superior al 50% en los niveles de PSA, porcentaje similar al obtenido en el estudio de Cicero et al.15, en el que un 42,3% de los pacientes experimentaron disminución de PSA. Este resultado es ligeramente inferior al obtenido en el estudio AFFIRM11, que es del 54%. En cambio, es superior al obtenido en el estudio de Badrising et al.13 (50% vs. 23%). Posiblemente, la mayor efectividad observada en nuestro estudio fue debida a que nuestra población presentaba un estadio menos avanzado de la enfermedad con respecto al estudio de Badrising et al.13, tanto es así que la mediana de PSA basal fue de 45,38 ng/mL en nuestro caso en comparación con una mediana de PSA basal de 463 ng/mL en el estudio anteriormente mencionado. En el grupo que no había recibido docetaxel previamente, un 39,13% de los pacientes experimentó una disminución igual o superior al 50% en los niveles de PSA. Este resultado es inferior al obtenido en el estudio PREVAIL12, que es de un 78%. Esto puede ser debido a que en el estudio PREVAIL12 se requería que los pacientes incluidos tuvieran un estado funcional ECOG 0-1 y, en nuestro caso, un 25,8% de los pacientes ya presentaban un ECOG de 2 al inicio de tratamiento con enzalutamida. Este peor estado funcional basal podría tener influencia en la menor respuesta observada en nuestro estudio.
La mediana de SLP en nuestro estudio fue de 9 meses, en concordancia con la obtenida en el estudio de Cicero et al.15, que fue de 8,3 meses.
En cuanto a la seguridad, enzalutamida puede considerarse un fármaco bien tolerado. La frecuencia de aparición y tipo de efectos adversos fueron similares a los reportados en los estudios AFFIRM11, PREVAIL12 y Badrising et al.13, siendo la fatiga la reacción adversa medicamentosa más prevalente, observada en un 67,74% de pacientes. En los estudios AFFIRM11 Y PREVAIL12 el 0,8% y el 0,1% de pacientes respectivamente presentaron una crisis epiléptica, porcentajes muy inferiores si los comparamos con nuestro estudio, en el que un 16,13% de pacientes sufrió una crisis epiléptica, posiblemente debido a que estos pacientes llevaban prescrito tramadol concomitante, pudiendo reducir el umbral epiléptico y aumentado así el riesgo de sufrir crisis epilépticas16. Enzalutamida, en nuestro estudio, produjo eventos óseos en un 41,93% de pacientes, de los cuales un 46,15% fueron radiación en el hueso, 30,77% fueron compresión de la médula espinal, 15,38% fractura ósea patológica y 7,69% cirugía ósea, resultados comparables a los obtenidos en el estudio PREVAIL12, en el que un 66,3% fueron radiación en el hueso, un 13,5% fueron compresión de la médula espinal, un 11,9% fractura ósea patológica y 3,7% cirugía ósea.
Nuestros resultados están en línea con los reportados en la literatura. La principal limitación es que se trata de un estudio retrospectivo con información extraída de la historia clínica informatizada de los pacientes, con un periodo de seguimiento corto y realizado en un único centro, con un tamaño muestral pequeño, a diferencia de los ensayos AFFIRM11, PREVAIL12 y Bradising et al.13, multicéntricos, donde el número de pacientes es de 1.199, 1.717 y 109, respectivamente. Además, este estudio incluye pacientes con enzalutamida en diferentes líneas de tratamiento, por lo que la población carece de homogeneidad en cuanto a respuesta se refiere. Estos hechos podrían influir en las leves diferencias apreciadas en cuanto a resultados obtenidos.
CONCLUSIONES
Enzalutamida ha demostrado ser un fármaco eficaz para el tratamiento del CPRCm. Es un fármaco bien tolerado, con aparición de cefaleas y fatiga como efectos adversos más prevalentes. Los resultados del presente estudio están en línea con los ensayos clínicos publicados que han posicionado la enzalutamida, por su eficacia y seguridad, como una alternativa para el tratamiento del CPRCm, pre o postquimioterapia, con la ventaja añadida de su administración por vía oral.
Conflicto de intereses: Los autores declaran no tener conflicto de intereses.
BIBLIOGRAFÍA
1. Alcaraz A, Medina R, Maroto P, Climent M, Castellano D, Carles J. Cáncer de próstata resistente a castración: ¿hacia dónde vamos? Actas Urológicas Españolas 2012;36(6):367-74.
2. Seom.org [Acceso junio 2017]. Disponible en: http:// www.seom.org/seomcms/images/stories/recursos/Las_cifras_del_cancer_en_Esp_2017.pdf.
3. Regidor E, Gutiérrez-Fisac JL, Alfaro M. Indicadores de Salud 2009. Evolución de los indicadores del estado de salud en España y su magnitud en el contexto de la Unión Europea. Madrid: Ministerio de Sanidad y Política Social, 2009. [Acceso Febrero 2012]. Disponible en: http://www.msc.es/estadEstudios/estadisticas/inforRecopilaciones/docs/Indicadores2009.pdf.
4. Carballido Rodríguez J. Cáncer de próstata avanzado. Información Terapéutica del Sistema Nacional de Salud 1998;22(2):33-43.
5. Heidenreich A, Bolla M, Joniau S, Mason M, Matveev V, Mottet N, et al. Guía clínica sobre el cáncer de próstata. Asociación Europea de Urología 2010.
6. Heidenreich A, Bastian PJ, Bellmunt J, Bolla M, Joniau S, Van Der Kwast T, et al. EAU guidelines on prostate cáncer. Part II: Treatment of advanced, relapsing, and castration-resistant prostate cáncer. Eur Urol. 2014;65: 467-79.
7. Eisenhauer EA, Therasse P, Bogaerts J, Schwartz, D. Sargent, R. Ford, et al. New response evaluation criteria in solids tumours: revised RECIST guideline (versión 1.1). Eur J Cancer. 2009;45:228-47.
8. Chi KN, Bjartell A, Dearnaley D, Saad F, Schröder FH, Sternberg C, et al. Castration-resistant prostate cáncer: from new pathophysiology to new treatment targets. Eur Urol. 2009;56:594-605.
9. Attard G, Cooper CS, de Bono JS. Steroid hormone receptors in prostate cáncer: a hard habit to break? Cancer Cell. 2009;16:458-62.
10. Scher HI, Fizazi K, Saad F, Taplin M-E, Sternberg CN, Miller K, et al. Increased survival with enzalutamide in prostate cancer after chemotherapy. N Engl J Med. 2012;367(13):1187-97.
11. Sternberg CN, de Bono JS, Chi KN, Fizazi K, Mulders P, Cerbone L, et al. Improved outcomes in elderly patients with metastatic castration-resistant prostate cancer treated with the androgen receptor inhibitor enzalutamide: results from the phase III AFFIRM trial. Ann Oncol. 2014;25(2):429-34.
12. Beer TM, Armstrong AJ, Sternberg CN, Higano CS, Iversen P, Loriot Y, et al. Enzalutamide in men with chemotherapy-naive metastatic prostate cancer (mCRPC): Results of phase III PREVAIL study. J Clin Oncol. 2014; 32(4s):abstr LBA1.
13. Badrising SK, Van der Noort V, Hamberg P, Coenen J L.L.M, Aarts MJ, Van Oort IM. Enzalutamide as a Fourth- or Fifth-Line Treatment Option for Metastatic Castration-Resistant Prostate Cancer. Oncology 2016.
14. Ficha técnica de Xtandi®. [Acceso Diciembre 2016]. Disponible en: http://www.ema.europa.eu/docs/es_ ES/document_library/EPAR_-_Product_Information/ human/002639/WC500144996.pdf.
15. Cicero G, De Luca R, Dorangricchia P, Dieli F. The clinical efficacy of enzalutamide in metastatic prostate cáncer: prospective single-center study. Anticancer Res. 2017 Mar;37(3):1475-80.
16. Ficha técnica de Adolonta®. [Acceso Junio 2017]. Disponible en: https://www.aemps.gob.es/cima/pdfs/ es/ft/59086/FichaTecnica_59086.html.pdf.
____
Descargar artículo en PDF: Efectividad y seguridad de enzalutamida en cáncer de próstata metastásico resistente a la castración
