Rueda-Naharro A1, Domínguez-Gozalo A1, Ricote-Lobera I2, Ortiz-Martín B2, García-Benayas E1, Torres-Perea R3
1 Licenciado en Farmacia. Facultativo Especialista en Farmacia Hospitalaria. Servicio de Farmacia
2 Licenciado en Farmacia. Facultativo Especialista en Farmacia Hospitalaria
3 Licenciado en Medicina. Facultativo Especialista de Medicina Interna, Enfermedades Infecciosas-VIH.
Servicio de Medicina Interna
Hospital Universitario Severo Ochoa. Leganés. Madrid (España)
____
Rev. OFIL 2016, 26;4:280-285
Fecha de recepción: 22/02/2016 – Fecha de aceptación: 28/05/2016
____
Correspondencia:
Aída Rueda Naharro
C/Gobernador, 2 – 1º C
28912 Leganés (Madrid)
Correo electrónico: aidarn.rueda@gmail.com
____
Resumen
Objetivo: Valorar eficacia, seguridad e impacto económico de la monoterapia con darunavir (DRV) 800 mg/día potenciado con ritonavir (r) 100 mg/día en pacientes VIH+ pretratados.
Método: Estudio observacional, retrospectivo, que incluyó pacientes VIH+ en tratamiento con DRV/r. Se recogieron, entre otras, variables demográficas, TAR previo y posterior a DRV/r, duración de la monoterapia, adherencia y coinfección por el virus de la Hepatitis C (VHC) así como cargas virales plasmáticas y recuentos de CD4. Se analizaron los motivos de suspensión de la monoterapia. El impacto económico se estimó a partir de la diferencia del coste del TAR previo y de la monoterapia, en base al precio medio de adquisición.
Resultados: Se analizaron 51 pacientes. 47,1% estaba coinfectado por VHC. La duración media de la monoterapia fue de 26 meses. La adherencia media fue 95,2%. Siete pacientes sufrieron fracaso viral. Once pacientes suspendieron el tratamiento por reacciones adversas, interacciones farmacológicas, y/o alteraciones analíticas. No hubo diferencias estadísticamente significativas entre recuento de CD4 posterior vs. previo a monoterapia. Tampoco encontramos relación entre el fracaso con DRV/r y el tratamiento previo con IP, el grado de adherencia, la coinfección por VHC, la carga viral plasmática (CVP) previa ni entre las determinaciones analíticas previas vs. posteriores.
Al finalizar el estudio, 32 pacientes (62,7%) continuaban con monoterapia. El ahorro medio por paciente tratado con DRV/r en monoterapia/mes fue 200,8€.
Conclusiones: El tratamiento en monoterapia con DRV/r es eficaz y coste-efectivo, sin embargo no mejora significativamente el perfil de efectos adversos del paciente a corto plazo.
Palabras clave: Darunavir, ritonavir, monoterapia, VIH, VIH+, tratamiento antirretroviral.
____
Introducción
El tratamiento antirretroviral (TAR) de inicio recomendado en la actualidad para la infección por el virus de la inmunodeficiencia humana (VIH) debe estar compuesto, en términos generales, por la combinación de 3 fármacos: 2 inhibidores de la transcriptasa inversa análogos de nucleósidos (ITIAN) + inhibidor de la integrasa (INI), 2 ITIAN + inhibidor de la transcriptasa inversa no análogo de nucleósido (ITIANN) ó 2 ITIAN + inhibidor de la proteasa (IP) potenciado con ritonavir (r)1. Con ello se consigue que la carga viral plasmática (CVP) permanezca indetectable, se restablezca la función inmunológica y se reduzca la morbi-mortalidad, mejorando la calidad de vida del paciente. No obstante, la eficacia puede estar condicionada por la aparición de efectos adversos que provoquen falta de adherencia y/o cambio del TAR1.
Los pacientes con CVP indetectable, alta adherencia y sin resistencias a IPs podrían beneficiarse de esquemas de tratamiento simplificados, con menos efectos adversos, elevada barrera genética y buen perfil farmacocinético, como es el darunavir potenciado con ritonavir (DRV/r)2,3. Esta estrategia ha demostrado la no inferioridad en cuanto a eficacia y seguridad respecto a la triterapia con 2 ITIAN más DRV/r4,5 y además disminuye el impacto económico del tratamiento de la infección6. Sin embargo, no debe generalizarse para todos los pacientes con TAR, sino plantearse como una opción en pacientes con toxicidad asociada a ITIAN7. Las guías GESIDA1 proponen la monoterapia como alternativa cuando no exista coinfección con el virus de la hepatitis B (VHB), la CVP sea menor de 50 copias/ml durante al menos 6 meses y no haya mutaciones en el gen de la proteasa o antecedentes de fracaso a IP/r.
El objetivo de este estudio es valorar la eficacia, seguridad y el impacto económico del TAR de mantenimiento con DRV 800 mg/día potenciado con ritonavir 100 mg/día en pacientes VIH+ pretratados.
Materiales y métodos
Se realizó un estudio observacional y retrospectivo durante 5 años (2009-2013) en un hospital general público universitario de 400 camas, que incluyó todos los pacientes VIH+ en tratamiento con DRV/r que recibieron la medicación en el Servicio de Farmacia. Los datos fueron obtenidos del programa informático de gestión FARHOS®, del registro de datos analíticos WEBLAB® y de la historia clínica.
Se recogieron variables demográficas: edad y sexo del paciente; de tratamiento: TAR previo y posterior a DRV/r, fecha de inicio y fin con DRV/r, unidades dispensadas respecto al tiempo transcurrido entre cada dispensación para el cálculo de la adherencia y si existía o no coinfección por el virus de la Hepatitis C (VHC). Se consideraron adherentes aquellos pacientes con una tasa de cumplimiento mayor del 90%8.
Se analizó si los pacientes cumplían los criterios de inclusión en tratamiento con monoterapia según las guías GESIDA1.
Para valorar la eficacia se recopilaron datos de CVP, número de CD4 previos y posteriores a la monoterapia y número y valor de los blips (repuntes virológicos transitorios con valores de CVP aislados y transitorios entre 50 y 200 copias/mL)1 durante el tratamiento con DRV/r. Se definió fracaso virológico (FV) como CVP >50 copias/mL en dos determinaciones consecutivas separadas 2-4 semanas tras tener una CVP indetectable (20 copias/ml=1,3 log, menor del límite de detección de la técnica); y fracaso inmunológico como la incapacidad de obtener un recuento adecuado de CD4 (>250 CD4/mcl) a pesar de mantener una CVP <50 copias/ml1.
Para valorar la seguridad se analizaron los motivos de suspensión del tratamiento con DRV/r; parámetros analíticos: creatinina sérica (Cr), triglicéridos (TG) y colesterol (CL); y si los pacientes estaban tratados con estatinas.
El impacto económico se estimó a partir de la diferencia del coste medio del TAR previo y de la monoterapia, en base al precio medio de adquisición, y se calculó tanto el ahorro medio mensual por paciente como el ahorro total durante todos los meses que estuvieron los pacientes en tratamiento con monoterapia.
Los datos se analizaron con el programa IBM SPSS Statistics v. 19. Se utilizó la prueba de Ji-Cuadrado para comparar proporciones y el Método de Newcombe para calcular el intervalo de confianza del 95% de las diferencias. El análisis de los parámetros analíticos se realizó con el procedimiento T-Test. Se consideró una p≤0,05 estadísticamente significativa.
Resultados
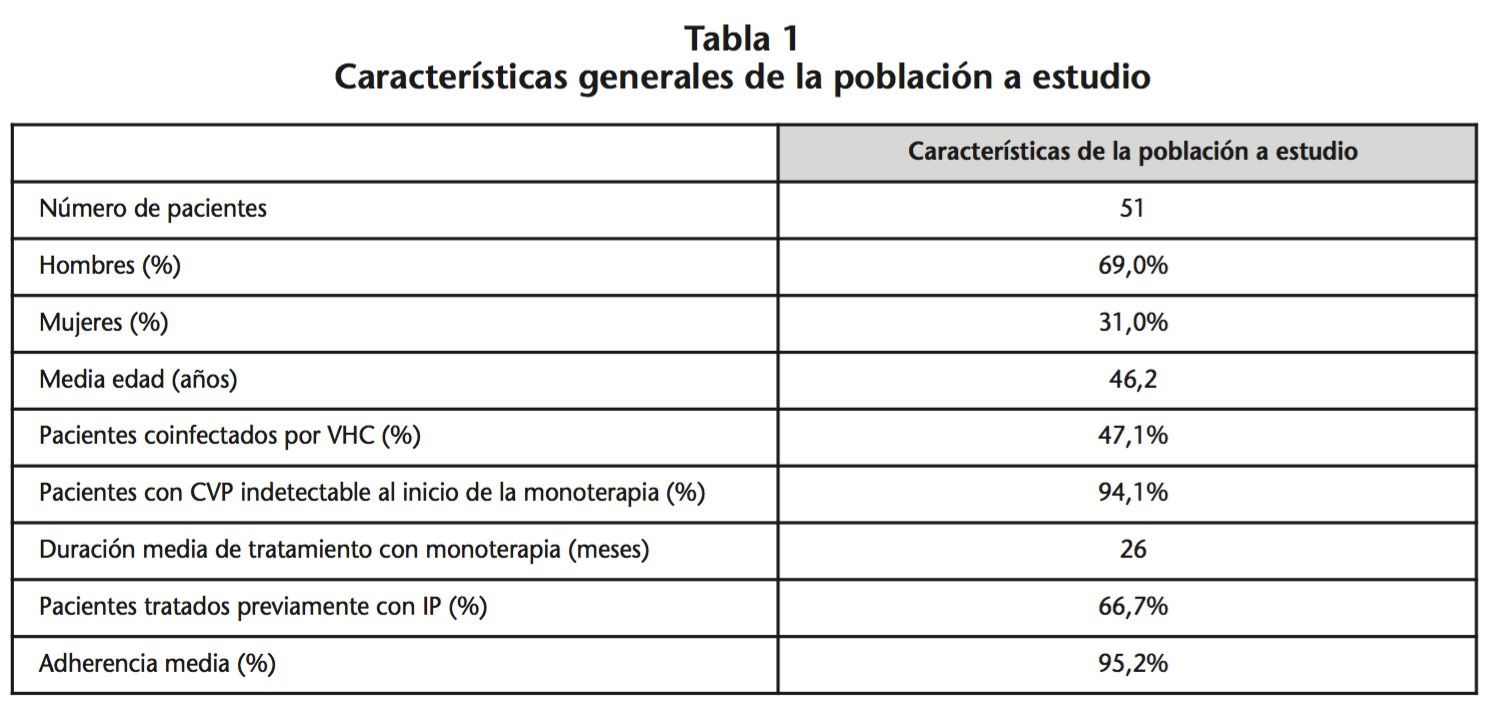
Durante el período de estudio se incluyeron 51 pacientes, 35 hombres y 16 mujeres, con una media de edad de 46 años (28-66 años). El 47,1% de los pacientes (n=24) estaban coinfectados por VHC. La duración media de tratamiento con DRV/r fue de 26 meses (1-51 meses).
De los pacientes con monoterapia incluidos en el estudio, ninguno presentó fracaso previo a IP ni coinfección por VHB, y el 94,1% (n=48) tuvo CVP negativa los 6 meses previos al inicio del tratamiento1, con lo cual el grado global de adecuación de los pacientes a las recomendaciones GESIDA para iniciar el tratamiento con monoterapia fue de un 94,1%.
La adherencia media al tratamiento con monoterapia fue del 95,25% (76-100%). Estos datos se encuentran recogidos en la tabla 1.
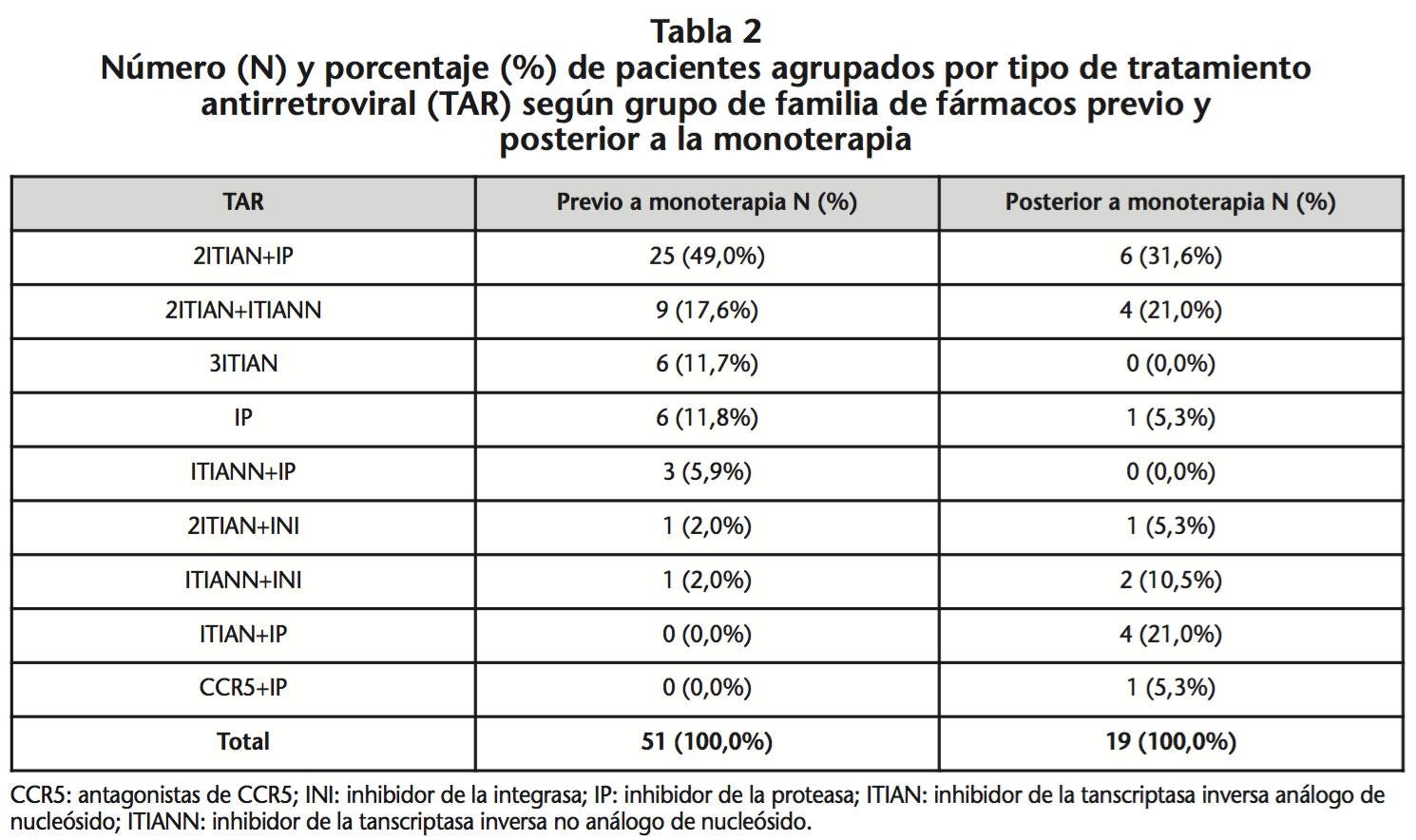
En relación al tratamiento previo, la mayoría fueron tratados con la combinación 2ITIAN+IP (49,0%), o con 2ITIAN+ITIANN (17,6%) (Tabla 2). Un 66,7% de los pacientes (n=34) recibió un IP previo: DRV (23,5%, n=12), atazanavir (ATV) (15,7%, n=8), lopinavir (LPV) (13,7%, n=7), saquinavir (9,8%, n=5) o fosamprenavir (3,9%, n=2).
Del total de pacientes, el 13,7% (n=7) sufrió FV. Estos pacientes estuvieron en tratamiento con monoterapia una media de 24 meses; sin embargo sólo se cambió el tratamiento al 7,8% (n=4).
Encontramos 4 pacientes a los que se les cambió el tratamiento por CVP detectable aunque no cumplían el criterio de FV: dos pacientes con CVP de 2 log, uno con 1.5 log y otro 3,6 log. Este último tuvo un grado de adherencia del 84%, mientras que los otros 3 fueron 100% adherentes.
No se contabilizó ningún paciente con fracaso inmunológico. No hubo diferencias estadísticamente significativas entre el recuento medio de CD4 posterior vs. previo a la monoterapia (28,8 células/µl; IC95% (-25,9) -83,6; p=0,295).
Tampoco se encontraron diferencias estadísticamente significativas entre los pacientes que fracasaron a DRV/r en función de si tomaban o no un IP previo a la monoterapia (RD=0,12; IC95% (-0,08) -0,27; p=0,134), del grado de adherencia (≥o< al 90%) (RD=-0,10; IC95% (-0,23) -0,18; p=0,670), de si estaban o no coinfectados por VHC (RD=-0,15; IC95% (-0,32) -0,02; p=0,054) o de si la CVP previa al inicio de la monoterapia era positiva o indetectable (RD=-0,08; IC95% (-0,20) -0,58; p=0,670).
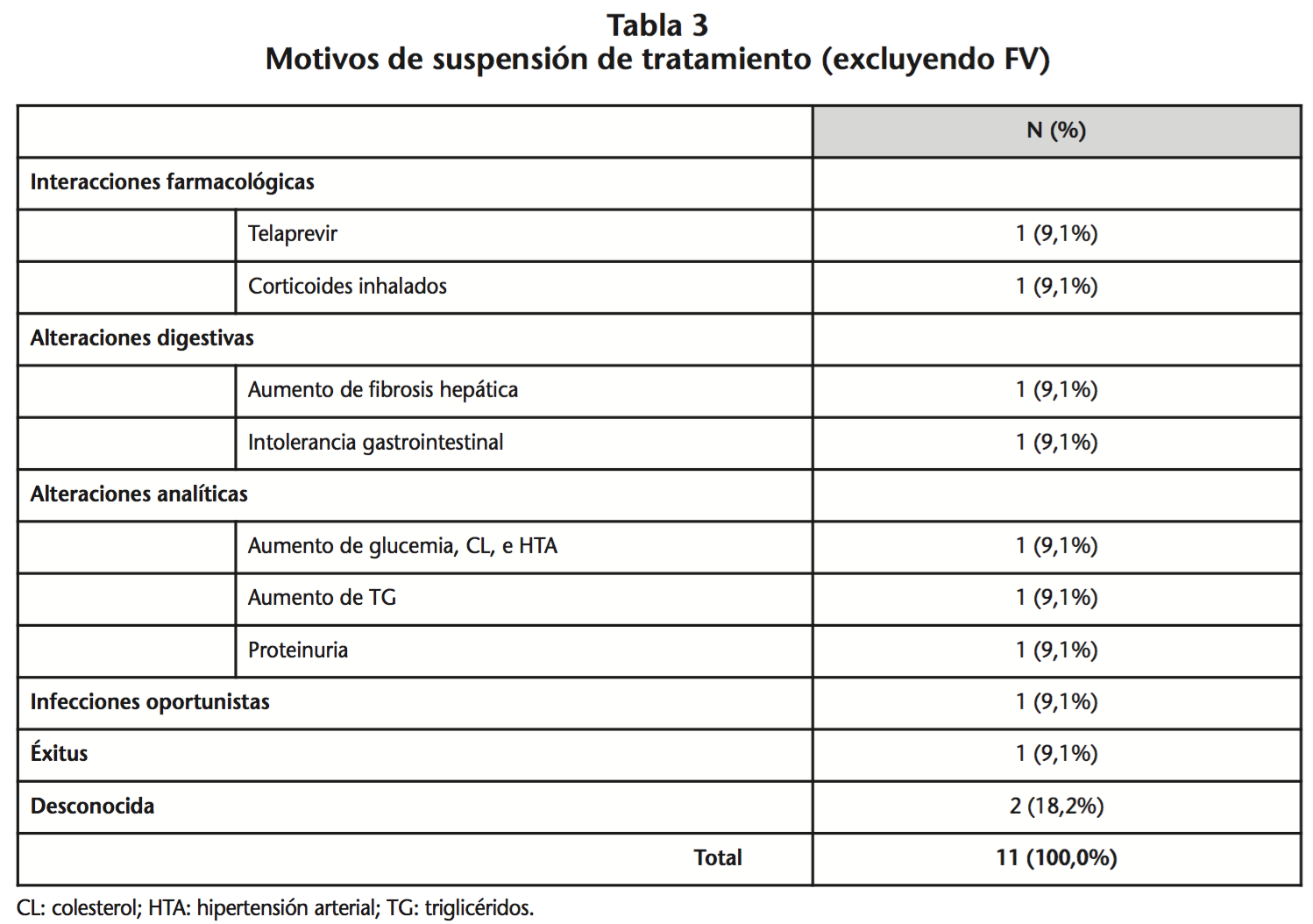
Del total de pacientes con monoterapia (n=51), a 11 se les suspendió el tratamiento debido principalmente a reacciones adversas, interacciones farmacológicas y alteraciones analíticas (Tabla 3). La duración media de la monoterapia en estos pacientes fue de 24,3 meses.
No se encontraron diferencias estadísticamente significativas entre los niveles de CL en sangre al finalizar el estudio vs. al inicio del mismo (p=0,154), siendo sólo un 11,8% (n=6) de pacientes los que recibieron tratamiento hipolipemiante con estatinas durante la monoterapia. Tampoco se encontraron en los niveles de TG (p=0,990) y de Cr (p=0,977).
Al finalizar el período de seguimiento, el 62,7% (n=32) de pacientes continuó con DRV/r en monoterapia. De los 19 pacientes a los que se les cambió el tratamiento, 11 mantuvieron DRV en el nuevo régimen y 1 continuó con monoterapia aunque con distinto IP (LPV/r), el mismo que llevaba previamente a DRV/r (Tabla 2).
El coste medio del tratamiento antirretroviral por paciente/mes previo a la monoterapia fue de 633,4€, (rango 274,5€ – 1057,6€) y el de la monoterapia de 432,58€. El ahorro medio estimado por paciente tratado con DRV/r en monoterapia/mes fue de 200,8€, (rango de ahorro [(-158,1€) – 625,0€]). Sólo en 5 de 51 pacientes con monoterapia el coste mensual de dicho tratamiento fue superior al coste de la terapia previa, no superando este incremento del coste los 158,1€/mes en ningún caso. El ahorro total debido a la prescripción de monoterapia en estos pacientes fue de 206.229,3€.
Discusión
La eficacia de la monoterapia con inhibidores de la proteasa ha sido estudiada principalmente con DRV/r y LPV/r, demostrando que es eficaz como tratamiento de mantenimiento4,9,10. ATV/r no ha tenido buenos resultados en los ensayos clínicos. No obstante, otros estudios han puesto de manifiesto que el FV es más frecuente con la monoterapia que con la triterapia tradicional11. Quizá por ello, hoy en día las sociedades científicas plantean la monoterapia con IPs como una opción a considerar en determinados casos más que como una recomendación.
El objetivo del TAR es la supresión de la CVP, es decir, conseguir unas cifras inferiores a 20-50 copias/mL. En pacientes con CVP habitualmente indetectable no es infrecuente detectar viremias de bajo nivel (50-200 copias/ml) o blips que vuelven a quedar indetectables o mantenerse en niveles bajos sin necesidad de cambiar el TAR. Nos encontraríamos en un escenario de FV con viremia baja. El porcentaje de FV según GESIDA1 observado en nuestro estudio, incluyendo las viremias de bajo grado fue del 13,7% (n=7), pero se realizó cambio de tratamiento únicamente en 4 pacientes. La Guías de la Sociedad Americana12 consideran FV si hay 2 determinaciones de CVP consecutivas >200 copias/ml. Según este criterio, nuestro porcentaje de FV se reduce a un 3,9% (n=2).
Los factores que pueden influir en el fracaso a la monoterapia son: llevar poco tiempo con TAR, elevada CVP al inicio de la monoterapia o adherencia al tratamiento inferior al 100%4,10,11. Una CVP positiva en los 6 meses previos al tratamiento con monoterapia puede influir negativamente en la respuesta al mismo y es una contraindicación para su prescripción1. Tres de nuestros pacientes (5,9%) iniciaron monoterapia con CVP+ si bien no encontramos diferencias estadísticamente significativas respecto a FV.
La aparición de blips aislados no es un factor predictor de FV1. Algunos autores13-15 relacionan los blips con el desarrollo de mecanismos de resistencia, no obstante otros muchos establecen que su aparición no compromete tratamientos futuros4,10,13,16,17.
De la experiencia con los primeros TAR se estableció una adherencia ≥95% para garantizar la máxima eficacia del tratamiento. Sin embargo, estudios recientes sugieren que niveles menores de cumplimiento en pacientes con IP potenciados con ritonavir, permiten lograr el objetivo terapéutico especialmente en pacientes que consiguieron viremias indetectables8,18. La elevada barrera genética de los IPs dificulta la selección de resistencias, incluso en situaciones desfavorables como tasas de adherencia ≤90%19. A ello se añade que la semivida de eliminación de DRV/r es de 15 horas3, por lo que omisiones puntuales de dosis parecen no afectar drásticamente a los niveles de fármaco en sangre. En nuestro caso no hemos observado que adherencias <90% hayan influido en la eficacia de la monoterapia con DRV/r.
La coinfección con VHC parece ser un factor predictor de CVP más elevadas, como se demuestra en el estudio MONET6. Sin embargo, en nuestra población tampoco hemos encontrado diferencias significativas en la incidencia de fracaso virológico entre los pacientes monoinfectados y coinfectados con VHC, al igual que Adrian Curran et al.20.
Los efectos adversos que más frecuentemente obligan a suspender la monoterapia con DRV/r según Santos et al.9 son molestias gastrointestinales y dislipemias, si bien en general son de tipo moderado y en ningún caso grado 3-4. Otros autores han observado que el cambio a monoterapia no influía significativamente en la función renal, hepática o perfil lipídico21. El estudio ARTEMIS22 demostró que los pacientes tratados con DRV/r presentaron menos diarrea grado 2-4 y menores variaciones del perfil lipídico que los tratados con LPV/r. No hemos encontrado diferencias significativas a nivel de perfil lipídico y función renal. Cabe destacar que dos pacientes suspenden tratamiento por alteraciones lipídicas, uno por proteinuria y un paciente por intolerancia digestiva.
En el estudio MONET6 se observó elevación de las transaminasas en pacientes coinfectados con VHC, mayoritariamente en el brazo de monoterapia. Uno de nuestros pacientes coinfectados suspendió tratamiento por aumento de fibrosis hepática, efecto que no podemos atribuir al DRV/r.
La monoterapia con DRV/r lleva asociada una evidente reducción de costes directos en relación con la triterapia, que a largo plazo se traduce en un importante ahorro económico10. Sin embargo, la no exposición a ITIAN también reduce el riesgo de efectos adversos a medio y largo plazo, y por tanto el coste que estos llevan asociados23. Del diseño de nuestro estudio solo puede concluirse un ahorro en los costes directos. En cualquier caso, en un momento de búsqueda de terapias cada vez más eficientes, la monoterapia se plantea como una opción terapéutica a considerar.
El estudio presentado tiene varias limitaciones como el pequeño tamaño de la muestra, la corta duración de seguimiento, falta de estudios de resistencias y de datos como reacciones adversas a medicamentos (lipodistrofia, osteoporosis…).
Conclusión
De los resultados obtenidos en nuestro estudio podemos concluir que la monoterapia con DRV/r es una alternativa eficaz, segura y coste/efectiva en pacientes VIH. Si bien es cierto que en estos momentos no disponemos de una evidencia tan a largo plazo como la de las terapias convencionales, la selección adecuada del paciente lo convierte en una opción terapéutica a considerar en términos de toxicidad, simplificación y coste.
El corto período de estudio impide analizar el impacto en la seguridad del tratamiento a largo plazo, sin embargo pone de manifiesto que la monoterapia con DRV/r no conlleva una mejora significativa del perfil de efectos adversos del paciente a corto plazo.
Conflicto de intereses: Los autores declaran no tener conflicto de intereses.
BIBLIOGRAFÍA
1. Documento de consenso de GeSIDA/Plan Nacional sobre el Sida respecto al tratamiento antirretroviral en adultos con infección por el virus de la inmunodeficiencia humana (Actualización enero 2015). Disponibles en http://www.gesida-seimc.org/contenidos/guiasclinicas/2015/gesidaguiasclinicas2015.
2. De Meyer S, Lathouwers E, Dierynck I, De Paepe E, Van Baelen B, Vangeneugden T, et al. Characterization of virologic failure patients on darunavir/ritonavir in treatment-experienced patients. AIDS. 2009;23:1829-1840.
3. Boffito M, Miralles D, Hill A. Pharmacokinetics, efficacy, and safety of darunavir/ritonavir 800/100 mg once-daily in treatment-naïve and -experienced patients. HIV Clin Trials. 2008 Nov-Dec;9(6):418-427.
4. Katlama C, Valantin MA, Algarte-Genin M, Duvivier C, Lambert-Niclot S, Girard PM, et al. Efficacy of darunavir/ritonavir maintenance monotherapy in patients with HIV-1 viral suppression: a randomized open-label, non inferiority trial, MONOI-ANRS 136. Aids. 2010; 24(15):2365-2374.
5. Schackman BR, Scott CA, Sax PE, Losina E, Wilkin TJ, McKinnon JE, et al. Potential risks and benefits of HIV treatment simplification: a simulation model of a proposed clinical trial. Clin Infect Dis. 2007;45:1062-1070.
6. Arribas JR, Horban A, Gerstoft J, Fätkenheuer G, Nelson M, Clumeck N. The MONET trial: darunavir/ritonavir with or without nucleoside analogues, for patients with HIV RNA below 50 copies/ml. AIDS. 2010 Jan 16;24(2):223-230.
7. Juan González-Valdivieso, Cristina Perez Reche, Manuela Gonzalez-Navarro, Cristina Roure Nuez. Identificación de pacientes en tratamiento antirretroviral candidatos a monoterapia con inhibidores de la proteasa. Farmacia Hospitalaria. 2012;36(2):111-112.
8. Gulick RM. Adherence to antiretroviral therapy: how much is enough? Clin Infect Dis. 2006;43(7):942-944.
9. Santos JR, Llibre JM, Berrio-Galan D, Bravo I, Miranda C, Pérez-Alvarez S, et al. Monotherapy with boosted PIs as an ART simplification strategy in clinical practice. J Antimicrob Chemother. 2015;70(4):1124-1129.
10. J. Saez de la Fuente, A. Such Díaz, C. Sánchez Gil, C. Esteban Alba, I. Escobar Rodríguez. Meta-análisis sobre la eficacia de la estrategia de monoterapia con inhibidores de la proteasa potenciados en pacientes VIH+. Farmacia hospitalaria. 2010;34(5):251-258.
11. Lambert-Niclot S, Flandre P, Valantin MA, Peytavin G, Duvivier C, Haim-Boukobza S. Factors associated with virological failure in HIV-1-infected patients receiving darunavir/ritonavir monotherapy. J Infect Dis. 2011; 204(8):1211-1216.
12. Panel on Antiretroviral Guidelines for Adults and Adolescents. Guidelines for the use of antiretroviral agents in HIV-1-infected adults and adolescents. Department of Health and Human Services. Available at: http://aidsinfo.nih.gov/contentfiles/lvguidelines/adultandadolescentgl.
13. Torres-Cornejo A, Benmarzouk-Hidalgo OJ, Gutierrez-Valencia A, Ruiz-Valderas R, Viciana P, López-Cortés LF. Low concordance and resistance mutation emergence in the HIV protease gene among circulating and cell-associated viruses at viral replication episodes during darunavir/ritonavir monotherapy. HIV Med. 2015 Jan;16(1):57-61.
14. Pulido F, Arribas JR, Hill A, Van Delft Y, Moecklinghoff C. «Analysis of drug resistance during HIV RNA viraemia in the MONET trial of darunavir/ritonavir monotherapy.» Antivir Ther. 2011;16(1):59-65.
15. Lambert-Niclot S, Flandre P, Valantin MA, Peytavin G, Sayon S, Morand-Joubert L, et al. Resistant minority species are rarely observed in patients on darunavir/ritonavir monotherapy. J Antimicrob Chemother. 2012; 67(6):1470-1474.
16. Lee PK, Kieffer TL, Siliciano RF, Nettles RE. HIV-1 viral load blips are of limited clinical significance. J Antimicrob Chemother. 2006;57:803-805
17. Pulido F, Arribas JR, Hill A, Moecklinghoff C. No evidence for evolution of protease inhibitor resistance from standard genotyping, after three years of treatment with darunavir/ritonavir, with or without nucleoside analogues. AIDS Res Human Retroviruses 2012; 28:1167-1169.
18. Recomendaciones GESIDA/SEFH/PNS para mejorar la adherencia al tratamiento antirretroviral. (Actualización de Junio de 2008). Disponible en: http://www.msssi. gob.es/ciudadanos/enfLesiones/enfTransmisibles/sida/docs/recomendacionesAdherenciaTrtoAntirretroviral062008.pdf.
19. Bangsberg DR, Kroetz DL, Deeks SG. Adherence resistance relationships to combination HIV antiretroviral therapy. Current HIV/AIDS reports 2007;4:65-72.
20. Curran A, Monteiro P, Domingo P, Villar J, Imaz A, Martínez E, et al. Effectiveness of ritonavir-boosted protease inhibitor monotherapy in the clinical setting: same results as in clinical trials? The PIMOCS Study Group. J Antimicrob Chemother. 2014 May;69(5): 1390-1396.
21. Silva P, García Queiruga M, Martínez López LM, Zas García MI, Margusino Framiñán L, Martín Herranz I. Cambio a monoterapia con inhibidores de proteasa potenciados con ritonavir: eficacia y efectos sobre la función renal, hepática y perfil lipídico. Farm Hosp. 2013;Supl. 1:9-63. 27.
22. Orkin C, DeJesus E, Khanlou H, Stoehr A, Supparatpinyo K, Lathouwers E, et al. Final 192-week efficacy and safety of once-daily darunavir/ritonavir compared with lopinavir/ritonavir in HIV-1-infected treatment-naive patients in the ARTEMIS trial. HIV Med. 2013;14:49-59.
23. Josep Maria Llibre-Codina, Miguel Ángel Casado-Gómez, Rainel Sánchez-de la Rosa, María Jesús Pérez-Elías, Jesús Santos-González, Celia Miralles-Álvarez, et al. Costes de la toxicidad asociada a los análogos de nucleósidos inhibidores de la transcriptasa inversa en pacientes con infección por el VIH-1. Enferm Infecc Microbiol Clin. 2007;25(2):98-107.
____
Download PDF: Eficacia, seguridad e impacto económico de la monoterapia con darunavir/ritonavir en la práctica clínica habitual
