Cañamares Orbis I1, Tojo Thomas de Carranza T2, Fortea Sola A3, Gómez Cabezuelo Y4
1 Farmacéutica Especialista en Farmacia Hospitalaria. Subdirección General de Farmacia y Productos Sanitarios, Madrid (España)
2 Médico Especialista en Medicina Familiar y Comunitaria. Residencia de Mayores Goya, Agencia Madrileña de Atención Social, Madrid (España)
3 Fisioterapeuta. Residencia de Mayores Goya, Agencia Madrileña de Atención Social, Madrid (España)
4 Enfermera. Directora Residencia de Mayores Goya, Agencia Madrileña de Atención Social, Madrid (España)
Fecha de recepción: 27/04/2018 – Fecha de aceptación: 10/06/2018
Correspondencia: Iciar Cañamares Orbis w Subdirección General de Farmacia y Productos Sanitarios. Consejería de Sanidad. Servicio Madrileño de Salud w Plaza Carlos Trias Bertrán, 7. Edificio Sollube, 5ª planta w 28020 Madrid (España)
iciar.canamares@salud.madrid.org
____
Resumen
Rivaroxaban es un anticoagulante oral de acción directa inhibidor del factor Xa, indicado para prevención de episodios tromboembólicos en cirugía programada de reemplazo de cadera o rodilla y en prevención de ictus o embolismo sistémico en pacientes con fibrilación auricular no valvular. A diferencia de los antagonistas de la vitamina K, no requiere monitorización periódica de INR.
Se describe el caso de una mujer de 84 años con fibrilación auricular en tratamiento con acenocumarol con control de INR subóptimo y que cumple criterios para cambio de anticoagulante a rivaroxaban. A los 17 días del inicio con el nuevo anticoagulante sufre una reacción adversa que requiere hospitalización. A pesar de que en la ficha técnica aparecen los trastornos hepatobiliares como observaciones post-comercialización, en nuestro caso se estableció una relación causal altamente probable.
Palabras clave: Enfermedad hepática inducida por sustancias y drogas, anticoagulantes, rivaroxaban, reacciones adversas a medicamentos, causalidad.
____
Introducción
Rivaroxaban es un anticoagulante oral de acción directa (ACOD) inhibidor del factor Xa que fue autorizado en España en 20081. Está indicado para prevención de episodios tromboembólicos en cirugía programada de reemplazo de cadera o rodilla y en prevención de ictus o embolismo sistémico en pacientes con fibrilación auricular no valvular. Actualmente se utiliza para aquellos pacientes que no pueden mantener un control de INR dentro de rango 2-3 a pesar de buen cumplimiento terapéutico. Se considera que el control de INR es subóptimo si el porcentaje de valores de INR dentro de rango terapéutico es inferior al 60% en al menos 6 meses2. A diferencia de los antagonistas de la vitamina K (ej.: acenocumarol), rivaroxaban es activo desde la primera dosis y su farmacocinética permite administrar el medicamento a dosis fijas sin requerir monitorización periódica de INR.
Rivaroxaban, así como otros ACOD excepto dabigatran, tiene metabolismo hepático CYP 3A4. En la ficha técnica de Xarelto® está descrita la elevación de enzimas hepáticas1 y en el Informe de Posicionamiento Terapéutico se advierte realizar pruebas de función hepática con apixaban y edoxaban2. Sin embargo, la hepatotoxicidad por rivaroxaban es una reacción adversa idiosincrásica e independiente de la dosis, que cubre un amplio espectro de manifestaciones, desde la elevación asintomática de enzimas hepáticas hasta el fallo hepático severo.
CASO CLÍNICO
Mujer de 84 años, independiente para actividades de la vida diaria, sin hábitos tóxicos, con antecedentes de fibrilación auricular, insuficiencia cardiaca congestiva moderada, estenosis aórtica leve, diabetes mellitus tipo 2 y deterioro cognitivo de probable origen vascular (GSD 5). En tratamiento con acenocumarol 4 mg según INR, bisoprolol 5 mg comprimido 1-0-1/2, losartan 100 mg comprimido 1-0-0, atorvastatina 40 mg comprimido 0-0-1, metformina/sitagliptina 1.000/50 mg comprimido 1-0-1 y quetiapina 25 mg comprimido 0-0-1.
A los 6 meses con acenocumarol la paciente presentó control de INR subóptimo. Se consultó con el Servicio de Medicina Interna, cumplía criterios de inicio de rivaroxaban 20 mg/24 h3. A los 17 días del inicio del nuevo anticoagulante se observaron cambios de comportamiento en la paciente como negativa a la ingesta, frecuentes atragantamientos y disnea. Solicitamos una analítica donde se objetivó una leve alteración del perfil hepático; además en este contexto, sumado a inestabilidad motora de reciente aparición, sufrió una caída casual sin traumatismo craneoencefálico ni otras consecuencias.
Coincidiendo con el empeoramiento clínico (aumento de fluctuación del nivel de conciencia, empezó a no obedecer a ordenes sencillas, mala tolerancia a la sedestación que se incrementaba cada día), el día 21 se realizó otro control analítico en el que se objetivó alteración de enzimas hepáticas >5-10 veces el límite superior normal (LSN). No se entendían los cambios analíticos que se estaban produciendo, por lo que se decidió mantener actitud conservadora con observación y seguimiento analítico. El día 28 un nuevo control mostró valores de alanino-aminotransferasa (ALT), aspartato-aminotransferasa (AST) y gamma-glutamil-transpeptidasa (GGT) >10 x LSN y fue derivada de inmediato al Servicio de Urgencias.
Durante su estancia en el Servicio Urgencias se realizaron diversas pruebas como radiografía de tórax, sedimento urinario y TAC cerebral, resultando todas ellas negativas. La clínica y los valores analíticos orientaban el diagnóstico a una posible encefalopatía por fallo hepático (urea: 125 mg/dl, amonio: 60 µmol/L, somnolencia, desorientación, movimientos lentos).
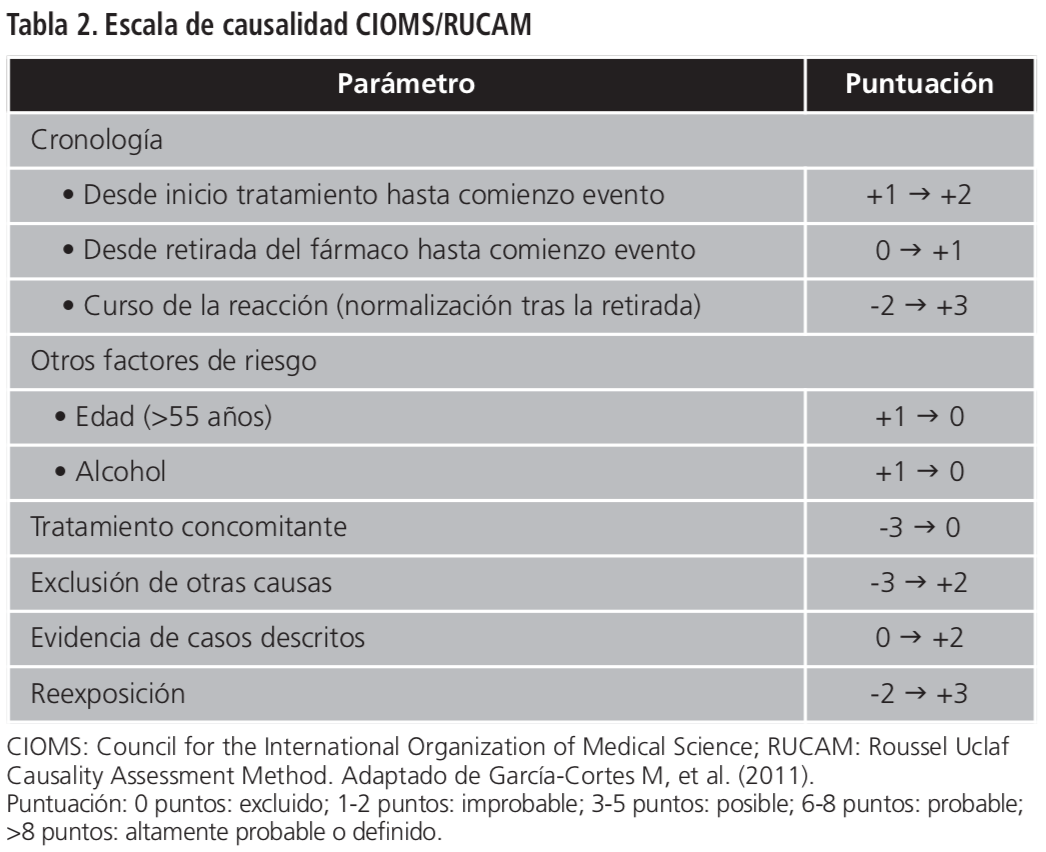
La paciente fue ingresada, se suspendieron todos los medicamentos hepatotóxicos y se iniciaron enema de lactulosa y sueroterapia. Durante su ingreso se descartaron otras posibles etiologías: vírica (VHB, VHC, VEB, CMV, herpes), autoinmune, tóxica e isquémica, filiando el diagnóstico a hepatotoxicidad por fármacos. Los parámetros analíticos indicaban hepatotoxicidad hepatocelular (R: 12,2) según la tabla 1. Se aplicó la escala de causalidad CIOMS/RUCAM con puntuación 12, apoyando como altamente probable hepatotoxicidad por rivaroxaban según la tabla 2. Se descartó causalidad por el resto de medicamentos crónicos por falta de relación temporal con la sintomatología4.
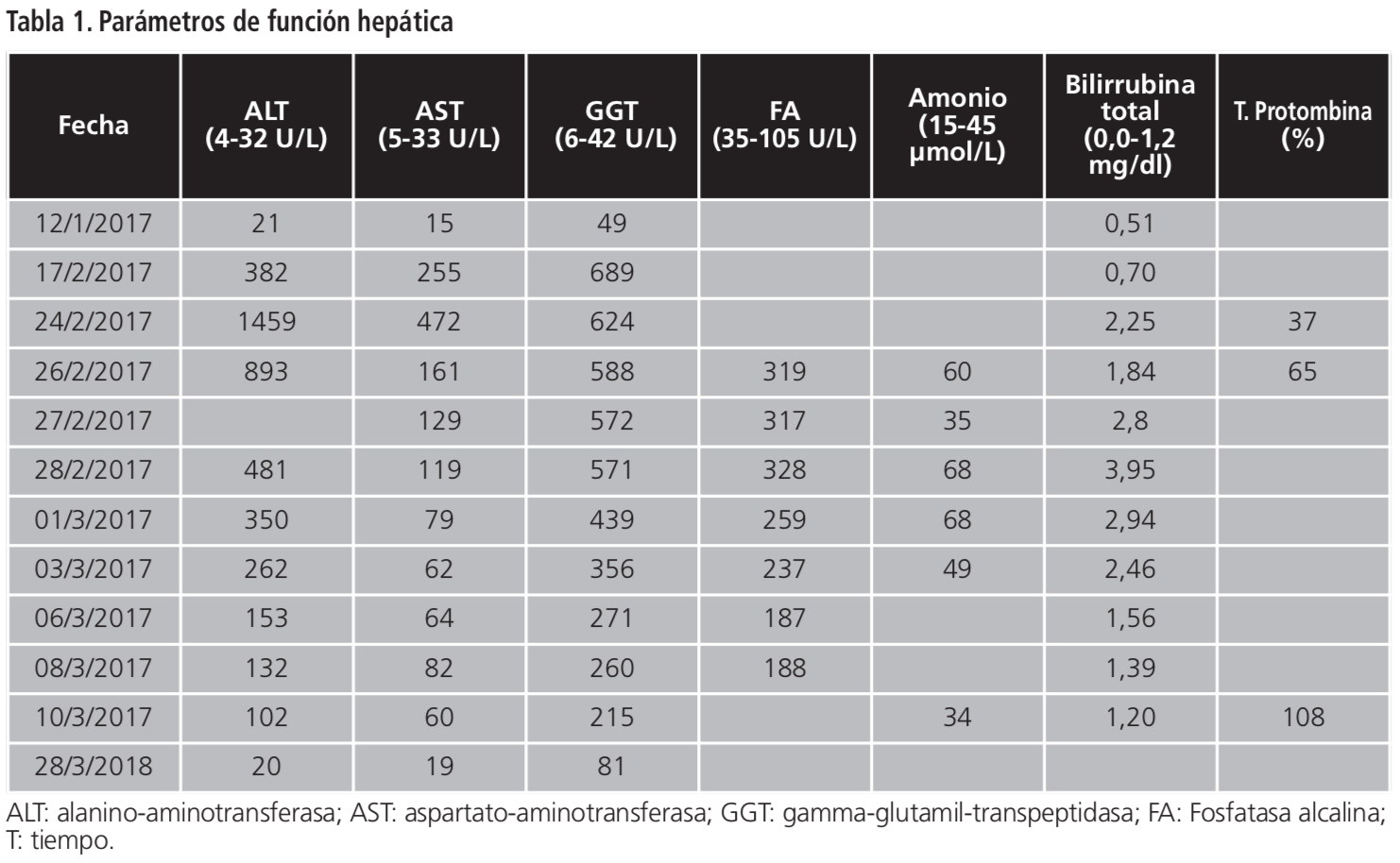
A los 15 días del ingreso se resolvió la encefalopatía con mejoría clínica (comenzó a obedecer órdenes sencillas, deambular) y lenta mejoría analítica. Se introdujo enoxaparina 4.000 UI/24 h con objetivo de reintroducir acenocumarol al alta con controles estrechos.
Este caso se ha notificado al Centro de Farmacovigilancia correspondiente5.
DISCUSIÓN
Se realizó una búsqueda bibliográfica en Pubmed, Embase y UpToDate. Hasta el momento se han publicado series de casos de hepatotoxicidad por rivaroxaban a partir de notificaciones post-comercialización y bases de datos de farmacovigilancia6,7.
El primer ACOD fue ximelagatran, en ensayos clínicos la tolerancia a corto plazo fue aceptable, pero a largo plazo se reportaron elevaciones de enzimas hepáticas al menos 3 veces superiores al LSN en el 8% de pacientes, que ocurrieron principalmente en los 6 primeros meses8. En España, ximelagatran fue autorizado en 2005 pero no llegó a ser comercializado, en 2006 fue retirado a nivel mundial.
Se considera hepatotoxicidad inducida por fármacos cuando en presencia de un fármaco sospechoso y sin otra causa justificable, se detecta alguna de las siguientes alteraciones: a) aumento de la ALT más de cinco veces el LSN, b) aumento de la fosfatasa alcalina (FA) más de dos veces el LSN, o c) aumento de la ALT más de tres veces el LSN más aumento de la bilirrubina total más de dos veces el LSN9.
El tiempo transcurrido desde el inicio de rivaroxaban al diagnóstico de hepatotoxicidad fueron 28 días y el tiempo medio descrito son 15 (2-180) días6.
Para determinar la causalidad en hepatotoxicidad existen varias escalas: el algoritmo de Naranjo, la escala CIOMS/RUCAM y la escala de María y Victorino, también denominada escala diagnóstica clínica. En nuestro caso hemos utilizado CIOMS/RUCAM por presentar mayor consistencia con el juicio clínico y por ser la recomendada en el momento actual. Sin embargo, la escala no sustituye al juicio clínico, es una herramienta para corroborar la sospecha. No hay que obviar que presenta la limitación de no discriminar al agente causal cuando hay sospecha de dos o más fármacos10.
Como conclusión, a pesar de que los anticoagulantes de acción directa no requieren control de INR, no obviar el seguimiento clínico continuado ni monitorizar la función hepática al menos durante los 6 primeros meses.
Conflicto de intereses: Los autores declaran no tener conflicto de intereses.
BIBLIOGRAFÍA
1. CIMA: Centro Información On Line Medicamentos de la AEMPS. Ficha tecnica Xarelto [Internet]. [citado 28 de marzo de 2018]. Disponible en: https://cima.aemps.es/cima/pdfs/es/ft/08472018/FT_08472018.pdf.
2. Agencia Española de Medicamentos y Productos Sanitarios, Eva Rocio Alfaro Lara, Cristina Avendaño Solá, Gonzalo Calvo Rojas, Centro de Informacion Farmacoterapeutica Servizo de Saude, Comité de Evaluacion de Nuevos Medicamentos de Atención Primaria Euskadi, et al. Criterios y recomendaciones generales para el uso de los anticoagulantes orales directos (ACOD) en la prevención del ictus y la embolia sistémica en pacientes con fibrilación auricular no valvular. Informe de Posicionamiento Terapéutico. [Internet]. 2016 [citado 28 de marzo de 2018]. Disponible en: https://www.aemps.gob.es/medicamentosUsoHumano/informesPublicos/docs/criterios-anticoagulantes-orales.pdf.
3. Dirección General de Coordinación de la Asistencia Sanitaria, Consejería de Sanidad, Comunidad de Madrid. Resolución 624-2016 de la Dirección General de Coordinación de la Asistencia Sanitaria del Servicio Madrileño de Salud por la que se actualizan las instrucciones para la utilización de los anticoagulantes orales de acción directa en el ámbito del Servicio Madrileño de Salud [Intranet]. 2016. Disponible en: https://saluda.sanidadmadrid.org/f5-w-68747470733a2f2f73616c7564616d61732e73616c75642e6d61647269642e6f7267$$/atematica/areafarmacia/Documents/Resolucion_Visado_ACOD_Dic_2016_FIRMA_ELECTRONICA.pdf.
4. Livertox Database [Internet]. Clinical and Research Information on Drug-Induced Liver Injury. [citado 12 de abril de 2018]. Disponible en: https://livertox.nih.gov/.
5. Agencia Española de Medicamentos y Productos Sanitarios. Notificación de Sospechas de Reacciones Adversas a Medicamentos [Internet]. [citado 28 de marzo de 2018]. Disponible en: https://www.notificaram.es/Pages/CCAA. aspx#no-back-button.
6. Licata A, Puccia F, Lombardo V, Serruto A, Minissale MG, Morreale I, et al. Rivaroxaban-induced hepatotoxicity: review of the literature and report of new cases. Eur J Gastroenterol Hepatol. 2018;30(2):226-32.
7. Raschi E, Poluzzi E, Koci A, Salvo F, Pariente A, Biselli M, et al. Liver injury with novel oral anticoagulants: assessing post-marketing reports in the US Food and Drug Administration adverse event reporting system: Liver injury and novel oral anticoagulants. Br J Clin Pharmacol. 2015;80(2):285-93.
8. Ximelagatran 36 mg film coated tablets withdrawn application [Internet]. [citado 22 de febrero de 2018]. Disponible en: Ximelagatran 36 mg film coated tablets.
9. Aithal GP, Watkins PB, Andrade RJ, Larrey D, Molokhia M, Takikawa H, et al. Case Definition and Phenotype Standardization in Drug-Induced Liver Injury. Clin Pharmacol Ther. 2011;89(6):806-15.
10. García-Cortés M, Stephens C, Lucena MI, Fernández-Castañer A, Andrade RJ. Causality assessment methods in drug induced liver injury: Strengths and weaknesses. J Hepatol. 2011;55(3):683-91.
____
