Lafarga-Lapieza V1, Meroño-Saura MA1, Colastra-Ugena E2, Portela-Sotelo A1, Díaz-Barreda MD3, Barreda-Hernández D1
1 Servicio de Farmacia. Hospital Virgen de la Luz. Cuenca (España)
2 Servicio de Análisis Clínicos. Hospital Virgen de la Luz. Cuenca (España)
3 Servicio de Oftalmología. Hospital Clínico Universitario Lozano Blesa. Zaragoza (España)
Fecha de recepción: 06/06/2022 – Fecha de aceptación: 27/06/2022
Correspondencia: Violeta Lafarga Lapieza – Hospital Virgen de la Luz (Servicio de Farmacia) – Calle Hermandad de Donantes de Sangre, 1 – 16002 Cuenca (España)
violetalaf@hotmail.com
____
Resumen
Objetivo: Los pacientes con defectos epiteliales corneales persistentes son, a menudo, refractarios a los tratamientos convencionales. La insulina tópica surge como una posible alternativa, habiendo demostrado su efectividad y seguridad. Sin embargo, en la bibliografía actual disponible, hay una falta de estudios de estabilidad. El objetivo del presente trabajo fue evaluar la estabilidad fisicoquímica y microbiológica de un colirio de insulina 10 UI/ml durante 28 días.
Método: Estudio de estabilidad fisicoquímica y microbiológica. Se elaboraron 2 lotes (A y B) de colirios de insulina 10 UI/ml, manteniendo el lote B cerrado hasta el día 15. Las variables fisicoquímicas analizadas fueron la concentración de insulina mediante inmunoanálisis quimioluminiscente, pH y osmolaridad. El estudio microbiológico se realizó mediante pruebas de esterilidad mientras que el estudio descriptivo se analizó mediante visualización directa.
Resultados: No se observaron cambios significativos de concentración (±10%) en los colirios a excepción de 2 valores en una de las muestras del lote B. El pH y la osmolaridad se mantuvieron dentro de los rangos fisiológicos del ojo. No se observó crecimiento microbiano ni cambios en las características organolépticas.
Conclusiones: Se puede considerar al colirio de insulina 10 UI/ml estable durante 28 días en refrigeración manteniendo el frasco abierto desde el día de su elaboración.
Palabras clave: Insulina, estabilidad, colirio, administración oftálmica, concentración, farmacotecnia.
Physicochemical and microbiological stability of a 10 IU/mL insulin eye drop
Summary
Objective: Patients with persistent corneal epithelial defects are often refractory to conventional treatments. Topical insulin emerges as a possible alternative of proven effectiveness and safety. However, in the current available literature, there is a lack of stability studies. The main objective of this study was to evaluate the physicochemical and microbiological stability of a 10 IU/ml insulin eye drop for 28 days.
Methods: Physicochemical and microbiological stability study. Two batches (A and B) of 10 IU/ml insulin eye drops were prepared, keeping batch B closed until day 15. The physicochemical variables analysed were insulin concentration by chemiluminescent immunoassay, pH and osmolarity. The microbiological study was performed by sterility tests while the descriptive study was assessed by direct visualization.
Results: No significant concentration changes (±10%) were observed in the eye drops except for 2 values in one of the samples from batch B. The pH and osmolarity remained within the physiological ranges of the eye. No microbiological growth or changes in organoleptic characteristics were observed.
Conclusions: Insulin 10 UI/ml eye drops can be considered stable for 28 days under refrigeration if the bottle is kept open from the day of its preparation.
Key words: Insulin, stability, eye drops, ophthalmic administration, concentration, pharmacotechnics.
____
INTRODUCCIÓN
La córnea es un tejido formado por cinco capas (de más superficial a más profunda: epitelio, membrana de Bowman, estroma, membrana de Descemet y endotelio) de cuya integridad depende que mantenga la transparencia necesaria para conseguir una buena capacidad y calidad visual. Puede verse alterada por diversas razones como son enfermedades con afectación únicamente ocular, como la mayoría de las distrofias corneales, o sistémicas, como la diabetes mellitus, complicaciones postquirúrgicas o traumatismos1,2. Cuando se produce una erosión ocular y fracasa la renovación y reepitelización que suele tener lugar los primeros 10-14 días, surgen los defectos corneales persistentes (DECP), cuyo tratamiento se considera un desafío1.
Los tratamientos convencionales, como lágrimas artificiales, suero autólogo y lentes de contacto terapéutico, se centran en proteger las capas más superficiales de la córnea y aportar condiciones favorables para facilitar su cicatrización1,2. Sin embargo, frente a los DECP, a menudo fracasan.
Otros tratamientos menos estudiados, como los colirios de insulina, fibronectina o timosina tópica, actúan sobre los factores de crecimiento implicados en la cicatrización, y aunque su mecanismo de acción no está claro, parecen influir en la regulación de la diferenciación y crecimiento de las células epiteliales y queratocitos estromales1.
La insulina, fármaco sistémico ampliamente conocido, es un péptido estrechamente relacionado con el factor de crecimiento similar a la insulina 1 (IGF-1), el cual está implicado en la cicatrización de heridas mediante la inducción de la migración y proliferación de las células epiteliales corneales1,3. La presencia de receptores de insulina en la glándula lagrimal y en la superficie ocular4-6 hacen pensar que la insulina tópica puede ser un tratamiento relevante en los DECP refractarios7. El IGF-1, junto con la sustancia P, aumenta la tasa de curación del epitelio después de la queratectomía fotorrefractiva en conejos8. Además, se demostró que la combinación de ambos acelera la cicatrización de heridas epiteliales corneales en animales diabéticos9.
El estudio de Zagon et al.2, fue el primero en demostrar que la insulina tópica mejora la cicatrización de heridas corneales en animales diabéticos. En ratas diabéticas, la insulina tópica mejora la sensibilidad corneal y la cicatrización de heridas después de abrasiones corneales10. También, se ha demostrado que la insulina tópica ralentiza la pérdida de los nervios corneales del plexo subbasal11 y previene la cicatrización tardía de las heridas del epitelio de la superficie ocular en ratones diabéticos2.
Posteriormente, se extrapolaron los estudios a sujetos humanos diabéticos, reflejando también una mejora en la tasa de curación de los DECP sin efectos secundarios locales o sistémicos apreciables3. Bartlett et al.12, observaron que la insulina formulada con solución salina hasta 100 UI/ml, no tenía toxicidad clínica para el ojo humano incluso tras varias dosis.
Para determinar las concentraciones de insulina tópica, se desarrolló un estudio donde se demuestra que la concentración más eficaz para curar el defecto epitelial corneal en pacientes diabéticos tras la vitrectomía fue de 0,5 UI/ml frente a otras superiores o placebo5. Sin embargo, en otros estudios se refleja como la insulina tópica 1 U/ml 4 veces al día mejora la tasa de curación de los DECP en pacientes diabéticos después de la vitrectomía3.
A pesar de propuestas históricas sobre el uso de colirio de insulina13, es actualmente cuando dicha práctica clínica está resurgiendo. En la mayoría centros hospitalarios de España se formulan colirios de insulina 1 UI/ml pero algunos pacientes son refractarios a dicho tratamiento siendo la insulina tópica a mayor concentración una posible alternativa. Por ello, se crea la necesidad de la realización de estudios en los que se determine la estabilidad y seguridad de preparaciones a mayor concentración. Aunque actualmente se conoce la ausencia de toxicidad de colirio de insulina hasta 100 UI/ml12, la reducida experiencia con dicho colirio crea la incertidumbre del intervalo de concentración que pueden llegar a requerir estos pacientes.
El objetivo del presente trabajo es determinar la estabilidad fisicoquímica y microbiológica de un colirio de insulina 10 UI/ml.
MÉTODOS
Material
Para la elaboración del colirio de insulina 10 UI/ml, siguiendo la experiencia en la elaboración del colirio de insulina 1 UI/ml, se empleó:
– Insulina humana soluble neutra (Actrapid® 100 UI/ml vial).
– Colirio de polietilenglicol y propilenglicol (Systane Ultra®).
– Cloruro sódico 0,9% 10 ml disolvente para uso parenteral.
Método de elaboración
Los colirios se prepararon en condiciones asépticas de trabajo, según la Guía de Buenas Prácticas de preparación de medicamentos en los Servicios de Farmacia Hospitalaria14, en campanas de flujo laminar horizontal.
La elaboración se realizó en dos etapas. Inicialmente se diluyó Insulina Actrapid® 100 UI/ml en una proporción 1:4 con cloruro sódico al 0,9% mediante una homogeneización obteniendo una solución de 20 UI/ml. A continuación, se realizó una segunda dilución de la solución obtenida anteriormente en proporción 1:1 con el colirio Systane Ultra® para lograr una concentración final de 10 UI/ml.
Para finalizar, se realizó una filtración a través de un filtro de 5 micras y se envasó en frascos estériles de vidrio de topacio de 10 ml de capacidad, en los que se dosificaron 5 ml de colirio de insulina 10 UI/ml.
Condiciones del estudio
Para el estudio de los colirios se elaboraron dos lotes (A y B) de dos muestras cada uno. La apertura de un colirio de cada lote se realizó el día de su elaboración (A1 y B1), manteniendo los otros cerrados hasta el día 15 (A2 y B2). Todos ellos se almacenaron refrigerados (2-8ºC) durante todo el estudio.
Para determinar el plazo de validez del colirio se evaluó la concentración de insulina (UI/ml), pH, isotonicidad (mOsm/L) y ausencia de crecimiento microbiano, cambios en las características organolépticas, aspecto y limpidez.
Todos las determinaciones se realizaron los días 0, 7, 15 y 28 para los colirios A1 y B1 y los días 15 y 28 para A2 y B2. Dichas determinaciones se corresponden con el periodo de tiempo transcurrido desde abril 2021 hasta mayo 2021.
Esta metodología pretende simular la conservación de los colirios en el domicilio del paciente si se le dispensan desde el Servicio de Farmacia 2 envases de colirio de insulina para su posterior administración domiciliaria, manteniendo uno abierto y otro cerrado hasta que se precise.
Se consideró cambio significativo de concentración cuando el colirio sufría variaciones de ±10% con respecto a la concentración inicial, considerándose por tanto no válido. Respecto al pH y osmolaridad, los colirios fueron establecidos como no aptos cuando los valores obtenidos se encontraban fuera de los márgenes fisiológicos del ojo (pH=7,4-9,5 y osmolaridad 270-300 mOsm/L). Ante la ausencia de crecimiento bacteriano y fúngico o la ausencia de partículas o cambios de color mediante visualización directa, las muestras se consideraban adecuadas.
Estabilidad fisicoquímica
Determinación de la concentración de insulina
La determinación cuantitativa de insulina se realizó mediante la técnica de inmunoanálisis quimioluminiscente de micropartículas en el analizador Alinity i (Abbott®). Para ello, se recogieron 0,5 ml de muestra, sin ser necesaria su dilución previa.
El ensayo Alinity i utiliza un método de cálculo de datos de ajuste a una curva logística de 4 parámetros (4PLC, Y ponderado) para generar la calibración y obtener resultados. Respecto a la comprobación de la calibración, el sistema Alinity i cuenta para la determinación de la insulina con 6 puntos de calibración (A-F) desde 0 UI/ml a 30 UI/ml. En el momento del ensayo el ajuste estaba establecido en -0,52 UI/ml a 30,09 UI/ml. La sensibilidad analítica, definida como el limite inferior de detección, es ≤0,1 UI/ml mientras que el intervalo analítico para dicho ensayo es de 0,1 UI/ml a 30 UI/ml.
En dicha técnica, los resultados se miden en unidades reactivas de luz (URL), existiendo una relación directamente proporcional entre la cantidad de insulina en la muestra y las URL detectadas por el sistema óptico.
Determinación de pH
El pH de la nueva formulación se determinó mediante el analizador Gem Premier 5000 (Werfen®). Se considera cómo adecuado el rango de pH entre pH=7,5-9,5 sin embargo el sistema de medición presenta un límite superior de detección de 7,92 por lo que todos valores superiores a dicho valor se expresan como >7,92. Con el fin de asegurar que dichos valores superiores a 7,92 se encuentran dentro del margen fisiológico del ojo se realizó una determinación visual complementaria a través de tiras reactivas graduadas (Merck®).
Determinación de osmolaridad
La osmolaridad se midió utilizando un osmómetro Advance 3300 (Tecil®) mediante la técnica de punto de fusión.
Estabilidad microbiológica
La estabilidad microbiológica de los colirios se determinó mediante pruebas de esterilidad, siguiendo las recomendaciones de la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica (SEIMC)15. Se inoculó una alícuota de 1 ml en medios convencionales para bacterias aerobias (agar sangre, agar chocolate), un medio selectivo para aislamiento de bacilos gramnegativos (agar MacConkey), y un medio selectivo para estreptococos (CNA). Además se inoculó un medio líquido de enriquecimiento tioglicolato los días establecidos anteriormente. Las placas de agar sangre, agar chocolate y CNA se incubaron a 35-37ºC en atmósfera enriquecida con un 5% de CO2 .El agar MacConkey y el caldo se incubaron a 35-37ºC. Las placas y los medios líquidos se examinaron diariamente para detectar la presencia de microorganismos. La primera lectura de las placas se hizo a las 24 horas de incubación. Los medios líquidos se examinaron diariamente para ver si existía turbidez indicativa de crecimiento, y se realizó subcultivo del caldo a las 48 horas de incubación en los medios sólidos descritos previamente. El tiempo de incubación de las placas iniciales fue de 4 días, y el de los subcultivos de 48 horas.
Estudios descriptivos
El método utilizado fue la visualización directa de las características organolépticas, aspecto y limpidez, con el fin de asegurar la ausencia de partículas en suspensión o cambios de color.
RESULTADOS
Estabilidad fisicoquímica
Determinación de concentración de insulina
En la tabla 1 se recogen las concentraciones obtenidas mediante inmunoanálisis quimioluminiscente de micropartículas. Desde el mismo día de elaboración se observaron concentraciones inferiores a las establecidas para la formulación.
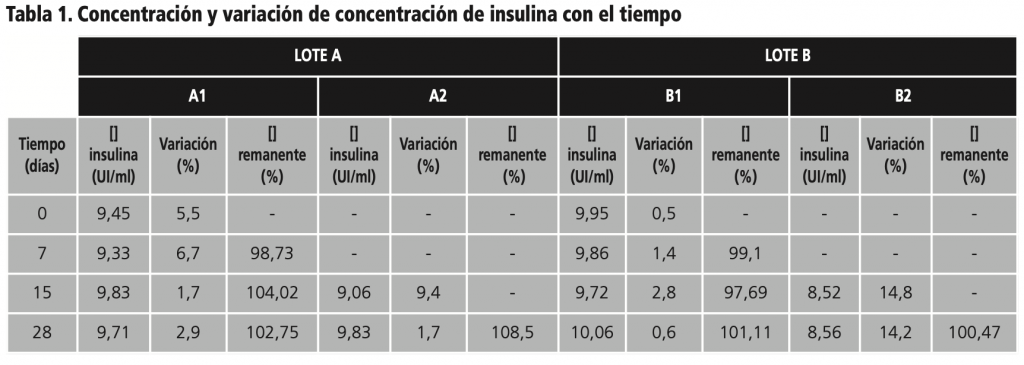
En los colirios cuya apertura se realizó en el día 0, A1 y B1, no se observaron cambios significativos al obtener variaciones máximas de 6,7% y del 2,8% respectivamente. Los valores de los colirios de insulina A2 y B2, abiertos el día 15, se encontraron dentro de los márgenes de variación establecidos, a excepción de los valores del lote B2 medidos en el día 15 y 28 (14,8% y 14,2%).
En la figura 1 se pueden observar las concentraciones de insulina de cada colirio, la variación de concentración de los 4 colirios respecto a la teórica y el porcentaje de concentración remanente de insulina respecto a la inicial (tiempo 0) a cada tiempo de muestreo.
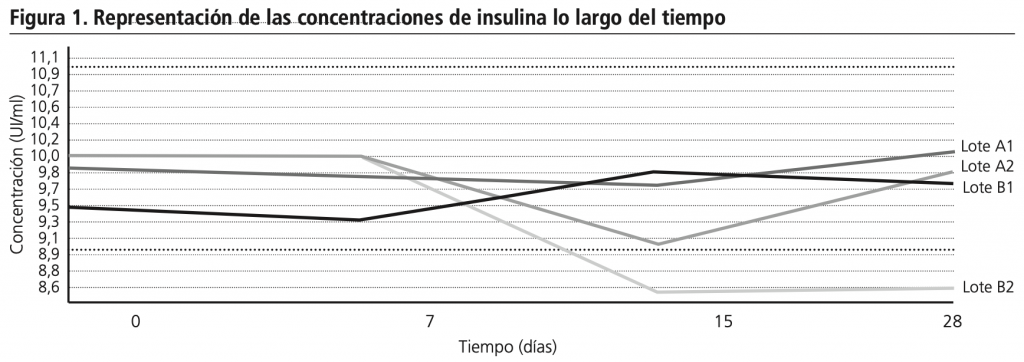
Para la expresión de la variación de los colirios A2 y B2 se supone una concentración de 10 UI/ml hasta el momento de su apertura.
Determinación de osmolaridad
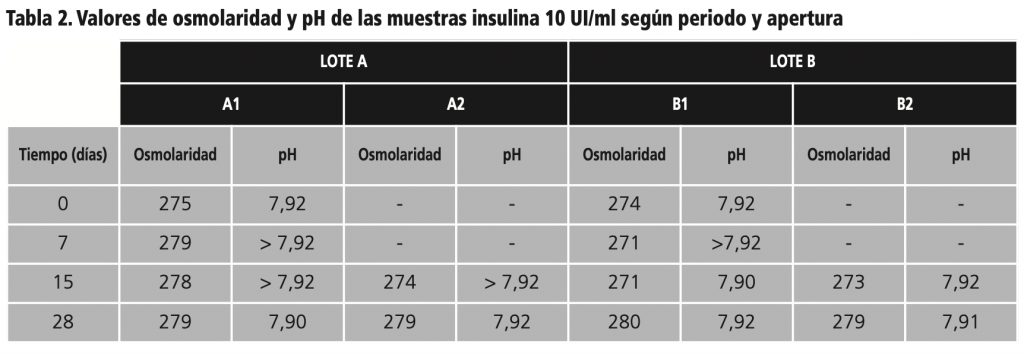
Los valores se mantuvieron estables, obteniendo un valor medio de 277,58±3,12 mOsm/L, el cual se haya dentro del rango fisiológico del ojo. En la tabla 2 se puede observar la variación de la osmolaridad de los 4 colirios a lo largo de todo el estudio.
Determinación de pH
En la tabla 2 se reflejan los datos obtenidos de medidas de pH. Cinco valores superaron el límite superior del pHmetro por lo que fueron expresados como >7,92. Para confirmar que dichos valores no se encontraban fuera del rango establecido, se confirmaron por visualización directa mediante tiras reactivas (Merck®). Todos ellos se consideraron aptos, con un valor de pH aproximado a 8. A pesar de estas diferencias, el pH se mantuvo dentro de los márgenes fisiológicos para el ojo, con un valor medio 7,94±0,04.
Estabilidad microbiológica
De acuerdo a las condiciones de almacenamiento establecidas, no se observó crecimiento microbiano en las muestras durante el tiempo del estudio.
Estudios descriptivos
No se apreciaron cambios de las características organolépticas, aspecto y limpidez al confirmar mediante visualización directa la ausencia de partículas o cambios de color durante el estudio.
DISCUSIÓN
La elaboración de fórmulas magistrales es una práctica frecuente cuya finalidad es cubrir vacíos terapéuticos y adaptar la administración de medicamentos disponibles en otras formas farmacéuticas, entre otros. Una vez establecida la composición cuali-cuantitativa de la preparación, surge la necesidad de realizar controles de estabilidad para garantizar una calidad y seguridad adecuada para la formulación.
La estabilidad de un medicamento se define como el tiempo durante el cual se conservan las propiedades físicas, químicas y microbiológicas adquiridas desde su fabricación dentro de unos límites específicos durante un periodo de conservación16. A raíz de dichos estudios se obtiene la información necesaria para establecer una recomendaciones de almacenamiento.
En estudios realizados previamente se ha demostrado la eficacia, efectividad y seguridad del colirio de insulina a diferentes concentraciones2,3,5,12. Sin embargo, en la bibliografía actual disponible, nos encontramos con la ausencia de estudios de estabilidad y cierta discrepancia acerca del tiempo de validez de estos colirios. En los estudios de Diaz-Valle et al.7 y Alvarado Fernandez et al.17, realizados con concentraciones 1 UI/ml, la estabilidad definida fue de 28 y 14 días respectivamente en refrigeración. La estabilidad determinada en otro estudio con colirio de insulina 0,5 UI/ml fue de 3 días18.
Dicha disparidad crea la necesidad de realizar un estudio específico de estabilidad fisicoquímica y microbiológica. En el presente trabajo, debido a las necesidades de los pacientes, se estudió el colirio de insulina 10 UI/ml. Esta concentración es 10 veces superior a las fórmulas más usadas actualmente en la práctica clínica diaria pero guarda un margen considerable con la concentración máxima sin toxicidad para el ojo12, quedando otras opciones terapéuticas de mayor concentración estudiadas como 50 UI/ml19, si esta no fuera eficaz.
Se aplicó la matriz de riesgo de preparación de medicamentos estériles de Sociedad Española de Farmacia Hospitalaria (SEFH)14 obteniendo un nivel de riesgo bajo. El tiempo de conservación establecido según la matriz es de 14 días refrigerado (2-8ºC), pero tras el análisis de los resultados del presente estudio, se determinó una estabilidad de 28 días, una vez abierto y en refrigeración.
Cabe destacar que desde el día de elaboración de los colirios de insulina 10 UI/ml se encontraron concentraciones inferiores a las establecidas, lo cual se asoció al proceso de elaboración. Además, durante el tiempo del estudio, se determinaron concentraciones variables según el día de apertura. Mientras que los colirios abiertos el día de su elaboración mantuvieron una variación de concentración dentro de los rangos establecidos como aptos, los colirios abiertos el día 15 desde su formulación sufrieron cambios significativos de concentración, sin poder determinar actualmente el motivo de ello. La ausencia, en el momento actual, de publicaciones similares disponibles impide la posibilidad de comparación.
Como limitaciones del trabajo cabe destacar el reducido tamaño muestral, tiempo de seguimiento y número de muestreos. En futuros estudios de estabilidad siguiendo la misma línea de investigación, éstos podrían aumentarse, siendo necesarios para validar y confirmar la replicabilidad de nuestros resultados y esclarecer las cuestiones que este trabajo no ha sido capaz de abarcar ya que excedían sus objetivos, como por ejemplo la degradación significativa de insulina en colirios que se mantienen cerrados desde su elaboración (A2 y B2) y la variabilidad de concentración en un mismo tiempo de muestreo. Si dicha degradación se confirmase resultaría de interés realizar estudios adicionales para determinar posibles factores que afecten a la estabilidad química como temperatura, envases o vehículos.
CONCLUSIONES
Este estudio no pretende evaluar la efectividad de un colirio de insulina 10 UI/ml pero si concluir que la atención farmacéutica en la elaboración y dispensación es segura, con el rigor metodológico que ha permitido establecer su estabilidad fisicoquímica y microbiológica durante 28 días manteniendo el frasco abierto desde el día de su elaboración según la formulación y condiciones del estudio descritas.
Conflicto de intereses: Las autoras declaran no tener conflicto de intereses.
BIBLIOGRAFÍA
1. Vaidyanathan U, Hopping GC, Liu HY, Somani AN, Ronquillo YC, Hoopes PC, et al. Persistent Corneal Epithelial Defects: A Review Article. MEHDI. 2019;8(3):163-176.
2. Zagon IS, Klocek MS, Sassani JW, McLaughlin PJ. Use of topical insulin to normalize corneal epithelial healing in diabetes mellitus. Arch Ophthalmol. 2007;25(8):1082-8.
3. Bastion ML, Ling KP. Topical insulin for healing of diabetic epithelial defects?: A retrospective review of corneal debridement during vitreoretinal surgery in Malaysian patients. Med J Malaysia. 2013;68(3):208-16.
4. Cruz-Cazarim ELC, Cazarim MS, Ogunjimi AT, Petrilli R, Rocha EM, Lopez RFV. Prospective insulin-based ophthalmic delivery systems for the treatment of dry eye syndrome and corneal injuries. Eur J Pharm Biopharm. 2019;140:1-10.
5. Fai S, Ahem A, Mustapha M, Mohd Noh UK, Bastion MC. Randomized Controlled Trial of Topical Insulin for Healing Corneal Epithelial Defects Induced During Vitreoretinal Surgery in Diabetics. Asia Pac J Ophthalmol (Phila). 2017;6(5):418-424.
6. Titone, R., Zhu, M. & Robertson, D.M. Insulin mediates de novo nuclear accumulation of the IGF-1/insulin Hybrid Receptor in corneal epithelial cells. Sci Rep. 2018;8(1):4378.
7. Diaz-Valle D, Burgos-Blasco B, Gegundez-Fernandez JA, Garcia-Caride S, Puebla-Garcia V, Peña-Urbina P, et al. Topical insulin for refractory persistent corneal epithelial defects. Eur J Ophthalmol. 2021;31(5):2280-6.
8. Wang AL, Weinlander E, Metcalf BM, Barney NP, Gamm DM, Nehls SM, et al. Use of Topical Insulin to Treat Refractory Neurotrophic Corneal Ulcers. Cornea. 2017;36(11):1426-8.
9. Nakamura M, Kawahara M, Morishige N, Chikama T, Nakata K, Nishida T. Promotion of corneal epithelial wound healing in diabetic rats by the combination of a substance P-derived peptide (FGLM-NH2) and insulin-like growth factor-1. Diabetología. 2003;46(6):839-42.
10. Ghiasi Z, Gray T, Tran P, Dubielzig R, Murphy C, McCartney DL, et al. The Effect of Topical Substance-P Plus Insulin-like Growth Factor-1 (IGF-1) on Epithelial Healing After Photorefractive Keratectomy in Rabbits. Transl Vis Sci Technol. 2018;7(1):12.
11. Chen DK, Frizzi KE, Guernsey LS, Ladt K, Mizisin AP, Calcutt NA. Repeated monitoring of corneal nerves by confocal microscopy as an index of peripheral neuropathy in type-1 diabetic rodents and the effects of topical insulin. J Peripher Nerv Syst. 2013;18(4):306-15.
12. Bartlett JD, Turner-Hensen A, Atchison JA, Woolley TW, Pillion DJ. Insulin Administration to the Eyes of Normoglycemic Human Volunteers. J Ocul Pharmacol Th. 2009;10(4): 683-90.
13. Aynsley TR. The use of insulin in the treatment of corneal ulcers. Br J Ophthalmol. 1945;29(7):361-3.
14. Casaus ME. Guía de Buenas Prácticas de Preparación de Medicamentos en Servicios de Farmacia Hospitalaria. Madrid: Ministerio de Sanidad, Consumo e Igualdad; 2014.
15. García-Lechuz Moya JM, González López JJ, Orta Mira N, Sánchez Romero MI. Recogida, transporte y procesamiento general de las muestras en el Laboratorio de Microbiología. Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica (SEIMC); 2017.
16. Chihuan K. Farmacopea de los Estados Unidos de America. Rockville: USP 37; 2014.
17. Alvarado Fernandez M, Montero Pérez O, García Giménez I, Peláez Bejarano A, Robustillo Cortés MA. Compounding an eye drop formulation of topical insulin for corneal defects refractory to previous treatment: experience in real clinical practice. Eur J Hosp Pharm. 2021;28(1):A20.
18. Quiroz-Mendoza JL, García Roa M, Romero Morales V, Valera Cornejo D, Vázquez Membrillo M, Ramírez Neria P, et al. Ensayo clínico de insulina tópica y hialuronato sódico en el tratamiento del defecto epitelial producido por el desbridamiento corneal transquirúrgico durante la vitrectomía vía pars plana en diabéticos. Rev. Mex. Oftalmol. 2021;95(2):63-70.
19. Serrano-Giménez R, Contreras-Macías E, García-Bernal A, Fobelo-Lozano MJ. Insulina tópica en el tratamiento de úlcera corneal refractaria en un paciente no diabético: a propósito de un caso. Farm Hosp. 2020;44(6):297-9.
____
