Rev. OFIL 2017, 27;2:187-192
Fecha de recepción: 03/05/2016 – Fecha de aceptación: 07/07/2016
Almanchel Rivadeneyra M, García Molina O, Tomás Luiz A, Muñoz Contreras MC, Menéndez Naranjo L, de la Rubia Nieto MA
Servicio de Farmacia. Hospital Clínico Universitario Virgen de la Arrixaca. Murcia (España)
Este trabajo ha sido presentado en forma de póster en el 60 Congreso Nacional de la Sociedad Española de Farmacia Hospitalaria,
celebrado en Valencia del 10 al 13 de noviembre de 2015. No ha sido publicado ni enviado para su publicación en ninguna otra revista
____
Correspondencia:
Miguel Almanchel Rivadeneyra
Hospital Clínico Universitario Virgen de la Arrixaca
(Servicio de Farmacia)
Ctra. Cartagena-Madrid, s/n
30120 El Palmar (Murcia)
Correo electrónico: miguel_almanchel@hotmail.com
____
Resumen
Objetivos: Analizar y comparar la efectividad de adalimumab (ADA) e infliximab (IFX) y el motivo de suspensión del tratamiento en pacientes con enfermedad de Crohn (EC).
Material y métodos: Estudio descriptivo, observacional y retrospectivo de todos los pacientes diagnosticados de EC tratados con ADA o IFX desde enero de 2010 a diciembre de 2014. Se registraron los siguientes datos: edad, sexo, duración de tratamiento, terapias previas con otros biológicos y causa de suspensión del tratamiento. Para medir la efectividad se midió la duración de tratamiento, mediante el método Kaplan-Meier se calculó la supervivencia global de ADA e IFX y se estimó la supervivencia a los 3 años. Para comprobar si existían diferencias entre ADA o IFX se utilizaron los test de Log-Rank y Breslow. La relación entre variables cualitativas se analizó mediante tablas de contingencia con el test de Chi-cuadrado de Pearson y las variables cuantitativas mediante el análisis t-Student. Los datos fueron analizados mediante el paquete estadístico SPSS v.22.
Resultados: El estudio incluyó 158 pacientes diagnosticados de EC (ADA; n=81 e IFX; n=77). La media de edad fue de 38±14 años en el grupo de ADA y de 39±13 en el de IFX (p=0,663); de los cuales, el 50,62% eran hombres en el grupo de ADA y el 51,95% en el de IFX (p=0,867). El 77,8% de los pacientes en el grupo de ADA y el 74,4% en el de IFX recibieron el fármaco en primera línea. En el momento del corte el 48,1% de los pacientes con ADA y el 51,9% con IFX, habían suspendido el tratamiento. La mediana de supervivencia fue de 42,7 meses para ADA (IC 95% 19,7-65,6%) y de 36 meses para IFX [Intervalo de confianza (IC) del 95% 6,4-65,5%] sin diferencias estadísticamente significativas entre ambos (Log-Rank: p=0,991; Breslow: p=0,621). La supervivencia a los 3 años fue del 53,1% para ADA y del 49,5% para IFX (p=0,75).
Conclusiones: En este estudio no se han encontrado diferencias significativas en términos de eficacia entre ambos anti-TNF.
Palabras clave: Enfermedad de Crohn, estudio, comparativo, efectividad, adalimumab, infliximab.
____
INTRODUCCIÓN
La Enfermedad de Crohn (EC) es una inflamación crónica de origen desconocido. Esta enfermedad puede afectar a cualquier parte del tracto digestivo y asociarse a manifestaciones sistémicas y extraintestinales. En su curso natural se alternan frecuentemente brotes de actividad inflamatoria con períodos de remisión y existe una elevada tendencia a la recurrencia tras la resección quirúrgica de los tramos afectados1.
Las tasas de incidencia de la EC han aumentado de forma significativa desde que esta enfermedad se describió por primera vez. La incidencia anual es de 1 a 10 casos cada 100.000 personas en el norte de Europa, Canadá y EE.UU., situándose en España alrededor de los 5 casos por cada 100.000 personas. No se han observado diferencias de predominio en ambos sexos (1:1). La edad de diagnóstico presenta un pico que va de los 20 a los 29 años, pudiendo afectar también a niños con diagnóstico más frecuente a partir de los 10 años de edad2.
En los últimos 15 años el tratamiento de la EC ha ido evolucionando, ya que junto al tratamiento corticoide, se añadieron en primer lugar los inmunomoduladores tiopurínicos (azatioprina y 6-mercaptopurina) y el metotrexato, y posteriormente los fármacos biológicos (anticuerpos monoclonales). Aproximadamente entre un 20 y un 30% de los pacientes con EC precisan tratamiento con biológicos para controlar su enfermedad3-5.
Actualmente, adalimumab (ADA) e infliximab (IFX), ambos inhibidores del factor de necrosis tumoral alfa (TNF-α), son los dos fármacos biológicos de primera línea para el tratamiento de la EC6,7. En el caso de pacientes con una EC de moderada a grave, que hayan tenido una respuesta inadecuada, presenten pérdida de respuesta, o intolerancia al tratamiento convencional o a un antagonista del factor de necrosis tumoral alfa (TNFα), se podría utilizar una segunda línea de biológicos, donde vedolizumab8,9, anticuerpo monoclonal humanizado (de tipo IgG1 dirigido contra la integrina α4β7 de linfocitos humanos) tendría esta indicación recogida en ficha técnica. En este último escenario existen otros dos fármacos biológicos en investigación para la EC, indicados en pacientes no respondedores o intolerantes a los dos anti-TNF-α con indicación actual: certolizumab-pegol10,11, también anti-TNF-α y usketinumab12,13 otro agente biológico con distinta diana terapéutica.
ADA e IFX han demostrado su eficacia y seguridad en diferentes ensayos clínicos14-20 realizados en condiciones ideales en lugar de en un ámbito real de aplicación con unos criterios de inclusión y de exclusión muy estrictos y con un periodo de seguimiento corto, lo que hace que sus pacientes no sean representativos.
Todo ello genera cierta incertidumbre a la hora de recomendar un anti-TNF-α u otro, debido a que no hay ensayos clínicos que comparen ambas alternativas entre sí21. Esto justifica la realización de estudios post-autorización que reflejen las condiciones habituales de la práctica clínica, ya que en este nuevo escenario, los resultados en efectividad y seguridad pueden ser diferentes22.
Nuestro estudio pretende comparar de forma directa la efectividad de ambos medicamentos anti-TNF-α, estudiar posibles diferencias de resultados entre ellos y analizar los motivos de suspensión del tratamiento en pacientes con EC.
MATERIAL Y MÉTODOS
Se diseñó un estudio descriptivo, observacional y retrospectivo en el que se incluyeron todos los pacientes diagnosticados de EC tratados con ADA subcutáneo (sc) o IFX intravenoso (IV) entre enero de 2010 y diciembre de 2014 en un hospital terciario de 863 camas.
Los datos recogidos para el estudio se obtuvieron de la historia clínica de los pacientes (Selene®), de la base de datos del programa informático de mezclas intravenosas en el caso de IFX y del programa de dispensación a Pacientes Externos para ADA (Silicon®).
Variables a estudio: Se recogieron las siguientes variables: variables demográficas (edad, sexo); variables clínicas y de actividad de la enfermedad [velocidad de sedimentación globular (VSG) y proteína C reactiva (PCR)], variables farmacológicas (terapias previas con otros biológicos y causa de suspensión del tratamiento), variables de efectividad (duración de tratamiento) y variables de discontinuidad de tratamiento (ineficacia del tratamiento, efectos adversos, abandono, remisión clínica, embarazo y exitus).
Análisis estadístico: Para medir la efectividad se midió la duración de tratamiento de ambos fármacos. Mediante el método Kaplan-Meier se calculó la supervivencia global de ADA e IFX y se estimó la supervivencia a los 3 años. Para comprobar si existían diferencias entre ADA o IFX se utilizaron los test de Log-Rank y Breslow. La relación entre variables cualitativas se analizó mediante tablas de contingencia con el test de Chi-cuadrado de Pearson y las variables cuantitativas mediante el análisis t-Student. Los datos fueron analizados mediante el paquete estadístico SPSS versión 22 (© 2015 SPSS Inc.).
No se obtuvo consentimiento informado de los pacientes ni su evaluación por el Comité Ético de Investigación Clínica al tratarse de un estudio retrospectivo no intervencional que no supuso ningún cambio en el tratamiento de los pacientes participantes. La información confidencial de los pacientes fue protegida de acuerdo a la normativa nacional establecida.
RESULTADOS
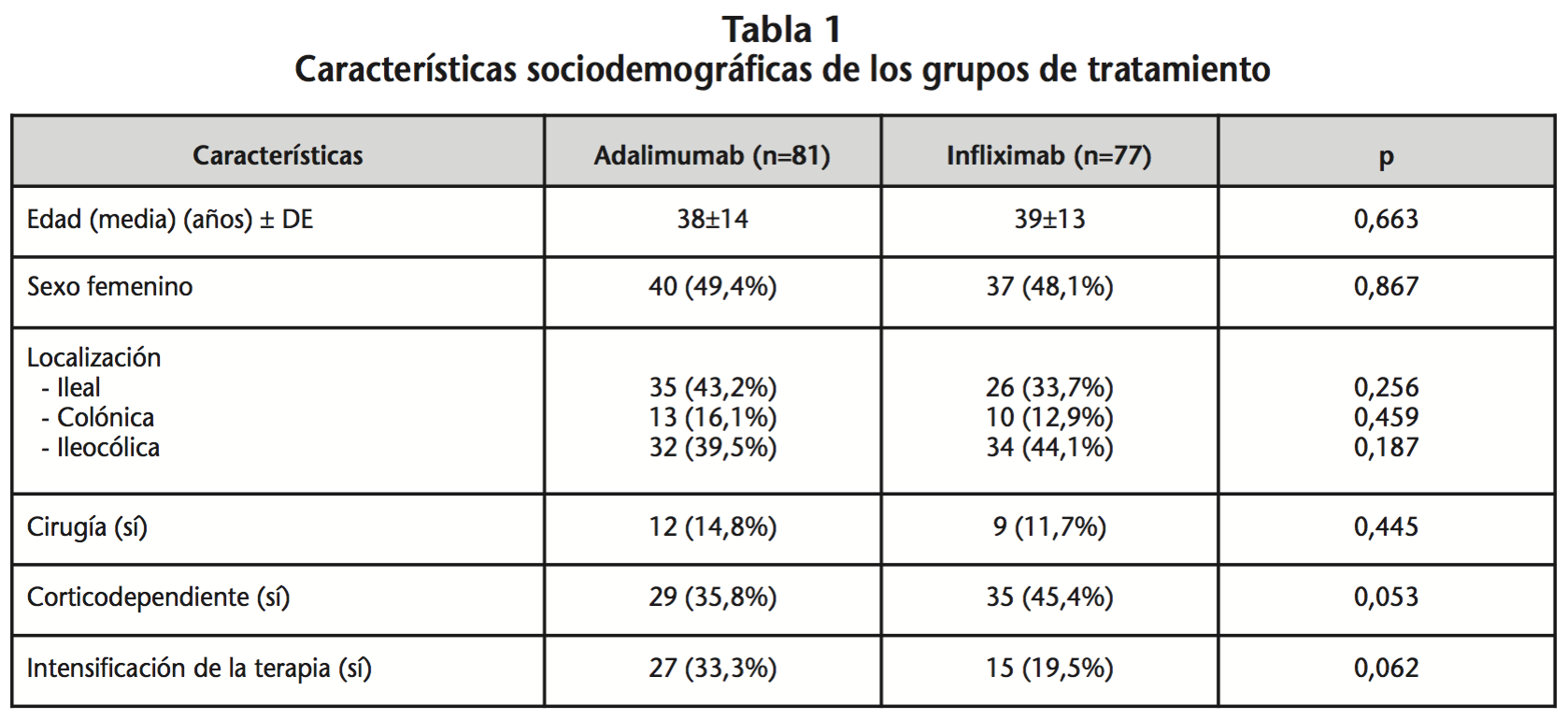
Durante el periodo de estudio se obtuvo una muestra total de 158 pacientes diagnosticados de EC en tratamiento con alguno de los fármacos a estudio (ADA; n=81 e IFX; n=77). La media de edad fue de 38 ±14 años en el grupo de ADA y de 39±13 años en el grupo de IFX (p=0,663). El 50,62% y el 51,95% fueron hombres en el grupo de ADA y de IFX respectivamente (p=0,867) (Tabla 1). El 77,8% de los pacientes en el grupo de ADA y el 74,4% de los pacientes en el grupo de IFX recibieron el fármaco en primera línea, mientras que el resto habían recibido previamente tratamiento con IFX o ADA, respectivamente.
Posología de la terapia:
• Inducción y mantenimiento del tratamiento biológico.
Se realizaron según las posologías recogidas en la ficha técnica de cada fármaco.
• Intensificación de la terapia: número de pacientes y descripción de la misma.
De los 81 pacientes tratados con ADA, 27 necesitaron intensificar el tratamiento, por 15 de los 77 pacientes tratados con IFX (p=0,062). La intensificación para ADA consistió en un aumento en la frecuencia de la dosificación a 40 mg semanales, mientras que para IFX, en intervalos de dosificación más cortos, de 6 semanas en 11 de los pacientes y de 4 semanas en los 4 restantes.
Causas de discontinuación del tratamiento:
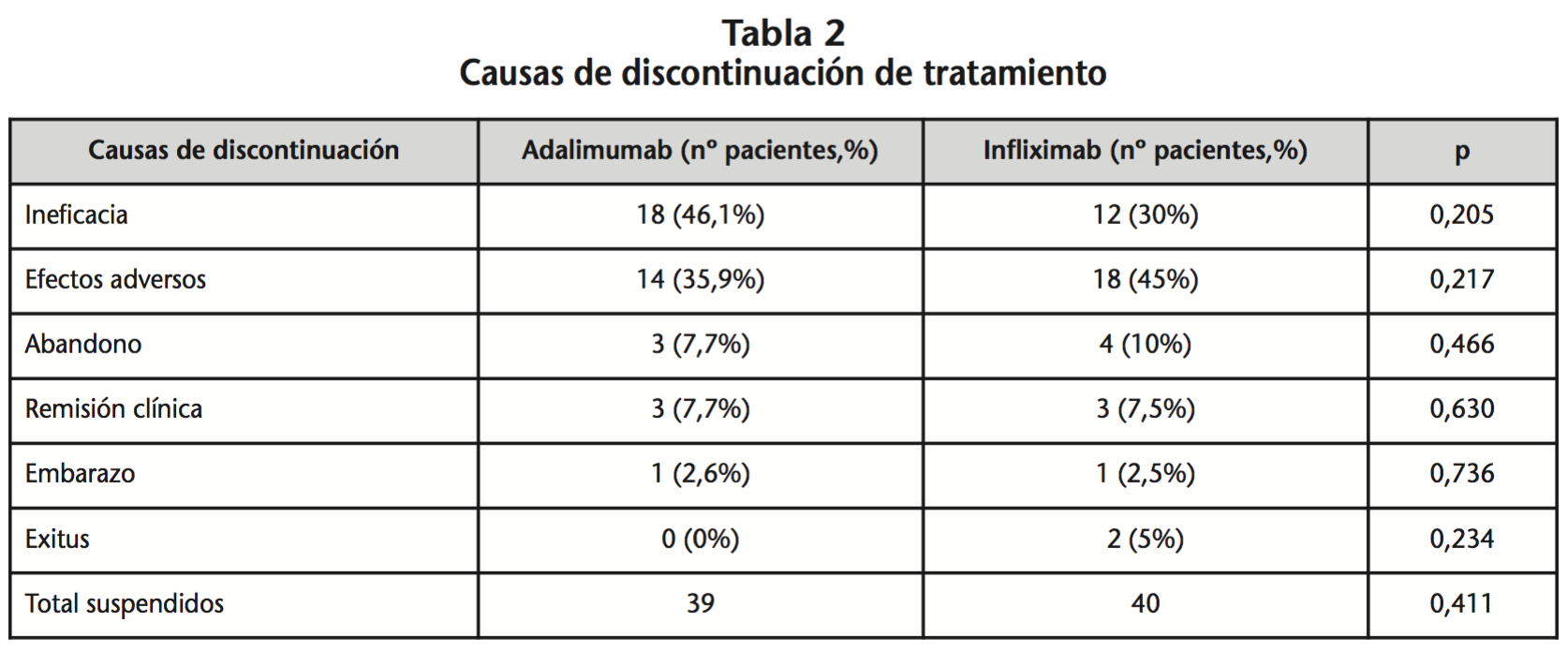
En el momento del corte, el 48,1% de los pacientes con ADA y el 51,9% con IFX, habían suspendido el tratamiento. De los pacientes tratados con ADA, 18 discontinuaron el tratamiento por ineficacia y 14 por la aparición de efectos adversos, ambas causas supusieron un 82% del total de las causas de discontinuación de ADA. Por contra, en el grupo de pacientes tratados con IFX, 18 discontinuaron el tratamiento por la aparición de efectos adversos y 12 por ineficacia, sumando entre ambas un 75% de las causas de discontinuación de IFX (Tabla 2).
Efectividad del tratamiento. Duración del tratamiento y variables de actividad del tratamiento: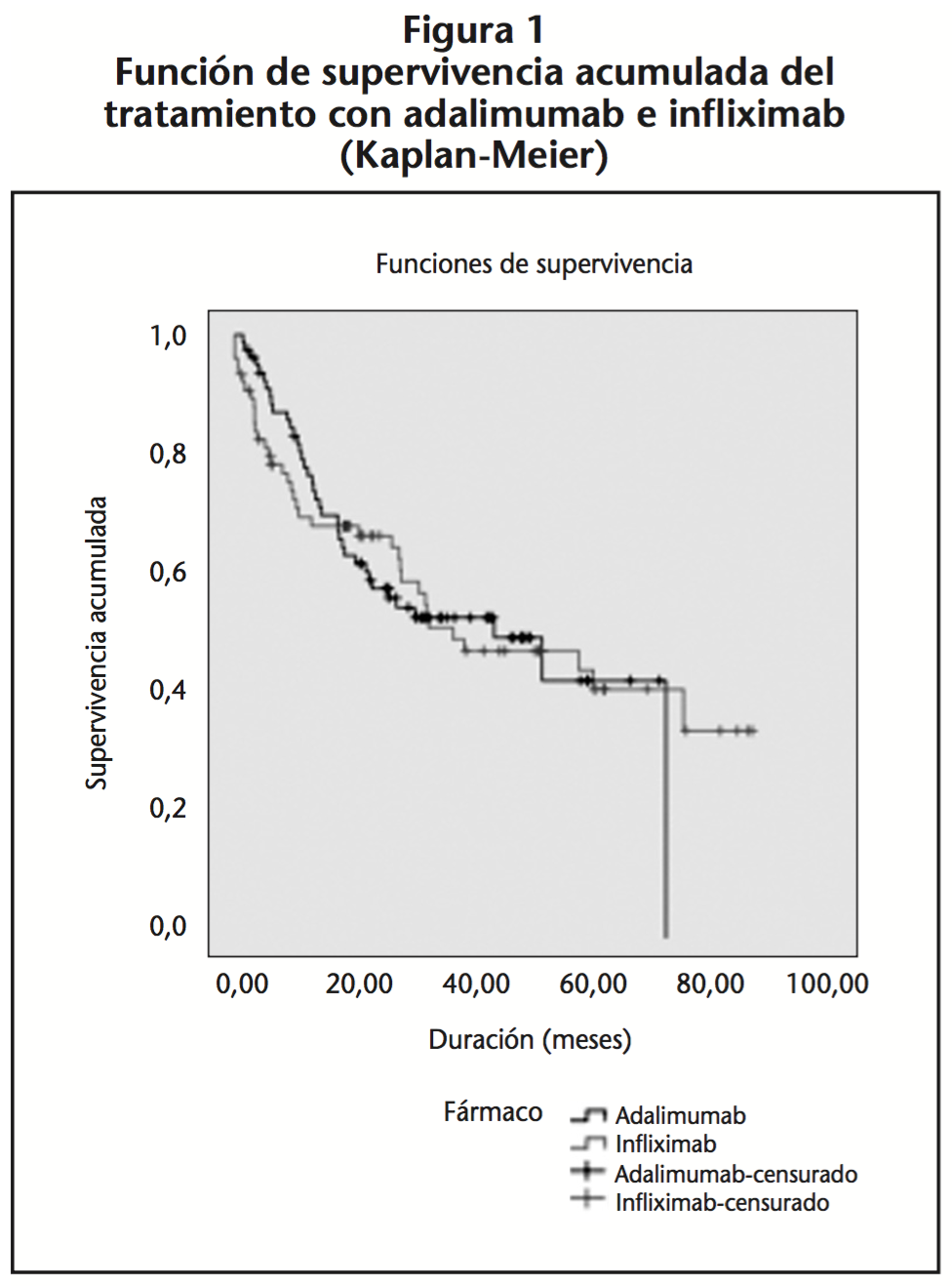
La mediana de supervivencia fue de 42,7 meses para ADA (IC 95% 19,7-65,6%) y de 36 meses para IFX (IC 95% 6,4-65,5%). Los test estadísticos de comparación entre los 2 grupos de tratamiento no revelaron diferencias estadísticamente significativas (Log-Rank: p=0,991; Breslow: p=0,621). La supervivencia a los 3 años fue del 53,1% para ADA y del 49,5% para IFX (p=0,75) (Figura 1).
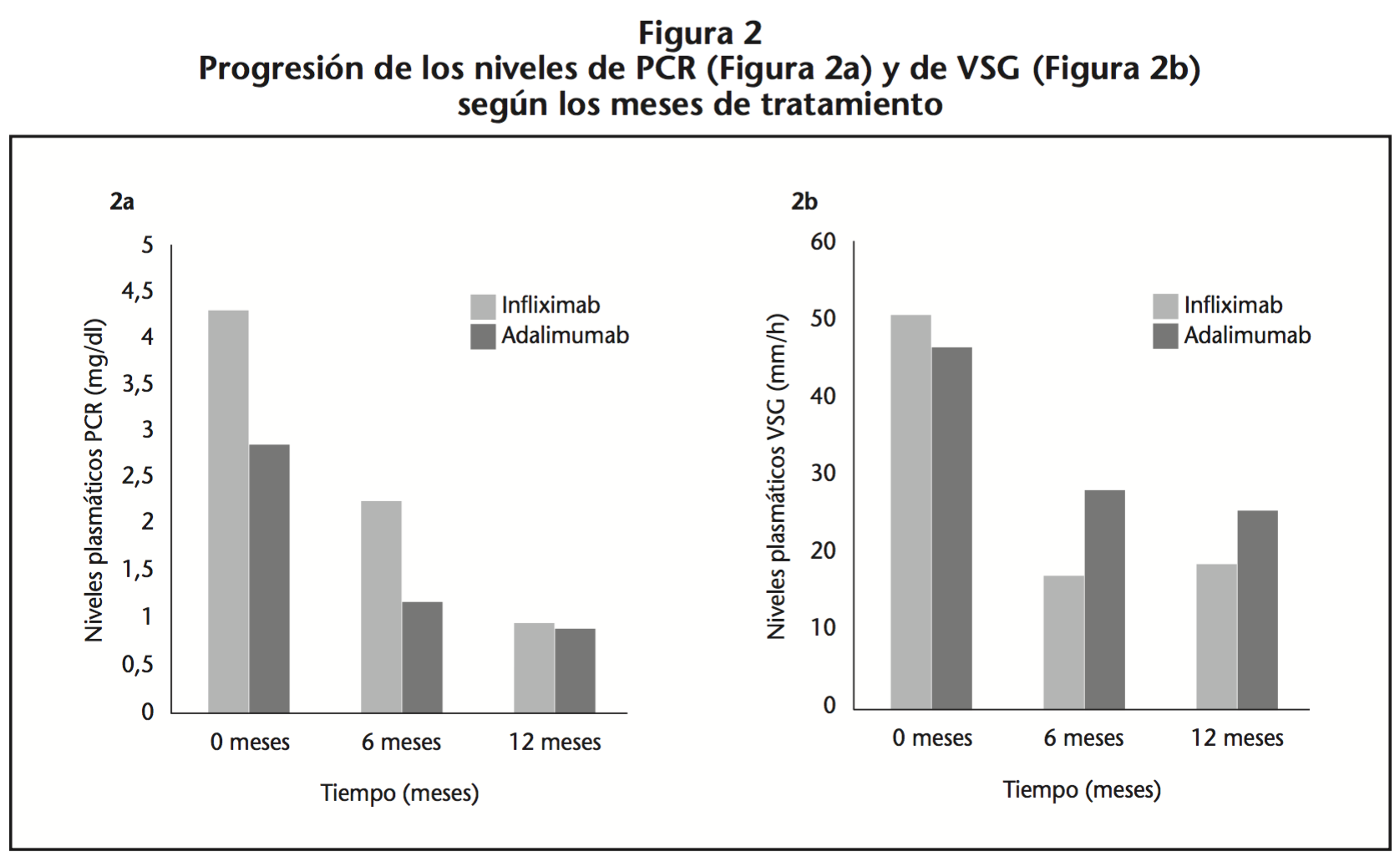
Las variables de actividad de la enfermedad (PCR y VSG) fueron disminuyendo progresivamente en ambos fármacos según los meses de tratamiento, sin apreciarse diferencias significativas (p>0.05) entre ambos tratamientos en ningún periodo de tiempo (Figura 2).
Analizando el uso concomitante de los biológicos con corticoides, se obtuvo un total de 29 pacientes (35,8%) corticodependientes para ADA y de 35 (45,4%) para IFX (p=0,053); mientras que los pacientes que necesitaron cirugía fueron 12 (14,8%) en el caso de ADA y 9 (11,7%) en el de IFX (p=0,445).
DISCUSIÓN
ADA e IFX son actualmente los dos fármacos anti-TNF con indicación aprobada en ficha técnica para el tratamiento de la EC en primera línea; ambos fármacos poseen un mecanismo de acción similar aunque una vía de administración diferente. Existen diferentes ensayos clínicos de gran calidad que demuestran la eficacia de ADA e IFX frente a placebo, pero sin una comparación directa entre ellos12-18. En diversos metaanálisis y revisiones sistemáticas23,24 se han comparado ambos fármacos entre sí mediante métodos indirectos, concluyéndose en todos ellos que no hay evidencia de superioridad clínica entre ellos.
Los estudios que comparan ADA e IFX de manera directa no son muy numerosos23,24. En el presente estudio no se han encontrado diferencias significativas en términos de efectividad entre ambos anti-TNF-α en el tratamiento de la EC. Una de las variables que hemos utilizado para medir la efectividad a los 3 años es la supervivencia global mediante el método Kaplan-Meier; al igual que en el estudio de Kestens et al.25 donde se observó una supervivencia global similar a la de nuestro estudio, siendo mayor el valor absoluto para IFX algo que no ocurrió en nuestro estudio donde ADA tuvo un valor mayor a IFX, aunque en ambos casos no se apreciaron diferencias significativas. En este estudio además analizan las causas de interrupción del tratamiento, teniendo en cuenta tres causas (pérdida de efecto, ausencia de efecto clínico y efectos adversos) por las seis de nuestro estudio (ineficacia, efectos adversos, abandono, remisión clínica, embarazo y exitus), aunque en ambos estudios no hubo diferencias significativas en este punto. En el estudio de Kestens et al., aproximadamente el 40% de los pacientes discontinuaron tratamiento a los 2 años por alguna de las causas anteriormente descritas, mientras que en nuestra cohorte de pacientes, aproximadamente el 50% discontinuaron el tratamiento biológico durante nuestro periodo de estudio, siendo la causa de discontinuación más común la pérdida de eficacia en el caso de ADA, y la aparición de algún efecto adverso para IFX, sin presentar, no obstante, diferencias significativas en ambos casos.
En otro estudio observacional comparativo, el de Osterman et al.26 se analizó la efectividad de ADA e IFX mediante unas variables distintas a las de nuestro estudio, concluyendo que se observó una efectividad similar en ambos fármacos; además en dicho estudio, del mismo modo que en el nuestro, se observó que los pacientes tratados con IFX necesitaban menos cirugías que los tratados con ADA, aunque no hubo diferencias significativas en ninguno caso.
Una limitación de nuestro estudio es el posible sesgo de confusión residual que se produce a partir de variables no medidas, evitables mediante la aleatorización y la restricción en la selección, sin embargo nuestro estudio es observacional y retrospectivo. A pesar de ello, las características de los pacientes de ambos grupos de estudio, resultaron ser bastante homogéneas (Tabla 1), aunque siempre en menor grado que de haberse llevado a cabo un estudio aleatorizado y prospectivo.
Los datos de nuestro estudio, junto con la bibliografía consultada21-24, sugieren una efectividad comparable de ambos medicamentos en la práctica clínica, sin embargo, se necesitan estudios prospectivos aleatorizados que permitan confirmar estos datos. A pesar de ello, el elevado coste y el riesgo financiero que supondría un ensayo de este tipo para los laboratorios fabricantes de los anti-TNF-α, dificulta su realización; de ahí la importancia de la realización de estudios de efectividad comparativos, observacionales retrospectivos como éste, que proporcionan datos de eficacia en condiciones reales y ayudan a posicionarlos en la elaboración de protocolos y guías clínicas. Por lo tanto, basándonos en los resultados de nuestro estudio y de los datos disponibles hasta la fecha, la elección de uno u otro se hará de modo individualizado, teniendo en cuenta la vía de administración, las características de los pacientes y el criterio médico.
Conflicto de intereses: Los autores declaran no tener conflictos de intereses.
BIBLIOGRAFÍA
1. P. Nos Mateu y J. Clofent Vilaplana. Enfermedad de Crohn. En: Ponce García J, coodinador. Tratamiento de las enfermedades gastroenterológicas. 3ª Edición. Asociación Española de Gastroenterología; 2011. p 293-304 ISBN: 978-84-7592-722-0.
2. Molodecky NA, Soon IS, Rabi DM, Ghali WA, Ferris M, Chernoff G, et al. Increasing incidence and prevalence of the inflammatory bowel diseases with time, based on systematic review. Gastroenterology. 2012 Jan; 142(1):46-54.
3. D’Haens G, Baert F, van Assche G, Caenepeel P, Vergauwe P, Tuynman H, et al. Early combined immunosuppression or conventional management in patients with newly diagnosed Crohn’s disease: an open randomised trial. Lancet. 2008 Feb 23;371(9613):660-7.
4. Dignass A, Van Assche G, Lindsay JO, Lémann M, Söderholm J, Colombel JF, et al for the European Crohn´s and Colitis Organization (ECCO). The second European evidence-based Consensus on the diagnosis and management of Crohn’s disease: Current management. J Crohns Colitis. 2010 Feb;4(1):28-62.
5. Van Assche G, Dignass A, Reinisch W, van der Woude CJ, Sturm A, De Vos M, et al. (ECCO). The second European evidence-based Consensus on the diagnosis and management of Crohn’s disease: Special situations. J Crohns Colitis. 2010 Feb;4(1):63-101.
6. European Medicine Agency (EMA). Summary of product characteristics: Remicade® (infliximab) (Internet). (Acceso: Febrero 2016). Disponible en: http://www.ema.europa.eu/docs/es_ES/document_library/EPAR_-_Product_Information/human/000240/ WC500050888.pdf.
7. European Medicine Agency (EMA). Summary of product characteristics: Humira® (adalimumab) (Internet). (Acceso: Febrero 2016). Disponible en: http://www.ema.europa.eu/docs/es_ES/document_library/EPAR_-_Product_Information/human/000481/ WC500050870.pdf.
8. European Medicine Agency (EMA). Summary of product characteristics: Entyvio® (vedolizumab) (Internet). (Acceso: Febrero 2016). Disponible en: http:// www.ema.europa.eu/docs/es_ES/document_library/EPAR_-_Product_Information/human/002782/ WC500168528.pdf.
9. Sands BE, Feagan BG, Rutgeerts P, Colombel JF, Sandborn WJ, Sy R, et al. Effects of vedolizumab induction therapy for patients with Crohn’s disease in whom tumor necrosis factor antagonist treatment failed. Gastroenterology. 2014 Sep;147(3):618-627.
10. Sandborn WJ, Lee SD, Randall C, Gutierrez A, Schwartz DA, Ambarkhane S, et al. Long-term safety and efficacy of certolizumab pegol in the treatment of Crohn’s disease: 7-year results from the PRECiSE 3 study. Aliment Pharmacol Ther. 2014 Oct;40(8):903-16.
11. Sandborn WJ, Abreu MT, D’Haens G, Colombel JF, Vermeire S, Mitchev K, et al. Certolizumab pegol in patients with moderate to severe Crohn’s disease and secondary failure to infliximab. Clin Gastroenterol Hepatol. 2010 Aug;8(8):688-695.
12. Sandborn WJ, Gasink C, Gao LL, Blank MA, Johanns J, Guzzo C, et al. Ustekinumab induction and maintenance therapy in refractory Crohn’s disease. N Engl J Med. 2012 Oct 18;367(16):1519-28.
13. Kopylov U, Afif W, Cohen A, Bitton A, Wild G, Bessissow T, et al. Subcutaneous ustekinumab for the treatment of anti-TNF resistant Crohn’s disease-the McGill experience. J Crohns Colitis. 2014 Nov;8(11):1516-22.
14. Hanauer SB, Feagan BG, Lichtenstein GR, Mayer LF, Schreiber S, Colombel JF, et al. Maintenance infliximab for Crohn’s disease: the ACCENT I randomised trial. Lancet. 2002 May 4;359(9317):1541-9.
15. Sands BE, Anderson FH, Bernstein CN, Chey WY, Feagan BG, Fedorak RN, et al. Infliximab maintenance therapy for fistulizing Crohn’s disease. N Engl J Med. 2004 Feb 26;350(9):876-85.
16. Colombel JF, Sandborn WJ, Reinisch W, Mantzaris GJ, Kornbluth A, Rachmilewitz D, et al. Infliximab, azathioprine, or combination therapy for Crohn’s disease. N Engl J Med. 2010 Apr 15;362(15):1383-95.
17. Hanauer SB, Sandborn WJ, Rutgeerts P, Fedorak RN, Lukas M, MacIntosh D, et al. Human anti-tumor necrosis factor monoclonal antibody (adalimumab) in Crohn’s disease: the CLASSIC-I trial. Gastroenterology. 2006 Feb;130(2):323-33.
18. Sandborn WJ, Hanauer SB, Rutgeerts P, Fedorak RN, Lukas M, MacIntosh DG, et al. Adalimumab for maintenance treatment of Crohn’s disease: results of the CLASSIC II trial. Gut. 2007 Sep;56(9):1232-9.
19. Colombel JF, Sandborn WJ, Rutgeerts P, Enns R, Hanauer SB, Panaccione R, et al. Adalimumab for maintenance of clinical response and remission in patients with Crohn’s disease: the CHARM trial. Gastroenterology. 2007 Jan;132(1):52-65
20. Panaccione R, Colombel JF, Sandborn WJ, D’Haens G, Zhou Q, Pollack PF, et al. Adalimumab maintains remission of Crohn’s disease after up to 4 years of treatment: data from CHARM and ADHERE. Aliment Pharmacol Ther. 2013 Nov;38(10):1236-47.
21. José Luis Cabriada, Isabel Vera, Eugeni Domènech, Manuel Barreiro-de Acosta, María Esteve, Javier P. Gisbert, Julia Panésg y Fernando Gomollón. Recomendaciones del Grupo Español de Trabajo en Enfermedad de Crohn y Colitis Ulcerosa sobre el uso de fármacos antifactor de necrosis tumoral en la enfermedad inflamatoria intestinal (2013). Gastroenterol Hepatol. 2013;36(3):127-146.
22. Song F, Altman DG, Glenny AM, Deeks JJ. Validity of indirect comparison for estimating efficacy of competing interventions: empirical evidence from published meta-analyses. BMJ. 2003 Mar 1;326(7387):472.
23. Singh S, Garg SK, Pardi DS, Wang Z, Murad MH, Loftus EV Jr. Comparative efficacy of biologic therapy in biologic-naïve patients with Crohn disease: a systematic review and network meta-analysis. Mayo Clin Proc. 2014 Dec;89(12):1621-35.
24. Stidham RW, Lee TC, Higgins PD, Deshpande AR, Sussman DA, Singal AG, et al. Systematic review with network meta-analysis: the efficacy of anti-TNF agents for the treatment of Crohn’sdisease. Aliment Pharmacol Ther. 2014 Jun;39(12):1349-62.
25. Kestens C, van Oijen MG, Mulder CL, van Bodegraven AA, Dijkstra G, de Jong D, et al. Adalimumab and infliximab are equally effective for Crohn’s disease in patients not previously treated with anti-tumor necrosis factor-α agents. Clin Gastroenterol Hepatol. 2013 Jul;11(7): 826-31.
26. Osterman MT, Haynes K, Delzell E, Zhang J, Bewtra M, Brensinger C, Chen L, et al. Comparative effectiveness of infliximab and adalimumab for Crohn’s disease. Clin Gastroenterol Hepatol. 2014 May;12(5):811-817.
____
Descargar archivo PDF: Estudio comparativo de la efectividad de adalimumab e infliximab en pacientes con enfermedad de Crohn
