Fecha de recepción: 13/07/2017 – Fecha de aceptación: 21/09/2017
García-Quintanilla L1,2*, Otero-Barreiro MC3*, González-Barcia M1,2, Virgós-Lamela A3, Rodríguez-Prada M1,2,
Lamas MJ1,2, Fernández-Ferreiro A1,2
1 Servicio de Farmacia. Xerencia de Xestión Integrada de Santiago de Compostela (SERGAS) (España)
2 Grupo de Farmacología Clínica. Instituto de Investigación Sanitaria de Santiago de Compostela (IDIS-ISCIII) (España)
3 Servicio de Cardiología. Xerencia de Xestión Integrada de Santiago de Compostela (SERGAS) (España)
*Ambos autores contribuyen por igual
____
Correspondencia:
Anxo Fernández Ferreiro
María Jesús Lamas
Xerencia Xestión Integrada de Santiago de Compostela (SERGAS)
(Servicio de Farmacia)
C/ A Choupana, s/n
15706 Santiago de Compostela
Correo electrónico: anxordes@gmail.com
Correo electrónico: maria.jesus.lamas.diaz@sergas.es
____
Resumen
Objetivos: La flebitis es una de las mayores complicaciones asociadas al uso de catéteres, para la cual no existen protocolos terapéuticos estandarizados. El objetivo de este estudio es analizar la utilización y evaluar la eficacia de la Solución de Burow en pacientes con flebitis.
Métodos: Estudio observacional prospectivo de nueve meses de duración en el que se describe el uso y se evalúa eficacia y seguridad de un protocolo de flebitis que utiliza fomentos con la Solución de Burow.
Resultados: Durante el periodo de inclusión, la Solución de Burow se ha utilizado en 35 pacientes con flebitis, de los cuales 12 se han excluido por falta de seguimiento diario. El grado de flebitis ha sido de grado IV en el 21% (n=5) de los pacientes, de grado III en el 52% (n=12), de grado II en el 22% (n=5) y de grado I en el 4% (n=1). El 95% de las flebitis han sido químicas, provocadas principalmente por antibióticos. El 83% (n=19) de los pacientes ha respondido a la terapia reduciéndose el grado de flebitis dos puntos, después de tres días de tratamiento y sólo un 17% (n=4) no ha respondido, necesitando aplicaciones tópicas de Feparil®. Ningún paciente ha sufrido reacciones adversas durante el tratamiento.
Conclusiones: La Solución de Burow es una formulación magistral que se ha utilizado principalmente en flebitis de grado III que afectan mayoritariamente a la vena cefálica y que tienen como primer desencadenante la utilización de antibióticos. El 69% de los pacientes han requerido su utilización durante tres días, observándose que en el 17% de los casos la aplicación de los fomentos no ha sido efectiva, sin embargo, estudios complementarios deben realizarse para la obtención de resultados concluyentes sobre su eficacia.
Palabras clave: Solución de Burow, catéter, eficacia, formulación magistral, flebitis, uso, seguridad.
____
INTRODUCCIÓN
La flebitis asociada a catéteres intravenosos es a día de hoy una de las complicaciones más frecuentes en pacientes hospitalizados. La flebitis, aparece como una alteración endotelial provocada por la inserción del catéter y la consecuente respuesta inflamatoria que se produce tras la agresión. Los mediadores activados producen el aumento de la permeabilidad del vaso y la extravasación del material proteico hacia el intersticio1, siendo los síntomas más importantes el dolor, eritema, inflamación y en casos más graves, fiebre2.
Las causas se dividen en: mecánicas, debidas al manejo del catéter, lugar de inserción o tiempo de permanencia del mismo; infecciosas o químicas. Estas últimas, son las más frecuentes y suelen ser debidas a la osmolaridad y pH de los fluidos infundidos, a la velocidad de administración de los mismos o a las características intrínsecas que poseen ciertos fármacos como la amiodarona o antibióticos como la cloxacilina3.
Actualmente no existe un tratamiento estandarizado para el tratamiento de las flebitis, siendo este paliativo en todos los casos. En la práctica clínica habitual, se utilizan diversos protocolos de tratamiento, entre los que se encuentran el uso de antiinflamatorios tópicos, geles de heparina y nitroglicerina o gasas frías con diversas soluciones, pero no existen estudios comparativos en donde se establezca la superioridad de eficacia de unos sobre otros4-7. No existen medicamentos desarrollados específicamente para el tratamiento la flebitis, por lo que su manejo se basa en la experiencia y en muchas ocasiones se recurre a formulaciones magistrales, como soluciones de acetato de aluminio, también denominada Solución de Burow. Esta formulación tiene como principal componente el acetato de aluminio, conocido principalmente por sus propiedades astringentes y por su capacidad de producir la precipitación de las proteínas a nivel tópico8.
La formulación magistral es una actividad estratégica dentro de los Servicios de Farmacia, fundamentalmente porque es una herramienta para resolver problemas que se presentan en la práctica clínica diaria, tales como el desabastecimiento de medicamentos elaborados por la industria, la preparación de medicamentos para enfermedades raras o la terapia individualizada en pacientes en situaciones especiales9. Sin embargo, la evaluación de la eficacia de las mismas es un factor clave para su correcto uso y aplicación. Actualmente, se conoce poco sobre el uso de la Solución de Burow y su mecanismo de acción para el tratamiento paliativo de la flebitis y su mayor evidencia de utilización y eficacia está descrita en el tratamiento de la otitis externa10,11.
Por ello, el objetivo del presente estudio es describir la utilización y evaluar la eficacia y seguridad de la Solución de Burow para el tratamiento tópico de la flebitis.
MATERIAL Y MÉTODO
Estudio observacional prospectivo, en el que se analiza el uso y se evalúa la efectividad y seguridad del protocolo de flebitis basado en la utilización de fomentos de Solución de Burow en pacientes con flebitis ingresados en la planta de cardiología del Hospital Clínico Universitario de Santiago de Compostela. El estudio ha sido aprobado por el Comité Ético de Investigación Clínica de Galicia. En la realización del mismo se han respetado las recomendaciones internacionales sobre investigación clínica enmarcadas dentro de la Declaración de Helsinki, habiéndose obtenido el consentimiento informado de los pacientes para la obtención y explotación de los datos obtenidos.
Inclusión de pacientes y protocolo de flebitis con Solución de Burow
Pacientes adultos ingresados en la planta de cardiología que desarrollaron flebitis y que requirieron tratamiento tópico con Solución de Burow durante el periodo comprendido entre octubre de 2016 y junio de 2017. Se han excluido del estudio a los pacientes a los que no se le ha podido realizar un seguimiento diario durante los cinco días que dura el tratamiento con los fomentos.
Datos clínicos y farmacoterapéuticos
Se han recogido datos demográficos de los pacientes (edad y sexo), localización de acceso vascular causante de la flebitis, causa de la flebitis (mecánica o química), posología de los fomentos, forma de aplicación, así como otros tratamientos tópicos concomitantes.
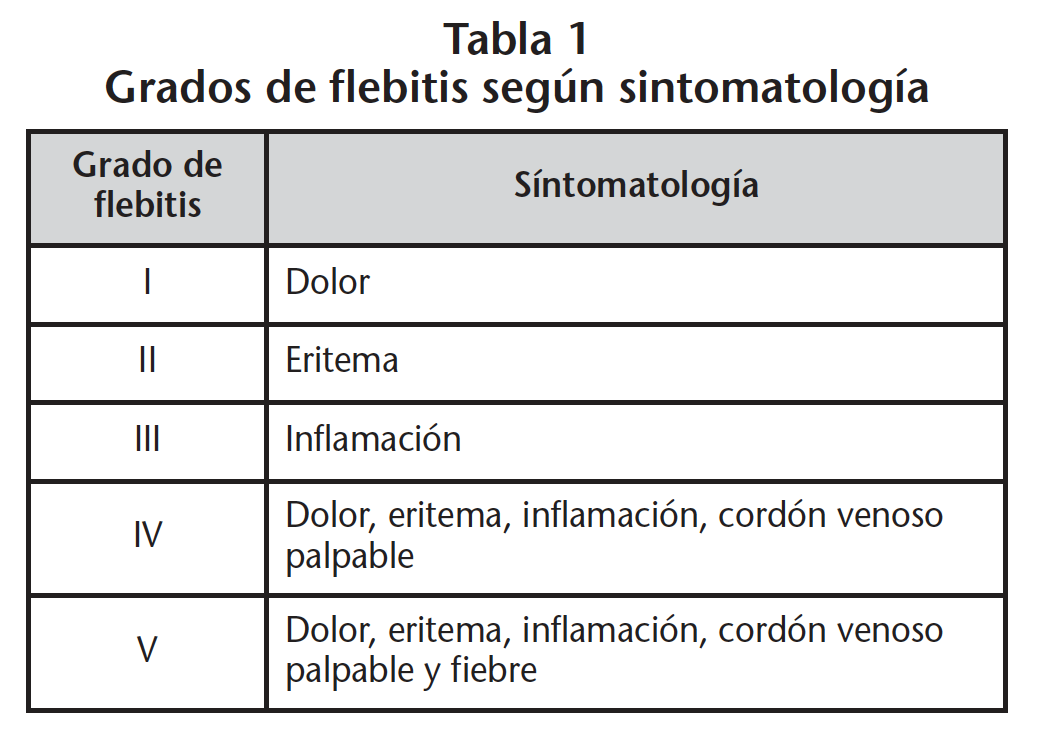
Se ha realizado una valoración clínica inicial del grado de flebitis y se clasifica la afectación en base a la sintomatología, usando para ello una modificación de la clasificación descrita por el INS (Infusion Nurses Society)12 (Tabla 1).
 Tras la aplicación de los fomentos con la Solución de Burow, se reevalúa diariamente el grado de flebitis a lo largo de su tratamiento. Para la evaluación de la efectividad de los fomentos, se ha definido que la terapia no es eficaz, cuando en el día 3 de tratamiento el grado de flebitis no se ha reducido en dos puntos con respecto al inicial. La evaluación de la seguridad se ha basado en la observación de la aparición de reacciones adversas cutáneas apreciables o efectos sistémicos que se pudiesen relacionar tras la aplicación de los fomentos.
Tras la aplicación de los fomentos con la Solución de Burow, se reevalúa diariamente el grado de flebitis a lo largo de su tratamiento. Para la evaluación de la efectividad de los fomentos, se ha definido que la terapia no es eficaz, cuando en el día 3 de tratamiento el grado de flebitis no se ha reducido en dos puntos con respecto al inicial. La evaluación de la seguridad se ha basado en la observación de la aparición de reacciones adversas cutáneas apreciables o efectos sistémicos que se pudiesen relacionar tras la aplicación de los fomentos.
Elaboración de la Solución de Burow
La preparación de la Solución de Burow es una formulación magistral elaborada en el Servicio de Farmacia Hospitalaria en base a lo descrito en el Formulario Nacional13. Para su elaboración se requiere de la producción de la solución madre con ácido acético glacial y sulfato de aluminio mezclado con carbonato cálcico, la cual se debe agitar durante dos días. Una vez pasado este tiempo se filtra y se le añade el ácido tartárico. A partir de esta solución madre preparamos lo que se conoce como Solución de Burow, que consiste en la dilución con agua al 5% de la solución madre. La conservación de esta formulación es a temperatura ambiente y la estabilidad es de 6 meses para solución madre y de 3 meses para la solución diluida.
RESULTADOS
Un total de 35 pacientes con flebitis han sido tratados tópicamente con Solución de Burow en forma de fomentos. De estos pacientes, 12 han sido excluidos, por no tener un seguimiento diario adecuado. El 65% de los pacientes han sido hombres con una edad media de 68±13 años, siendo la edad media de las mujeres similar (69±13 años). La localización de la flebitis ha sido causada por catéter vascular en todos los casos, variando la localización de la misma; la vena cefálica ha sido la más afectada, observándose flebitis en el 56% (n=13) de los pacientes, 26% (n=6) en vena dorsal miembro superior, y el restante 17% (n=4) en otras localizaciones como la basílica.
En el 95% (n=22) de los casos, la flebitis ha tenido desencadenante químico, siendo el 46% (n=10) de las mismas causada por antibióticos como cloxacilina e imipenem, en el 36% (n=8) por furosemida y en el 18% (n=4) por otros medicamentos como el hierro intravenoso.
Estos pacientes han recibido Solución de Burow en forma de fomentos en la zona afectada, siendo aplicados, en todos los casos, cada 8 horas. Los fomentos han sido administrados a temperatura entre 2 y 8ºC y se han mantenido durante 20 minutos en la zona afectada.
El grado de flebitis que presentan los pacientes en el momento de requerir el primer fomento ha sido de grado IV en el 21% (n=5), de grado III en el 52% (n=12), de grado II en el 22% (n=5) y de grado I en el 4% (n=1). El 100% de los pacientes han requerido fomentos durante los dos primeros días, reduciéndose al 69% (n=16) los que lo han requerido durante tres días. Tras estos tres días de tratamiento, se evalúa la eficacia, observándose que el 17% (n=4) de los pacientes no han respondido a la terapia y han requerido cambio de tratamiento a Feparil® crema. El cuarto día de tratamiento es mantenido en el 17% de los pacientes, y solamente el 9% lo han requerido durante cinco días. Con respecto a la seguridad, ningún paciente ha sufrido reacciones adversas durante el tratamiento, no observándose reacciones cutáneas anómalas tras la aplicación de los fomentos ni reacciones sistémicas apreciables.
DISCUSIÓN
En un medio hospitalario, la mayoría de los pacientes es usuario de catéteres venosos, siendo la flebitis la principal complicación relacionada con la canalización de las vías. La flebitis, que se produce como una respuesta inflamatoria frente a la agresión provocada al canalizar la vía e infundir los diversos tratamientos endovenosos, no tiene un tratamiento claro y coexisten en la actualidad la aplicación de diversos protocolos14-16. En el presente estudio analizamos la utilización y evaluamos la eficacia de la Solución de Burow, una formulación magistral para la que existe una importante limitación de estudios sobre su utilización en flebitis17.
El farmacéutico elaborador, debe valorar la eficacia de las formulaciones magistrales que elabora en el día a día con el fin de optimizarlas y valorar en cuál de ellas debe invertir su tiempo y esfuerzo9. En base a los resultados observados, la Solución de Burow podría definirse como una alternativa terapéutica eficaz en el tratamiento de las flebitis postinfusionales, sin embargo, deben de tenerse en cuenta una serie de parámetros que podrían influir en estas afirmaciones. Por un lado, se debe señalar que todos los pacientes han sido tratados con Solución de Burow en forma de fomentos fríos, pudiendo ser la propia temperatura un factor importante en la resolución del proceso inflamatorio7.
Por otra parte, se debe señalar que durante la elaboración de la Solución de Burow se producen varias reacciones químicas: precipitan sulfato cálcico e hidróxido de aluminio con desprendimiento de dióxido de carbono. Este complejo proceso, no permite conocer con exactitud cuál es la concentración final de aluminio que se obtiene por lo que no se puede relacionar la eficacia con una concentración concreta de principio activo18.
Además, hay que tener en cuenta que las tres moléculas utilizadas en su fabricación (ácido acético, sulfato de aluminio y ácido tartárico) tienen propiedades astringentes por lo que no se sabe a cuál de ellos se puede atribuir la eficacia de la formulación.
Los astringentes precipitan proteínas de la superficie celular sin afectar a la funcionalidad de las propias células, con lo que se origina una capa protectora de la mucosa y piel inflamada. A la vez se produce vasoconstricción, por tanto, disminuye la exudación inflamatoria y la secreción de las mucosas. Clásicamente los astringentes se clasifican en astringentes metálicos (plomo, aluminio y zinc) y orgánicos (taninos). Dentro de los metálicos, el más utilizado es el de aluminio y suele emplearse en la forma conocida con el nombre de solución de acetato de aluminio o Solución de Burow, estabilizada con ácido acético o más frecuentemente con ácido tartárico18. Llegado a este punto, debe indicarse que existe gran disparidad en la descripción y composición de la Solución de Burow en las diferentes farmacopeas y formularios consultados13,19,20,21, lo que todavía dificulta más la estandarización de esta formulación y posibles estudios de eficacia comparativos.
Por último, se deben de tener en cuenta las limitaciones del presente estudio, pues además del limitado número de pacientes incluidos, debido a la baja utilización de la formulación, no existe un grupo control que nos permita comparar la efectividad frente a otros protocolos de tratamiento o incluso frente a placebo, con o sin aplicación de frío local. Por tanto, para llegar a resultados concluyentes, sería necesaria la realización de estudios prospectivos, aleatorizados, doble ciego en los que se tengan en cuenta los parámetros previamente expuestos. La complejidad técnica para la realización de este tipo de estudios supone un esfuerzo difícilmente asumible en el campo de la formulación magistral por varios motivos, entre ellos la falta de interés en su financiación ya que no se trata de medicamentos comercializados. Por todo ello, estudios como el presente, a pesar de sus limitaciones, son importantes para aportar luz en un campo con tantas lagunas de conocimiento como es la valoración de la eficacia de las formulaciones magistrales.
Financiación: Para la realización del presente estudio no se ha contado con financiación pública ni privada, tratándose de investigación clínica independiente.
Agradecimientos: A.F-F al Instituto de Salud Carlos III (ISCIII) CM15/00188.
Conflicto de intereses: Los autores declaran no tener conflicto de intereses.
BIBLIOGRAFÍA
1. Carballo M, Llinas M & Feijoo M. Phlebitis in peripheral catheters (I). Incidence and risk factors. Rev Enferm Barc. Spain 27,25-32(2004).
2. Arias-Fernández L, Suérez-Mier B, Martínez-Ortega M del C & Lana A. Incidence and risk factors of phlebitis associated to peripheral intravenous catheters. Enferm Clínica Engl Ed. 27,79-86(2017).
3. Sugamura M, et al. Ototoxicity of Burow solution on the guinea pig cochlea. Am J Otolaryngol. 33,595-599 (2012).
4. Vecchio C & Frisinghelli A. Topically applied heparins for the treatment of vascular disorders: a comprehensive review. Clin Drug Investig. 28,603-614(2008).
5. dos Reis PED, Silveira RC de CP, Vasques CI & de Carvalho EC. Pharmacological interventions to treat phlebitis: systematic review. J Infus Nurs Off Publ Infus Nurses Soc. 32,74-79(2009).
6. Laszlo H. Cosmetic compositions comprising a native mineral substance for the treatment of phlebectasiae and process for preparing same. Patent US5091194 A (1988).
7. Pérez Melgarejo E. Flebitis postinfunsión en catéteres venosos periféricos: una actualización del arte. Horiz Enferm. 22,37-48(2011).
8. Grupo Farmacotecnia, Plan Normalizado de Trabajo para la elaboración de Agua de Burow. (2014).
9. Fernández-Ferreiro A, González-Barcia M, Otero Espinar FJ, Blanco Méndez J, Lamas MJ. Retos en la formulación magistral oftálmica. Farm Hosp. 40,1-2(2016).
10. Başal Y, et al. The Effects of Topical Burow’s and Castellani’s Solutions on the Middle Ear Mucosa of Rats. J Int Adv Otol. 11,253-256(2015).
11. Yamano T, Higuchi H, Nakagawa T & Morizono T. Ototoxicity of acetic acid on the guinea pig cochlea. J Otolaryngol. – Head Neck Surg. 44,(2015).
12. Infusion Nurses Society. Infusion Nurses Standard of Practice. J Intraven Nurs. 34,(2011).
13. Ministerio de Sanidad y Consumo. Formulario nacional; preparaciones oficinales y extemporáneas. (Comisión del Formulario Nacional, 2007).
14. Zheng GH, Yang L, Chen HY, Chu JF & Mei L. Aloe vera for prevention and treatment of infusion phlebitis. Cochrane Database Syst Rev. CD009162(2014).
15. C, R. T. & Mp, B. E. Treatment applied to post-perfusion phlebitis. Rev Enfermeria Barc. Spain 29,55-7,59-60 (2006).
16. Di Nisio M, Peinemann F, Porreca E & Rutjes AWS. Treatment for superficial infusion thrombophlebitis of the upper extremity. Cochrane Database Syst Rev. CD011015 (2015).
17. Gomez Sanchez MP, Parraga M & Romero Espino E. Estudio de la eficacia del agua de burow como reductor del edema y hematoma en extravasaciones durante hemodialisis. Comun Present. Al XXXVI Congr Nac. SEDEN (2011).
18. Ojeda A del P. Farmacia Galenica Especial. (Romargraf. 1969).
19. Agencia Española del Medicamento y Productos Sanitarios. Real Farmacopea Española. (2011).
20. British Pharmacopoeia. (European Directorate for the Quality of Medicines & HealthCare, 2016).
21. Convention U. S. P. Farmacopea de los Estados Unidos de América, USP. (United States Pharmacopeia, 2013).
____
Descargar artículo en PDF: Estudio de la Utilización, Eficacia y Seguridad de la Solución de Burow en el tratamiento de la flebitis
