Rev. OFIL 2017, 27;2:181-186
Fecha de recepción: 18/05/2016 – Fecha de aceptación: 20/06/2016
Martiarena Ayestarán A, Martínez Martínez C, Mínguez Cabeza AC
Farmacéutico Especialista en Farmacia Hospitalaria. Servicio de Farmacia. Hospital Universitario Araba (Sede Txagorritxu). Vitoria-Gasteiz (España)
____
Correspondencia:
Amaia Martiarena Ayestarán
C/Andrearriaga nº 1A 1ºB
20305 Irún (Guipúzcoa)
Correo electrónico: amaiamarti@hotmail.com
____
Resumen
Objetivo: Determinar el coste anual por episodio de tratamiento y el porcentaje de dosis media recibida según práctica clínica, de tocilizumab, etanercept, adalimumab o infliximab en artritis reumatoide (AR), espondilitis anquilosante (EA) y artritis psoriásica (Aps); así como, comparar estos resultados con el coste teórico y la dosis según ficha técnica.
Método: Estudio observacional retrospectivo. Se incluyeron pacientes con AR, EA y Aps procedentes de Reumatología que recibieron tratamiento con estas terapias al menos durante 1 año entre enero 2009–diciembre 2013 y fueron atendidos por el Servicio de Farmacia.
Resultados: Se estudiaron 251 episodios de tratamiento: 106 de adalimumab, 89 de etanercept, 38 de infliximab y 18 de tocilizumab. Adalimumab fue el medicamento más dispensado (42,2%). Hubo diferencias en el coste real anual entre las terapias subcutáneas: etanercept fue un 4,0% más barato que adalimumab en AR (p=0,012), un 12,2% más barato en EA (p=0,002) y un 18,2% más barato en Aps (p=0,001). La mediana del coste real anual fue menor que la mediana del coste teórico anual en todas las terapias excepto para infliximab. Infliximab fue la única terapia cuyo coste real en AR fue superior al coste teórico (p=0,140). En AR, los porcentajes de dosis media recibidas fueron inferiores a las teóricas para tocilizumab (86,7%), etanercept (93,1%) y adalimumab (89,3%), pero no para infliximab (114,2%).
Conclusiones: Etanercept, adalimumab y tocilizumab se emplearon en un porcentaje de dosis inferiores a las recomendadas en ficha técnica.
Palabras clave: Coste, tocilizumab, etanercept, adalimumab, infliximab, artritis reumatoide, espondilitis anquilosante, artritis psoriásica.
____
INTRODUCCIÓN
El creciente coste sanitario es una de las mayores preocupaciones de los países desarrollados, especialmente en aquellos donde la cobertura sanitaria es universal. La estimación de los costes directos de las enfermedades crónicas, como la Artritis Reumatoide (AR), Espondilitis Anquilosante (EA) o la Artritis Psoriásica (Aps), se ha convertido en una herramienta fundamental para realizar una adecuada provisión de los recursos sanitarios.
Las terapias biológicas constituyen uno de los avances más importantes en el tratamiento de distintos tipos de artritis crónicas y procesos inmuno-mediados de las últimas décadas. Su eficacia clínica ha sido ampliamente confirmada en ensayos clínicos y estudios observacionales, con un perfil de seguridad y tolerabilidad aceptables1. Dentro de las terapias biológicas se incluyen los antagonistas del factor de necrosis tumoral: infliximab, etanercept, adalimumab, golimumab y certolizumab pegol. Todos ellos tienen indicación en AR y, excepto certolizumab pegol, también están aprobados en Aps y EA. En la AR también han recibido su aprobación los biológicos abatacept, rituximab y tocilizumab.
No existen prácticamente estudios «head to head» entre los diversos biológicos, pero varios meta-análisis y revisiones sistemáticas demuestran una eficacia similar entre ellos, por lo que la elección de una terapia biológica se basa en la vía de administración, la pauta posológica, la seguridad, la preferencia y comorbilidades del paciente, así como en el coste económico2-4.
En la práctica clínica, una monitorización frecuente de la actividad de la enfermedad y un ajuste cuidadoso de las dosis administradas, ha demostrado ser más efectivo que un tratamiento de rutina5. Es necesario un tratamiento mantenido para minimizar el riesgo de recaída, pero en determinados casos, es posible la modificación de la posología2,5. Son claves por tanto, la gestión de las dosis y el gasto asociado a los mismos, buscando mejorar la eficiencia de los tratamientos. Los estudios observacionales permiten estimar la utilización real de los fármacos6. Por todo ello, teniendo en cuenta el elevado coste de las terapias biológicas, el objetivo de este estudio es determinar el coste anual por episodio de tratamiento biológico y el porcentaje de dosis media recibida según práctica clínica habitual de tocilizumab, etanercept, adalimumab o infliximab en AR, EA y Aps; así como, comparar estos resultados con el coste teórico y la dosis según ficha técnica.
MATERIAL Y MÉTODOS
Pacientes
Estudio observacional retrospectivo. Se incluyeron todos los pacientes (≥18 años) con AR, EA o Aps confirmada (según clasificación CIE-9), pertenecientes al Servicio de Reumatología de un hospital de tercer nivel, que recibieron tratamiento con etanercept, adalimumab, infliximab y/o tocilizumab al menos durante 1 año dentro del periodo enero 2009–diciembre 2013 y fueron atendidos por el Servicio de Farmacia. Se excluyeron golimumab, certolizumab pegol y abatacept por el bajo número de casos: 6, 3 y 0, respectivamente. Un mismo paciente pudo ser tratado con varias de las terapias biológicas analizadas durante el estudio. Así mismo, debían cumplir estar en monoterapia con uno de estos biológicos o en combinación con fármacos antirreumáticos modificadores de la enfermedad (FAME) sintéticos, antinflamatorios no esteroides (AINE), corticoides y/o analgésicos. Para las terapias con posología peso-dependiente (infliximab o tocilizumab) era imprescindible tener el peso del paciente. Además, para confirmar el diagnóstico, los pacientes con AR debían cumplir los criterios de clasificación del American College of Rheumatology; los pacientes con EA, los criterios de clasificación de Nueva York modificados/ASAS; y los pacientes con Aps, los criterios de clasificación CASPAR.
Los datos se recogieron a partir de la historia clínica electrónica y del programa de atención farmacéutica de la consulta del Servicio de Farmacia.
Variables
Se estudiaron características demográficas (género y edad); características clínicas (indicación farmacoterapéutica); coste anual (euros) por episodio de tratamiento biológico y el porcentaje de dosis media recibida de cada medicamento en la práctica clínica de cada patología.
Se obtuvo un dato de dosis (miligramos) y de coste (euros) para cada episodio de tratamiento. A partir de ellos, se obtuvo la mediana por terapia biológica en cada indicación farmacoterapéutica.
El tiempo real de tratamiento con cada fármaco, se determinó teniendo en cuenta la primera y la última fecha de dispensación, y los periodos de interrupción temporal de cada caso.
Para el cálculo de la desviación entre la dosis media real con respecto a la recomendada en ficha técnica, se consideró el valor 100% como dosis total en condiciones teóricas. Se comparó este dato teórico con la dosis total real recibida expresada en porcentaje.
Este estudio obtuvo la autorización del Comité Ético de Investigación Clínica (CEIC) del Hospital Universitario Araba. Además, fue clasificado por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) como «Estudio Posautorización con Otros Diseños diferentes al de seguimiento prospectivo» (EPA-OD).
Análisis estadístico
Los datos se analizaron mediante el paquete estadístico SPSS v17.0. Se realizó un análisis descriptivo del coste anual de cada episodio de tratamiento biológico y del porcentaje de dosis media recibida según práctica clínica habitual de cada patología. Con la idea de ver si había diferencias, se comparó esta información con el coste teórico y la dosis según ficha técnica, presentando los resultados con la mediana.
Para determinar la normalidad de las variables cuantitativas se empleó la prueba de bondad de ajuste Kolmogorov-Smirnov. Se consideraron significativos los valores de p<0,05.
Dado que no se cumplió la normalidad, se aplicaron las pruebas no paramétricas Test H de Kruskall-Wallis para determinar si había o no diferencias entre los tratamientos biológicos en las distintas patologías estudiadas, y el Test U de Mann-Whitney para hacer las comparaciones dos a dos de estas terapias.
Para el estudio de la posible asociación de datos apareados en variables cuantitativas, se utilizó la prueba no paramétrica de Wilcoxon.
RESULTADOS
Se estudiaron 251 episodios de tratamiento: 106 de adalimumab, 89 de etanercept, 38 de infliximab y 18 de tocilizumab. El conjunto de los episodios correspondieron a 236 pacientes. La descripción de cada terapia biológica se detalla en la tabla 1.
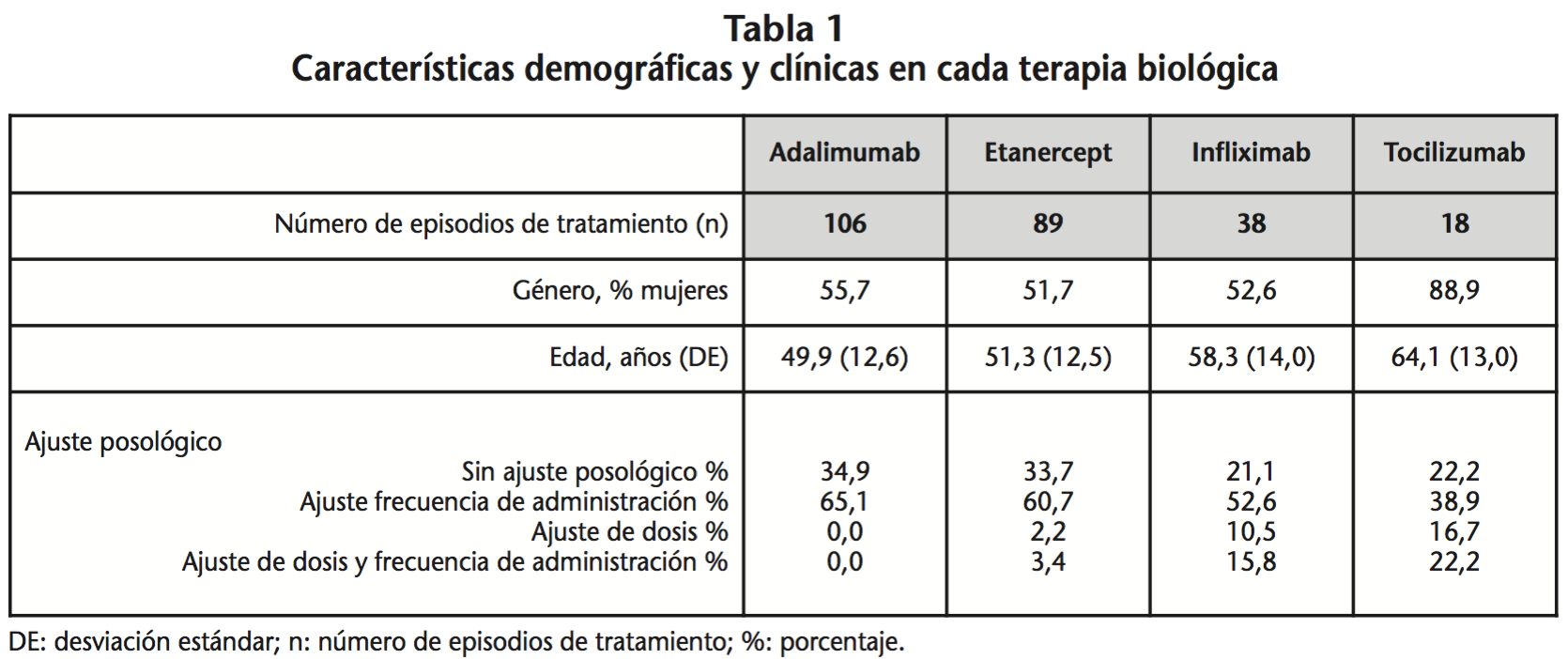
Adalimumab fue el medicamento más dispensado tanto por patología como en su conjunto. El 59,4% de los episodios de tratamiento analizados fueron para tratar AR, el 23,5% para EA y el 17,1% para tratar Aps (Tabla 2). En AR, los valores promedio del porcentaje de dosis recibidas eran inferiores a las especificadas en ficha técnica para todas las terapias, excepto para infliximab. En el resto de patologías, el porcentaje de dosis recibida fue inferior a la teórica en todos los casos, incluido infliximab. Sólo en AR, estas diferencias eran estadísticamente significativas. En esta patología, infliximab fue la terapia que más se alejó de la posología establecida en ficha técnica y etanercept la que más se aproximó a ella. En EA, infliximab fue también la terapia que más se alejó de la posología teórica pero adalimumab fue la que más se acercó a ella. En Aps en cambio, etanercept fue la terapia que más se desvió de la posología teórica y adalimumab la que más se acercó a ella (Tabla 3).
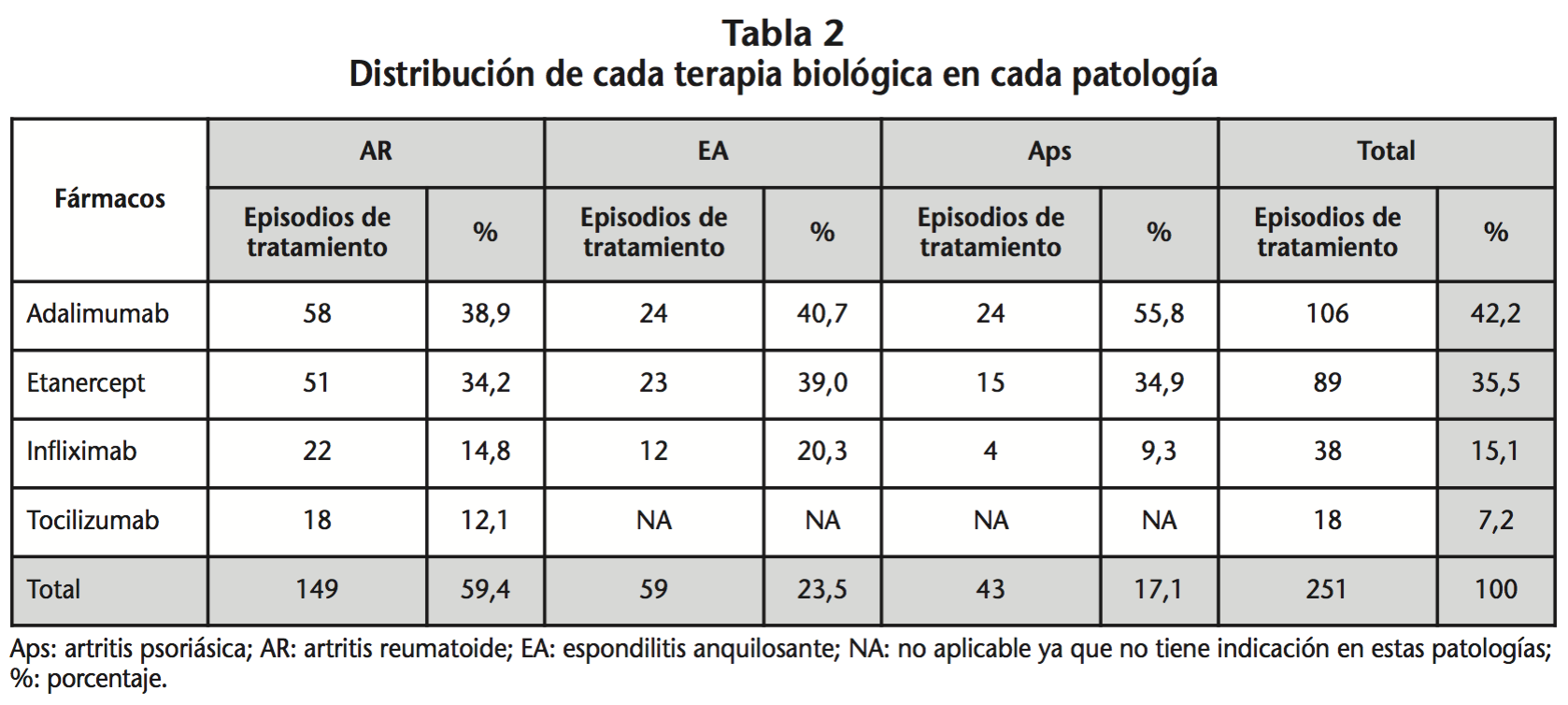
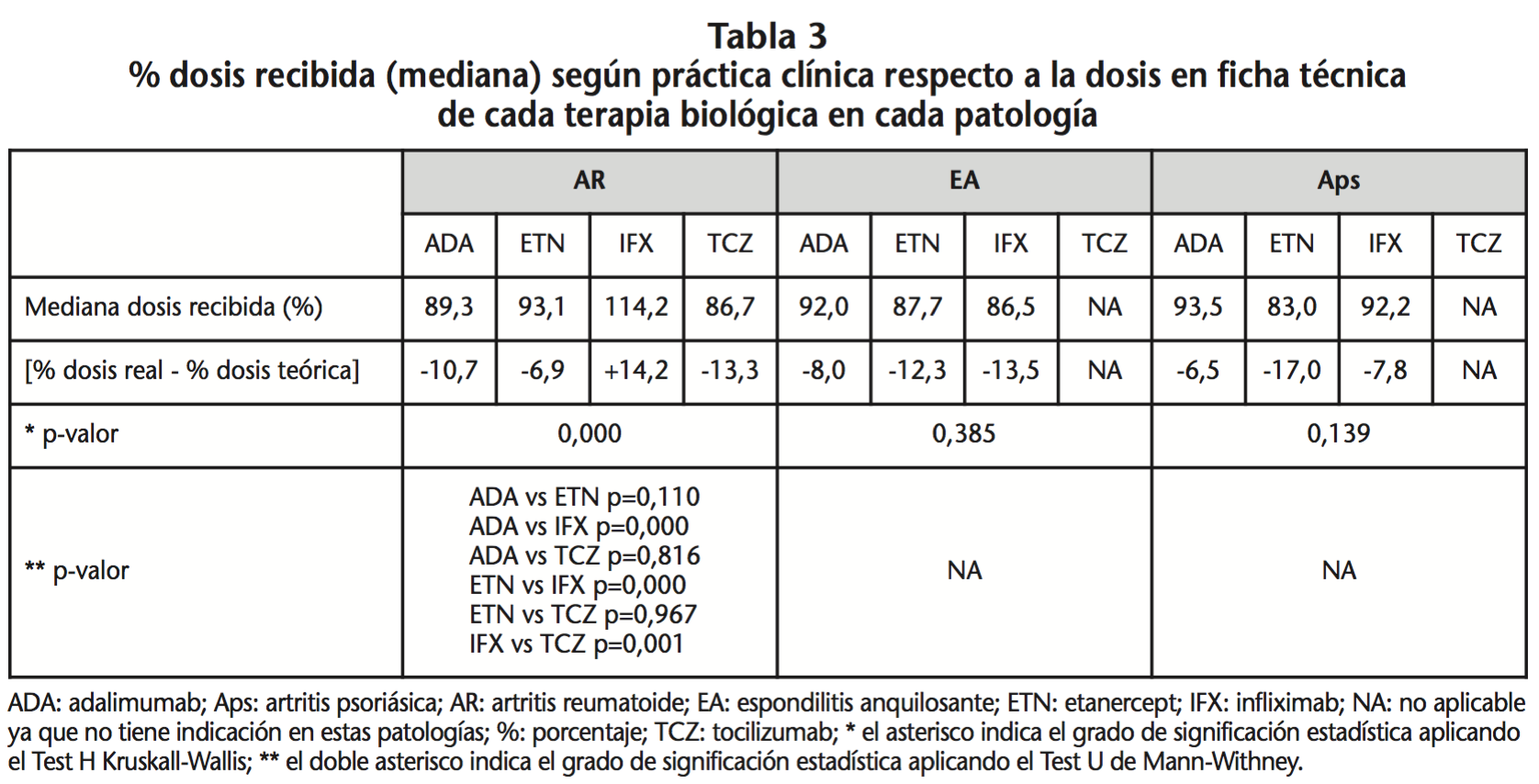
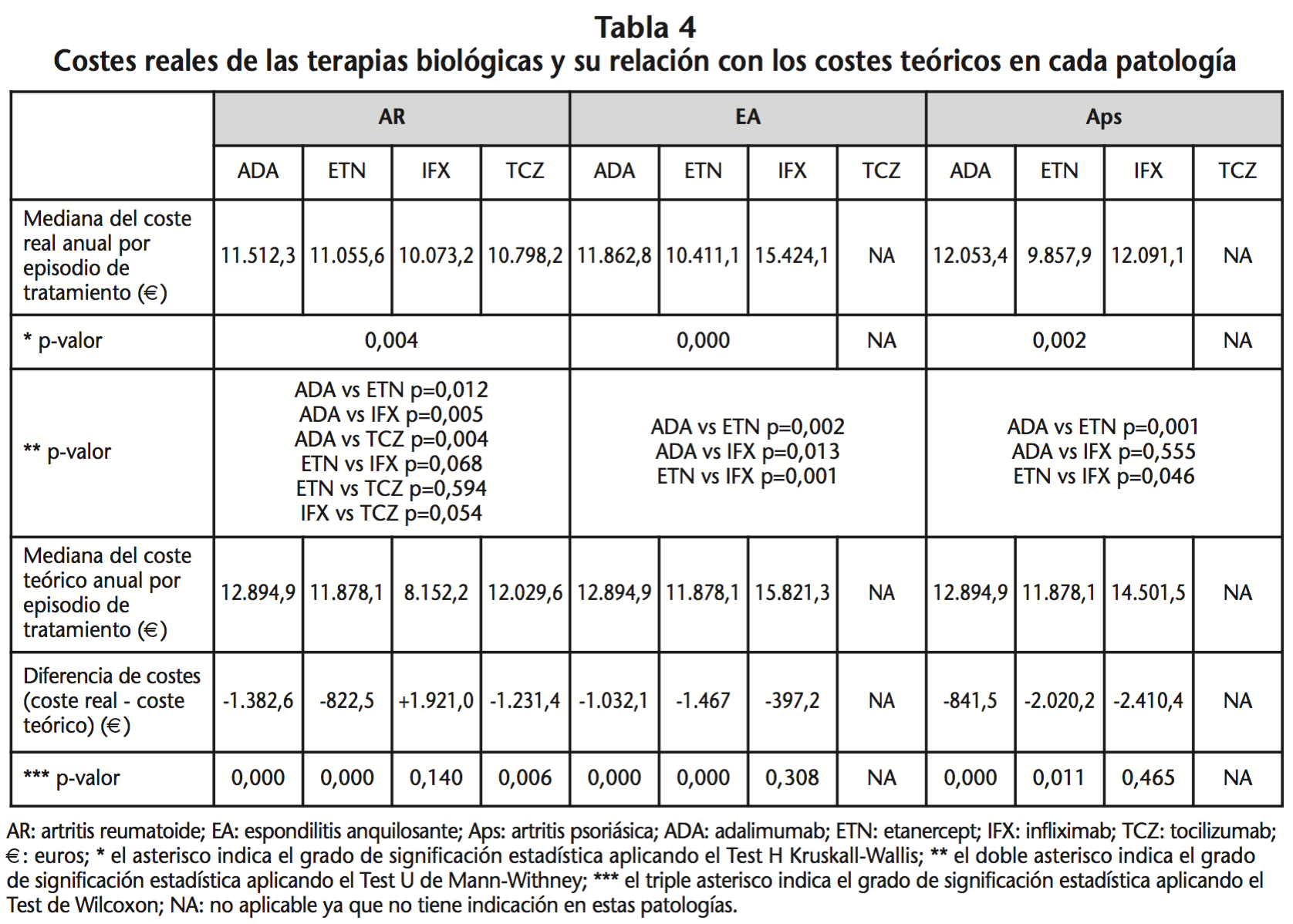
Los resultados del coste anual real de cada episodio de tratamiento y su relación con el coste teórico correspondiente se describen en la tabla 4. En ella se observa que hubo diferencias en el coste estadísticamente significativas entre las distintas terapias en todas las patologías. Además, la mediana del coste real anual por episodio de tratamiento fue menor, con diferencias estadísticamente significativas, respecto a la mediana del coste teórico anual en todas las terapias con indicación farmacoterapéutica (adalimumab, etanercept, tocilizumab) excepto para infliximab. Infliximab fue la única terapia cuyo coste real fue superior al coste teórico, cumpliéndose únicamente en AR. Pero, a su vez en esta patología, infliximab fue la terapia más barata (su coste real anual por episodio de tratamiento fue inferior al del resto de terapias biológicas). Por el contrario, adalimumab fue la terapia más cara, con diferencias estadísticamente significativas al compararlo con los demás biológicos. Destaca la diferencia significativa en coste (p=0,012) entre adalimumab y etanercept, con un ahorro con etanercept de 456,7€ por año frente a su homólogo de administración subcutánea adalimumab. En relación a las terapias intravenosas, infliximab fue más barata que tocilizumab, pero las diferencias no eran significativas. En EA y Aps en cambio, la terapia más costosa por año de tratamiento fue infliximab. Entre los fármacos subcutáneos, etanercept fue 1.451,7€ más barato que adalimumab en EA y 2.195,5€ más barato que adalimumab en Aps, siendo las diferencias estadísticamente significativas.
DISCUSIÓN
El presente estudio analizó, según práctica clínica habitual de un hospital de tercer nivel, el coste real anual por episodio de tratamiento biológico y el porcentaje de dosis recibida de adalimumab, etanercept, infliximab y tocilizumab en AR, EA y Aps.
En este análisis retrospectivo se observó que las terapias biológicas estudiadas, en más de la mitad de los casos, se emplearon para tratar a mujeres con AR, EA o Aps, observación descrita también en otros estudios7,8. Estas terapias se utilizaron, en más de la mitad de los casos, para tratar AR, que se ajusta a lo indicado en la bibliografía7,9.
Adalimumab fue el medicamento más dispensado tanto por patología como en su conjunto. Sin embargo, al comparar el coste real anual por episodio de tratamiento con adalimumab frente a su homólogo subcutáneo etanercept en cada una de las patologías, hubo diferencias estadísticamente significativas en el coste a favor de etanercept. Etanercept fue un 4,0% más barato que adalimumab en AR, un 12,2% más barato en EA y un 18,2% más barato que adalimumab en Aps.
La diferencia de la dosis real respecto a la dosis recomendada en ficha técnica, impacta directamente en el coste del tratamiento biológico9. Generalmente, estos pacientes son tratados inicialmente con las dosis recomendadas en la ficha técnica (según los resultados de ensayos clínicos fase III) pero, cuál es la actitud a seguir en presencia de una remisión sostenida, no está tan claro. Existen datos en la literatura que demuestran que el abandono de estas terapias produce una recidiva clínica de la enfermedad en la mayoría de los casos10,11. No obstante, consensos y opiniones de expertos2,4,7,12-15 sobre el manejo de estas terapias biológicas en enfermedades reumáticas sugieren que, es factible modificar la posología de estos fármacos hasta la mínima dosis eficaz. La idea es que algunos pacientes, quizá tratados demasiado intensivamente con las dosis estándar, puedan obtener el mismo beneficio con una dosis menor. Prueba de ello es el ensayo PRESERVE16, donde a los pacientes con AR de moderada actividad, se les disminuyó la dosis de etanercept (25 mg/semana), y se comprobó que se mantenía la efectividad clínica. Otros estudios http://www.reumatologiaclinica.org/es/reduccion-dosis-terapias-biologicas-enfermedades/articulo/90268009/ – bib8 también afirman que, los ajustes posológicos de las terapias biológicas en la práctica clínica, no suponen pérdidas significativas de control de la enfermedad8,14. Del mismo modo, pacientes con EA en remisión pueden reducir la dosis de etanercept o incrementar el intervalo de administración, consiguiendo mantener la efectividad de la terapia13,17,18. En el caso de la Aps, se ha demostrado que al alargar el intervalo posológico de adalimumab a cada 4 semanas, se consigue mantener en remisión a estos pacientes19.
En nuestro estudio, los valores medios del porcentaje de dosis recibidas fueron inferiores a las teóricas para todas las terapias excepto para infliximab, en el caso de la AR. Concretamente, supusieron una reducción del 10,7% para adalimumab, del 6,9% para etanercept y del 13,3% para tocilizumab. En el caso de infliximab, hubo un incremento de dosis del 14,2%, pero en dicha enfermedad, resultó ser el menos costoso por episodio de tratamiento y año. Este exceso de dosis descrita también en la literatura20,21, puede estar relacionado con el escalado de dosis, establecido ya en el momento de iniciar el estudio (el escalado de dosis podría estar relacionado con la reducción de actividad por presencia de anticuerpos neutralizantes anti-infliximab)22,23. Para las patologías EA y Aps, el porcentaje de dosis medias recibidas fueron inferiores al 100% en todas las terapias (infliximab, adalimumab y etanercept).
Se confirma por tanto que, en la práctica clínica de nuestro hospital es habitual ajustar la posología, siendo lo más típico ajustar la frecuencia de administración de los agentes biológicos tal y como se describe en la literatura13-15.
En AR, el ajuste posológico realizado en adalimumab, etanercept o tocilizumab, indujo una reducción estadísticamente significativa del coste respecto al coste teórico. De igual modo, en EA y Aps, el ajuste posológico en adalimumab y etanercept produjo una reducción estadísticamente significativa del coste respecto al coste teórico. Estas afirmaciones no se cumplieron para infliximab en ninguna de las enfermedades, ya que el ajuste posológico por exceso en AR y por defecto en EA y Aps, no provocaron diferencias estadísticamente significativas entre el coste real y el coste teórico.
Entre las limitaciones del estudio cabe mencionar que, se trata de un estudio observacional unicéntrico de práctica clínica, con un número relativamente reducido de casos por patología, lo cual hace que los resultados sólo puedan interpretarse en la realidad del hospital del estudio. Por otra parte cabe indicar que, no se diferenció entre pacientes nuevos y pacientes en continuación de tratamiento con infliximab, donde hay diferencias en el régimen posológico, lo cual ha podido influir en el porcentaje de dosis recibida y en consecuencia, en el coste real de infliximab en cada patología. Finalmente expresar que, la falta de adherencia al tratamiento ha podido influir en el dato del porcentaje de dosis recibida dado que afecta a la frecuencia de administración y por tanto, a la dosis total recibida.
En este estudio se demuestra que el coste real anual debe tenerse en cuenta a la hora de seleccionar un FAME biológico, ya que múltiples revisiones sistemáticas han concluido que la eficacia de estas terapias es similar en el tratamiento de estas patologías y por tanto, la eficiencia debe ser una de las claves en su selección.
CONCLUSIONES
En este estudio se demuestra que etanercept, adalimumab y tocilizumab se emplean en un porcentaje de dosis inferiores a las recomendadas en ficha técnica en todas las patologías excepto para infliximab en artritis reumatoide. Se manifiesta además que, infliximab es la única terapia cuyo coste real es superior al coste teórico, cumpliéndose únicamente en artritis reumatoide. Pero, a su vez en esta enfermedad, infliximab es la terapia más barata (su coste real anual por episodio de tratamiento es inferior al del resto de terapias biológicas).
Conflicto de intereses: Los autores declaran no tener conflictos de intereses.
BIBLIOGRAFÍA
1. Furst DE, Keystone EC, Braun J, Breedveld FC, Burmester GR, De Benedetti F, et al. Updated consensus statement on biological agents for the treatment of rheumatic diseases, 2011. Ann Rheum Dis. 2012;71 Suppl 2:i2-45.
2. Sanmartí R, García-Rodríguez S, Álvaro-Gracia JM, Andreu JL, Balsa A, Cáliz R, et al. 2014 update of the Consensus Statement of the Spanish Society of Rheumatology on the use of biological therapies in rheumatoid arthritis. Reumatol Clin. 2015;11:279-294.
3. Gibson J, Harris H, McLaren S. Reduced dose and frequency of Anti-TNF therapy in rheumatic diseases. Ann Rheum Dis. 2012;71 Suppl 3:103.
4. Juanola X, Zarco P, Sanz J, Muñoz S, Mulero J, Linares LF, et al. Consensus Statement of the Spanish Society of Rheumatology on the management of biologic therapies in spondyloarthritis except for psoriatic arthritis. Reumatol Clin. 2011;7:113-123.
5. Bakker MF, Jacobs JWG, Verstappen SMM, Bijlsma JWJ. Tight control in the treatment of rheumatoid arthritis: efficacy and feasibility. Ann Rheum Dis. 2007;66 Suppl 3:iii56-60. Erratun in: Ann Rheum Dis.2008;67(1):140.
6. Rubio-Terrés C, Ordovás JP, Pla R, Martínez C, Sánchez MJ, Rosado MA. Use and cost of biological disease-modifying anti-rheumatic drugs in Spain (PRAXIS study). Farm Hosp. 2007;31:78-92.
7. Schabert VF, Watson C, Gandra SR, Goodman S, Fox KM, Harrison DJ. Annual costs of tumor necrosis factor inhibitors using real-world data in a commercially insured population in the United States. J Med Econ. 2012;15(2):264-275.
8. Ramírez-Herráiz E, Escudero-Vilaplana V, Alañón-Plaza E, Trovato-López N, Herranz-Alonso A, Morell-Baladrón A, et al. Efficiency of adalimumab, etanercept and infliximab in rheumatoid arthritis patients: dosing patterns and effectiveness in daily clinical practice. Clin Exp Rheumatol. 2013;31:559-565.
9. Schabert VF, Watson C, Joseph GJ, Iversen P, Burudpakdee C, Harrison DJ. Costs of tumor necrosis factor blockers per treated patient using real-world drug data in a managed care population. J Manag Care Pharm. 2013;19(8):621-630.
10. Brocq O, Millaseau E, Albert C, Grisot C, Flory P, Roux CH, et al. Effect of discontinuing TNFalpha antagonist therapy in patients with remission of rheumatoid arthritis. Joint Bone Spine. 2009;76(4):350-355.
11. Tanaka Y, Hirata S, Kubo S, Fukuyo S, Hanami K, Sawamukai N, et al. Discontinuation of adalimumab after achieving remission in patients with established rheumatoid arthritis: 1-year outcome of the HONOR study. Ann Rheum Dis. 2015;74(2):389-395.
12. González-Álvaro I, Martínez-Fernández C, Dorantes-Calderón B, García-Vicuña R, Hernández-Cruz B, Herrero-Ambrosio A, et al. Spanish Rheumatology Society and Hospital Pharmacy Society Consensus on recommendations for biologics optimization in patients with rheumatoid arthritis, ankylosing spondylitis and psoriatic arthritis. Rheumatology (Oxford). 2015;54(7):1200-1209.
13. Lee J, Noh JW, Hwang JW, Oh JM, Kim H, Ahn JK, et al. Extended dosing of etanercept 25 mg can be effective in patients with ankylosing spondylitis: a retrospective analysis. Clin Rheumatol. 2010;29(10):1149-1154.
14. Inciarte-Mundo J, Hernández MV, Rosario V, Ruiz-Esquide V, Cabrera-Villalba S, Ramírez J, et al. Reduction of biological agent dose in rheumatic diseases: descriptive analysis of 153 patients in clinical practice conditions. Reumatol Clin. 2014;10(1):10-16.
15. Smolen JS, Landewe R, Breedveld FC, Dougados M, Emery P, Gaujoux-Viala C, et al. EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease-modifying antirheumatic drugs. Ann Rheum Dis. 2010 (6);69:964-975. Erratun in: Ann Rheum Dis. 2011;70(8):1519.
16. Smolen JS, Nash P, Durez P, Hall S, Ilivanova E, Irazoque-Palazuelos F, et al. Maintenance, reduction, or withdrawal of etanercept after treatment with etanercept and methotrexate in patients with moderate rheumatoid arthritis (PRESERVE): a randomised controlled trial. Lancet. 2013;381(9870):918-929.
17. Navarro-Compan V, Moreira V, Ariza-Ariza R, Hernández-Cruz B, Vargas-Lebron C, Navarro-Sarabia F. Low doses of etanercept can be effective in ankylosing spondylitis patients who achieve remission of the disease. Clin Rheumatol. 2011;30(7):993-996.
18. Cantini F, Niccoli L, Cassara E, Kaloudi O, Nannini C. Duration of remission after halving of the etanercept dose in patients with ankylosing spondylitis: a randomized, prospective, long-term, follow-up study. Biologics. 2013;7:1-6.
19. Cantini F, Niccoli L, Cassara E, Kaloudi O, Nannini C. Sustained maintenance of clinical remission after adalimumab dose reduction in patients with early psoriatic arthritis: a long-term follow up study. Biologics. 2012;6:201-206.
20. Ollendorf DA, Massarotti E, Birbara C, Burgess SM. Frequency, predictors, and economic impact of upward dose adjustment of infliximab in managed care patients with rheumatoid arthritis. J Manag Care Pharm. 2005;11(5):383-393.
21. Gilbert TD Jr, Smith D, Ollendorf DA. Patterns of use, dosing, and economic impact of biologic agent use in patients with rheumatoid arthritis: a retrospective cohort study. BMC Musculoskeletal Disord. 2004;5(1):36.
22. Pascual-Salcedo D, Plasencia C, Ramiro S, Nuño L, Bonilla G, Nagore D, et al. Influence of immunogenicity on the efficacy of long-term treatment with infliximab in rheumatoid arthritis. Rheumatology (Oxford). 2011;50(8):1445-1452.
23. Garces S, Demengeot J, Benito-Garcia E. The immunogenicity of anti-TNF therapy in immune-mediated inflammatory diseases: a systematic review of the literature with a meta-analysis. Ann Rheum Dis. 2013;72(12):1947-1955.
____
Descargar artículo completo en PDF: Estudio del coste de las terapias biológicas en patologías reumáticas según práctica clínica de un hospital
