Castro Bolívar JF1, Barrios Araujo AM2, Nigrinis Pérez AI3
1 Docente de la Facultad de Química y Farmacia. Universidad del Atlántico. Barranquilla (Colombia)
2 Farmacéutica Asistencial. Hospital Regional Manuela Beltrán. Socorro. Santander (Colombia)
3 Jefe de Local Cruz Verde 384 Santiago de Chile (Chile)
Fecha de recepción: 14/02/2022 – Fecha de aceptación: 01/03/2022
Correspondencia: Jose Francisco Castro Bolívar w Carrera 45 No. 80-82 Edificio Panorama 80 Apto 202 w Barranquilla-Atlántico (Colombia)
josecastro@mail.uniatlantico.edu.co
____
RESUMEN
Objetivo: Estudiar el uso de los medicamentos con indicaciones off-label en pediatría intrahospitalarios en una clínica de tercer nivel de la ciudad de Barranquilla-Atlántico.
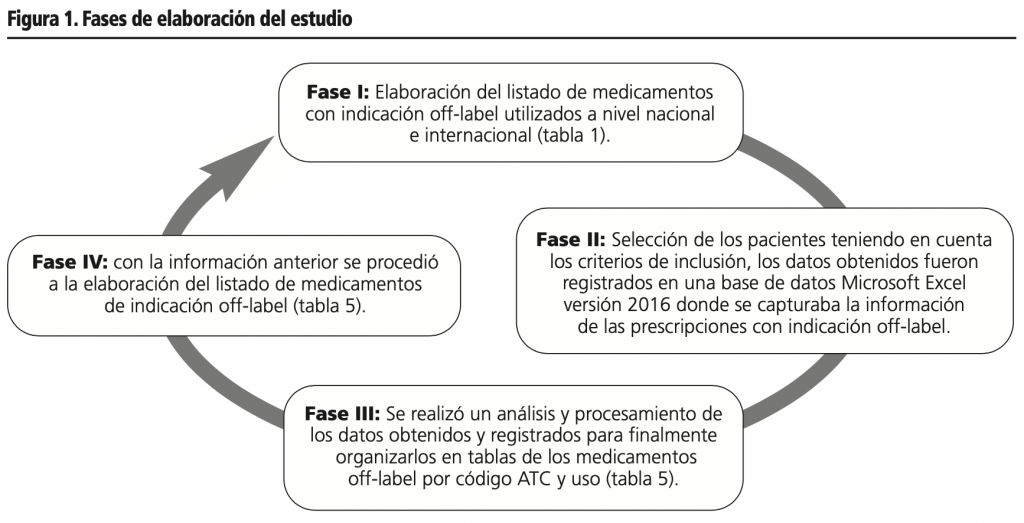
Metodología: El diseño empleado en este estudio fue observacional, donde se obtuvo la frecuencia de las prescripciones y administración de los medicamentos con indicación no aprobada. El estudio se realizó en cuatro fases, la primera fue la búsqueda sistemática de medicamentos basados en la literatura científica, en la segunda fase se seleccionaron los pacientes basados en los criterios de inclusión del estudio, la tercera fase se realizó el análisis y procesamiento de los datos y la cuarta fase fue la construcción del listado de medicamentos off-label.
Resultados: Se realizó un seguimiento a 204 pacientes de los pabellones Caribe y UCI Pediátrica, que cumplieran con los criterios de inclusión, durante el periodo de tres meses de estudio. Se identificaron 386 medicamentos con indicación off-Label en 765 prescripciones durante el periodo de estudio, identificándose al menos un medicamento prescrito con uso no incluido o indicación off-label. Según su acrónimo a nivel de la clasificación ATC, los pertenecientes a los tres niveles o grupos más destacados fueron los pertenecientes al grupo J con un 26,94%, grupo N 20,98% y el grupo C con un 16,68% de las prescripciones.
Conclusiones: El mayor porcentaje de la población durante el periodo de estudio fue el primer año de vida. Los medicamentos con mayor número de prescripciones fueron el meropenem, la dipirona, salbutamol, espironolactona, enalapril, bromuro de ipatropio, la gentamicina, caspofungina, propanolol y tramadol.
Palabras clave: Off-label, pediatría, indicación no aprobada, uso no incluido.
Study of the use of medications with off-label indication in pediatric patients intrahospital in a third level clinic in the city of Barranquilla
SUMMARY
Objective: To study the use of drugs with off-label indications in in-hospital pediatric patients in a third-level Clinic in the city of Barranquilla-Atlántico.
Methodology: The design used in this study was observational, where the frequency of prescriptions and administration of drugs with an unapproved indication was obtained. The study was carried out in four phases, the first was the systematic search for drugs based on the scientific literature, in the second phase the patients were selected based on the inclusion criteria of the study, the third phase was the analysis and processing of the data and the fourth phase was the construction of the list of off-label drugs.
Results: 204 patients from the Caribe and Pediatric ICU wards, who met the inclusion criteria, were followed during the three (3) month study period. 386 drugs with off-label indication were identified in 765 prescriptions during the study period, identifying at least one drug prescribed with use not included or off-label indication. According to its acronym at the level of the ATC classification, those belonging to the three most prominent levels or groups were those belonging to group J with 26.94%, group N 20.98% and group C with 16.68% of the prescriptions.
Conclusions: The highest percentage of the population during the study period was the first year of life. The medications with the highest number of prescriptions were meropenem, dipyrone, salbutamol, spironolactone, enalapril, ipatropium bromide, gentamicin, caspofungin, propanolol and tramadol
Key words: Off-label, pediatrics, indication not approved, use not included.
____
INTRODUCCIÓN
El concepto de uso off-label, o medicamentos de uso no incluido en el registro sanitario (UNIRS). Es el uso de medicamentos bajo condiciones no autorizadas por las agencias reguladoras de medicamentos para su comercialización, lo cual se debe a que estos medicamentos no han sido sometidos a ensayos clínicos de seguridad y eficacia. Los pacientes pediátricos suelen ser excluidos de los ensayos clínicos para el desarrollo de nuevos fármacos que, en ocasiones son usados de forma empírica. Este estudio evaluó las prescripciones para pacientes pediátricos hospitalizados.
El medicamento deberá estar sujeto a una solicitud de autorización de comercialización, o sometido a ensayos clínicos. El utilizar un medicamento en condiciones distintas a las señaladas en su ficha técnica autorizada, es conocido como off-label1.
En Colombia podemos encontrar las razones del uso de off-label como:
• Las prioridades de investigación están enfocadas a adultos.
• Consideraciones éticas y pocos estudios en niños que dan poca evidencia que no permiten tener resultados extrapolados a los resultados con adultos por muchas diferencias como los metabolismos y las enfermedades.
• En niños existe la necesidad de asegurar que los medicamentos sean seguros, eficaces y con dosis claramente identificadas.
En una investigación realizada en el año 2013 fueron reportadas 2.220 prescripciones con indicación off-label en pacientes pediátricos en un hospital de Bogotá2.
En Colombia, el medicamento que tenga un uso no incluido en el registro sanitario, con evidencia de eficacia y seguridad que salvaguarde la vida, es nominado como UNIRS, para su evaluación y posterior aprobación por el Instituto Nacional de Vigilancia de Medicamentos y Alimentos (INVIMA). El proceso lo realiza la Sociedad Científica, ante el Ministerio de Salud y Protección Social (MPS) o por parte de este último. Culminado el proceso de revisión de oficio, algún titular no está de acuerdo con la inclusión del uso en su registro sanitario, el MPS podrá solicitar la modificación del registro sanitario3.
El INVIMA en 2015 dio a conocer una guía para la presentación de modificaciones al registro sanitario para la dirección de medicamentos y productos biológicos, ASS-RSA-FM062. Se debe anexar reporte de la información científica, estudios clínicos, información generada por agencias regulatorias internacionales o documento técnico que justifique de manera sólida los cambios solicitados4.
Un elevado porcentaje de los medicamentos que se utilizan en niños a nivel internacional no están aprobados para su uso, por razones éticas, legales y económicas que justifican el no realizar ensayos clínicos, la industria farmacéutica supone una cuota de mercado pequeña para la mayor parte de los medicamentos off-label. Lo anterior da como resultado la ausencia de información de la eficacia y seguridad, por lo que se deben extrapolar los datos procedentes de estudios realizados en adultos, en el año 1968 Harry C. Shirkey los denomino “huérfanos terapéuticos” por la falta de información científica5.
El presente estudio surge como necesidad insatisfecha de estudiar el uso de los medicamentos con indicaciones off-label en pacientes pediátricos intrahospitalarios en una clínica de la ciudad de Barranquilla-Atlántico para tomar las medidas correctivas del uso de estos en la institución, a nivel pediátrico versus los medicamentos utilizados como off-label registrados en la literatura científica. La poca información científica para el uso de medicamentos de indicaciones no aprobadas; la ausencia de claridad y congruencia en las decisiones institucionales podría ocasionar problemas de acceso a ciertos medicamentos y riesgos para la salud2.
MATERIALES Y MÉTODOS
El estudio fue de tipo descriptivo-propositivo de corte longitudinal. La población objeto fue de edades entre 1 día a 18 años ingresados durante los meses de abril a julio de 2020. Criterios de inclusión: pacientes de 1 día de nacido hasta 18 años, agrupados por grupos etarios, poseer prescritos medicamentos de uso off-label para tratar sus problemas de salud. Criterios de exclusión: pertenecientes a pabellones diferentes al pediátrico y UCI pediátrica.
En la figura 1 se describen las fases de elaboración del estudio.
RESULTADOS Y DISCUSIÓN
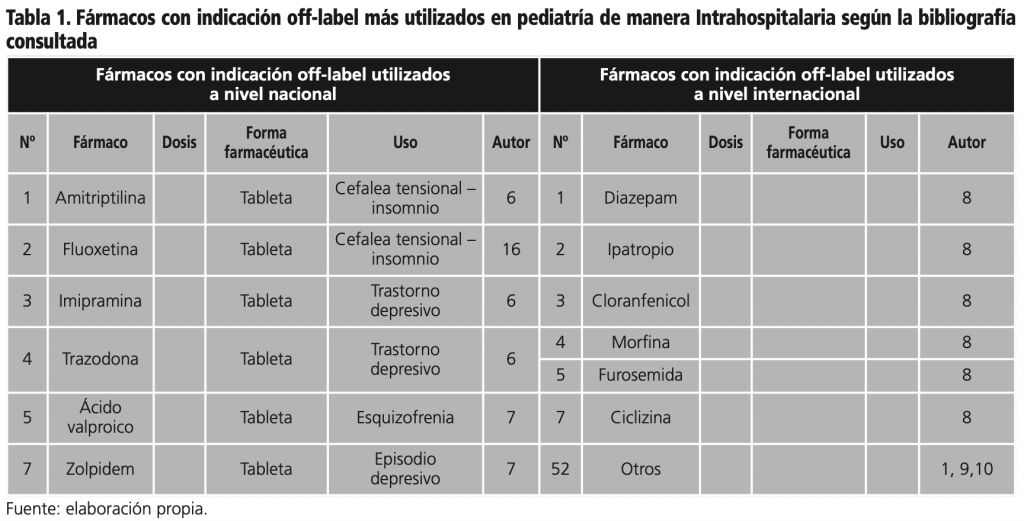
Para el análisis se identificaron a nivel nacional 7 medicamentos con indicación off-label6,7 en su mayoría antipsicóticos y a nivel nacional 52 medicamentos1,8-10, para un total de 59 medicamentos con una diferencia significativa, lo que muestra una notable deficiencia de estudios sobre el uso de los medicamentos con indicación off-label en Barranquilla-Colombia en pacientes pediátricos.
En el periodo de estudio ingresaron 497 pacientes pertenecientes al pabellón Caribe y UCI Pediátrica, de los cuales 204 (41,04%) cumplieron con los criterios de inclusión. Con predomino del género masculino (54,41%) y femenino (45,59%), con edades entre 1 día y 1 año. La población de Fletscher-Covaleda PM et al.11, realizado en la ciudad de Bogotá en el 2017 fue de 420 pacientes, incluyó prescripciones de psicofármacos, los pacientes de los grupos etarios fueron los menores de 14 años y mayores de 45 años. El estudio de E. Blanco et al.12, el grupo de edades evaluado fue de 0 a 14 años y el número de la población fue el doble.
El número de pacientes incluidos en este estudio fue 4,25 veces mayor al reportado por López Martínez et al.10, que incluyeron pacientes ingresados en la UCI neonatal, clasificados como prematuros y a término. Al igual que los datos obtenidos por Morales Carpi et al.5 en el año 2008, que estudiaron pacientes pediátricos con edades entre 0 y 14 años.
La tabla 2 relaciona grupos etarios con mayor inclusión durante el periodo de estudio, el primer año de vida lactante menor con 82 (40,19%) de la población, seguido de los pertenecientes a los primeros 28 días de vida (neonato) con 47 (23,03%) y finalmente las edades entre los 3 y 6 años o preescolar con un 25 (12,25%) de la población en estudio.
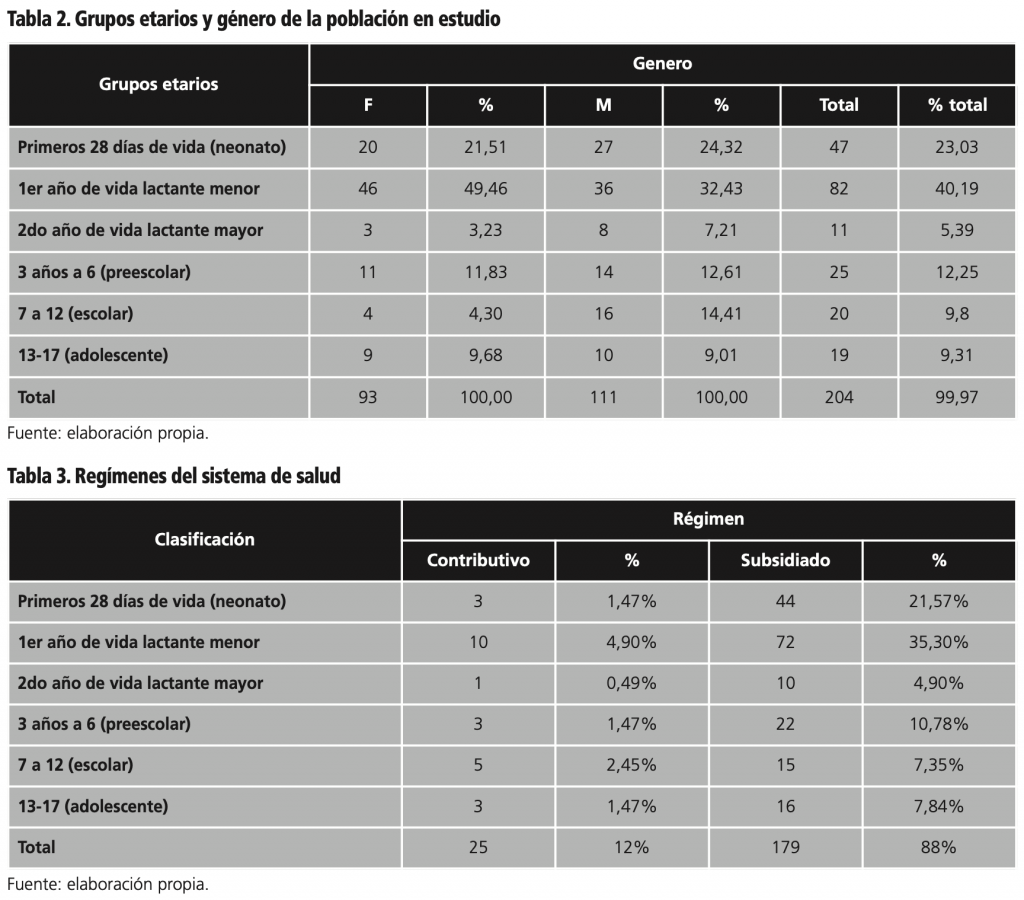
La tabla 3 evidencia el tipo de régimen, destacándose el subsidiado con 179 (88%) de la población en estudio y 25 (12%) equivalente al régimen contributivo. En los estudios referenciados ninguno incluyó el tipo de régimen.
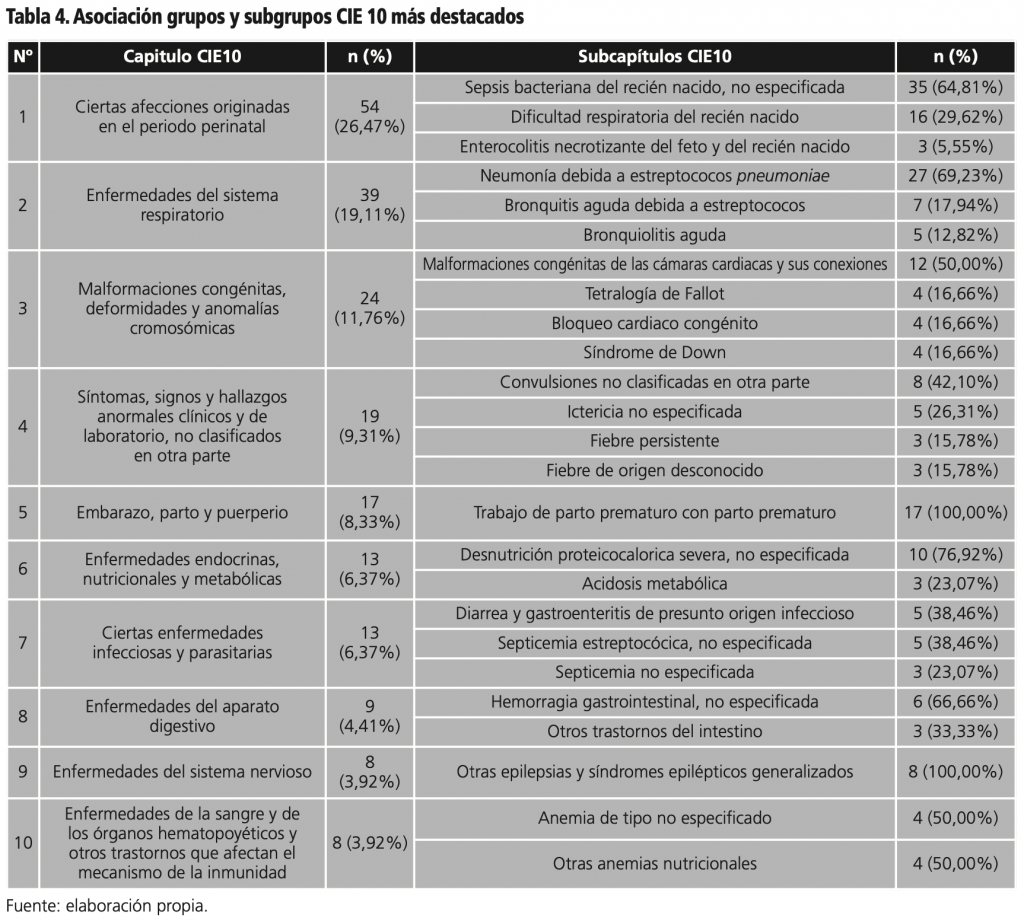
Los diagnósticos se agruparon por el código CIE-10 resultando 371 problemas de salud diferentes entre capítulos y subcapítulos, se detectaron pacientes con un mínimo de 1 y máximo de 4 diagnósticos de ingreso en cada uno de los 204 pacientes.
La tabla 4 muestra los 10 capítulos y subcapítulos del CIE 10 con mayor número de diagnósticos de ingreso de pacientes, con 371 diagnósticos. Estos fueron clasificados por: diagnósticos de ingreso individuales (subcapítulos) y enlazados así, capítulo XVI: ciertas afecciones originadas en el periodo perinatal con 54 (26,47%), capítulo X: enfermedades del sistema respiratorio con 39 (19,11%), capítulo XVII: malformaciones congénitas, deformidades y anomalías cromosómicas 24 (11,76%), capítulo XVII: síntomas, signos y hallazgos anormales clínicos y de laboratorio, no clasificados en otra parte 19 (9,31%), capítulo XV: embarazo, parto y puerperio con 17 (8,33%), capítulo IV: enfermedades endocrinas, nutricionales y metabólicas con 13 (6,37%), capítulo XI: enfermedades del aparato digestivo con 9 (4,41%), capítulo VI: enfermedades del sistema nervioso 8 (3,92%), y capítulo III: enfermedades de la sangre y de los órganos hematopoyéticos y otros trastornos que afectan el mecanismo de la inmunidad con 8 (3,92%). El estudio de López Martínez et al.10 fue similar, con el 50% de la población un diagnóstico de cardiopatía congénita.
La tabla 5 muestra nueve de los 72 medicamentos con prescripción off-label durante el estudio, difiere del número total de medicamentos obtenido por Morales-Carpi C. et al. con 152 medicamentos5, Danés Carreras I. et al. con 92 medicamentos9, Blanco-Reina E. et al. con 74 medicamentos12 y R. López Martínez et al. con 48 medicamentos10. Los medicamentos con indicación off-label con mayor número de prescripciones con sus respectivos diagnósticos de ingreso, fueron el meropenem con 42 (10,62%) prescripciones y el más prescrito en el grupo etario de los primeros 28 días de vida y los menores de 3 meses de vida, seguido de la dipirona con 39 (10,10%) de las prescripciones más utilizado en población pediátrica perteneciente a los primeros 28 días de vida y primer año de vida lactante y el salbutamol con 32 (8,29%) de indicaciones off-label en pacientes de los grupos etarios de los primeros 28 días de vida, el primer año de vida lactante, segundo año de vida lactante mayor hasta los 3 años. Durante el periodo de estudio donde se identificaron 386 indicaciones off-label, estos fueron clasificados por grupos ATC sobresaliendo el grupo J antiinfecciosos en general para uso sistémico 104 (26,94%) prescripciones, grupo N sistema nervioso 81 (20,98%) prescripciones, grupo C sistema cardiovascular 54 (16,68%) prescripciones, grupo A del sistema digestivo y metabolismo con 20 prescripciones, grupo R sistema respiratorio 61 prescripciones off-label. Similar a lo reportado por Danel Carreras I. et al.9 Donde el grupo J de antiinfecciosos de vía sistémica fue el de mayor relevancia con mayor número de prescripciones (33), seguido del grupo N (14) y por último el grupo C (8).

La tabla 6 muestra nueve medicamentos con indicación off-label con mayor número de prescripciones con sus diagnósticos de ingreso detallándose la indicación aprobada para su uso versus la indicación en el estudio, esta última corresponde a la descrita en el prospecto.
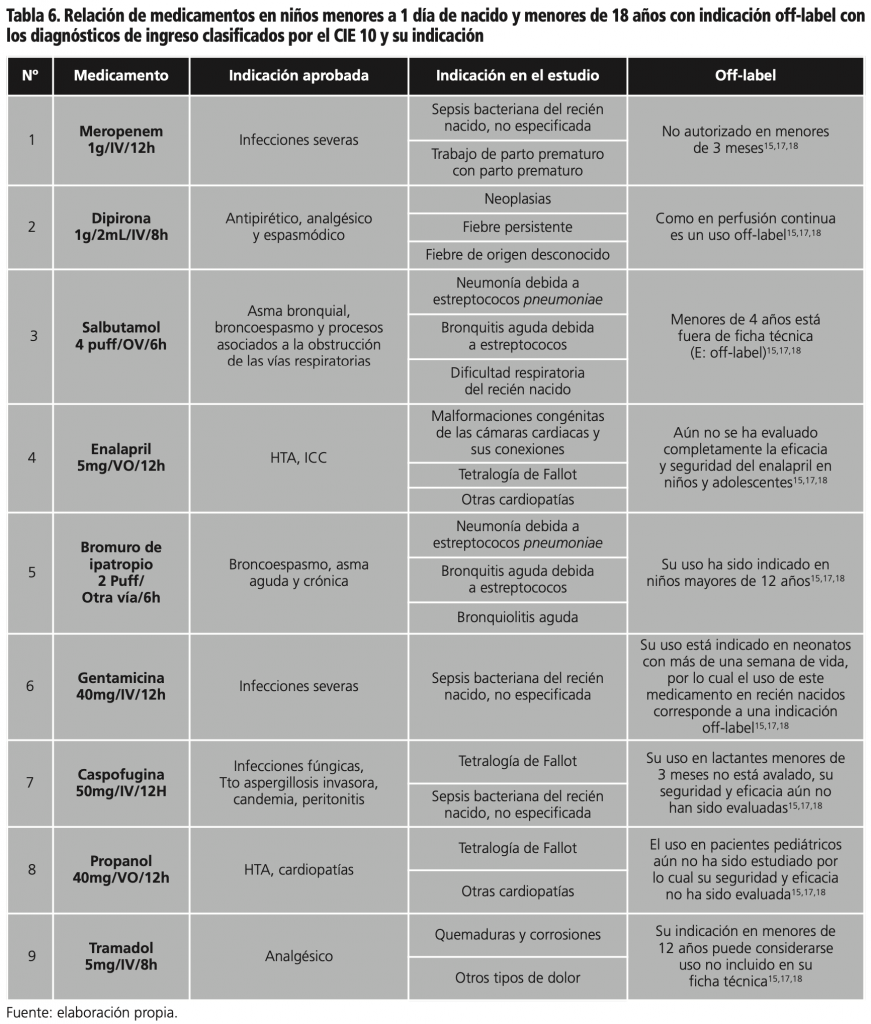
De estos medicamentos identificados tres corresponden a la lista de medicamentos con indicación off-label, de la literatura base en el estudio1,6,8-10,13. García-Sabina A. et al. incluyo el salbutamol1, Danés Carreras I. et al. insertó el bromuro de ipratropio como uso off-label sin describir su indicación y la gentamicina utilizada en la profilaxis en el tratamiento de prematuros9.
En los niños se experimentan cambios durante su desarrollo lo que puede ocasionar cambios provisionales en la absorción y metabolismo de fármacos afectando la eficacia y seguridad. Es de vital importancia estudiar su comportamiento en población pediátrica, donde hay pocos estudios clínicos, por esta razón se hacen vulnerables y su indicación sin garantizar la seguridad y eficacia14.
Las indicaciones de las prescripciones del meropenem fueron la sepsis bacteriana del recién nacido no especificada con 22 (5,92%) y el trabajo de parto prematuro con 5 (1,34%). Su indicación estuvo acorde con lo descrito en su ficha técnica, indicado en pacientes pediátricos mayores de 3 meses, pero no existe experiencia clínica en menores de 3 meses por IV15. Por lo tanto, la prescripción de este medicamento es considerada como indicación off-label. Los efectos secundarios en población pediátrica son datos no muy específicos al no ser la población objetivo predestinado para su uso, los efectos no son totalmente identificados, algunos efectos adversos podrían ser riesgo de toxicidad hepática, en el sistema nervioso central puede ocasionar, cefalea, parestesia rash, prurito, urticaria. Raramente se han observado reacciones cutáneas graves, tales como eritema multiforme, síndrome de Stevens-Johnson y necrólisis epidérmica tóxica16.
La dipirona fue prescrita en 39 (10,10%) pacientes con neoplasias, fiebres persistentes de origen desconocido distribuidos así: 6 (1,61%), seguido de 3 (0,8%) indicaciones cada una, el prospecto indica que este medicamento en los niños debe utilizarse en casos severos y otros tratamientos hayan resultado ineficaces, o el paciente sea intolerante a otros agentes antipiréticos. Debe administrarse durante un periodo corto. Con estricto control clínico en niños menores de 1 año. Uso no recomendado en lactantes menores de 3 meses o niños con peso menor a 5 kg porque puede producir una posible alteración de la función renal15, al evidenciarse un aumento de la vida media, con 2,5 o más de 40 horas, lo que puede contribuir a reacciones adversas por acumulación del fármaco17,18.
El salbutamol fue prescrito en 32 (8,29%) pacientes, para el tratamiento de la neumonía originada por estreptococos pneumoniae 10 (2,69%), bronquitis aguda debida a estreptococos 9 (2,42%) y la dificultad respiratoria del recién nacido 4 (1,07%), prescrito acorde con el prospecto. En niños menores de 4 años no se ha evaluado la seguridad y eficacia. Se han realizado 3 estudios (SB020001, SB030001, SB030002) a las dosis recomendadas, los resultados muestran que el salbutamol tiene un perfil de seguridad comparable con pacientes mayores de 4 años19, pero en sus indicaciones existe restricción a menores de 4 años, la decisión de la inclusión de nuevos usos o población a la que es destinado debe ser realizada por la comunidad científica internacional nominándolo con estudios que demuestren la eficacia y seguridad en esta población.
El enalapril fue prescrito en malformaciones congénitas de las cámaras cardiacas y sus conexiones 6 (1,61%), tetralogía de Fallot 3 (0,68%) y en otras cardiopatías 10 (2,69%). Aún no se ha evaluado completamente la eficacia y seguridad del enalapril en niños y adolescentes15. La seguridad y la eficacia son los principales objetivos en el desarrollo de un medicamento, esto garantiza la diferencia entre una dosis habitualmente efectiva y una dosis que pueda producir efectos secundarios graves, por lo cual su uso debe estar garantizado.
El bromuro de ipatropio fue prescrito en patologías como la neumonía por estreptococos pneumoniae en 3 (0,8%) pacientes, bronquitis aguda debida a estreptococos en uno (0,26%) y la bronquiolitis aguda con 2 (0,53%). Su uso ha sido indicado en niños mayores de 12 años15. Su eficacia y seguridad aún no han sido evaluadas en esta población. Por lo cual su indicación puede ser considerada como UNIRS.
La gentamicina fue prescrita en la sepsis bacteriana del recién nacido no especificada con 13 (3,5%), su uso es indicado en neonatos con más de una semana de vida, por lo cual el uso de este medicamento en recién nacidos corresponde a una indicación off-label15. La nefrotoxicidad y ototoxicidad constituyen los principales efectos adversos. Tanto la nefrotoxicidad como la ototoxicidad se relacionan con concentraciones persistentemente elevadas. Es necesario revisar la necesidad de monitorización plasmática sistemática y la posología de gentamicina en este grupo de pacientes20.
La caspofungina se prescribió para la tetralogía de Fallot 2 (0,53%) y la sepsis bacteriana del recién nacido no especificada con 6 (1,61%). Su uso en lactantes menores de 3 meses su seguridad y eficacia aún no han sido evaluadas, por lo cual su uso no resulta seguro y no se puede comprobar la efectividad en su tratamiento farmacológico15.
El propanolol fue prescrito en diagnósticos como la tetralogía de Fallot en 4 (1,07%) y en otras cardiopatías en un 9 (2,42%), el uso en pacientes pediátricos aún no ha sido estudiado por lo cual su seguridad y eficacia no se han evaluado15.
El tramadol fue prescrito en patologías como las quemaduras y corrosiones en 4 (1,07%), en otro tipo de dolor en 9 (2,42%), este medicamento está asociado a riesgos de depresión del sistema respiratorio e hipotensión, además de producir RAM como estreñimiento, sedación y vómitos. Su indicación en menores de 12 años puede considerarse UNIRS21.
En Colombia el INVIMA posee normas para la protección de la salud individual y colectiva de los colombianos22,23. Algunos medicamentos con registro sanitario vigente, se usan de formas diferentes a las autorizadas. Actualmente existen los UNIRS (Anexo 7), los usos incluidos corresponden a nominaciones que hicieron sociedades científicas desde el año 2014 que fueron evaluadas por el Instituto de Evaluación Tecnológica en Salud (IETS), quienes emitieron un concepto favorable para su prescripción.
La Resolución 1885 de 2018, el Ministerio de Salud y Protección Social estableció el mecanismo de nominación, evaluación y aprobación de los UNIRS por razones legales y técnicas22.
Dentro de los 72 medicamentos catalogados como UNIRS se destacan 6 medicamentos del estudio, los cuales se encuentran semaforizados de la siguiente manera: verde en los que existe evidencia de la eficacia y seguridad: amikacina, ganciclovir, hidrocortisona, sildenafilo y el levetiracetam y el color amarillo que poseen información de la eficacia y la seguridad, no suficiente, se sugiere ampliar la revisión, en este grupo como el nifedipino. Se colige que existen tres razones por las cuales los medicamentos no son registrados en el listado UNIRS: 1. La falta de evidencia científica que soporte su indicación no incluido en su ficha técnica. 2. La tramitología y 3. La falta de interés por parte de los laboratorios farmacéuticos en realizar estudios en población pediátrica1,24.
Las indicaciones off-label son realizadas por los médicos, basado en el juicio clínico y experiencia, de acuerdo al principio de autonomía médica y el riesgo beneficio para los pacientes, lo que garantiza la prescripción de medicamentos con registro sanitario, son las agencias sanitarias y su aprobación se basa en datos con evidencia clínica, estas evalúan la eficacia y la seguridad realizando evaluaciones del balance riesgo beneficio, el beneficio supera el riesgo potencial. Y se garantiza que el medicamento será efectivo y no presentará riesgos potenciales durante su uso24,30.
El hecho de que un medicamento no esté aún aprobado para uso en pediatría no significa que esté contraindicado, esto quiere decir que no existen datos suficientes, para validar su uso en situaciones o edades particulares25. Ello podría crear un conflicto ético si se priva al paciente de sus supuestos beneficios26. En estos casos el hecho de administrar un medicamento en esas circunstancias obliga a prescribir fuera de su uso descrito en la ficha técnica (respecto a dosis, grupo de edad, vía de administración, indicación diferente)27-29.
CONCLUSIONES
• Se Identificó un listado de los medicamentos con indicación off-label utilizados en pacientes pediátricos intrahospitalarios en una clínica de tercer nivel de la ciudad de Barranquilla-Atlántico, obteniendo 72 medicamentos con prescripción off-label durante el periodo de estudio. Los de mayor frecuencia fueron meropenem, dipirona, salbutamol, espironolactona, enalapril, bromuro de ipratropio, gentamicina, caspofungina, propanolol y tramadol.
• Se determinaron los factores incidentes en el uso de estos medicamentos con indicación off-label en pacientes pediátricos, se infiere tres razones fundamentales por la cual los medicamentos no son registrados como UNIRS. 1. La falta de evidencia científica que soporte su indicación no incluido en su ficha técnica, 2. La tramitología y 3. La falta de interés por parte de los laboratorios farmacéuticos en realizar estudios en población pediátrica.
• Se evaluó el perfil de utilización de medicamentos con indicación off-label en pacientes pediátricos, la mayor parte de estos medicamentos fueron prescritos en pacientes pertenecientes al grupo etario 1er año de vida lactante, grupo de pacientes con gran vulnerabilidad, al no existir suficientes estudios clínicos realizados con indicación en niños, las prescripciones de ciertos medicamentos son extrapolados con los estudios realizados en adultos, se debe garantizar la seguridad y eficacia del uso de medicamentos en este grupo de pacientes.
Conflicto de intereses: Los autores declaran no tener conflicto de intereses.
BIBLIOGRAFÍA
1. García-Sabina A, Rabuñal Rey R, Martínez-Pacheco R. Revisión sobre el uso de medicamentos en condiciones no incluidas en su ficha técnica. Farm Hosp. 2011;35(5):264-77. Revisado 23/04/18.
2. López, J. Seguridad y vigilancia en el uso off label. [Internet]. Colombia: Invima; 2016 [citado 28 de junio de 2018]. Disponible en: https://www.invima.gov. co/images/pdf/farmacovigilancia_alertas/eventos/IV-Encuentro-Nacional/Memorias/1-11-Seguridad-y-vigilancia-en-el-uso-off-label.pdf.
3. ABECÉ Sobre: Medicamentos con Usos No Incluidos en Registro Sanitario – UNIRS. Ministerio de protección social.2019. Disponible: https://www.minsalud.gov. co/sites/rid/Lists/BibliotecaDigital/RIDE/VS/MET/abc-medicamentos-con-unirs.pdf.
4. Guía para la presentación de modificaciones al registro sanitario para la dirección de medicamentos y productos biológicos. INVIMA. 2017. Disponible: https://www.invima.gov.co/images/pdf/bioequivalencia/Guia-para-la-Presentacion-de-Modificaciones-al-Registro-Sanitario.pdf.
5. Morales-Carpi C, Julve Chover N, Carpi Lobatón R, Estañ L, Rubio E, Lurbe E, et al. Medicamentos utilizados en pediatría extrahospitalaria: ¿Disponemos de información suficiente? An Pediatr. 2008;68(5):439-46. Revisado 26/04/18.
6. Machado-Alba JE, David C, Plaza M, Solarte J. Patrones de prescripción de antidepresivos en pacientes afiliados al Sistema General de Seguridad Social en Salud de Colombia. 2011;30(5):461-8. Revisado 23/04/18.
7. Radley DC, Finkelstein SN, Stafford RS. Off-label Prescribing Among Office-Based Physicians. Arch Intern Med. 2006;166(9):1021-1026. doi:10.1001/archinte.166.9.1021.
8. Conroy S, McIntyre J, Choonara I. Unlicensed and off label drug use in neonates. Archives of Disease in Childhood – Fetal and Neonatal Edition 1999; 80:F142-F145.
9. Danés Carreras I, Vallano Ferraz A, de la Cruz Sugrañes G, Juárez Giménez JC, Arnau de Bolós JM. Utilización de medicamentos y condiciones de uso recomendadas en pediatría. An Pediatría [Internet]. 2002;57(5):414-9. Available from: http://www.sciencedirect.com/science/article/pii/S1695403302779587 Revisado 20/3/18.
10. López Martínez R, Cabañas Poy MJ, Oliveras Arenas M, Clemente Bautista S. Utilización de medicamentos en una UCI neonatal: Estudio prospectivo. Farm Hosp. [Internet]. 2005;29(1):26-9. Available from: http://dx.doi.org/10.1016/ S1130-6343(05)73632-1. Revisado 20/03/18.
11. Fletscher-Covaleda PM, López-Gutiérrez JJ, Machado-Duque M, Machado-Alba JE. Off-label use of psychotropic drugs beyond officially approved indications in Colombia. Rev Fac Med. 2017;65(3):411-5. Revisado 23/04/18.
12. Blanco-Reina E, Vega-Jiménez MA, Ocaña-Riola R, Márquez-Romero EI, Bellido-Estévez I. Estudio de las prescripciones farmacológicas en niños a nivel de atención primaria: evaluación de los usos off-label o fuera de ficha técnica. Aten Primaria. 2015;47(6):344-50. Revisado 23/04/18.
13. Radley DC, Finkelstein SN, Stafford RS. Off-label Prescribing Among Office-Based Physicians. Arch Intern Med. 2006;166(9):1021-1026. doi:10.1001/archinte.166.9.1021.
14. Riva Natalia, Cáceres-Guido Paulo, Licciardone Nieves, Imventarza Oscar, Monteverde Marta, Staciuk Raquel, et al. Monitorización terapéutica del tacrolimus en pacientes pediátricos trasplantados sujetos a conversión de marcas comerciales. Farm Hosp. [Internet]. 2017 Abr [citado 2019 Abr 24]; 41(2):150-168. Disponible en: http://scielo.isciii.es/scielo.php?script=sci_arttext&pid=S1130-63432017000 200150&lng=es.http://dx.doi.org/10.7399/fh. 2017.41.2.10534.
15. Base de Datos de medicamentos del Consejo General de Farmacéuticos (Bot PLUS 2.0): https://botplusweb.portalfarma.com.
16. Cuzzolin L, Atzei A, Fanos V. Off -label and unlicensed prescribing for newborns and children in different settings: a review of the literature and a consideration about drug safety. Expert Opin Drug Saf. 2006;5(5):703-18.
17. Pediamécum. Edición 2012. Disponible en: http://www.pediamecum.
18. Klasco RK (ed.): USP DI® Drug Information for the Healthcare Professional.
Micromedex. Greenwood Village, Colorado (ed. 2014).
19. Ficha técnica salbutamol. Asociación Española de pediatría. Febrero 17 de 2017. disponible: https://www.aeped.es/comite-medicamentos/pediamecum/ salbutamol.
20. Buitrago.T, Calderón. C, Vallejos. A. Dipirona: ¿Beneficios subestimados o riesgos sobredimensionados? Revisión de la literatura. Rev. Colomb. Cienc. Quím. Farm. 2014;43:173-195.
21. Telechea Héctor, Gesuele Juan, Grosso Pedro, Galarraga Florencia, Guzzo Florencia, Speranza Noelia, et al. Parámetros farmacocinéticos de gentamicina en recién nacidos de término: ¿Es necesario monitorizar en forma sistemática sus concentraciones plasmáticas? Rev. chil. infectol. [Internet]. 2016 Febrero [citado 2019 Agosto 03]; 33(1):7-11. Disponible en: https://scielo.conicyt.cl/ scielo.php?script=sci_arttext&pid=S0716-10182016000100001&lng= es.http://dx.doi.org/10.4067/S0716-10182016000100001.
22. INVIMA [internet].Bogota, Colombia. Instituto Nacional de vigilancia de medicamentos y alimentos. Consultado [9 de junio del 2018]. Diosponible enhttps://www.invima.gov.co/conformacion-de-las-salas-especializadas/239salasespecializadas/index.php?option=com_content&view=article&id=1064:atas-2006&catid=239:sala-especializada-de-medicamentos-y-productos-bio&Itemid=596.
23. Quienes somos. Instituto nacional de vigilancia de medicamentos y alimentos. disponible: https://www.invima.gov.co/web/guest/qui%C3%A9nes-somos.
24. Listado UNIRS Marzo 2019. Ministerio de salud y protección social. Marzo de 2019. Disponible: https://www.sispro.gov.co/central-prestadores-de-servicios/Pages/MIPRES.aspx
25. Laughon M.M, Benjamin D, Mechanism to provide safe and effective drugs for children. www. Pediatrics.org/cgi/doi/10.1542/peds.2014-1585.doi: https:// dx.doi.org/10.1542/peds. 2014-1585. (accessed 01 March 2017).
26. Delgado O, Puigventós F, Clópés A. Posicionamiento del farmacéutico de hospital ante la utilización de medicamentos en condiciones diferentes a las autorizadas. Farm Hosp. 2009;33(5):237-9.
27. Bellis J R, Kirkham J J, Thiesen S Et al. Adverse drug reactions and off-label and unlicensed medicines in children: a nested case-control study of inpatients in a pediatric hospital. http://Gertrudis Martí-Aromir, Pilar Terradas-Mercader, M. Victoria Borras-Pérez, Elizabeth Blarduni-Cardón, Lidia Castro-Feijóo, María Chueca-Guindulain, Ignacio Diez-López, M. Teresa Muñoz-Calvo, Isolina Riaño-Galán, M. Ángeles Donoso-Sanz, Grupo de Ética de la SEEP Rev Esp Endocrinol Pediatr 2017 – Volumen 8. Edición 3 52 www.biomedcentral.com/1741-7015/ 11/238. (accessed 01 March 2017).
28. Isolina Riaño-Galán, M. Ángeles Donoso-Sanz, Grupo de Ética de la SEEP Rev Esp Endocrinol Pediatr 2017 – Volumen 8. Edición 3 52 www.biomedcentral.com/1741-7015/11/238. (accessed 01 March 2017).
29. Wharton GT, Murphy MD, Avant D, Goldsmith JV, Chai G, Rodríguez MJ. Impact of Pediatric exclusivity on drug labeling and demonstrations of efficacy. Pediatrics 2014 Aug; 134(2):e512-8. doi: https://dx.doi.org/10.1542/peds. 2013-2987.
30. Benitz W E, Tatro DS. The pediatric drug handbook. (3ª ed.) St Louis: Mosby-year book, 1995.
____
