Rev. OFIL 2017, 27;2:159-164
Fecha de recepción: 12/05/2016 – Fecha de aceptación: 13/07/2016
Riestra Ayora AC1,2, Berisa Prado S1, Fernández Llano L3, Navarro Hernández C3, Hernández Santos D3, Fanjul Bolado P3, Merayo-Lloves J1,2
1 Instituto Oftalmológico Fernández-Vega-Fundación de Investigación Oftalmológica (España)
2 Universidad de Oviedo (España)
3 DropSens (España)
____
Correspondencia:
Ana Cristina Riestra Ayora
Instituto Oftalmológico Fernández-Vega
(Servicio de Farmacia)
Avda Dres. Fernández Vega, 34
33012 Oviedo
Correo electrónico: acriestra@gmail.com
____
Resumen
Objetivos: El propósito de este estudio es determinar la estabilidad de la solución de fenilefrina al 1,5% en suero fisiológico y solución salina balanceada expuesta a diferentes condiciones ambientales mediante un método de análisis electroquímico.
Material y métodos: La elección de las condiciones del ensayo se realizó según las recomendaciones de las guías de armonización ICH sobre estabilidad y pruebas de nuevas sustancias y productos. Además de la cuantificación de la concentración de fenilefrina mediante un método de análisis electroquímico se realizaron controles de osmolaridad, pH y análisis microbiológicos de la formulación.
Se prepararon 4 lotes de 5 unidades de fenilefrina en solución salina balanceada y fenilefrina en una disolución de cloruro sódico 0,9%. Se sometieron a distintas condiciones ambientales: temperatura ambiente (25°C±2°C/humedad relativa 60%±5%), frigorífico (5°C±3°C) y congelador (-20°C±5°C). Las determinaciones se realizaron inmediatamente, 1, 4 y 6 meses después de la preparación.
Resultados: No se detectó ningún cambio significativo en la concentración, entendido como una variación superior al 5% de su valor inicial. Además no se observaron diferencias en atributos físicos.
Los valores de pH más adecuados se obtuvieron con solución salina balanceada manteniéndose constantes durante todo el estudio. No se observaron diferencias significativas en la osmolaridad entre las preparaciones.
Todos los cultivos microbiológicos resultaron negativos.
Conclusión: La formulación de fenilefrina 1,5% en BSS presenta valores más adecuados de pH para la administración intracamerular.
Durante un periodo de 6 meses no se detectaron variaciones superiores al 5% en la concentración de fenilefrina mediante el método propuesto, no existiendo diferencias significativas entre la conservación a temperatura ambiente, en nevera o congelador.
Palabras clave: Fenilefrina, estabilidad de medicamentos, oftalmología, formulación medicamentos.
____
INTRODUCCIÓN
El síndrome del iris flácido intraoperatorio IFIS, de sus siglas en inglés, (intraoperative floppy-iris syndrome), es un comportamiento anómalo del iris durante la intervención de cataratas, aunque también se han descrito casos durante trabeculectomías. El IFIS se caracteriza por la triada:
• Ondulación del iris en respuesta a las corrientes del líquido intraocular.
• Propensión al prolapso hacia las incisiones.
• Miosis intraoperatoria progresiva a pesar del uso de midriáticos preoperatorios.
En el 2002 se describieron los primeros casos de iris flácido. En 2005 Chang y Campbell establecieron la relación del IFIS con los antagonistas de los receptores adrenérgicos α11.
El mecanismo por el que se podría presentar el IFIS es el bloqueo competitivo de los receptores adrenérgicos alfa-1a presentes en el músculo dilatador del iris. Su bloqueo impide la contracción muscular, provocando por tanto miosis.
Los pacientes bajo tratamiento con Tamsulosina presentan una mayor incidencia de IFIS (43-90%), siendo además más grave, aunque también se produce con otros antagonistas α como: alfuzosina, doxazosina y terazosina. La mayor relación con la Tamsulosina se produce por su mayor afinidad por el RAα1a. Recientemente también se ha asociado este síndrome con el tratamiento con risperidona2.
En la literatura se han descrito casos de IFIS hasta tres años después de haber suspendido el tratamiento con Tamsulosina. La persistencia de IFIS tras suspender el tratamiento sugiere una atrofia muscular semipermanente y pérdida de tono muscular. Se desconoce el tiempo necesario para que se produzcan estos cambios musculares. Parece que este síndrome ocurre de 4 a 6 meses tras el inicio del tratamiento con bloqueantes α adrenérgicos1.
El síndrome de Iris flácido se asocia a un mayor riesgo de complicaciones quirúrgicas, principalmente a ruptura de la cápsula posterior y trauma del iris.
Existen distintas estrategias de manejo del IFIS, que se pueden dividir en 2 categorías:
• Farmacológicas: Fenilefrina o epinefrina intracamerular y atropina tópica pre-operatoria.
• Mecánicas: Viscoelásticos, ganchos retractores de iris o anillos de expansión pupilar.
Los fármacos intracamerulares presentan varias ventajas sobre el resto de medidas por ser más simples, menos traumáticos y más rápidos.
La fenilefrina es un agonista adrenérgico utilizado en oftalmología tanto en colirio como en inyección intracamerular. Presenta un mecanismo de acción mixto. Actúa estimulando directamente los receptores adrenérgicos e indirectamente liberando las catecolaminas existentes en las terminaciones adrenérgicas.
Se ha evaluado la eficacia de diferentes concentraciones (0,3-1,5%), pero la fenilefrina 1,5% ha sido más estudiada tanto en cirugía de cataratas no-IFIs como en la IFIS asociada a la utilización de ARAα13-5.
Lorente en su estudio sobre la profilaxis del síndrome de iris flácido con fenielfrina confirma que, al contrario que la epinefrina intracamerular, la fenilefrina 1,5% intracamerular revierte la miosis y el prolapso de iris intraoperatorios. Además concluye que, aunque la fenilefrina intracamerular revierte el IFIS, es más adecuada la administración preoperatoria profiláctica ya que se consigue un mayor diámetro pupilar y se evita la atrofia del iris secundaria al prolapso.
En la formulación de las soluciones intracamerulares se debe tener en muy cuenta el pH y la osmolaridad para no dañar las células endoteliales. El pH del humor acuoso está en torno a 7,2 y su osmolaridad entre 300 y 310 mOsm/kg.
Estudios in vitro demuestran que fuera del rango de pH de 6,5 a 8,5 se producen alteraciones tanto funcionales como estructurales en la córnea. Un pH extremo causa daño celular directo y ruptura de las uniones estrechas, perdiendo así la función de barrera6. En cuanto a la osmolaridad, la córnea puede soportar de 200 a 400 mOsm/kg sin marcada toxicidad celular. Sin embargo, se producen variaciones en el grosor corneal con soluciones hipo/hipertónicas, siendo la osmolaridad ideal de 300 mOsm/kg7. Se han descrito, incluso, casos de síndrome tóxico del segmento anterior por utilizar soluciones con valores inadecuados de pH u osmolaridad8. Además las formulaciones deben estar libres de partículas en suspensión.
La fenilefrina 1,5% para administración intracamerular no está disponible comercialmente por lo que se prepara como fórmula magistral.
Por este motivo se decidió realizar un estudio para determinar la estabilidad de la solución de fenilefrina al 1,5% en suero fisiológico y solución salina balanceada expuesta a diferentes condiciones ambientales mediante un método de análisis electroquímico.
MATERIAL Y MÉTODOS
Como diluyentes de la fenilefrina hidroclruro (Acofarma, España) se utilizaron NaCl 0,9% (Suero Fisiológico Braun, B Braun Medical) y solución salina balanceada (BSS, Alcon Laboratories, UK) en función de datos publicados previamente9,10.
Se prepararon 4 lotes de cada formulación de 5 unidades, diluyendo la fenilefrina en el disolvente correspondiente con posterior filtración esterilizante (Filtro Millex GP 0,22μm, Merck KGaA, Darmstadt, Alemania), y envasado en viales topacio de vidrio tipo I de 5 ml, con tapón de caucho y cápsula de aluminio. Como control se utilizó fenilefrina 1,5% en solución salina tamponada con tampón citrato, elaborada en una farmacia de elaboración a terceros. Cada solución fue etiquetada con su composición y tiempo de muestreo.
La elección de las condiciones de conservación se realizó según las recomendaciones de la Conferencia Internacional sobre armonización de requisitos técnicos para el registro de productos farmacéuticos de uso humano (ICH, de sus siglas en inglés). Siendo las siguientes:
• 25ºC±2ºC y 60%±5% de humedad relativa.
• 5ºC±3ºC.
• -20ºC±5ºC.
Los análisis se realizaron el día de la preparación (t0), 1,4 y 6 meses después (t1, t4 y t6).
No se realizó ningún test de fotoestabilidad por ser conocida la degradación de la fenilefrina por exposición a la luz.
Desarrollo del método electroquímico de análisis
Se desarrolló un método de análisis electroquímico para la detección de fenilefrina. Se realizó una caracterización electroquímica mediante voltamperometría cíclica y posteriormente se optimizaron los parámetros de detección de la especie para realizar la curva de calibración en las condiciones óptimas de medida.
Se observó un proceso de oxidación a ≈ 0,55V. Esta corriente de oxidación se usó como señal analítica para el desarrollo del método de análisis.
El nuevo método de análisis electroquímico (voltamperometría de pulso diferencial) se validó respecto a valoración potenciométrica (Crison Instruments S.A.) así como a absorbancia (monocromador Ocean Optics USP2000+, celda de diseño propio, paso óptico 1 cm), métodos estándar11. La fenilefrina control se consideró el patrón de referencia (Tabla 1).
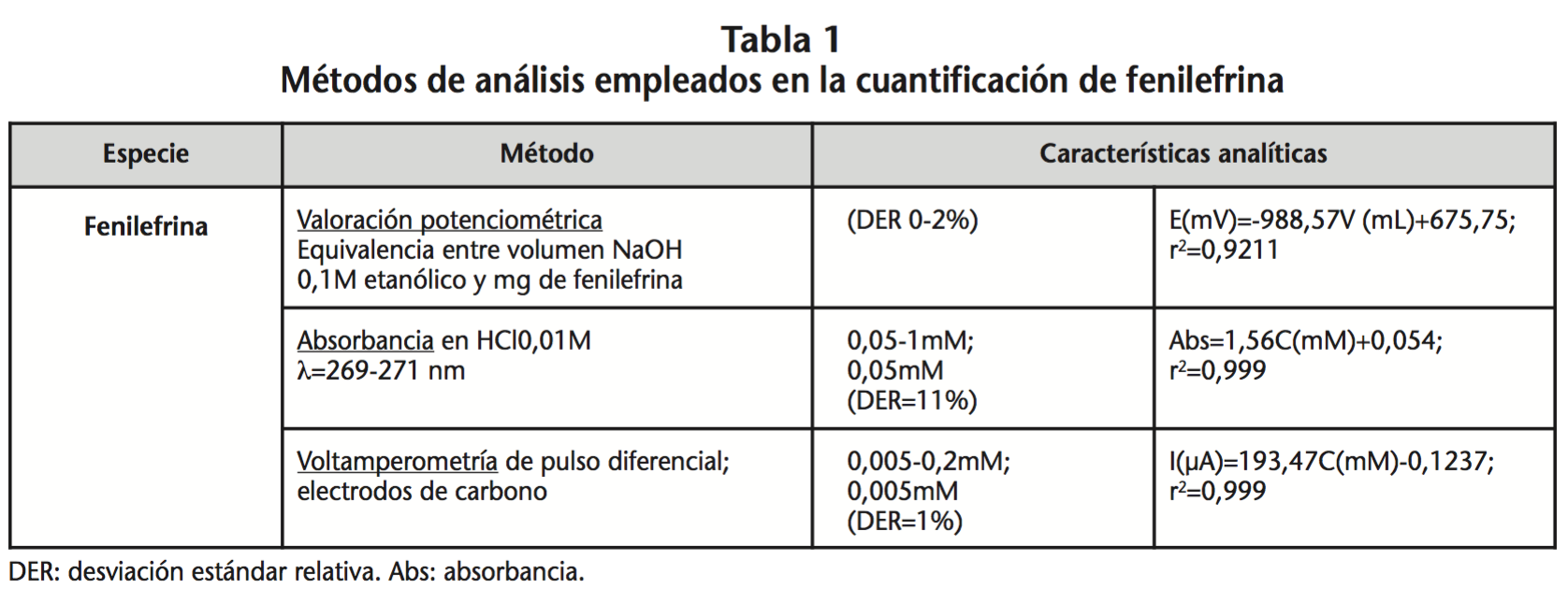
Para valorar la especificidad del método y comprobar si los posibles productos de degradación interfieren con la señal analítica de la fenilefrina se decidió hacer un estudio de degradación acelerada. Se prepararó una disolución de fenilefrina 1,5% en BSS, se filtró a través de un filtro Millex GP de 0,22 mcm y se envasó en diferentes viales. Estos viales se conservaron bajo las siguientes condiciones:
• Congelador y protegido de la luz (Tº <-20 ºC).
• Frigorífico y protegido de la luz (Tº 2-8ºC).
• Tª ambiente y protegido de la luz (Tª 20-25ºC).
• Tª ambiente expuesto a la luz (Tª 20-25ºC).
• Tª 40ºC.
Las medidas se realizaron tras someter durante 7 y 15 días los distintos viales en estas condiciones de almacenamiento. Como referencia se tomó la señal de fenilefrina a T0.
Al no observarse disminución de la concentración de fenilefrina durante los 15 días se decidió realizar una oxidación electroquímica de una disolución 1 mM de fenilefrina por aplicación de un potencial de oxidación de 1,5V durante diferentes tiempos. Con el fin de asegurar que los productos de oxidación electroquímica no se depositan sobre la superficie activa del electrodo, la oxidación se llevó a cabo con una celda electroquímica diferente a la de medida (cambiando el electrodo de trabajo para cada medida) (Figura 1).
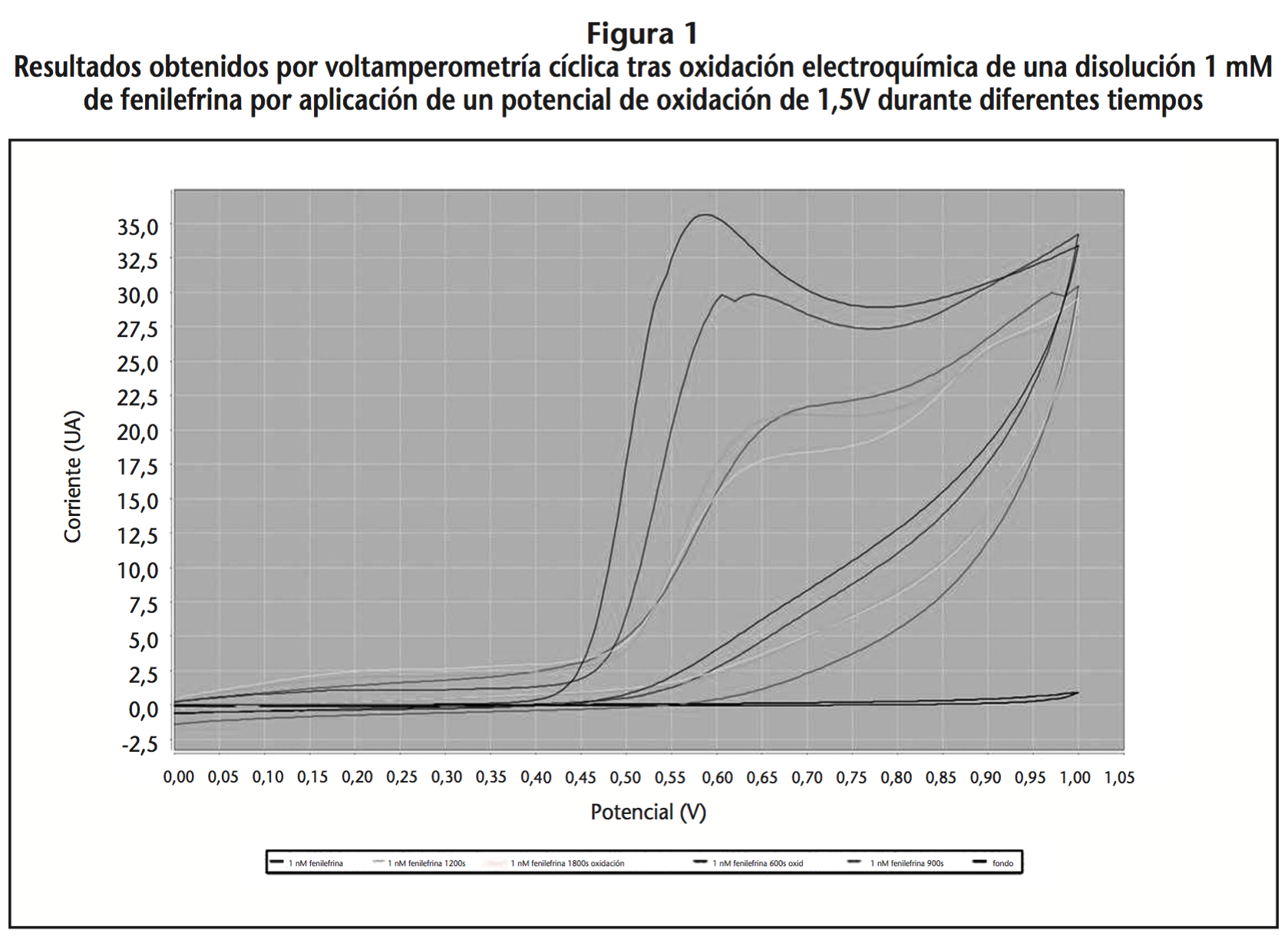
La intensidad correspondiente a una concentración de fenilefrina 1 mM disminuyó al aplicar un potencial de oxidación a mayores tiempos (Tabla 2).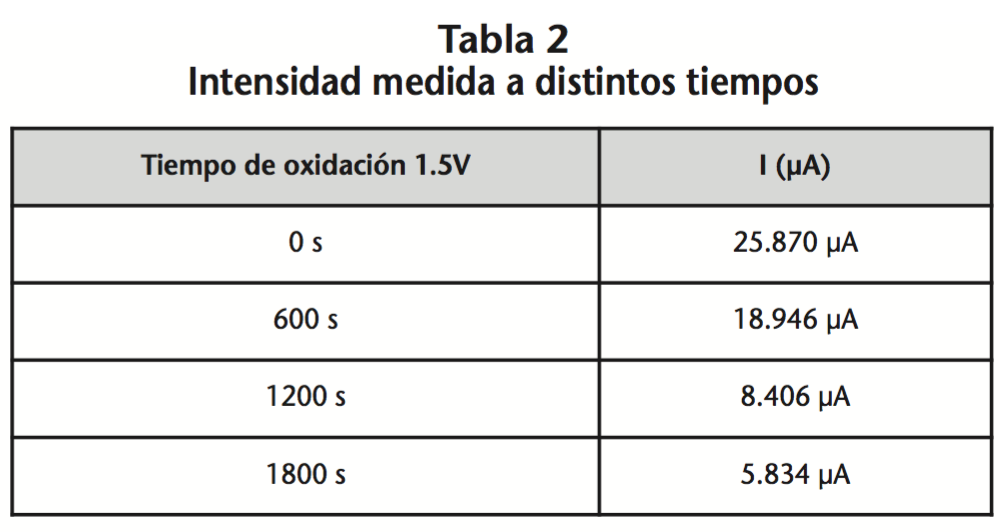
Para evaluar la repetitividad del método se realizaron todas las medidas analíticas por triplicado. Siento en todos los casos la variabilidad igual o menor al 3%.
Para establecer la reproducibilidad de las condiciones de análisis se realizaron calibraciones por operadores diferentes a partir de disoluciones de fenilefrina patrón preparadas por cada operador en días distintos (Tabla 3).
Para comprobar la robustez de las medidas, se llevaron a cabo medidas de diferentes concentraciones del rango lineal variando el valor del pH o de la fuerza iónica de la disolución reguladora.
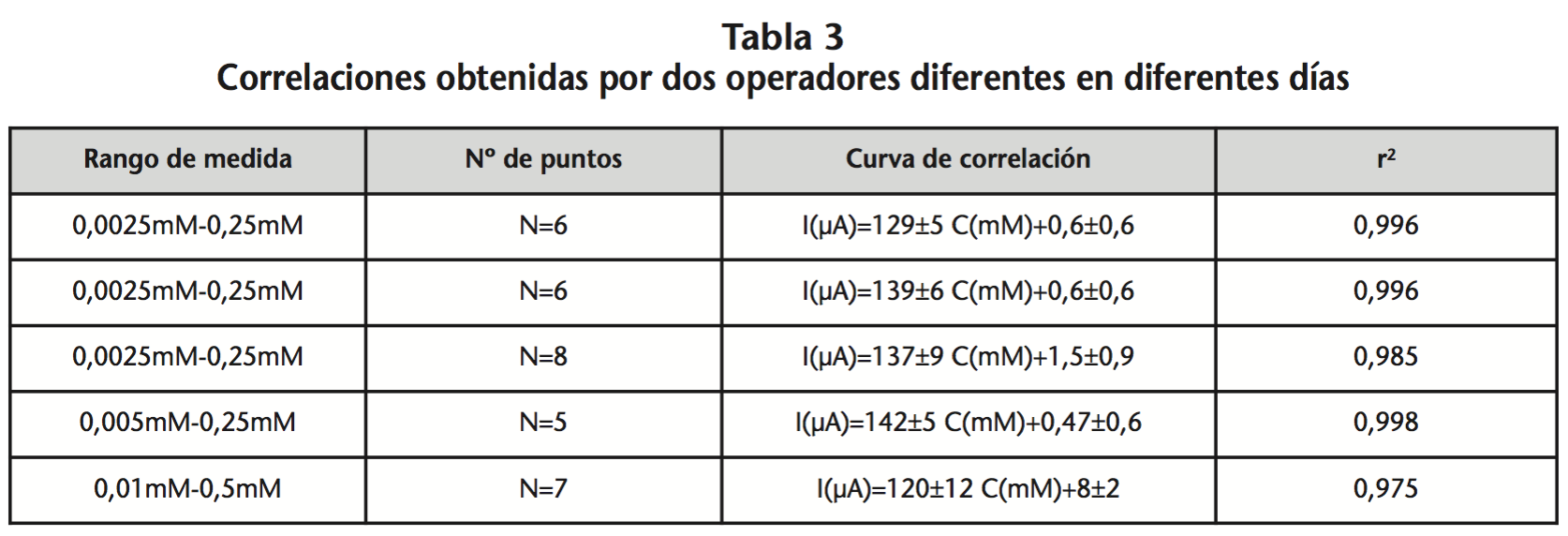
La desviación de las medidas al variar la fuerza iónica o el pH de la disolución reguladora es similar a la desviación de las medidas al realizar cuantificaciones por quintuplicado de una concentración de fenilefrina en las mismas condiciones de análisis. Las variaciones en fuerza iónica y pH no parecen tener un efecto reseñable en la señal analítica demostrando la robustez del método.
Además de comprobar la concentración de fenilefrina en los diferentes preparados farmacéuticos así como su evolución en función de las condiciones de almacenamiento y el medio de disolución, se estudió la evolución en el tiempo de otros parámetros tales como la osmolaridad (Osmostat® OM-6020, Kyoto, Daiichi) y el pH (pHmetro Crison Instruments S.A.). Todas las determinaciones analíticas se realizaron por triplicado.
La estabilidad física se constató por observación directa sobre fondo blanco y negro, valorándose en cada observación color, precipitación y turbidez de las soluciones.
Para evaluar la limpidez se realizó el ensayo de partículas subvisibles descrito en la Real Farmacopea Española por el método de recuento de partículas al microscopio.
La validación de la técnica aséptica se realizó de forma previa al estudio. Además se realizaron controles microbiológicos ambientales tanto por contacto como por sedimentación.
Se realizó un control de esterilidad del producto final en todos los lotes. Para los cultivos bacteriológicos se sembraron las muestras en placas de agar sangre y agar chocolate (Becton Dickinson GmbH, Germany), leyéndose a las 72 horas. Para el control micológico se sembraron las muestras en agar Sabouraud durante 14 días.
Se consideraron “cambios significativos” en la preparación durante el tiempo del estudio:
1. Un cambio del 5% en la concentración respecto a su valor inicial.
2. No cumplir los criterios de aceptación para el aspecto y atributos físicos (color, turbidez, precipitación…).
3. No cumplir con el criterio de aceptación de pH (6,5-8,5).
RESULTADOS
– Estabilidad química
Durante todo el tiempo del estudio las condiciones ambientales se mantuvieron dentro de los límites establecidos.
La concentración de fenilefrina se mantuvo dentro del margen del 95-105% tanto en las muestras de BSS como en las de NaCl 0,9%, no observándose diferencias entre la conservación a temperatura ambiente, en frigorífico o en congelador. Se observó que en algunas determinaciones la concentración medida era superior a la basal. Lo que puede ser debido a fenómenos de evaporación.
– pH y osmolaridad
Las medias de los valores de pH sólo se mantuvieron dentro del rango establecido (6,5-8,5) en el caso del BSS. Resultando más ácidas (5-6) para la solución de NaCl 0,9%.
La osmolaridad media de las preparaciones de NaCl 0,9% fue de 416±16 mOsm/kg, en el caso de BSS de 424±5 mOsm/kg y en la fenilefrina de referencia de 277,8±1,4 mOsm/kg.
– Estabilidad física
Durante el periodo de estudio no se observaron cambios en los atributos físicos: color, turbidez o precipitación.
Los preparados cumplieron el ensayo de partículas subvisibles para preparaciones inyectables establecido en la Real Farmacopea Española.
– Estabilidad microbiológica
Todos los cultivos microbiológicos resultaron negativos.
DISCUSIÓN
En el presente trabajo se ha desarrollado un método analítico para la cuantificación de fenilefrina en preparados farmacéuticos más sencillo que los disponibles actualmente y con buenos resultados. El método analítico es novedoso pero ha sido validado frente a espectrofotometría, método utilizado ya en trabajos anteriores para la determinación de fenilefrina en estudios de estabilidad10,12 pese a ser la cromatografía líquida de alta resolución la más empleada9,13,14.
En trabajos publicados previamente para demostrar que el método (HPLC) era indicador de estabilidad se adicionó a la solución de fenilefrina NaOH 1 N en ebullición disminuyendo de esta manera entre un 10% y un 30% la señal de la fenilefrina y apareciendo señales nuevas9,13. En otro trabajo las muestras fueron sometidas a condiciones drásticas como hidrólisis ácida (HCl 3 N), hidrólisis básica (NaOH 3 N) y oxidación (H2O2) y expuestas a la luz durante 3 días. Sólo se pudo apreciar una ligera degradación por la disminución de la altura de los picos y la aparición de pequeños picos en el cromatograma secundarios como posibles productos de degradación14.
En nuestro caso la exposición a la luz no produjo variaciones significativas en la degradación del principio activo por lo que se decidió oxidar la muestra evidenciándose una disminución de la concentración de fenilefrina sin aparecer interferencias por los productos de degradación. Por lo que se podría asumir que el método es indicador de estabilidad.
Estudios previos habían demostrado la estabilidad durante al menos 84 días a temperatura ambiente de una solución de fenilefrina hidrocloruro en cloruro sódico 0,9% (2,5 mg/ml), aunque no se demostró que el método fuera indicador de estabilidad. Gupta describe que la degradación de fenilefrina diluida en NaCl 0,9% (0,2 y 0,1 mg/ml) y conservada en bolsas de PVC es menor al 1% en 14 días y Kiser demuestra una estabilidad de 30 días de una solución de fenilefrina 100 mcg/ml en NaCl 0,9% conservada tanto a temperatura ambiente, como en frigorífico o congelador y expuesta a la luz.
En el trabajo de González Rodríguez presentado en el Congreso de la SEFH 2009, se encuentra que la estabilidad de la fenilefrina 1,5% en solución salina balanceada (BSS) es de 3 meses, siendo mayor cuando se conserva refrigerada9,10,13.
En el presente estudio se establece que la fenilefrina disuelta en BSS o en NaCl es estable hasta 6 meses bajo diferentes condiciones ambientales, sin embargo es imprescindible resaltar que pese a que se haya constatado la estabilidad química durante ese periodo es necesario realizar controles microbiológicos de las preparaciones para poder dar una estabilidad superior a 24h a temperatura ambiente, 3 días en nevera o 45 días congelado a -20ºC, que se asignarían siguiendo las recomendaciones de capítulo 797 de la farmacopea americana por ser una preparación de riesgo alto.
Los resultados de pH obtenidos resultaron similares a los publicados por Kiser en el estudio de estabilidad de fenilefrina hidrocloruro en jeringas de polipropileno y González Rodríguez. Los valores de pH más adecuados se obtienen con BBS situándose en 7 su valor medio.
Según los datos de González Rodríguez la osmolaridad de la fenilefrina 1,5% en agua era de 225 mOsm/kg, mientras que en NaCl 0,9% y en BSS era 400 y 410 mOsm/kg respectivamente por lo que en nuestro estudio fueron estos dos disolventes los elegidos para la preparación intracamerular. Los resultados obtenidos en el presente estudio siguen en la línea de los publicados con anterioridad; el rango de osmolaridad obtenido va de 390 a 440 mOsm/kg, a pesar de que los valores elevados se relacionan en parte con la evaporación de la muestra por el cambio de temperatura, parecen demasiado elevados para la administración intracamerular, en la que la osmolaridad óptima se sitúa en torno a los 300 mOsm/kg. Por lo que son necesarios más estudios que permitan lograr una osmolaridad más fisiológica, manteniendo el pH en torno a 7 y sin afectar a la estabilidad físico-química de la preparación.
CONCLUSIÓN
En la preparación de fenilefrina 1,5% para inyección intracamerular se considera más conveniente el uso de BSS como disolvente por presentar valores más adecuados de pH para la administración intracamerular.
La solución es estable químicamente durante un periodo de 6 meses, no existiendo diferencias significativas entre la conservación a temperatura ambiente, en nevera o congelador. Son necesarios más estudios para ajustar la osmolaridad a 300 mOsm/kg.
Conflicto de intereses: Los autores declaran no tener conflictos de intereses.
BIBLIOGRAFÍA
1. Chang DF, Campbell JR. Intraoperative floppy iris syndrome associated with tamsulosin. Journal of cataract and refractive surgery. 2005;31(4):664-73.
2. Ford RL, Sallam A, Towler HM. Intraoperative floppy iris syndrome associated with risperidone intake. European journal of ophthalmology. 2011;21(2):210-1.
3. Gurbaxani A, Packard R. Intracameral phenylephrine to prevent floppy iris syndrome during cataract surgery in patients on tamsulosin. Eye (London, England). 2007;21(3):331-2.
4. Manvikar S, Allen D. Cataract surgery management in patients taking tamsulosin staged approach. Journal of cataract and refractive surgery. 2006;32(10):1611-4.
5. Lorente R, de Rojas V, Vazquez de Parga P, Moreno C, Varela J, Landaluce ML, et al. Intracameral phenylephrine 1.5% for prophylaxis against intraoperative floppy iris syndrome: prospective, randomized fellow eye study. Ophthalmology. 2012;119(10):2053-8.
6. Gonnering R, Edelhauser HF, Van Horn DL, Durant W. The pH tolerance of rabbit and human corneal endothelium. Investigative ophthalmology & visual science. 1979;18(4):373-90.
7. Edelhauser HF, Hanneken AM, Pederson HJ, Van Horn DL. Osmotic tolerance of rabbit and human corneal endothelium. Archives of ophthalmology. 1981;99(7):1281-7.
8. Mamalis N, Edelhauser HF, Dawson DG, Chew J, LeBoyer RM, Werner L. Toxic anterior segment syndrome. Journal of cataract and refractive surgery. 2006;32(2): 324-33.
9. Kiser TH, Oldland AR, Fish DN. Stability of phenylephrine hydrochloride injection in polypropylene syringes. American journal of health-system pharmacy: AJHP: official journal of the American Society of Health-System Pharmacists. 2007;64(10):1092-5.
10. N GR. Ensayo de estabilidad de la fenilefrina clorhidrato al 1´5% en diferentes condiciones de elaboración. Poster presentado Congreso SEFH 2009. 2009.
11. Riestra ACF L, Navarro C, Fanjul P, Merayo-Lloves J. Validación de un método de detección electroquímica para la cuantificación de fenilefrina en preparados farmacéuticos. 58 Congreso SEFH. 2013.
12. Pérez Maroto MTLI R, Rantaolaya Perrín R, Tornero Torres O, Requena Cartula T. Estabilidad y esterilidad de un colirio de fenilefrina 2,5%. Farmacia hospitalaria: organo oficial de expresion cientifica de la Sociedad Espanola de Farmacia Hospitalaria. 1999;23:48-52.
13. Gupta VDP. Chemical Stability of Phenylephrine Hydrochloride After Reconstitution in 0.9% Sodium Chloride Injection for Infusion. International journal of pharmaceutical compounding. 2004;8(2):153-5.
14. Monteagudo Licea RGP, Caridad Margarita; Botet García, Martha; Troche Concepción, Yenilen; Montes de Oca Porto, Yanet. Validation of an analytical method for quality control and stability study of 10 % Phenylephrine eyedrops. Revista Cubana de Farmacia. 2013;44(4):444-502.
____
Descargar artículo en PDF: Estudio de estabilidad de fenilefrina 1,5% intracamerular
