Buendía Bravo S, Serna Romero O, Cruz Cruz T
Servicio de Farmacia. Hospital Universitario del Sureste. Arganda del Rey. Madrid (España)
Fecha de recepción: 04/03/2021 – Fecha de aceptación: 06/04/2022
Correspondencia: Silvia Buendía Bravo – Hospital Universitario del Sureste (Servicio de Farmacia) – Ronda del Sur, 10 – 28500 Arganda del Rey. Madrid (España)
sbuendia@salud.madrid.org
____
RESUMEN
Objetivos: Cuantificar y clasificar los eventos adversos (EA) asociados a los tratamientos empleados para la COVID-19. Describir los medicamentos empleados y su frecuencia de utilización.
Material y métodos: Estudio retrospectivo, unicéntrico, que incluye pacientes adultos con infección confirmada por SARS-CoV-2 con fecha de ingreso hospitalario entre el 13/03/2020 y 13/04/2020 y con fecha de alta o exitus anterior a 31/05/2020. El período de estudio fue el ingreso y los 30 días posteriores al alta. Se registraron datos demográficos, clínicos, relativos al tratamiento y a los EA. Se categorizó la probabilidad de causalidad del fármaco mediante el algoritmo de Karch y Lasagna modificado.
Resultados: Se incluyeron 183 pacientes de los cuales en el 51% se registró algún evento adverso. Se utilizaron hasta 9 fármacos diferentes. La combinación más utilizada fue hidroxicloroquina más azitromicina (57,5%). Se notificaron 142 EA durante el ingreso, siendo los más prevalentes los trastornos hematológicos (24,6%) y gastrointestinales (15,5%). Un 29,6% son producidos probable o posiblemente por fármacos usados para el tratamiento de la COVID-19. El medicamento que produjo más reacciones adversas fue el lopinavir-ritonavir (25% de pacientes). Se detectaron 7 interacciones farmacológicas que produjeron alargamiento del intervalo QT del electrocardiograma. En el período de estudio, la prevalencia de tromboembolismo es del 13,1%.
Conclusiones: Casi un tercio de los eventos adversos registrados durante la primera fase de la pandemia, pudieron ser debidos a los tratamientos empleados. La profilaxis anticoagulante adecuada y evitar las interacciones, son las principales claves para evitar problemas relacionados con medicamentos en los pacientes con COVID-19.
Palabras clave: COVID, seguridad, interacción.
Retrospective observational study of adverse events associated with the treatments used for COVID-19
SUMMARY
Objectives: Quantify and classify adverse events (AE) associated with the treatments used for COVID-19. Describe the medication used and its frequency of use.
Material and methods: A retrospective, single-center study, including adult patients with confirmed SARS-CoV-2 infection, hospital admission date between March 13th, 2020 and April 13th, 2020 and with a discharge or death date prior to May 31st, 2020. The study period was from the admission date and until 30 days after discharge. Demographic data, clinical data, treatment and adverse events were recorded. The probability of drug causality was categorized using the modified Karch and Lasagna algorithm.
Results: 183 patients were included of which 51% had some adverse event. Up to 9 different drugs were used. The most used combination was hydroxychloroquine plus azithromycin (57.5%). 142 AE were reported during admission, being haematological (24.6%) and gastrointestinal (15.5%) disorders the most prevalent. 29.6% are probably or possibly produced by drugs used for the treatment of COVID-19. The drug that caused the most adverse reactions was lopinavir-ritonavir (25% of patients). Seven drug interactions were detected that produced lengthening of the QT interval of the electrocardiogram. In the study period, the prevalence of thromboembolism is 13.1%.
Conclusions: Almost a third of the adverse events registered during the first phase of the pandemic could be due to the treatment used. Adequate anticoagulant prophylaxis and avoiding interactions are the main keys to prevent drug-related problems in patients with COVID-19.
Key words: COVID, security, interaction.
____
INTRODUCCIÓN
El tratamiento de una nueva enfermedad, producida por la infección del coronavirus SARS-CoV-2, denominada COVID-19, ha supuesto en el año 2020 un reto mundial para los profesionales sanitarios, que se han enfrentado a una emergencia sanitaria. Al principio de la epidemia, no se disponía de ningún tratamiento autorizado para la nueva enfermedad y la evidencia procedente de ensayos clínicos controlados era insuficiente. Todo ello dio lugar al reposicionamiento de fármacos autorizados para otras indicaciones en base a la bibliografía disponible en ese momento y el balance riesgo-beneficio favorable. La Organización Mundial de la Salud define este tipo de utilización de fármacos como MEURI (Monitored Emergency Use of Unregistered Interventions)1.
Se han utilizado como antivirales: lopinavir-ritonavir, remdesivir, hidroxicloroquina (asociado o no a azitromicina) e interferon, y como inmunomoduladores: tocilizumab, siltuximab, ruxolitinib, baricitinib, anakinra o colchicina2.
Según la NCCMERP (National Coordinating Council for Medication Error Reporting and Prevention), se define un evento adverso a fármacos, como cualquier daño resultante de la intervención médica relacionado con un medicamento3. Los que no se pueden prevenir y son inherentes al medicamento, se denominan reacciones adversas. Por el contrario, aquellos prevenibles como las interacciones farmacológicas son errores de medicación4.
Una reacción adversa a medicamentos (RAM) es todo efecto perjudicial y no deseado que se presenta después de la administración de un medicamento a las dosis normalmente utilizadas en el hombre5. Para determinar el nivel de probabilidad por la que se puede considerar que el agente causal es un determinado fármaco, se puede emplear la puntuación del algoritmo de Karch y Lasagna modificado6.
La seguridad de la combinación de los medicamentos utilizados para tratar la COVID-19, se ha ido evaluando por el Sistema Español de Farmacovigilancia con las notificaciones de sospechas de reacciones adversas7 pero no hay estudios de utilización de estos medicamentos publicados en condiciones reales de uso.
El objetivo principal de este estudio es cuantificar y clasificar los eventos adversos asociados a los tratamientos empleados para la COVID-19 para poder describir el perfil de seguridad de los mismos. El objetivo secundario, es describir los medicamentos empleados en la infección por SARS-CoV-2 y su frecuencia de utilización.
MATERIAL Y MÉTODOS
Estudio retrospectivo, descriptivo, en un hospital general. Los criterios de inclusión fueron: pacientes adultos con infección confirmada por SARS-CoV-2 que ingresan en unidades de hospitalización, con fecha de ingreso hospitalario entre el 13 de marzo de 2020 y el 13 de abril de 2020, con fecha de alta o exitus anterior a 31 de mayo de 2020 y que han sido tratados con alguno de los siguientes fármacos durante más de 2 días: lopinavir-ritonavir, hidroxicloroquina, interferón beta o remdesivir.
El período de estudio fue el ingreso y los 30 días posteriores al alta. Las fuentes de información utilizadas fueron: la historia clínica electrónica del hospital (Selene®) y el programa de Farmacia (Farmatools®).
Se diseñó una base de datos con las siguientes variables a recoger:
1) Datos demográficos: Edad, sexo y comorbilidades.
2) Datos relativos al ingreso hospitalario: Fecha de ingreso, fecha de alta o exitus, si requiere ingreso en UCI y si requiere asistencia sanitaria en el centro 30 días post-alta.
3) Datos clínicos: Si tiene diagnóstico clínico de neumonía y escala CURB-65 al ingreso (gravedad).
4) Datos relativos al tratamiento: Utilización de fármacos del protocolo intrahospitalario de tratamiento de COVID-19 (medicamento, pauta, fecha de inicio y fin) y registro de medicación concomitante.
5) Datos referentes al evento adverso: Se registró cualquier evento adverso que conste en la historia clínica durante el período de estudio. Si el paciente fue tratado con lopinavir-ritonavir o colchicina, se prestó especial atención al registro de alteraciones gastrointestinales. Si fue tratado con hidroxicloroquina, se registró electrocardiogramas e intervalo QT corregido (QTc). Si fue tratado con tocilizumab, se registraron los parámetros analíticos de sangre de los 7 días posteriores al tratamiento.
6) Para el análisis de eventos adversos: En aquellos eventos adversos en los que un fármaco puede ser el causante, se categorizó la causalidad según el algoritmo de Karch y Lasagna modificado, y se registró si ha requerido suspensión del mismo.
Si consta trombopenia inducida por heparina (TIH), se calculó la puntuación TIH score8.
El estudio fue autorizado por el CEIm (Comité de Ética de Investigación con Medicamentos) de referencia de nuestro Hospital.
RESULTADOS
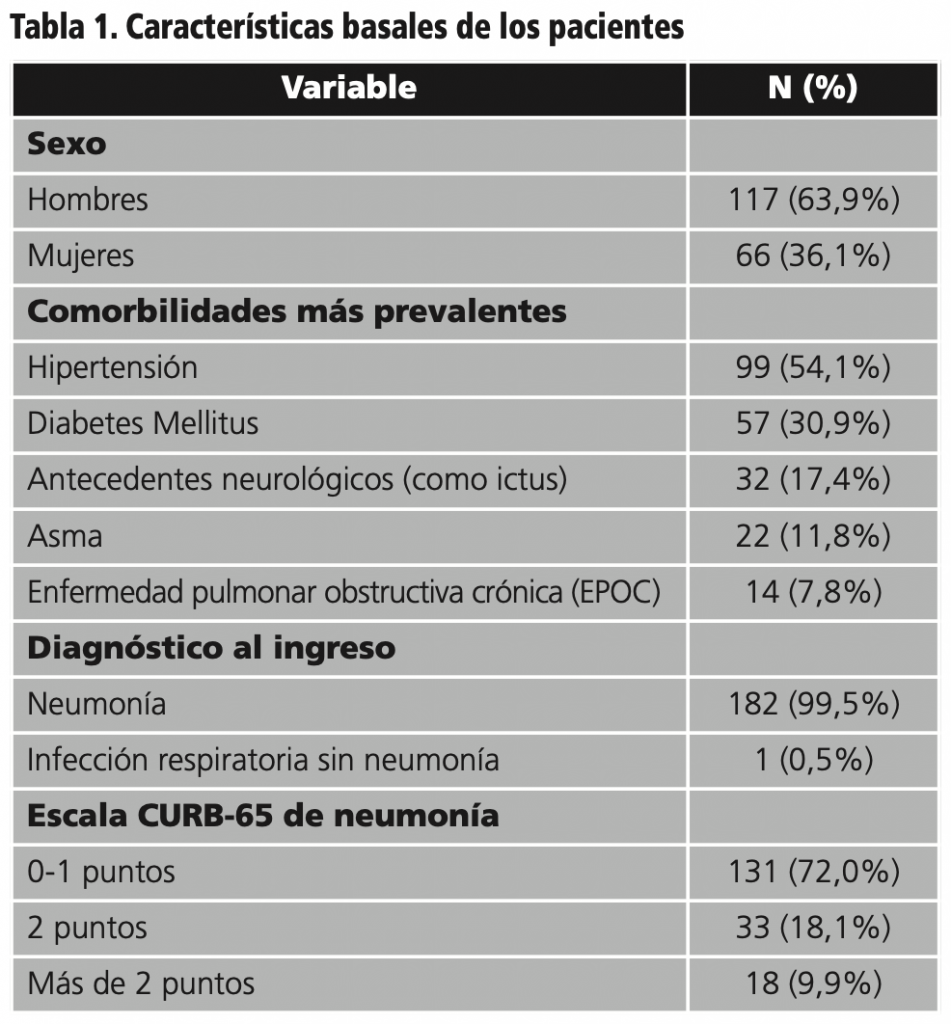
Durante el período de estudio, fueron incluidos 183 pacientes con edad media (desviación estándar, SD) de 64,2 (15,2) años. Las características basales se describen en la tabla 1.
De los 183 pacientes, el 13,1% requirieron Unidad de Cuidados Intensivos (UCI), 13,7% fallecieron y 16,3% necesitaron asistencia sanitaria en los 30 días post-alta (33% por no haberse resuelto la sintomatología respiratoria, 13% por tromboembolismo, 10% por problema neurológicos, 10% por otras infecciones y 34% por otras causas). De estos pacientes que acuden a Urgencias en el mes posterior al alta, el 30% reingresa.
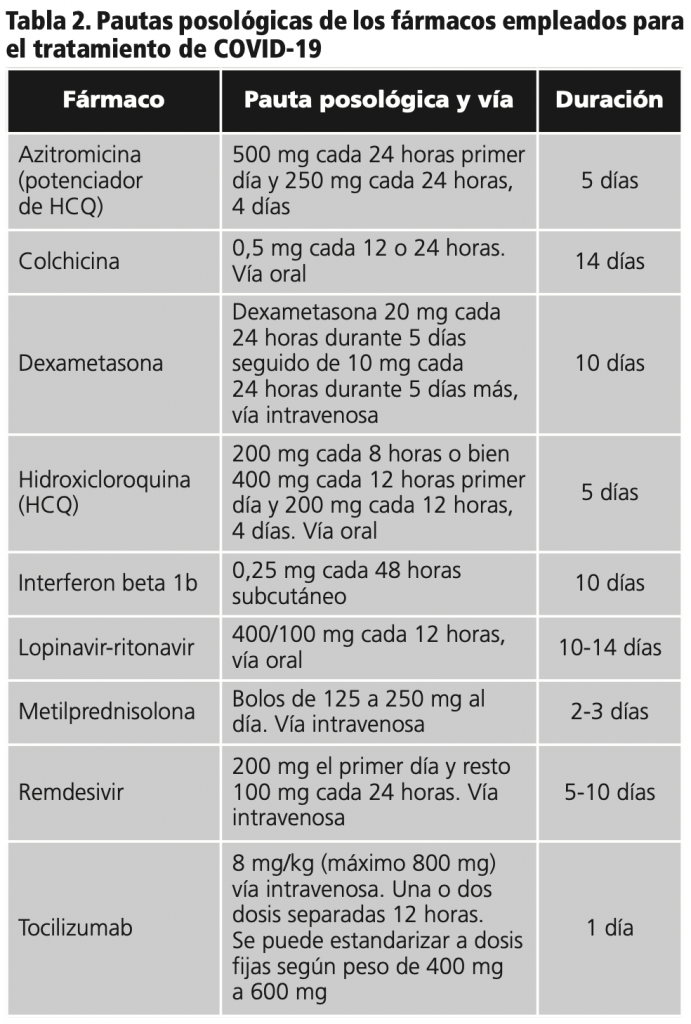
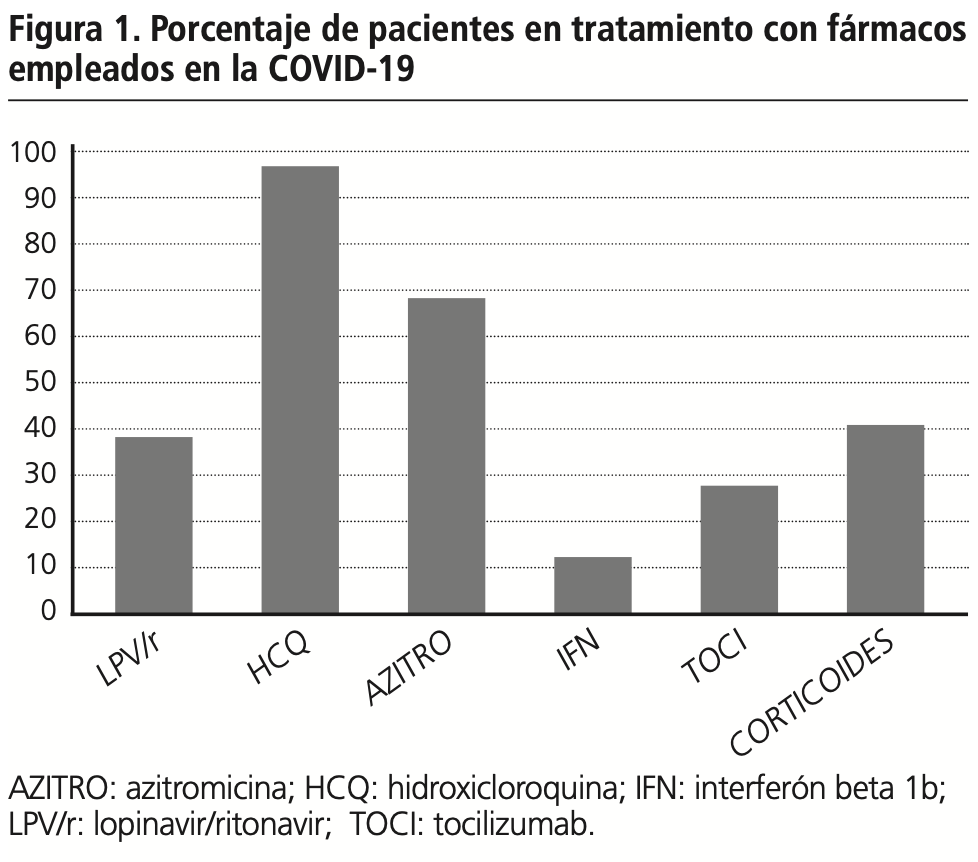
En cuanto a los fármacos utilizados se ha usado: hidroxicloroquina o lopinavir-ritonavir en monoterapia en un 8,7% de los pacientes, combinaciones de ambos en el 33,8% de pacientes y la combinación hidroxicloroquina potenciada con azitromicina en el 57,5%. En el 15,3% de los casos se emplean 3 o 4 fármacos con potencial antiviral por paciente. Las pautas empleadas en nuestro hospital se muestran en la tabla 2.
En el caso de lopinavir-ritonavir, la duración media del tratamiento ha sido de 7,6 días (mínimo 1 y máximo 14 días). Fue prescrito tocilizumab en 44 pacientes con una media (SD) de 1,44 (0,50) dosis por paciente, y colchicina en 2 pacientes.
La distribución de la utilización de los fármacos más representativos se puede observar en la figura 1.
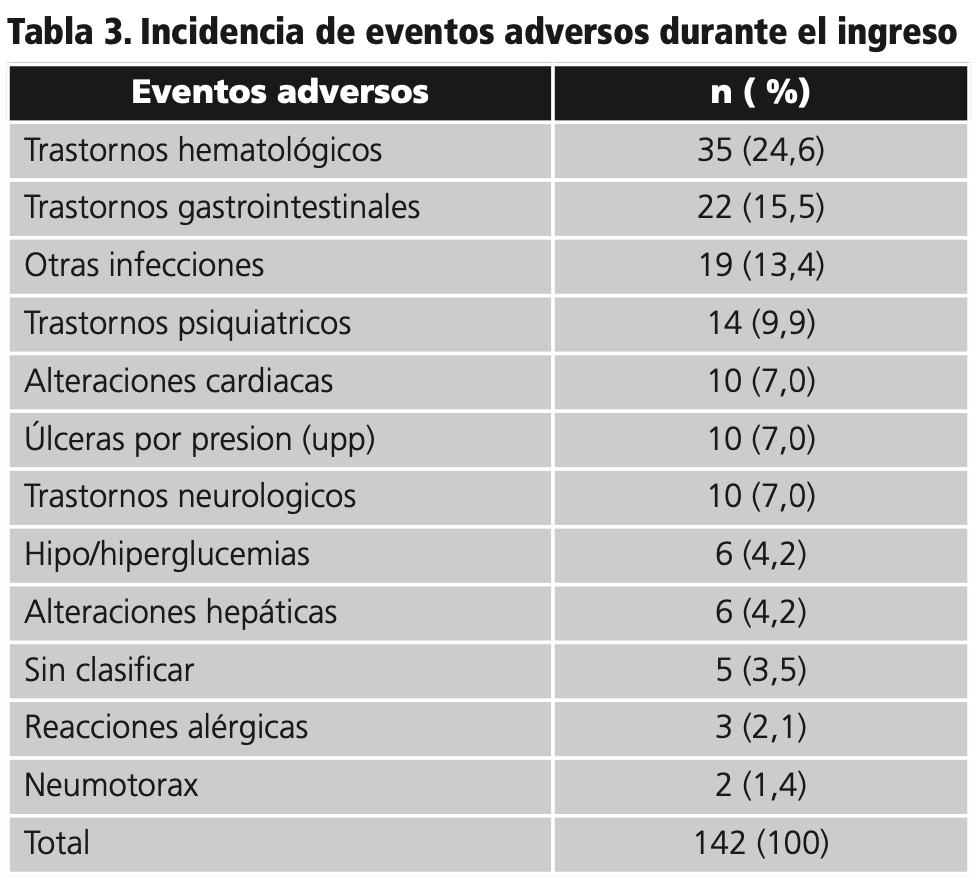
Respecto a los eventos adversos registrados durante el ingreso, fueron notificados 142 en 93 pacientes, de los cuales el 54,2% están relacionados con estancias en UCI. El detalle de los eventos adversos puede verse en la tabla 3.
Los trastornos hematológicos son el evento adverso más prevalente. En total, se han producido 35 eventos adversos, de los cuales el 57% son tromboembolismos (mayoritariamente pulmonar) y 43% son alteraciones del hemograma. Se ha registrado 1 posible TIH, que queda excluida según el TIH score. El 9% se refieren a leucocitosis reactiva.
También destacan los trastornos gastrointestinales (68% diarrea), que suponen un 32% de suspensión precoz de fármacos, mayoritariamente lopinavir-ritonavir (86% de los casos).
Por otra parte, el 11% de los eventos adversos son infecciones secundarias, en su mayoría sobreinfecciones bacterianas (81%), en un 14% hongos en la boca (muguet) y en un 5% se produce reactivación de virus herpes. Conllevó la retirada precoz de corticoides en el 5%.
Respecto a los trastornos psiquiátricos, en un 43% hay delirio, agitación o ansiedad (cuadros hiperactivos, mayoritariamente delirium post-UCI), en un 36% confusión o disminución del nivel de conciencia (cuadros hipoactivos) y en un 21% hay alucinaciones. Esta circunstancia se solventa con la introducción de fármacos antipsicóticos o ansiolíticos y supone la retirada de fármacos (hidroxicloroquina y lopinavir-ritonavir) en el 14% de los pacientes.
En cuanto a las alteraciones cardiacas, el 70% se refieren a alargamiento del intervalo QT del electrocardiograma (EC) y de éstas sólo en 1 paciente hay sintomatología de arritmia. La hidroxicloroquina está implicada en el 86% de alargamientos del intervalo QT, y en todos los casos se combina con un inhibidor enzimático u otro fármaco con riesgo potencial (levofloxacino o risperidona).
En los pacientes en tratamiento con hidroxicloroquina, se ha detectado que en el 31,9% de pacientes no consta que se haya realizado un electrocardiograma basal al ingreso y en el 1,6% de pacientes el hallazgo de un pequeño alargamiento del QT basal supone la no adicción de lopinavir-ritonavir a la hidroxicloroquina.
Respecto a las alteraciones hepáticas, en todas se ha descrito hipertrasaminemia y se refieren a pacientes críticos. En el 50% motivó la retirada de algún fármaco.
Hubo tres reacciones alérgicas, una de ellas fue una reacción sistémica con suspensión de lopinavir-ritonavir e hidroxicloroquina, y otras dos toxicodermia de tipo rash.
En el mes posterior al alta se encontraron 20 eventos adversos. El más prevalente es el tromboembolismo (4 pacientes). En total, en el período de estudio, el 2,2% de los pacientes sufre trombosis en vena periférica (TVP) y el 10,9% tromboembolismo pulmonar (TEP).
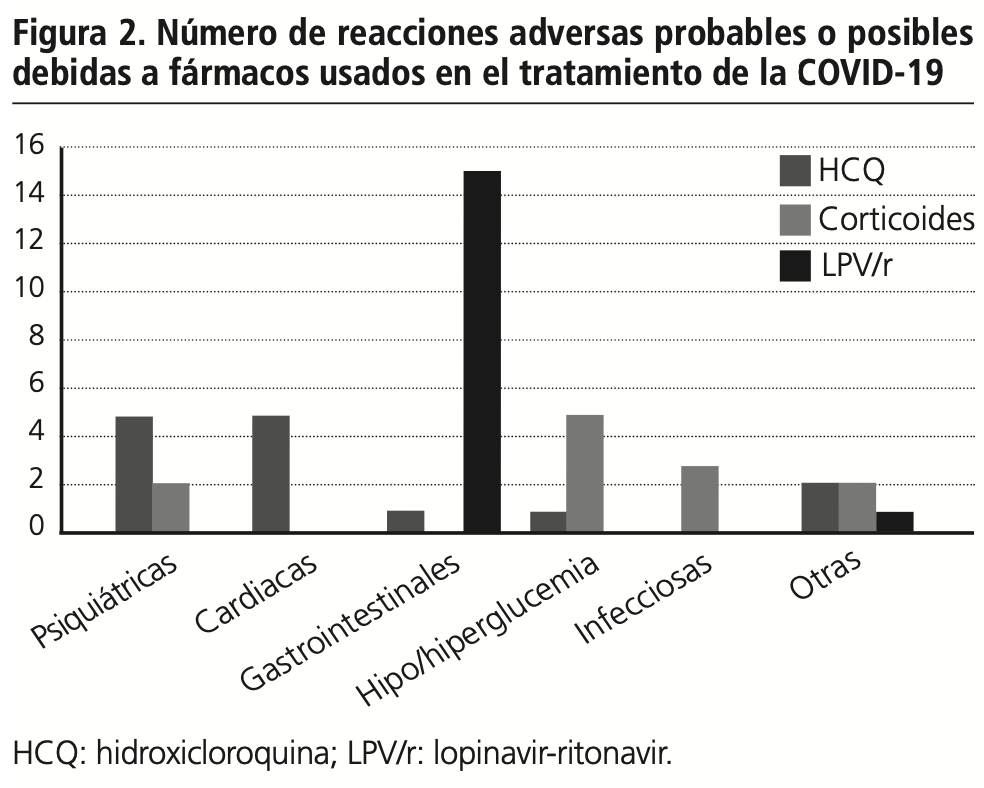
El 29,6% de los eventos adversos podrían deberse a un fármaco empleado en el tratamiento de la COVID-19 (figura 2).
En el 17% de estos eventos, hay al menos una interacción. Las reacciones adversas están notificadas en un 25% de pacientes de lopinavir-ritonavir, un 17% de los que toman corticoides y en el 7,7% de los toman hidroxicloroquina.
DISCUSIÓN
Los protocolos hospitalarios de tratamiento de la enfermedad han ido cambiando considerablemente en poco tiempo, para intentar incorporar la evidencia científica del momento9. Los tratamientos empleados están en la línea de lo que se expone en el estudio español del Registro SEMI-COVID-1910 siendo la más frecuente las pautas basadas en hidroxicloroquina (85,6% de los pacientes del registro multicéntrico, frente a 99,5% en nuestro centro). La diferencia puede ser debida a la heterogenicidad de los protocolos en cada hospital.
Distintas terapias dirigidas contra mediadores de la inflamación (tocilizumab, anakinra, baricitinib, etc.) se han posicionado como posibles tratamientos en la segunda fase de la enfermedad11, sin embargo, en la actualidad, no se ha demostrado suficientes resultados para recomendarlos12. La pauta de tocilizumab (24% de los pacientes) empleada en el estudio ha ido cambiando según las recomendaciones y la disponibilidad del mismo, pero no se le consideró agente causal de reacciones adversas, por lo que fue bien tolerado.
Los pacientes con COVID-19 grave pueden desarrollar una respuesta sistémica que lleva a síndrome de distress respiratorio y fallo multiorgánico, donde está indicado el tratamiento con corticoides12. En nuestro estudio, fueron usados en un 37,7% de los pacientes y aunque en un primer momento hubo controversias en su utilización11, finalmente el ensayo RECOVERY demuestra la reducción de mortalidad13. Las pautas de corticoides han ido sufriendo variaciones hasta las actuales recomendaciones de dexametasona 6 mg al día durante 10 días. Los efectos adversos más destacables se correlacionan con las encontradas en nuestro estudio: hiperglucemias, infecciones secundarias o trastornos psiquiátricos12. Destaca la posibilidad de alteraciones hematológicas como leucocitosis reactiva7.
El fármaco al que se le imputan más reacciones adversas es el lopinavir-ritonavir. La reacción adversa más común son los trastornos gastrointestinales. En el estudio, hay un 24,4% de pacientes que desarrollan este evento producido probable o posiblemente por este fármaco, lo que va en consonancia con el Registro Español de Farmacovilancia con un dato del 35% de incidencia7. Sin embargo, la hidroxicloroquina aunque produce reacciones adversas en sólo un 7,7% de nuestros pacientes, éstas pueden ser más graves ya que suponen alteraciones psiquiátricas o prolongación del intervalo QT del electrocardiograma.
La peligrosidad de la prolongación del intervalo QT14, especialmente en la combinación de hidroxicloroquina y azitromicina (la más empleada) ha sido alertada por múltiples organismos15 y estudios16. Existe una relación cualitativa entre prolongación del intervalo QT y riesgo de torsade de pointes (TdP), que es un efecto adverso raro pero muy grave17. Todos los alargamientos del QT, fueron motivados por interacciones farmacológicas, implicando a más fármacos con potencial arritmogénico o a inhibidores enzimáticos como azitromicina o ritonavir. Debido a su balance beneficio-riesgo inadecuado, actualmente no se recomienda el uso de hidroxicloroquina salvo en el contexto de los ensayos clínicos18.
Un evento adverso relevante en la patología de la enfermedad es el desarrollo de trombos. La prevalencia media ponderada de tromboembolismo venoso es, según un metanálisis19, de 31,3%, sin embargo, en nuestro estudio es del 13,1%. La media de TEP es de 18,9%, lo que es coherente con nuestros datos (10,9%).
Durante el período de inclusión del estudio, no se habían emitido recomendaciones oficiales respecto a la necesidad de anticoagulación a dosis mayores (1 mg/kg/día de enoxaparina) de las habituales para profilaxis20, por lo que se desconoce si una mayor dosis de enoxaparina habría evitado algún tromboembolismo.
Entre las principales limitaciones de nuestro estudio están: la variabilidad en la interpretación de la historia clínica que dispone información sin codificar y la posible pérdida de datos al alta.
También habría que considerar el efecto de la multitud de combinaciones de fármacos que fueron probados que además, no están tampoco exentos de efectos adversos y que favorecieron la aparición de interacciones farmacológicas por inhibición enzimática.
CONCLUSIONES
Casi un 30% de los eventos adversos registrados durante la primera fase de la pandemia por SARS-CoV-2, pudieron ser debidos a los tratamientos empleados. La profilaxis anticoagulante adecuada y evitar las interacciones, son las principales claves para evitar problemas relacionados con medicamentos en los pacientes con COVID-19.
Conflicto de intereses: Las autoras declaran no tener conflicto de intereses.
BIBLIOGRAFÍA
1. World Health Organization. Guidance for managing ethical issues in infectious disease outbreaks. Geneva: WHO; 2016.
2. Agencia Española de Medicamentos y Productos Sanitarios. Tratamientos disponibles sujetos a condiciones especiales de acceso para el manejo de la infección respiratoria por SARS-CoV-2. [Internet]. 2020 [consultado 08/07/2020]. Disponible en: https://www.aemps.gob.es/la-aemps/ultima-informacion-de-la-aemps-acerca-del-covid%E2%80%9119/tratamientos-disponibles-para-el-manejo-de-la-infeccion-respiratoria-por-sars-cov-2/.
3. Morimoto T. Adverse drug events and medication errors: detection and classification methods. Quality and Safety in Health Care. 2004;13(4):306-14.
4. Otero-López MJ, Alonso-Hernández P, Maderuelo-Fernández JA, Garrido-Corro B, Domínguez-Gil A, Sánchez-Rodríguez Á. Acontecimientos adversos prevenibles causados por medicamentos en pacientes hospitalizados. Medicina Clínica. 2006;126(3):81-7.
5. Otero López MJ, Codina Jané C, Tamés Alonso MJ, Pérez Encinas M. Grupo de trabajo Ruiz-Jarabo 2000. Errores de medicación: estandarización de la terminología y clasificación. Farm Hosp. 2003;27(3):137-149.
6. Naranjo CA, Busto U, Sellers EM, Sandor P, Ruiz I, Roberts EA, et al. A method for estimating the probability of adverse drug reactions. Clin Pharmacol Ther. 1981;30(2):239-45.
7. Agencia Española de Medicamentos y Productos Sanitarios. Sospechas de reacciones adversas notificadas con tratamientos utilizados en COVID-19. Informe: 9 [Internet]. 2020 [consultado 15/12/2020]. Disponible en: https://www. aemps.gob.es/la-aemps/ultima-informacion-de-la-aemps-acerca-del-covid% E2%80%9119/sospechas-de-reacciones-adversas-notificadas-con-tratamientos-utilizados-en-covid-19/.
8. Colorio C. Sociedad Argentina de Hematología. Trombocitopenia inducida por heparina (TIH). Hematología. 2012;16:25-28.
9. Centro de Coordinación de Alertas y Emergencias sanitarias. Dirección General de Salud Pública, Calidad e Innovación. Ministerio de Sanidad. Manejo clínico del COVID-19: atención hospitalaria. Versión 5 [Internet]. 2020 [consultado 18/06/2020].Disponible en: https://www.mscbs.gob.es/profesionales/saludPublica/ccayes/alertasActual/nCov/documentos/Protocolo_manejo_clinico_ah_COVID-19.pdf.
10. Casas-Rojo JM, Antón-Santos JM, Millán-Núñez-Cortés J, Lumbreras-Bermejo C, Ramos-Rincón JM, Roy-Vallejo E, et al. Características clínicas de los pacientes hospitalizados con COVID-19 en España: resultados del Registro SEMI-COVID-19. Revista Clínica Española. 2020;220(8):480-94.
11. Díaz E, Amézaga Menéndez R, Vidal Cortés P, Escapa MG, Suberviola B, Serrano Lázaro A, et al. Tratamiento farmacológico de la COVID-19: revisión narrativa de los Grupos de Trabajo de Enfermedades Infecciosas y Sepsis (GTEIS) y del Grupo de Trabajo de Transfusiones Hemoderivados (GTTH). Med Intensiva [Internet]. [Citado 31/01/21]; Disponible en: http://www.medintensiva.org/es-tratamiento-farmacologico-covid-19-revision-narrativa-avance-S0210569 120302473.
12. COVID-19 Treatment Guidelines Panel. Coronavirus Disease 2019 (COVID-19) Treatment Guidelines. National Institutes of Health [Internet]. Estados Unidos de America; 2021. [Consultado 31/01/2021]. Disponible en: https://www. covid19treatmentguidelines.nih.gov/.
13. The WHO Rapid Evidence Appraisal for COVID-19 Therapies (REACT) Working Group, Sterne JAC, Murthy S, Diaz JV, Slutsky AS, Villar J, et al. Association Between Administration of Systemic Corticosteroids and Mortality Among Critically Ill Patients With COVID-19: A Meta-analysis. JAMA. 2020;324(13):1330.
14. Alcalde González R, Cárdaba García RM. Análisis del síndrome de QT largo y su relevancia para la práctica clínica enfermera. Enferm Cardiol. 2019; 26(76):27-38.
15. Agencia Española de Medicamentos y Productos Sanitarios. Nota de Seguridad MUH (FV) 07/2020. Cloroquina/hidroxicloroquina:precauciones y vigilancia de posibles reacciones adversas en pacientes con COVID-19. [Internet] [Actualizado 14/05/2020]. Disponible en: https://www.aemps.gob.es/ informa/ notasinformativas/medicamentosusohumano-3/seguridad-1/2020-seguridad-1/cloroquina-hidroxicloroquina-precauciones-y-vigilancia-de-posibles-reacciones-adversas-en-pacientes-con-covid-19/.
16. Mercuro NJ, Yen CF, Shim DJ, Maher TR, McCoy CM, Zimetbaum PJ, et al. Risk of QT Interval Prolongation Associated With Use of Hydroxychloroquine With or Without Concomitant Azithromycin Among Hospitalized Patients Testing Positive for Coronavirus Disease 2019 (COVID-19). JAMA Cardiol. 2020;5(9):1036-41.
17. Hernández-Arroyo MJ. Seguridad en el paciente: prescripción de fármacos que prolongan el intervalo QT. Farmacia Hospitalaria. 2015;(5):227-39.
18. Agencia Española de Medicamentos y Productos Sanitarios. Nota de Seguridad AEMPS 18/2020. Información acerca del uso de hidroxicloroquina para el tratamiento de COVID-19. [Internet] [Publicado 2/06/2020]. Disponible en: https://www.aemps.gob.es/informa/notasinformativas/laaemps/2020-laaemps/informacion-acerca-del-uso-de-hidroxicloroquina-para-el-tratamiento-de-covid-19/.
19. Di Minno A, Ambrosino P, Calcaterra I, Di Minno MND. COVID-19 and Venous Thromboembolism: A Meta-analysis of Literature Studies. Semin Thromb Hemost. 2020;46(07):763-71.
20. Sociedad Española de Trombosis y Hemostasia. Recomendaciones de tromboprofilaxis y tratamiento antitrombótico en pacientes con COVID-19 [Internet]. [Publicado 21/04/2020]. Disponible en: https://www.covid-19.seth.es/recomendaciones-de-tromboprofilaxis-y-tratamiento-antitrombotico-en-pacientes-con-covid-19/.
____