Rodríguez Quesada PP, Caro Teller JM, García Muñoz C, Cortijo Cascajares S, Fernández Redondo D, Ortiz Pérez S, Rosas Espinoza CR, Ferrari Piquero JM
Hospital Universitario 12 de octubre. Servicio de Farmacia. Madrid (España)
Fecha de recepción: 29/12/2021 – Fecha de aceptación: 24/01/2022
Correspondencia: Pedro Pablo Rodríguez Quesada – Universitario 12 de octubre. Servicio de Farmacia (Semisótano Residencia General) – Av. de Córdoba, s/n – 28041 Madrid (España)
pedropablo.rodriguez@salud.madrid.org
____
RESUMEN
Objetivo: Evaluar el impacto clínico que la interacción de capecitabina con inhibidores de la bomba de protones (IBP) puede tener sobre la efectividad del tratamiento de mantenimiento en pacientes con cáncer de colon metastásico (CCm).
Material y métodos: Estudio retrospectivo, observacional descriptivo que incluyó a todos los pacientes con CCm tratados con capecitabina sola o en combinación entre enero 2013-diciembre 2016. Los pacientes fueron divididos en dos grupos según si fueron o no tratados con IBP concomitantemente con capecitabina.
Se evaluaron variables demográficas, farmacológicas y clínicas, siendo la supervivencia libre de progresión (SLP) la variable elegida para evaluar el impacto clínico de la interacción.
Resultados: Se incluyeron 150 pacientes. De ellos, el 57,33% varones, media de edad 70,10±12,06 años; el 55,33% tuvieron un ECOG 1 y el 58,67% utilizaron IBP.
Un 39,33% fueron tratados con capecitabina en monoterapia, 31,33% CapeOx, y 20% capecitabina+bevacizumab y 9,33% CapeOx+bevacizumab. El 53,33% tuvo un tratamiento basado en capecitabina en primera línea, la frecuencia de variaciones de tratamiento fue de 42,0% reducción de dosis, 38,0% retraso, y 12% interrupción tratamiento. El 78,0% presentó alguna toxicidad, destacando 34,67% diarrea y 30,0% (síndrome mano-pie).
La SLP media fue de 6,69 vs 6,0 meses (HR=0,97; IC95% 0,68-1,39; p=0,87) en favor de los pacientes que no utilizaron IBP, aunque la relación fue no significativa.
Conclusiones: En la población estudiada, los pacientes con CCm que recibieron tratamiento de mantenimiento basado en capecitabina y que utilizaron IBP simultáneamente, presentaron una tendencia no significativa a la disminución de la SLP.
Palabras clave: Capecitabina, IBP, interacciones.
Evaluation of the interaction of capecitabin with proton pump inhibitors in patients with metastatic colon cáncer
SUMMARY
Objective: To evaluate the clinical impact that the interaction of capecitabine with proton pump inhibitors (PPIs) may have on the effectiveness of maintenance treatment in patients with metastatic colon cancer (mCC).
Material and methods: Retrospective, observational, descriptive study that included all patients with CCm treated with capecitabine alone or in combination between January 2013-December 2016. The patients were divided into two groups according to whether or not they were treated with PPIs concomitantly with capecitabine.
Demographic, pharmacological and clinical variables were evaluated, with progression free survival (PFS) being the variable chosen to evaluate the clinical impact of interaction.
Results:150 patients were included. Of them, 57.33% were men, mean age 70.10±12.06 years; 55.33% had an ECOG 1 and 58.67% used it in PPIs.
39.33% were treated with capecitabine in monotherapy, 31.33% CapeOx, and 20% capecitabine+bevacizumab and 9.33% CapeOx+bevacizumab. 53.33% had a first-line capecitabine-based treatment, the frequency of treatment variations was 42.0% dose reduction, 38.0% delay, and 12% treatment interruption. 78.0% presented any toxicity, (highlighting 34.67% diarrhea and 30.0% hand-foot syndrome).
The mean PFS was 6.69 vs 6.0 months (HR=0.97; 95% CI 0.68-1.39; p=0.87) in favor of patients who did not use IBP, although the relationship was not significant.
Conclusions: In the population studied, patients with mCC who received maintenance treatment based on capecitabine and who used PPIs simultaneously, showed a non-significant trend towards a decrease in PFS.
Key words: Capecitabine, PPI, interactions.
____
INTRODUCCIÓN
Las opciones de tratamiento para pacientes con cáncer colorrectal metastásico (CCRm) se han incrementado significativamente durante las últimas décadas. Durante muchos años, el 5-fluorouracilo (5-FU) intravenoso con o sin leucovorina (5-FU / LV) fue el único tratamiento disponible para estos pacientes.
Las fluoropirimidinas todavía se consideran la columna vertebral del tratamiento sistémico en el CCRm. Sin embargo, varios fármacos han demostrado su eficacia en esta enfermedad, aunque cada uno con diferente magnitud y en distintas líneas de tratamiento. Estos incluyen los fármacos citotóxicos oxaliplatino, irinotecán y trifluridina/tipiracilo, y las terapias dirigidas como bevacizumab (anticuerpo contra el factor de crecimiento endotelial vascular VEGF), aflibercept (anticuerpo contra el receptor para VEGF-A / B y factor de crecimiento placentario), ramucirumab (anticuerpo contra VEGFR-2), cetuximab y panitumumab (anticuerpos contra el receptor del factor de crecimiento epitelial EGFR, restringido a pacientes con tumores RAS de tipo salvaje), regorafenib (un inhibidor multicinasa) y más recientemente, la inmunoterapia (nivolumab, ipilimumab y pembrolizumab)1. Aunque la implementación de algunos de estos fármacos en la práctica habitual es un tema y pembrolizumab de debate continuo, no hay duda de que han contribuido a mejorar el pronóstico de los pacientes con CCRm.
La prolongación de la supervivencia asociada a una mejora o mantenimiento de la calidad de vida es el objetivo principal de los tratamientos. En un grupo limitado y seleccionado de pacientes, algunos de estos fármacos pueden convertir las metástasis irresecables (generalmente hepáticas) en lesiones resecables, con posibilidad de cura2. En conjunto, en ensayos recientes de fase 3 se han reportado tiempos de supervivencia global (SG) de aproximadamente 3 años3, que contrasta en gran medida con la mediana de 7 a 8 meses que se mostró en una serie de pacientes que no recibieron ningún tratamiento. Como consecuencia de que cada vez se consigan mejores datos de supervivencia con tratamientos de mantenimiento, la toxicidad y la estancia hospitalaria asociados con el tratamiento cobran más relevancia4.
El enfoque en la terapéutica oncológica se ha intensificado hacia opciones dirigidas y orales con la esperanza de mejorar la eficacia y limitar los efectos tóxicos. Las terapias orales contra el cáncer se han vuelto cada vez más populares debido a la facilidad de administración, la preferencia del paciente y el menor impacto sobre los recursos sanitarios5.
El 5-FU es un antimetabolito análogo de pirimidina intravenoso que se transforma en 2 metabolitos activos, trifosfato de 5-fluorouridina y monofosfato de 5-fluorodesoxiuridina, que posteriormente interfieren con la síntesis y reparación de proteínas y ADN6,7. La capecitabina es un profármaco que se metaboliza a su forma activa, 5-fluorouracilo (5-FU), en tres pasos enzimáticos. Después de la administración oral, la capecitabina es metabolizada primero por el hígado o la carboxilesterasa intestinal para formar 5′-desoxi-5-fluorocitidina (5′-DFCR). Luego se convierte en 5′-desoxi-5-fluorouridina (5′-DFUR) por la citidina desaminasa expresada en el hígado, y luego en 5-FU por la timidina fosforilasa (TP), que se localiza preferentemente en los tejidos tumorales8,9.
La capecitabina se usa ampliamente en todo el mundo para tratar tumores sólidos, como el CCR, el cáncer gastroesofágico y el cáncer de mama. Se emplea tanto en monoterapia como en terapia combinada con otros fármacos contra el cáncer. La capecitabina es considerada como una terapia equivalente al 5-FU y la leucovorina en el CCR metastásico.
Sin embargo, un problema potencial de la quimioterapia oral es la variabilidad en la absorción en la circulación sistémica10. Fármacos como los inhibidores de la tirosina quinasa (ITK) requieren de pH ácido para disolverse y absorberse11, por lo que hay que tener en cuenta cualquier fármaco que pueda actuar a este nivel.
Los inhibidores de la bomba de protones (IBP) son un grupo de fármacos comúnmente utilizados para tratar la enfermedad por reflujo gastroesofágico y otros trastornos hipersecretores. Estos agentes ejercen sus efectos terapéuticos inactivando las bombas de adenosina trifosfatasa Hþ / Kþ en las células parietales para reducir la secreción de ácido gástrico12. En algunos casos, el reflujo es un efecto secundario gastrointestinal directo de la capecitabina13,17,18.
Se ha demostrado que los IBP alteran la absorción de los agentes anticancerosos orales, posiblemente debido a sus efectos sobre el pH gástrico14. Cada vez existe más literatura que cuestiona la variabilidad farmacocinética entre la administración parenteral y oral. Específicamente, una gran cantidad de ITK dependen de la solubilidad dependiente del pH para disolverse en el estómago y luego ser absorbidos11. Gran parte de estos datos provienen de datos preclínicos en los que las elevaciones del pH gástrico pueden afectar la capacidad de un ITK para disolverse y finalmente alcanzar la circulación sistémica. De hecho, varios estudios retrospectivos han sugerido que la coadministración de IBP o antagonistas del receptor de histamina (antiH2) con ITK pueden conducir a una menor eficacia de erlotinib y sunitinib en pacientes con cáncer de pulmón no microcítico o de células renales en estadios avanzado y/o metastásico respectivamente15,16. Es posible que esta interacción no se limite a los ITK dado que muchos fármacos orales requieren un medio lo suficientemente ácido para disolverse adecuadamente antes de su absorción sistémica.
La evidencia de una interacción farmacológica entre los IBP y otros ITK llevó a un análisis ad hoc del estudio TRIO-013 / LOGiC para investigar si existía una interacción similar con lapatinib. El estudio TRIO-013 / LOGiC fue un ensayo controlado aleatorizado de fase III que investigó capecitabina y oxaliplatino (CapeOx) con o sin lapatinib en cáncer gastroesofágico avanzado y metastásico HER-2 positivo. El grupo de tratamiento con lapatinib no mostró diferencias en la SLP y la SG entre los pacientes en tratamiento con IBP y los que no lo usaban. Sin embargo, se observó una ventaja de supervivencia estadísticamente significativa en el brazo de control de CapeOx que favorecía a los que no tomaban IBP frente a los que lo tomaban, lo que sugiere por primera vez que existía una interacción entre IBP y capecitabina18. Además, existen otros estudios que evaluaron la supervivencia libre de recurrencia en pacientes con estadios iniciales de CCR, obteniendo resultados en la misma línea19,20.
La interacción propuesta se atribuyó a la reducción de la disgregación de los comprimidos de capecitabina debido a los cambios en el pH gástrico por la administración concomitante de IBP, lo que provocó una disminución de la absorción del fármaco. Por el contrario, otros estudios sugieren que los IBP pueden afectar la progresión del CCR en sí, lo que podría ser la causa de estos resultados. Un mecanismo propuesto para esta posible interacción fármaco-enfermedad comienza con la hipergastrinemia inducida por IBP, lo que conduce a un aumento de la proliferación de la mucosa colorrectal21,22. Otra teoría implica el crecimiento excesivo de bacterias intestinales y la formación de sales biliares tóxicas debido a la reducción de la acidez22.
Objetivo del estudio
El objetivo de este estudio es evaluar el impacto clínico que puede tener la interacción de capecitabina con inhibidores de la bomba de protones (IBP) sobre la eficacia del tratamiento de mantenimiento en pacientes con cáncer de colon metastásico (CCm).
MATERIAL Y MÉTODOS
Diseño del estudio y población
Se trata de un estudio observacional retrospectivo realizado en un hospital de grupo 5 según la clasificación norma GRD 2008 del Ministerio de Sanidad Español de 1.200 camas23. El estudio incluyó a todos los pacientes adultos diagnosticados con cáncer de colon metastásico tratados con un régimen basado en capecitabina desde enero de 2013 hasta diciembre de 2016 según los registros de dispensación del Servicio de Farmacia.
Recogida de datos
Se incluyeron pacientes diagnosticados de cáncer de colon metastásico tratados con un régimen basado en capecitabina desde enero de 2013 hasta diciembre de 2016. Se realizó una recogida retrospectiva de datos desde el inicio del tratamiento, y el seguimiento se realizó hasta finalizar su tratamiento con capecitabina o hasta el 31 de diciembre de 2016. Las variables evaluadas fueron las siguientes:
a) Demográficas: sexo y edad al inicio del tratamiento.
b) Diagnósticas: estadio de la enfermedad y estado funcional al inicio del tratamiento.
c) Terapéuticas: ECOG basal, tratamiento con IBP, composición del tratamiento a base de capecitabina, número de líneas de tratamiento previas, toxicidades asociadas y variaciones de tratamiento.
d) Clínicas: se calculó la supervivencia libre de progresión (SLP) como variable para la evaluación del impacto clínico de la interacción.
Para la identificación de pacientes y la recogida de datos, se utilizó el software de dispensación de medicamentos de farmacia hospitalaria para pacientes externos (FARHOS®), los registros médicos electrónicos de atención primaria (HORUS®) y hospitalaria (HCIS®) y el software de prescripción de órdenes de prescripción de oncología (Oncofarm®).
El estadio de la enfermedad se clasificó de acuerdo con la sexta edición del sistema AJCC (American Joint Committee on Cancer). El estado funcional del paciente al inicio del tratamiento se clasificó de acuerdo con la escala de estado funcional (PS) del Eastern Cooperative Oncology Group (ECOG). La progresión de la enfermedad se evaluó clínica o radiológicamente.
Los pacientes se dividieron en dos grupos: a) usuarios de IBP: pacientes en tratamiento con IBP durante ≥20% del tiempo en tratamiento con capecitabina; b) no usuarios de IBP: pacientes en tratamiento con capecitabina, sin IBP o pacientes en tratamiento con IBP durante <20% del tiempo de tratamiento con capecitabina.
Las variaciones del tratamiento se definieron en tres grupos: a) retraso (>3 días); b) reducción de dosis; c) interrupción del tratamiento.
Análisis estadístico
Las variables fueron descritas mediante media y desviación estándar para variables cuantitativas y frecuencia absoluta y relativa para variables cualitativas. Las diferencias iniciales en las características clínicas y demográficas se evaluaron mediante la prueba χ2 o la t de Student, según corresponda.
Se realizaron análisis de supervivencia. La SLP se definió como el tiempo transcurrido desde el inicio del tratamiento hasta la progresión de la enfermedad o la muerte. El análisis de supervivencia se realizó mediante el método de Kaplan Meier. En el análisis de supervivencia, se comparó a los usuarios de IBP con los no usuarios de IBP. Las diferencias entre ambos grupos se determinaron mediante la prueba de Log rank. Se incluyeron en el análisis estadístico los pacientes que continuaron el tratamiento al final del estudio y los que interrumpieron la capecitabina por una razón distinta a la progresión de la enfermedad. Además, se realizó un análisis univariante utilizando el modelo de regresión de Cox para identificar las variables independientes asociadas con la progresión de la enfermedad. El estimador fue al hazard ratio (HR).
Todos los valores de p se calcularon utilizando un intervalo de confianza (IC) del 95% y se consideró significancia estadística con p<0,05.
El análisis estadístico fue realizado con Stata® v15.
RESULTADOS
Pacientes
De los 163 pacientes con CCm tratados con capecitabina durante el período del estudio, finalmente 150 reunieron todos los criterios para ser incluidos en el presente estudio. De ellos, el 54,33% fueron varones, con una edad media de 70,10±12,06 años; El 55,33% tenía un ECOG 1 al inicio del estudio y el 58,67% cumplieron criterios para estar en el grupo de usuarios de IBP.
De todos los pacientes, el 39,33% fueron tratados en algún momento de su seguimiento con capecitabina en monoterapia, el 31,33% con CapeOx, el 9,33% CapeOx+bevacizumab y el 20% capecitabina+bevacizumab. Además, el 56,0% tenía una pauta de tratamiento basada en capecitabina en primera línea para la enfermedad metastásica. Las variaciones en el tratamiento se dieron en el 38,0% como retraso, 42,0% reducción de dosis y 12,0% interrupción del tratamiento. Además, el 78,0% de los pacientes presentaba alguna toxicidad asociada al tratamiento, de los cuales el 34,67% presentaba diarrea y el 30,0% síndrome mano-pie (tabla 1).
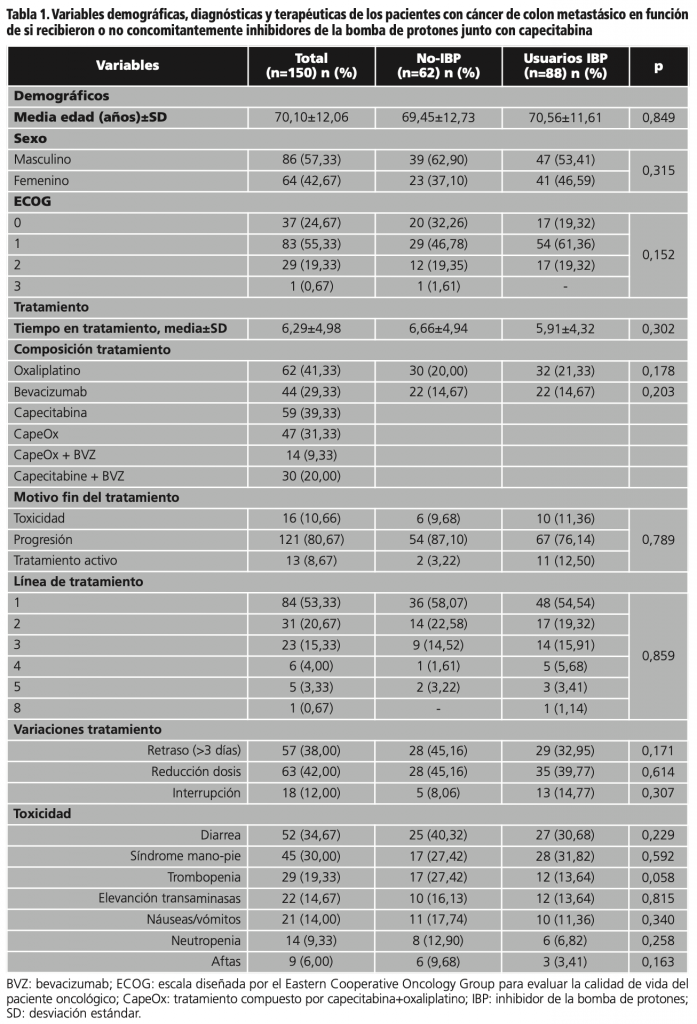
El análisis estadístico concluyó que la distribución de las variables anteriores fue homogénea entre los grupos estudiados en función de la presencia o ausencia de IBP en su tratamiento crónico.
Efecto de los IBP
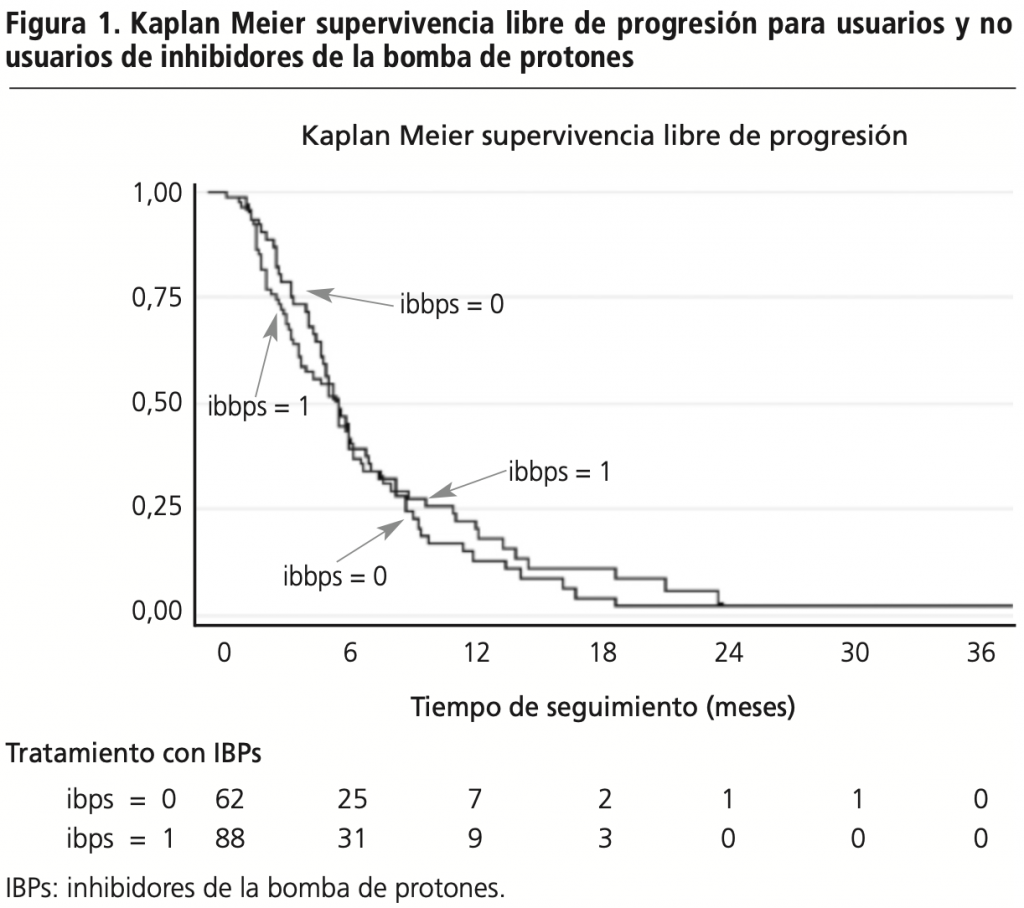
El 58,67% (n=88) de los pacientes incluidos en el estudio estuvieron más de un 20% del tiempo de tratamiento con capecitabina recibiendo tratamiento concomitante con IBP. La SLP media entre ambos grupos fue de 6,69 vs 6,0 meses (HR=0,97; IC95% 0,68-1,39; p=0,87) a favor de los pacientes que no utilizaron IBP (figura 1).
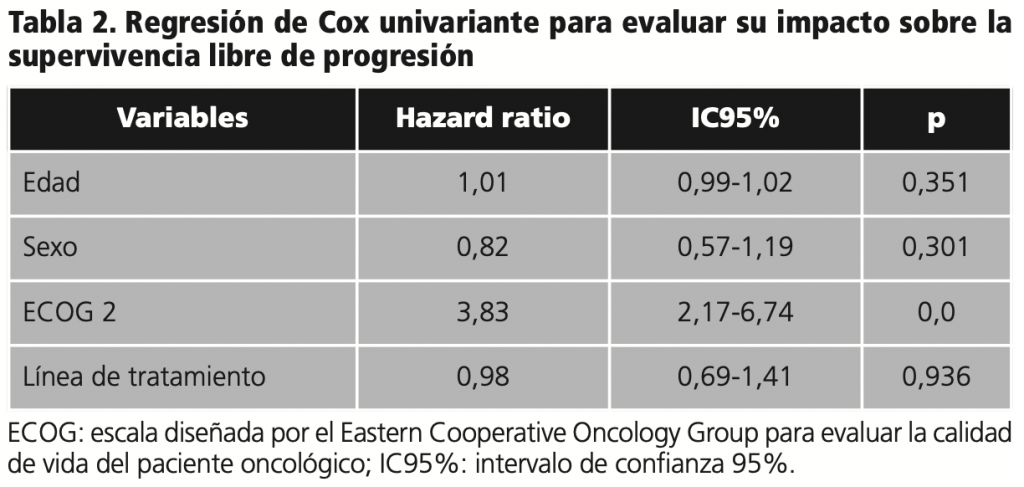
El análisis univariante se realizó empleando el modelo de regresión de Cox, incluyendo edad, sexo, ECOG y línea de tratamiento, el cual tuvo como resultado que ninguna de las variables estudiadas tuvo significación estadística sobre la SLP (tabla 2).
DISCUSIÓN
Los IBP son fármacos ampliamente consumidos por la población en general para prevenir el daño gastrointestinal y para tratar el reflujo gastroesofágico, así como las úlceras gástricas o infecciones por Helicobacter Pylori24,25. Además, existe una alta prevalencia de uso en pacientes oncológicos26-28, especialmente para tratar la irritación gástrica derivada de los AINE y la dexametasona.
Asimismo, la capecitabina es un fármaco muy utilizado en pacientes con CCR, tanto como terapia adyuvante tras cirugía como en tratamiento de mantenimiento en pacientes con CCR en estadios avanzados y metastásicos.
Son varios los estudios que han puesto de manifiesto el impacto negativo potencial que el uso de IBP puede tener sobre la eficacia de capecitabina como agente antitumoral17-20. Sin embargo, estos estudios19,20 se centran en estadios iniciales de la enfermedad (I-III), dejando la evaluación del impacto sobre la eficacia en enfermedad metastásica a un análisis ad hoc del estudio TRIO-013/LOGiC en pacientes con cáncer gastroesofágico HER2+, el cual estaba diseñado para evaluar la eficacia de añadir lapatinib al tratamiento con CapeOx17,18. Por ello, hasta la fecha ningún estudio ha evaluado el impacto que el uso de IBP tiene sobre la eficacia de capecitabina en pacientes con CC en estadios avanzados (metastásicos).
En primer lugar, cabe destacar que en nuestro estudio el motivo de finalización del tratamiento fue la progresión de la enfermedad en más de un 80% de los pacientes y que la terapia con capecitabina fue usada en primera línea de la enfermedad metastásica en un 53,33% de los casos.
El interés del presente estudio frente a los realizados en pacientes en estadios iniciales17-20 de la enfermedad, reside en dos aspectos fundamentales: duración de tratamiento y proporción de uso de IBP. Por un lado, la duración del tratamiento adyuvante en CCR está limitada por lo general a 6 ciclos (18 semanas), mientras que esta duración es más amplia (hasta 6 meses de media) en nuestro estudio. Por otro lado, la proporción de pacientes en tratamiento con IBP es notablemente superior en pacientes con estadios avanzados de la enfermedad (entre el 42% en el estudio TRIO-013/LOGiC y el 58,67% en nuestro estudio) frente a aproximadamente el 25% en los estudios de estadios iniciales18-20. Asimismo, cabe destacar que nuestro estudio es el primero que evalúa esta interacción en la práctica clínica real.
Los resultados de nuestro estudio muestran que no existe una variación significativa en la SLP entre los pacientes que recibieron capecitabina concomitantemente con IBP y los que no los recibieron, en contra de los resultados aportados por los estudios previos. Este resultado puede tener su justificación en dos estudios que evalúan la farmacocinética capecitabina29,30.
Por un lado, Abdi, Z. et al., evaluaron el impacto de la edad avanzada en la farmacocinética de capecitabina y sus metabolitos en pacientes con cáncer de mama y CCR, obteniendo como resultado que, en los pacientes más ancianos, la constante de absorción era inferior a la observada en los grupos de pacientes más jóvenes29. Dado que en nuestro estudio la media de edad se sitúa en torno a los 70 años (frente a los 60 años de media en los estudios previos), este factor puede contribuir a que, independientemente del efecto de los IBP, la capecitabina presentase una tasa de absorción menor y, por tanto, no haya una diferencia estadísticamente significativa entre los resultados de SLP entre ambos grupos.
Por otro lado, Sekido M et al., evaluaron el efecto que un IBP (rabeprazol) tenía sobre la farmacocinética de capecitabina, obteniendo como resultado que rabeprazol no afectaba a la farmacocinética de capecitabina, ya que no hubo alteraciones significativas en el área bajo la curva de concentraciones plasmáticas-tiempo de capecitabina30. Este resultado, cuestionaría la hipótesis de los tres estudios mencionados anteriormente17-20, los cuales justifican la variación en la eficacia del tratamiento de capecitabina en una alteración de su absorción como consecuencia de la variación del pH gástrico inducida por los IBP.
Limitaciones
Una limitación de nuestro estudio es la falta de datos farmacocinéticos para obtener una correlación con los resultados obtenidos. Son necesarios estudios farmacocinéticos para dilucidar el mecanismo exacto de la interacción entre IBP y capecitabina. Otra limitación es que los datos de tratamiento con IBP estuvieron basados en las prescripciones de los mismos en el módulo de prescripción de atención primaria, por lo que es posible que no reflejen con precisión si los pacientes realmente tomaron la medicación. Además, no se tuvo en cuenta el IBP recibido por los pacientes o su dosis.
CONCLUSIONES
En la población estudiada, los pacientes con cáncer de colon metastásico que tuvieron tratamiento de mantenimiento con regímenes basados en capecitabina y que utilizaron de forma simultánea IBP, no presentaron un efecto significativo sobre la supervivencia libre de progresión.
Conflicto de intereses: Los autores declaran no tener conflicto de intereses.
BIBLIOGRAFÍA
1. Benson, A. B., Venook, A. P., Al-Hawary, M. M., Arain, M. A., Chen, Y. J., Ciombor, K. K., … & Gurski, L. A. (2021). Colon cancer, version 2.2021, NCCN clinical practice guidelines in oncology. Journal of the National Comprehensive Cancer Network, 19(3),329-359.
2. Bismuth H, Adam R, Lévi F, et al. Resection of nonresectable liver metastases from colorectal cancer after neoadjuvant chemotherapy. Ann Surg. 1996;224: 509-520.
3. Cremolini C, Loupakis F, Antoniotti C, et al. FOLFOXIRI plus bevacizumab versus FOLFIRI plus bevacizumab as first-line treatment of patients with metastatic colorectal cancer: updated overall survival and molecular subgroup analyses of the open-label, phase 3 TRIBE study. Lancet Oncol. 2015;16(13):1306-1315.
4. Simkens LH, Van Tinteren H, May A, et al. Maintenance treatment with capecitabine and bevacizumab in metastatic colorectal cáncer (CAIRO3): a phase 3 randomised controlled trial of the dutch colorectal cancer group. Lancet. 2015;385(9980):1843-1852.
5. Borner MM, Schoffski P, de Wit R, et al. Patient preference and pharmacokinetics of oral modulated UFT versus intravenous fluorouracil and leucovorin: a randomised crossover trial in advanced colorectal cancer. Eur J Cancer. 2002; 38:349-58.
6. BC Cancer Agency. Drug name: fluorouracil. BC Cancer Agency drug manual. 2015. Available at: http://www.bccancer.bc.ca/drug-database-site/Drug Index/Fluorouracil_monograph_1Sep2015.pdf. Accessed: July 19, 2016.
7. Koukourakis GV, Kouloulias V, Koukourakis MJ, Zacharias GA, Zabatis H, Kouvaris J. Efficacy of the oral fluorouracil pro-drug capecitabine in cáncer treatment: a review. Molecules. 2008;13:1897-922.
8. Reigner B, Blesch K, Weidekamm E. (2001) Clinical pharmacokinetics of capecitabine. Clin Pharmacokinet. 40:85-104
9. Miwa M, Ura M, Nishida M, Sawada N, Ishikawa T, Mori K, Shimma N, Umeda I, Ishitsuka H (1998) Design of a novel oral fluoropyrimidine carbamate, capecitabine, which generates 5-fluorouracil selectively in tumours by enzymes concentrated in human liver and cancer tissue. Eur J Cancer. 34:1274-1281.
10. McLeod HL, Evans WE. Oral cancer chemotherapy: the promise and the pitfalls. Clin Cancer Res. 1999;5:2669-71.
11. Budha NR, Frymoyer A, Smelick GS, et al. Drug absorption interactions between oral targeted anticancer agents and PPIs: is pH-dependent solubility the achilles heel of targeted therapy? Clin Pharmacol Ther. 2012;92:203-13.
12. Robertson DJ, Larsson H, Friis S, Pedersen L, Baron JA, Sørensen HT. Proton pump inhibitor use and risk of colorectal cancer: a population-based, caseecontrol study. Gastroenterology. 2007;133:755-60.
13. Van Cutsem E, Verslype C, Tejpar S. Oral capecitabine: bridging the Atlantic divide in colon cancer treatment. Semin Oncol. 2005;32:43-51.
14. Smelick GS, Heffron TP, Chu L, et al. Prevalence of acid-reducing agents (ARA) in cancer populations and ARA drug-drug interaction potential for molecular targeted agents in clinical development. Mol Pharm. 2013; 10:4055-62.
15. Ha VH, NgoM, Chu MP, Ghosh S, Sawyer MB, Chambers CR. Does gastric acid suppression affect sunitinib efficacy in patients with advanced or metastatic renal cell cancer? J Oncol Pharm Pract. 2014;21(3):194-200.
16. Nieves Sedano N, Caro Teller JM, García Muñoz C, Fernández Redondo D, Ponce Aix S, Menéndez Orenga M, Ferrari Piquero JM. Clinical impact of gastric acid suppressing medication on the effectiveness of tyrosine kinase inhibitors in lung cancer patients. J BUON May-Jun 2018;23(3):647-653.
17. Hecht JR, Bang Y, Qin S, et al. Lapatinib in combination with capecitabine plus oxaliplatin in HER2-positive advanced or metastatic gastric, esophageal, or gastroesophageal adenocarcinoma: the TRIO-013/LOGiC trial. J Clin Oncol. 2013;31(Suppl) (Abstract LBA4001). 2013 ASCO Annual Meeting.
18. Chu MP, Hecht JR, Slamon D, Wainberg ZA, Bang YJ, Hoff PM. Association of Proton Pump Inhibitors and Capecitabine Efficacy in Advanced Gastroesophageal Cancer Secondary Analysis of the TRIO-013/LOGiC Randomized Clinical Trial. JAMA Oncol. 2017 Jun 1;3(6):767-773.
19. Sun J, Ilich AI, Kim CA, Chu MP, Wong GG, Ghosh S. Concomitant Administration of Proton Pump Inhibitors and Capecitabine is Associated with Increased Recurrence Risk in Early Stage Colorectal Cancer Patients. Clin Colorectal Cancer. 2016 Sep;15(3):257-63.
20. Wong GG, Ha V, Chu MP, Dersch-Mills D, Ghosh S, Chambers CR. Effects of Proton Pump Inhibitors on FOLFOX and CapeOx Regimens in Colorectal Cancer. Clin Colorectal Cancer. 2019 Mar;18(1):72-79.
21. Ahn JS, Park SM, Eom CS, Kim S, Myung SK. Use of proton pump inhibitor and risk of colorectal cancer: a meta-analysis of observational studies. Korean J Fam Med. 2012;33:272-9.
22. Graham C, Ramjeesingh R, Orr C, Bricks CS, Hopman WM, Hammad N. A retrospective study on the role of proton pump inhibitors in colorectal cáncer disease survival. Curr Oncol. 2016 Dec;23(6):e583-e588.
23. Departamento de Métodos Cuantitativos en Economía y Gestión. Clasificación de hospitales públicos españoles mediante el uso del análisis de conglomerados [monografía en Internet]. Universidad de Las Palmas de Gran Canaria; 2007 [consultado 14/04/2021]. Disponible en: https://www.mscbs. gob.es/estadEstudios/estadisticas/docs/CMBD/CLASIFICACIONHOSPITALESCLUSTER.pdf.
24. Talley NJ, American Gastroenterological Association. American Gastroenterological Association medical position statement: evaluation of dyspepsia. Gastroenterology. 2005;129:1753-5.
25. Asaka M, Sugiyama T, Kato M, et al. A multicenter, double-blind study on triple therapy with lansoprazole, amoxicillin and clarithromycin for eradication of Helicobacter pylori in Japanese peptic ulcer patients. Helicobacter. 2001; 6:254-61.
26. Smelick GS, Heffron TP, Chu L, et al. Prevalence of acid-reducing agents (ARA) in cancer populations and ARA drug-drug interaction potential for molecular targeted agents in clinical development. Mol Pharm. 2013;10:4055-62.
27. Kim YH, Masago K, Mishima M. Erlotinib and gastrointestinal ulcer. J Thorac Oncol. 2010;5:1108-9.
28. Ryken TC, McDermott M, Robinson PD et al. The role of steroids in the management of brain metastases: a systematic review and evidence-based clinical practice guideline. J Neurooncol. 2010;96:103-14.
29. Abdi, Z. D., Lavau-Denes, S., Prémaud, A., Urien, S., Sauvage, F. L., Martin, J., … & Rousseau, A. (2014). Pharmacokinetics and exposure-effect relationships of capecitabine in elderly patients with breast or colorectal cancer. Cancer chemotherapy and pharmacology, 73(6),1285-1293.
30. Sekido, M., Fujita, K. I., Kubota, Y., Ishida, H., Takahashi, T., Ohkuma, R., … & Sasaki, Y. (2019). Rabeprazole intake does not affect systemic exposure to capecitabine and its metabolites, 5′-deoxy-5-fluorocytidine, 5′-deoxy-5-fluorouridine, and 5-fluorouracil. Cancer chemotherapy and pharmacology, 83(6), 1127-1135.
___