Rosado-Hernández F1, Maza-Larrea JA2, Peredo-Gómez KM3, Vázquez-Rangel A4, Rojas-Velasco G5
1 Centro Institucional de Farmacovigilancia. Instituto Nacional de Cardiología. Ciudad de México (México)
2 Departamento de Farmacología Clínica. Instituto Nacional de Cardiología. Ciudad de México (México)
3 Departamento de Seguimiento Farmacoterapéutico. Instituto Nacional de Cardiología. Ciudad de México (México)
4 Departamento de Nefrología del Instituto Nacional de Cardiología Ignacio Chávez. Ciudad de México (México)
5 Unidad de Terapia Intensiva del Instituto Nacional de Cardiología Ignacio Chávez. Ciudad de México (México)
Fecha de recepción: 21/01/2022 – Fecha de aceptación: 12/03/2022
Correspondencia: Med/Q.F.B. José Antonio Maza Larrea w Departamento de Farmacología Clínica del Instituto Nacional de Cardiología Ignacio Chávez w Juan Badiano No. 01. Col. Selección XVI, Alcaldía Tlalpan w 14080 Zona de Hospitales Tlalpan, Ciudad de México (México)
jose.maza@cardiologia.org.mx
____
RESUMEN
Introducción: La enfermedad de COVID-19, es una enfermedad emergente cuya patogénesis se relaciona con la tormenta de citocina, la interleucina 6 juega un papel importante en la tormenta de citocinas. El medicamento tocilizumab, es un anticuerpo monoclonal humanizado, el cual se une al receptor soluble IL-6. En pacientes con COVID-19 se ha observado que el uso de tocilizumab disminuye la inflamación exacerbada. Ante este nuevo uso del medicamento es relevante establecer el balance beneficio-riesgo en estos pacientes con COVID-19, identificando con ello las reacciones adversas a medicamentos que pueden estar relacionadas al uso de tocilizumab.
Materiales y métodos: Estudio de farmacovigilancia descriptivo y transversal en una cohorte retrospectiva en pacientes sospechosos o confirmados por COVID-19 en el Instituto Nacional de Cardiología Ignacio Chávez de la Ciudad de México, México en el periodo 05 de mayo del 2020 al 20 de enero del 2021.
Resultados: De los 36 pacientes participantes en este estudio, la edad promedio fue 53 años, de los cuales 30 fueron hombres y 6 fueron mujeres. Las comorbilidades identificadas en este estudio fue la hipertensión arterial sistémica, seguida de la diabetes mellitus tipo II. En la evaluación de los estudios de laboratorio se observó que 2 pacientes desarollaron neutropenia moderada, mientras que en 5 pacientes se identificó trombocitopenia leve y 2 pacientes desarrollaron trombocitopenia moderada. Las infecciones bacterianas identificadas en el estudio con el uso del medicamento fueron: 5 aislamientos de Klebsiella oxytoca, 4 a Escherichia coli y 4 a Pseudomonas aeruginosa.
Conclusión: Al conocer las posibles reacciones adversas a medicamento en los pacientes con COVID-19 que se les administro tocilizumab, nos permitió identificar los riesgos asociados al medicamento, determinado el perfil de seguridad y poder estar alerta de infecciones bacterianas, neutropenias y trombocitopenias, mediante un seguimiento farmacoterapéutico y con ello identificar tempranamente alteraciones posiblemente asociadas al uso de tocilizumab.
Palabras clave: COVID-19, SARS-CoV-2, farmacovigilancia, reacciones adversas al medicamento, tocilizumab.
Evaluation of the safety profile of the drug tocilizumab in patients suspected or confirmed by COVID-19
SUMMARY
Introduction: COVID-19 is a new emerging disease which pathogenesis is mediated by a cytokines storm, interleukin 6 plays an important part of this storm. Tocilizumab is a humanized monoclonal antibody that binds to the IL-6 receptor. In patient with COVID-19, exacerbated inflammation has been observed to decrease when given tocilizumab. Due to the new use of this drug is relevant to stablish the risk-benefit ratio in COVID-19 patients, by identifying the drug adverse reactions that may be related to the use of tocilizumab.
Material and methods: Descriptive and cross-sectional pharmacovigilance study in a retrospective cohort in patients suspected or confirmed by COVID-19 in the National Institute of Cardiology in Mexico City, Mexico from May 5, 2020 to January 20, 2021.
Outcomes: From 36 patients in this study, the average age was 53 years of which 30 were men and 6 were women. The comorbidities identified in this study were systemic arterial hypertension followed by type II diabetes mellitus. Evaluating the laboratory results we observed 2 patients developed moderate neutropenia, 5 patients presented mild thrombocytopenia and 2 patients moderate thrombocytopenia. The bacterial infections identified in the study with the use of the tocilizumab were: 5 isolates Klebsiella oxytoca, 4 isolates Escherichia coli and 4 Pseudomonas aeruginosa.
Conclusion: Knowing the possible drug adverse reactions that occurred in patients with COVID-19 who were administered tocilizumab, allow us to the identify the risks associated with the drug, determining the safety profile and be alert of bacterial infections, neutropenia, and thrombocytopenia, throughout a pharmacotherapeutical follow up, thereby identifying possible associated alterations possibly restated with the use of tocilizumab.
Key words: COVID-19, SARS-CoV-2, pharmacovigilance, adverse drug reactions, tocilizumab.
____
INTRODUCCIÓN
La enfermedad de COVID-19, es una nueva enfermedad emergente asociada a patogénesis complicada. Sin embargo, los estudios de laboratorio demuestran que la tormenta de citocinas juega un papel importante en la enfermedad SARS-CoV-21 y se ha observado que la interleucina 6, juega un papel importante en la tormenta de citocinas, por lo cual los agentes anti-IL6 se han propuesto como un tratamiento primordial para combatir la enfermedad de COVID-192,3.
La terapéutica propuesta para el tratamiento de la infección por SARS-CoV-2 engloba tantos tratamientos farmacológicos y no farmacológicos. Dentro de los tratamientos no farmacológicos tenemos: la oxigenoterapia, ventilación mecánica invasiva y no invasiva, la posición prona y oxigenación por membrana extracorpórea (ECMO). Por otra parte, las opciones farmacológicas como: corticoesteroides (dexametasona, prednisolona y metilprednisolona), retrovirales (remdesivir, lopinavir/ritonavir) y antiinflamatorios como tocilizumab han sido utilizados para mejoras la sintomatología por COVID-194.
El medicamento tocilizumab, es un anticuerpo monoclonal humanizado el cual se une en la membra como en el recepto soluble IL-6, que está indicado para la artritis reumatoide, pero en pacientes con COVID-19 se ha observado que disminuye la inflamación exacerbada en estos pacientes5.
Stone et al. en su estudio doble ciego aleatorizado y controlado, utilizaron el medicamento tocilizumab, para valorar la eficacia de bloquear el receptor de la interleucina 6 en el síndrome hiperinflamatorio en pacientes COVID-19, donde concluyeron que el tocilizumab no fue efectivo para prevenir a la intubación o muerte en los estados moderados o graves en pacientes COVID-19, pero si en disminuir la inflamación6.
El perfil de seguridad de los medicamentos, pueden ser evaluados mediante los estudios de farmacovigilancia, porque estos estudios permiten identificar reacciones adversas al medicamento en estudios clínicos y post-comercialización. En los pacientes enfermos por COVID-19, se tiene poca información sobre su seguridad y se ha asociado un riesgo mayor de infecciones secundarias, después de la terapia con tocilizumab y corticoides7. Las reacciones adversas más graves identificadas en los pacientes tratados con tocilizumab fueron infecciones graves, neutropenia y/o trombocitopenia entre otros8. Ante este nuevo uso del medicamento es relevante establecer el balance beneficio riesgo en estos pacientes con COVID-19, identificando con ello las reacciones adversas a medicamentos que pueden estar relacionadas al uso de tocilizumab.
MATERIALES Y MÉTODOS
Diseño del estudio
Estudio de farmacovigilancia descriptivo, transversal en una cohorte retrospectiva en los pacientes sospechosos o confirmados por COVID-19 en el Instituto Nacional de Cardiología Ignacio Chávez de la Ciudad de México, México en el periodo 05 de mayo del 2020 al 20 de enero del 2021.
Selección de los pacientes
Los pacientes infectados por SARS-CoV-2 fueron seleccionados con base en los criterios establecidos por la Secretaría de Salud de México9 mismos a los que se les administró tocilizumab con una dosis única (6 mg/kg peso corporal) por vía intravenosa más el tratamiento estándar establecido por el Instituto Nacional de Cardiología Ignacio Chávez.
Los criterios de elegibilidad en el uso del medicamento tocilizumab fueron: pacientes sin infecciones concomitantes previas a la administración del medicamento, enzimas hepáticas >5x límites superior normal (LSN), número total de plaquetas <100 x 109/L, número total de neutrófilos <1,5 x 109/L o cualquier historial médico conocido por diverticulosis o perforación gastrointestinal con base a las contraindicaciones de las características del medicamento.
Identificación de las reacciones adversas al medicamento
Se evaluaron a 36 pacientes sospechosos o confirmados de COVID-19, quienes recibieron una única dosis de tocilizumab en un rango de 400 mg a 800 mg por paciente en vía intravenosa más el tratamiento estándar para combatir síntomas y signos de COVID-19. Las reacciones adversas al medicamento, fueron clasificadas por dos farmacéuticos clínicos mediante el diccionario MedDRA 23.010; usando la clasificación por Órganos y Sistemas (SOC) y termino preferente (PT) para ser reportados en el software Vigiflow®.
Los pacientes fueron monitoreados a partir de la administración del medicamento tocilizumab, evaluándose los siguientes laboratorios: neutrófilos (10^3/µL) y plaquetas (10^3/µL), enzimas hepáticas AST (U/L) y ALT (U/L), de los cuales tomamos los valores de referencia del laboratorio clínico del Instituto Nacional de Cardiología Ignacio Chávez y monitoreados por 14 días, ver tabla 1.
Por otra parte, también se monitoreo las reacciones adversas de las infecciones bacterianas o fúngicas secundarias a la administración posterior del tocilizumab durante 28 días en los pacientes11.
Evaluación del número total de neutrófilos por el efecto de tocilizumab
En la evaluación del efecto del medicamento tocilizumab en el número total de neutrófilos, se monitorearon a los pacientes por 14 días posterior a la administración del medicamento y se clasificó el grado de severidad de la neutropenia mediante los criterios terminológicos comunes para eventos adversos (siglas en inglés, CTCAE)12, ver tabla 2.
Evaluación del número total de plaquetas por el efecto de tocilizumab
El efecto del medicamento tocilizumab en el número total de plaquetas, se clasificó la severidad de la trombocitopenia con base a la tabla 313, posterior a la administración del medicamento, donde se monitoreo por 14 días a los pacientes para observar el efecto del medicamento.
Evaluación del efecto de las enzimas hepáticas (AST/ALT) por tocilizumab
Para llevar a cabo la evaluación de las enzimas hepáticas, utilizamos la guía del grupo de Consejo de Organizaciones Internacionales de Ciencias Médicas (siglas en inglés, CIOMS) Drug-induced livery injury (DILI)14. Se revisó el expediente clínico de los pacientes en los que se revisó antecedentes patológicos, estudios de laboratorio (química clínica) y medicamentos concomitantes, donde registramos diariamente los datos de las enzimas hepáticas (AST/ALT) a partir de la administración del medicamento hasta un seguimiento de 14 días. Se considero un efecto del medicamento cuando posterior a la administración de medicamento se observa un incremento de las enzimas AST/ALT con base a la siguiente tabla 4.
Evaluación de las infecciones secundarias
Se evaluaron la identificación de las infecciones bacterianas o fúngicas secundarias, posterior a la administración del medicamento tocilizumab, tomando solo aquellas infecciones secundarias que aparecieron al 2 día de la administración del medicamento y con un monitoreo de 28 días15.
Análisis estadístico
Las variables cualitativas nominales fueron representadas en porcentajes y frecuencias, así como la posible asociación entre las variables cualitativas nominales se utilizo la Chi cuadrada de Pearson.
RESULTADOS
Los datos demográficos de los 36 pacientes fueron: 30 hombres (83,3%) y 6 mujeres (16,6%) del presente estudio. La edad promedio que se identificó en hombres (53 años) y mujeres (50 años). Las comorbilidades que se identificaron fueron: 9 pacientes con diabetes mellitus tipo II, de los cuales 5 hombres y 4 mujeres; mientras que la hipertensión arterial sistémica fueron 11 hombres y 3 mujeres (tabla 5).
Evaluación del número total de neutrófilos por el efecto de tocilizumab
Dentro de lo resultados observamos que no existe una disminución significativa de los neutrófilos posterior a la administración del medicamento tocilizumab. Solo se observó que en 2/36 (6%) pacientes entre los días 06 al día 09 posterior a la administración se presentó una disminución entre 1,5 10^3/L a 1,4 10^3/L (neutropenia moderada), pero se observó que en el día 10 empezó un incremento progresivo de los neutrófilos en ambos pacientes (tabla 6).
Evaluación del número total de plaquetas por el efecto de tocilizumab
De los 36 pacientes evaluados sobre el efecto en las plaquetas observamos que 7 (19,4%) pacientes presentaron diferentes grados de trombocitopenia como se muestran en los siguientes resultados en la tabla 7. Es importante señalar que la identificación de las trombocitopenias apareció en los primero tres días posteriores a la administración del medicamento tocilizumab.
Evaluación del efecto de las enzimas hepáticas (AST/ALT) por tocilizumab
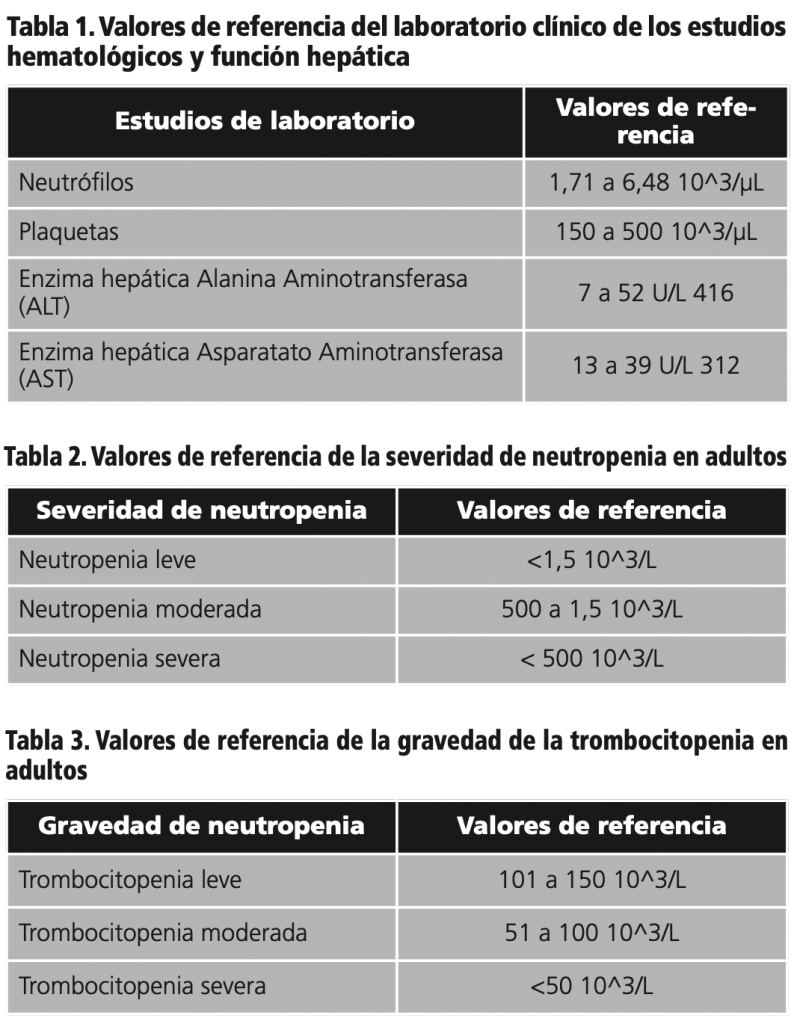
Un solo paciente desarrolló daño al hígado inducida por medicamento (DILI) causa por el tocilizumab; el cual incremento 8 veces por el límite superior de lo normalizado (LSN), lo cual se describe como un incremento de ALT (416) U/L / AST (312) U/L. Este paciente incrementó progresivamente la enzima ALT desde el día 07 posterior a la administración hasta alcanzar en el día 10 un incremento a 722 U/L (8x LSN), lo cual se refiere como DILI en este paciente, ver figura 1.
Evaluación de las infecciones secundarias
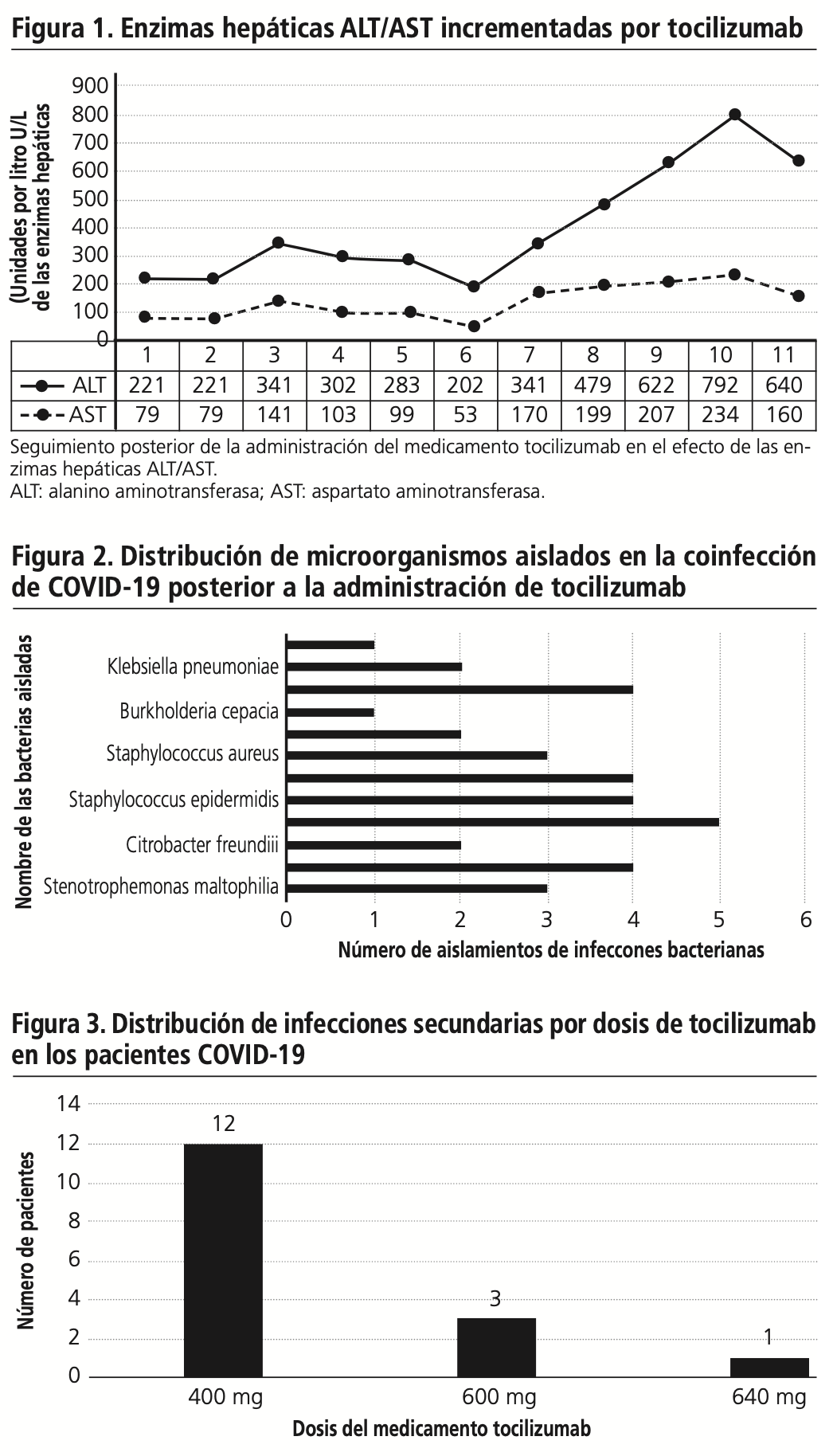
Nosotros identificamos 16/36 (44%) pacientes, quienes desarrollaron infecciones bacterianas o fúngicas posterior a la administración del tocilizumab, dentro de las cuales las demostramos en el siguiente gráfico de distribución de microrganismo asilados, (figura 2).
Además, deseábamos conocer si existía relación entre la dosis y la aparición de las infecciones secundarias, donde encontramos que la dosis de 400 mg de tocilizumab se identificaron una mayor distribución de las infecciones, pero esta no puede ser correlacionada directamente a la dosis del medicamento en el presente estudio, porque no tuvimos el mismo número de pacientes con la dosis de 640 mg, lo cual no es comparable en el presente estudio (figura 3).
Con base en el resumen de las caractéristicas del medicamento tocilizumab, un riesgo identificado importante son las infecciones secundarias en pacientes diabéticos con el medicamento, por lo cual nosotros encontramos que los pacientes no diabéticos (codificado 0) presentaron una asociación mayor de infecciones secundarias en comparación a los pacientes diabéticos (codificado 1) con Chi X2 Pearson = 0,14, lo cual indica que no es estadisticamente significativo en la asociación de las variables cualitativas (tabla 8).
DISCUSIÓN
Al valorar la seguridad del medicamento tocilizumab en pacientes sospechosos o confirmados por COVID-19 y evaluar los eventos adversos que se identificaron durante el monitoreo de 28 días en nuestro estudio, donde encontramos que las infecciones secundarias fueron identificadas en los primero 8 días posteriores a la administración de una sola dosis de tocilizumab, esto lo podemos comparar con el estudio retrospectivo de Campochiaro et al., donde evaluaron la seguridad y eficacia durante 28 días e identificando una tasa de infección de una sola dosis de tocilizumab (9%) en comparación con una segunda dosis de tocilizumab (33%), con una p=0,0611. Además, los resultados sobre la seguridad del medicamento tocilizumab se evaluó en otro estudio clínico aleatorizado, donde se clasificaron en un grupo con tocilizumab en comparación al placebo más tratamiento estándar por Salama et al., y se identificó que en el grupo de tocilizumab 38 de los 250 (15,2%) pacientes desarrollaron eventos adversos graves en comparación al grupo del placebo más tratamiento estándar que fueron 25 de los 127 (19,7%) pacientes16, mientras que nosotros no encontramos eventos adversos graves en nuestro estudio. En un estudio de seguimiento a largo plazo el grupo de Pettit et al., encontraron que las personas que recibieron el medicamento tocilizumab con enfermedad grave de COVID-19, aparecieron más infecciones secundarias tardías. Además, que un número considerado casos tuvieron complicaciones relacionadas con tocilizumab, como prueba de función hepática alteradas y reacción alérgica relacionada con la infusión, por lo cual nosotros solo encontramos que un solo paciente presento daño al hígado inducido al medicamento tocilizumab17.
CONCLUSIONES
Este estudio de farmacovigilancia activa nos permiten evaluar la seguridad del medicamento tocilizumab en los pacientes con COVID-19, identificando los riesgos asociados al medicamento y poder prever daño a los pacientes con COVID-19, observamos que las infecciones bacterianas, son la posible reacción adversa a medicamentos mayormente identificada en el presente estudio, seguidas de las alteraciones de laboratorio como neutropenia y trombocitopenias, por lo cual se sugiere realizar un seguimiento farmacoterapéutico para identificar alteraciones de laboratorio e infecciones bacterianas posiblemente asociadas en el uso del medicamento tocilizumab. Por otra parte, no encontramos la necesidad de ajustar dosis del medicamento tocilizumab en los pacientes con COVID-19 ni tampoco observamos que en los pacientes con comorbilidades como diabetes mellitus tipo II existiera un incremento de las infecciones secundarias posterior a la administración del medicamento de tocilizumab.
Confidencialidad: La información obtenida en el presente artículo fue manejada bajos criterios de confidencialidad respetando así la información personal de los pacientes.
Financiamiento: El presente estudio no fue patrocinado por ninguna institucional gubernamental de México, ni laboratorio farmacéutico ni cualquier otra.
Reacciones adversad a los medicamentos: En el presente estudio del medicamento tocilizumab fueron reportadas todas las recciones adversas al medicamento al Centro Nacional de Farmacovigilancia (CNFV) de la Comisión Federal para la Protección contra Riesgos Sanitarios (COFEPRIS).
Agradecimientos: Dra. Karol S. Luna Buendía de la Universidad West-Hill, Facultad de Medicina y al Dr. Alejandro Quiroz-Martínez, líder del Departamento de Cardiología 8° Piso del Instituto Nacional de Cardiología Chávez, Ciudad de México, México.
Conflicto de intereses: Los autores declaran no tener conflicto de intereses.
BIBLIOGRAFÍA
1. Lan, S. H., Lai, C. C., Huang, H. T., Chang, S. P., Lu, L. C., & Hsueh, P. R. (2020). Tocilizumab for severe COVID-19: a systematic review and meta-analysis. International Journal of Antimicrobial Agents, 56(3), 106103.
2. Zhang C, Wu Z, Li JW, Zhao H, Wang GQ. The cytokine release syndrome (CRS) of severe COVID-19 and interleukin-6 receptor (IL-6R) antagonist tocilizumab may be the key to reduce the mortality. Int J Antimicrob Agents 2020;55:105954.
3. Zhang S, Li L, Shen A, Chen Y, Qi Z. Rational use of tocilizumab in the treatment of novel coronavirus pneumonia. Clin Drug Investig. 2020;40:511-18.
4. Protocolo de manejo para la infección por COVID-19. Medigraphic. https://www.medigraphic.com/pdfs/medcri/ ti-2020/ti201c.pdf.
5. Agencia Europa de Medicamentos. Anexo I. Ficha Técnica o Resumen de las Características del Producto. https://www.ema.europa.eu/en/documents/ product-information/roactemra-epar-product-information_es.pdf.
6. Stone, J. H., Frigault, M. J., Serling-Boyd, N. J., Fernandes, A. D., Harvey, L., Foulkes, A. S., Horick, N. K., Healy, B. C., Shah, R., Bensaci, A. M., Woolley, A. E., Nikiforow, S., Lin, N., Sagar, M., Schrager, H., Huckins, D. S., Axelrod, M., Pincus, M. D., Fleisher, J., Sacks, C. A., … BACC Bay Tocilizumab Trial Investigators (2020). Efficacy of Tocilizumab in Patients Hospitalized with Covid-19. The New England Journal of Medicine. 383(24), 2333-2344.
7 . Busani S., Bedini A., Biagioni E., Serio L., Tonelli R. Two fatal cases of acute liver failure due to HSV-1 infection in COVID-19 patients following immunomodulatory therapies. Clin Infect Dis. 2020.
8 . AEMPS. Tratamientos disponibles sujetos a condiciones especiales de acceso para el manejo de la infección respiratoria por SARS-CoV-2 [consultado 7 de octubre de 2020].
9. Dirección General de Epidemiologia. Lineamientos estandarizado para la vigilancia epidemiológica y por laboratorio de la enfermedad respiratoria viral. Enero 2021.
10. Medical Dictionary for Regulatory Activities (MedDRA) versión 23.0 https://www.meddra.org/how-to-use/support-documentation/spanish.
11. Campochiaro, C., Della-Torre, E., Cavalli, G., De Luca, G., Ripa, M., Boffini, N., Tomelleri, A., Baldissera, E., Rovere-Querini, P., Ruggeri, A., Monti, G., De Cobelli, F., Zangrillo, A., Tresoldi, M., Castagna, A., Dagna, L., & TOCI-RAF Study Group (2020). Efficacy and safety of tocilizumab in severe COVID-19 patients: a single-centre retrospective cohort study. European Journal of Internal Medicine. 76, 43-49. https://doi.org/10.1016/j.ejim.2020.05.021.
12. Boxer LA. How to approach neutropenia. Hematology Am Soc Hematol Educ Program. 2012;2012:174-182. doi: 10.1182/asheducation.V2012.1.174.3798251.
13. Erkurt, M.A., Kaya, E., Berber, I., Koroglu, M., & Kuku, I. (2012). Thrombocytopenia in Adults: Review Article. Journal of Hematology. 1, 44-53.
14. Drug-induced liver injury (DILI): Current status and future directions for drug development and the post-market setting. A consensus by a CIOMS Working Group. Geneva, Switzerland: Council for International Organizations of Medical Sciences (CIOMS), 2020.
15. Sciascia S, Aprà F, Baffa A. Pilot prospective open, single-arm multicentre study on off-label use of tocilizumab in severe patients with COVID-19. Clin Exp Rheumatol. 2020 May 1 [PubMed] [Google Scholar].
16. Lundh A. (2021). Tocilizumab in Patients Hospitalized with Covid-19 Pneumonia. The New England Journal of Medicine. 384(15),1473. https://doi.org/ 10.1056/NEJMc2100217.
17. Chaudhry, D., & Singh, P. K. (2020). Tocilizumab and COVID-19. Indian journal of critical care medicine: peer-reviewed, official publication of Indian Society of Critical Care Medicine. 24(9),741-743. https://doi.org/10.5005/jp-journals-10071-23608.
____