Rev. OFIL 2017, 27;4:335-340
Fecha de recepción: 03/10/2016 – Fecha de aceptación: 28/02/2017
Alonso Domínguez MT, Nájera Pérez MD, Soria Soto M, Titos Arcos JC, León Villar J, Sánchez Catalicio MM
Servicio de Farmacia. Hospital Universitario Morales Meseguer. Murcia (España)
____
Correspondencia:
Mª Teresa Alonso Domínguez
Servicio de Farmacia
Hospital Universitario Morales Meseguer
Avda. Marqués de los Vélez, s/n
30008 Murcia
Correo electrónico: Teresaldo87@gmail.com
____
RESUMEN
Objetivo: Analizar la efectividad y seguridad del uso del regorafenib en pacientes con cáncer colorectal metastásico de un hospital general en la práctica clínica.
Métodos: Estudio retrospectivo observacional de 18 meses donde se incluyeron pacientes que iniciaron con regorafenib. Se recogieron las siguientes variables: edad, sexo, escala ECOG (Eastern Cooperative Oncology Group), dosis inicial y ajuste; gen K-RAS (mutado-nativo), líneas de tratamiento previas, y reacciones adversas (RA). En cuanto a la efectividad: Supervivencia global (SG), supervivencia libre de progresión (SLP), respuesta al tratamiento según criterios RECIST (Response Evaluation Criteria in Solid Tumors); duración de la terapia y motivo de suspensión.
Resultados: Iniciaron tratamiento 33 pacientes con una mediana de edad de 60 años (36-79), siendo el 51,5% (17) varones, y una mediana de tratamiento de 3,3 meses (0,4-17,3). El 72,7% (24) iniciaron tratamiento con ECOG 0-1. El 57,5% (19) fue K-RAS mutado y una mediana de líneas previas de 3 (1-5). El 84,8% (28) de los pacientes iniciaron con dosis plenas (160 mg), y al 33,3% (11) del total se le ajustó la dosis. La mediana de meses de tratamiento fue 3,3 (0,4-17,3); de SLP 3,8 (0,4-17,3) y de SG 4,6 meses (0,4-11,4 ). El 84,8% (28) de los pacientes sufrieron RA, al 87,8% (29) se le evalúo la respuesta siendo progresión de enfermedad en el 72,4% (21).
Conclusión: Los mejores resultados se observaron en pacientes con mejor ECOG. El estado K-RAS no influyó en la supervivencia. Se requieren futuros esfuerzos para reconocer aquellos subgrupos de pacientes que obtendrían mayores beneficios, teniendo en cuenta el elevado número de RA.
Palabras clave: Regorafenib, cáncer colon metastásico, efectividad, seguridad.
____
INTRODUCCIÓN
El cáncer colorectal (CCR) es el segundo cáncer más común en Europa y el tercero del mundo, después de los cánceres de pulmón y mama. En España, la tasa estimada ajustada por edad oscila entre 45-65 nuevos casos por cada 100.000 habitantes para hombres y en 24-36 casos por cada 100.000 habitantes para mujeres, con una mortalidad ajustada por edad de entre 17-26/100.000 y 8-12/100.000 habitantes para hombres y mujeres respectivamente. La mayoría de los pacientes con CCR tienen más de 60 años en el diagnóstico y no es frecuente en menores de 40 años1,2.
Se estima que entre un 20-35% de los pacientes son diagnosticados inicialmente con CCR en estadío metastásico, y que un 20-25% de los pacientes desarrollarán metástasis durante el tratamiento3,4. Se sabe que existen alteraciones moleculares, las cuales predisponen a los pacientes a sufrir este tipo de enfermedad3,4. Uno de los genes más habituales es el K-RAS, cuyo estado de mutación sirve como factor predictivo de la respuesta a terapias especificas frente al receptor del factor de crecimiento epidérmico (EGFR)5.
Durante la última década, el pronóstico de los pacientes con CCR metastásico ha mejorado debido a la disponibilidad de nuevos fármacos. No obstante, muchos pacientes progresan tras las terapias estándar manteniendo un buen estado general, siendo candidatos a continuar con más líneas de tratamiento. Las nuevas terapias incluyen el anticuerpo monoclonal bevacizumab frente al factor de crecimiento del endotelio vascular (VEGF); el cetuximab y panitumumab frente al EGFR para pacientes con estado RAS nativo. Como tratamiento de segunda línea, se dispone de otros agentes, como el aflibercept frente a los receptores de VEGF1 y 2, y el regorafenib, inhibidor de la tirosina multikinasa (TKI)6.
El regorafenib es un fármaco antitumoral, vía oral, que bloquea varias proteinquinasas, incluidas las quinasas implicadas en la angiogénesis tumoral (VEGFR1, -2, -3, TIE2), la oncogénesis (KIT, RET, RAF-1, BRAF, BRAFV600E) y el microambiente tumoral (PDGFR, FGFR). La dosis recomendada es de 160 mg (4 comprimidos de 40 mg), administrados una vez al día durante 3 semanas, seguidas de 1 semana de descanso. El periodo completo de 4 semanas es un ciclo. Se debe continuar con este tratamiento mientras se observen beneficios o hasta la aparición de toxicidad inaceptable7.
Las indicaciones aprobadas por la EMEA y la FDA para el regorafenib son las siguientes8:
– En pacientes adultos ya tratados con: CCR metastásico previamente tratados con las terapias disponibles o no se les considera candidatos adecuados a dichas terapias (fluoropirimidinas, terapia anti-VEGF y terapia anti-EGFR).
– En GIST (gastrointestinal stromal tumors): irresecables o metastáticos que progresaron con imatinib y sunitinib o son intolerantes al mismo.
Nos proponemos un estudio para analizar la efectividad y seguridad del regorafenib en la práctica habitual en un hospital de tercer nivel, en una serie de pacientes de manera retrospectiva.
Nos planteamos los siguientes objetivos:
• Conocer las características de dichos pacientes en un hospital general.
• Analizar la SLP, SG y duración de tratamiento, así como la tasa de respuesta al tratamiento.
• Analizar las características de los pacientes que continuaron en tratamiento a fecha fin del estudio.
• Analizar las reacciones adversas (RA).
• Analizar el coste de tratamiento directo derivado de la utilización de regorafenib.
MATERIALES Y MÉTODOS
Se realizó un estudio retrospectivo, observacional durante 18 meses (noviembre 2013 – abril 2015) en el que se incluyeron todos los pacientes que iniciaron con regorafenib.
Se recogieron las siguientes variables: edad, sexo, escala Eastern Cooperative Oncology Group (ECOG), localización, dosis inicial y ajuste; tipo de gen K-RAS (mutado-nativo) y líneas de tratamiento previas. En cuanto a la efectividad, fueron recogidas las siguientes variables: SG, SLP, tasa de respuesta al tratamiento: enfermedad estable (EE), respuesta parcial (RP) y progresión de la enfermedad (PE), según criterios RECIST (Response Evaluation Criteria in Solid Tumors), y duración de la terapia. La tasa de respuesta fue medida en función de cada paciente y de su situación clínica. La evaluación de la seguridad se realizó mediante la notificación de las RA y la suspensión del tratamiento. Las RA fueron clasificados según los criterios de terminología comunes del Instituto Nacional del Cáncer (CTCAE versión 4.0).
Así mismo se calculó el precio medio por paciente.
Como criterios de inclusión, se incluyeron todos los pacientes que iniciaron regorafenib. Las características de los pacientes incluidos se compararon con las características de los pacientes que participaron en los ensayos pivotales.
El regorafenib se trató de manera individualizada, requiriendo la conformidad de la Dirección del centro para su prescripción y dispensación.
Los datos de los pacientes se trataron de manera confidencial, la base de datos utilizada y la información de los pacientes fue registrada de manera anonimizada. Las recogida de datos se realizó mediante consulta del programa informático de historias clínicas (Selene®), programa de prescripción y validación (SAVAC®) y programa informático de prescripción y validación de citostáticos (Farmis_Oncofarm®). El análisis estadístico se llevó a cabo en el programa SPSS versión 20 relacionando la SG y la SLP con las siguientes variables: sexo y edad, ECOG al inicio del tratamiento, estado K-RAS, número de líneas de tratamiento previas, ajuste de dosis. El método estadístico aplicado fue Kaplain-Meier.
RESULTADOS
Durante los 18 meses en los que se desarrolló el estudio iniciaron tratamiento con regorafenib 31 pacientes con CCR y 2 pacientes con GIST. Las características de los pacientes y del tratamiento se describen en la tabla 1. A la fecha de corte del estudio, el 33,33% (11) de los pacientes fallecieron, al 51,51% (17) le suspendieron el tratamiento y tan sólo el 15,15% (5) continúan.
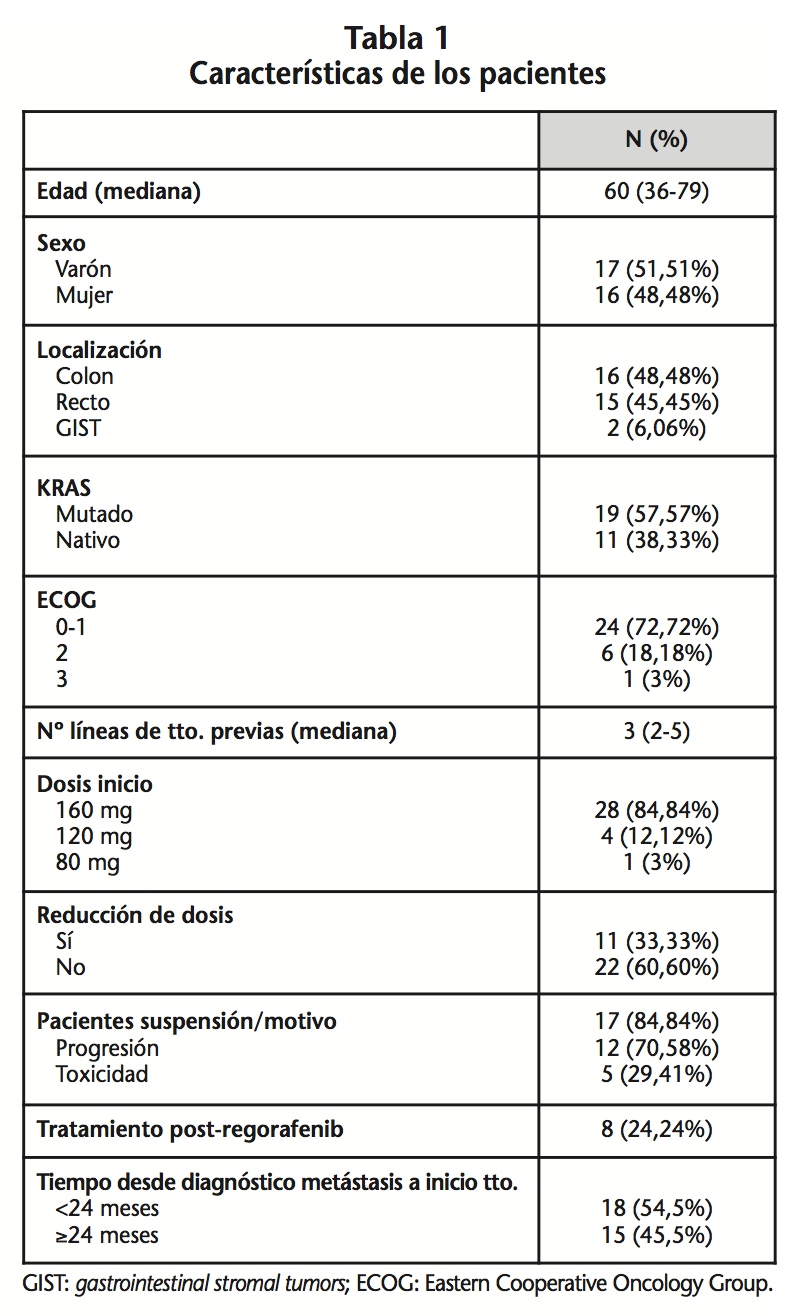
La mediana de líneas previas de tratamiento fue de 3 (1-5). Solamente un paciente tuvo 1 línea de tratamiento (GIST). El 60,6% (20) de los pacientes fueron diagnosticados inicialmente con CCR en estadío metastásico.
En relación a la dosis de regorafenib, el 84,84% (28) comenzaron con dosis plena de 160 mg. El 12,12% (4) iniciaron con dosis reducida de 120 y 80 mg por problemas hematológicos, hepáticos y digestivos. La mediana de la dosis fue 160 mg (80-160).
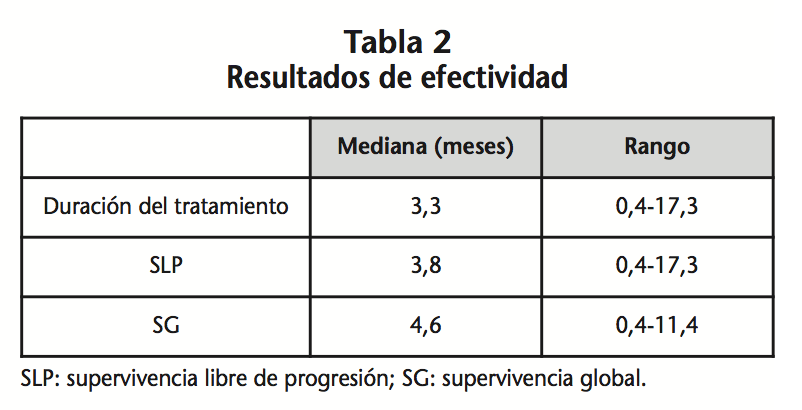
La mediana de duración de tratamiento fue de 3,3 meses (0,4-17,3; DS 3,39). Los resultados de efectividad se recogen en la tabla 2, destacando una SLP de 3,8 y una SG de 4,6 meses. La respuesta fue evaluada en el 87,8% (29) de los pacientes, siendo PE en el 72,4% (21); EE en el 17,2% (5) y RP en el 10,3% (3).
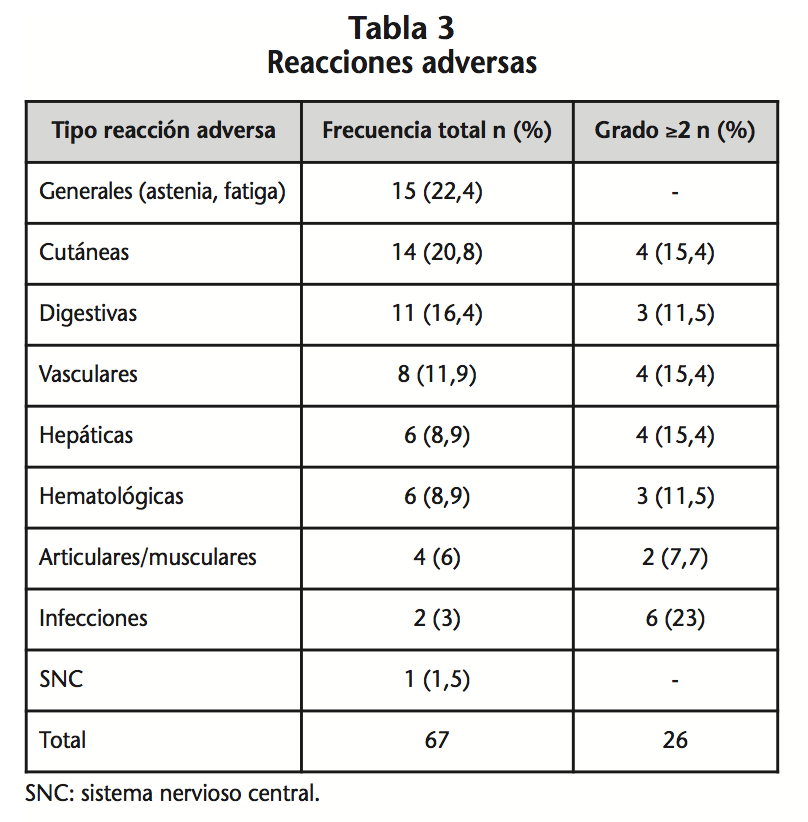
Se registraron un total de 67 RA en un 84,8% (28) de los pacientes, con una mediana de 3 RA/paciente. No obstante, 26 de ellas fueron graves (grado ≥2) en 11 pacientes. Las RA se clasificaron por clase de órganos y sistemas (Tabla 3). Al 44,44% (8) de los pacientes con RA se le suspendió el tratamiento. A un 33,33% (11) del total de la muestra se le realizó reducción de dosis por RA de grado ≥2 (hematológicas, cutáneas y generales).
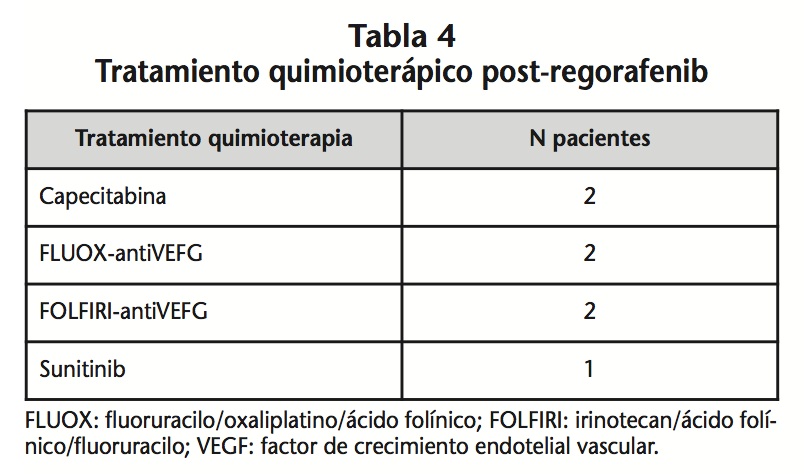
La principal causa de suspensión fue la progresión en el 70% (12) de los pacientes y en el 30% (5) restante; la toxicidad. El 24,24% (8) de los pacientes que suspendieron el tratamiento con regorafenib continuaron tratándose con diferentes esquemas de quimioterapia (Tabla 4), ya que su estado general era ECOG <2.
El 57% (19) de los pacientes de la muestra fue KRAS mutado. En relación a la localización del tumor, no hubo gran diferencia entre colon y recto (45,4 y 48,4%). También se observa una mayor SLP en presencia de KRAS mutado y menor número de líneas de tratamiento previas, aunque esta diferencia no es significativa.
Al relacionar la SG con las líneas de tratamiento previas, aunque la relación no sea significativa (p<0,37), se observa tendencia a un menor número de líneas.
La supervivencia no fue distinta según la localización o mutación del gen K-RAS. No hubo diferencias en la SG en aquellos pacientes que tuvieron reacciones grado ≥2 respecto a las que fueron grado <2 (p<0,245) ni respecto al ajuste de dosis (p<0,374).
De los 11 pacientes fallecidos, la mediana de SG fue de 4,4 (0,5-17,3) y de duración de tratamiento 1,5 meses (0,5-7,8).
En relación a los pacientes que continúan en tratamiento, la mediana de edad fue 58 años (47-79) y la mediana de duración de tratamiento de 7,5 meses (4,5-17,3). Tres iniciaron con dosis de 160 mg, uno con 120 mg y un último con 80 mg. Ninguno ha sufrido reducción de dosis, y 2 han sufrido RA grado ≥2 (cutáneas y digestivas). Todos tenían un ECOG 0-1 al inicio, y el estado del gen K-RAS era mutado.
Con una mediana de 3,3 meses (0,4-17,3) de tratamiento, el coste total del tratamiento fue de 8.561€/paciente (no se tuvo en cuenta el periodo de descanso). El coste total estimado para los 33 pacientes asciende a 282.513€.
DISCUSIÓN
Durante la última década, el pronóstico de los pacientes con CCR metastásico ha mejorado sustancialmente debido a la disponibilidad de muchos fármacos activos contra esta enfermedad y su uso estratégico. Dentro de estas opciones, se ha demostrado que el tratamiento antiangiogénico es eficaz como tratamiento de primera línea y de segunda línea, incluso cuando se continúa más allá de la progresión tumoral. La regulación angiogénica se compone de diferentes vías, y la inhibición de un único objetivo, como el bloqueo de VEGF inducido por bevacizumab, conduce a la regulación positiva de diversos factores proangiogénicos1. Por lo tanto, en un tratamiento de salvamento, un inhibidor de multicininasa con actividad antiangiogénica podría ser una alternativa terapéutica racional9.
La eficacia del regorafenib está basada en un ensayo fase III internacional (CORRECT)10. Posteriormente, se realizó un estudio asiático (CONCUR)11, con similar diseño metodológico. Ambos fueron multicéntricos, aleatorizados, doble ciego y controlados con placebo en pacientes con CCR refractario a tratamiento. Los criterios de valoración fueron similares: El objetivo primario fue la (SG; los secundarios, el perfil de toxicidad, la SLP y el beneficio clínico (BC), que comprende RP y EE.
Las diferencias entre ambos estudios, fueron el tamaño de la muestra (760 pacientes en CORRECT y 204 en CONCUR) y la distribución geográfica.
Los principales criterios de inclusión fueron los mismos: pacientes con CCR m (estadío IV), escala ECOG 0-1, expectativa de vida de >3 meses, progresión durante o en los 3 meses siguientes al último tratamiento y conocimiento del estado mutacional del gen KRAS. Quedaron excluidos aquellos pacientes con enfermedad metastásica a nivel del sistema central; con cardiopatía isquémica inestable, insuficiencia cardiaca (NYHA ≥2), coagulopatía o hemorragia activa.
Regorafenib recibió por parte de la Comisión Europea la autorización de comercialización el 26/Agosto/2013. EL balance de beneficio/riesgo fue considerado positivo pese al modesto resultado en términos de SG (1,4 meses más que en el grupo placebo) mostrado en el ensayo CORRECT y una SLP de 1,96 meses. Se consideró que debido a la posición que ocuparía el regorafenib en el tratamiento del paciente (tras fracaso a terapias disponibles), el beneficio mostrado en estos pacientes supera el riesgo asociado a su uso. Sin embargo, con los datos disponibles hasta el momento no se podía identificar al subgrupo de pacientes en los que pueda tener más eficacia y/o menos toxicidad.
Como limitaciones de nuestro estudio tenemos que considerar el pequeño tamaño de la muestra y el diseño retrospectivo. En el ensayo CORRECT, principal ensayo pivotal comentado, en este último, todos los pacientes tuvieron un ECOG 0-1, mientras que en el nuestro un 21% de los pacientes, un ECOG >2. En ambos estudios, la mediana de líneas de tratamiento previos fue de 3.
La mediana de la SLP, fue de 3,8 meses frente a 1,96 meses del estudio de referencia y la SG de 4,6 meses (0,4-11,6) vs. 6,4 meses. La posible explicación de esta diferencia , podría ser la diferencia del tamaño de muestra y el diseño retrospectivo del estudio. Se observa una SLP superior en aquellos pacientes con un ECOG 0-1. Esto nos obliga a pensar que los pacientes con ECOG >1 no se deberían haber incluido, tal como se había previsto en los criterios de inclusión de los estudios pivotales. Los pacientes con mejor estado funcional tuvieron supervivencia más prolongada (p=0,009 Long Rank).
La tasa de respuesta, entendida como RP y EE, fue inferior en nuestro estudio con un 24% vs. al 41% de estudio CORRECT.
En cuanto a la seguridad, el 84,8% (28) sufrieron RA. Esta frecuencia es similar a los estudios CORRECT y CONCUR. En este último, el 100% de los pacientes tuvieron RA, siendo el 54% de grado 3, destacando síndrome mano-pie (SMP) (16%) e hipertensión (11%). Tanto en nuestro estudio como en el CORRECT, las reacciones adversas más frecuentes fueron: astenia y SMP. En relación a las más graves (grado ≥2) en ambos estudios destacaron la lesión hepática y hemorragias.
Hay que destacar que un 67% de los pacientes en el ensayo CORRECT, tuvieron RA que llevaron a una modificación de dosis. En nuestro estudio, este porcentaje fue menor, siendo el 33,3%.
En la revisión de García-Alfonso y cols.12, se preguntan si el regorafenib conlleva beneficios en pacientes pre-tratados con CCR metastásico y tras analizar los estudios disponibles concluyen en la importancia fundamental de utilizar la dosis adecuada y que los pacientes partan de un estado ECOG bueno, para obtener beneficios del tratamiento con regorafenib.
En un meta-análisis de ensayos con regorafenib, la RA SMP, se dio en un 61% de los pacientes, porcentaje superior al de nuestro estudio (20%). Este tipo de reacción adversa es bastante común en el grupo de fármacos inhibidores de la tirosina kinasa13.
Tougeron et al.14 presentaron el estudio REBECCA15 en el encuentro de las ESMO 2014. Es importante destacar los resultados de este estudio, que se diseñó como un estudio de cohortes retrospectivo, en el que se estudió la supervivencia, la seguridad y los potenciales factores pronóstico de un grupo de pacientes con carcinoma colorectal metástasicos, en tratamiento con regorafenib en condiciones de práctica clínica habitual. El patrón de los pacientes del estudio, 654, fueron similiares a los del estudio CORRECT, con la excepción de que tan sólo el 10% presentaron un ECOG ≤1 y la dosis de inicio fue <160 mg en el 18% de la muestra. No obstante los resultados de SG fueron similares a los del CORRECT (5,6 vs. 6,4 meses), con una mediana de seguimiento fue de 16,5 meses. Más adelante, se pudo ver que los pacientes que más se beneficiaron del tratamiento con regorafenib en el estudio REBECCA, fueron aquellos con no más de dos localizaciones metastásicas; dosis de inicio de 160 mg, un ECOG ≤1 así como ausencia de metástasis hepáticas. Adicionalmente los resultados del estudio parecen indicar que los pacientes que sufrieron como efecto secundario el síndrome mano-pie durante el primer mes de tratamiento, alcanzaron una mayor supervivencia. No obstante, estos resultados, deben ser comprobados en posteriores estudios16.
Nuestra serie de pacientes coincide con los resultados del estudio REBECCA, en la importancia de seleccionar pacientes con estado ECOG 0-1. Así mismo, los resultados de SG en nuestra serie (4,6 meses), se acercan más a los resultados obtenidos en el estudio REBECCA, en tratamiento en práctica clínica habitual (5,6 meses), que a los resultados del ensayo pivotal CORRECT (6,4 meses).
Se dispone de datos más recientes del ensayo en fase IIIb, CONSIGN, llevado a cabo para valorar el perfil de seguridad de regorafenib en pacientes con CCR metastásico, en 2.872 pacientes. En estos pacientes la mediana de duración de tratamiento fue de 2,5 meses. Toxicidad de grado ≥2 apareció en el 80% de los pacientes, siendo las más frecuentes: hipertensión (15%) y SMP (14%)17.
Con el objetivo de determinar la dosis más eficaz y con el menor número de RA, se están proponiendo diferentes estrategias, como iniciar con dosis más bajas (80 mg-120mg) e intentar aumentar según tolerancia o iniciar con la dosis establecida de 160 mg y posteriormente reducirla si aparecen RA. En nuestro estudio los pacientes iniciaron con la dosis estándar establecida, salvo contraindicaciones en 5 pacientes, los cuales tuvieron que iniciar con dosis menores.
Como aparece en resultados, el 24,24% (8) de los pacientes que suspendieron el tratamiento con regorafenib continuaron tratándose con diferentes esquemas de quimioterapia. En otra serie de 128 pacientes tratados con regorafenib y analizados retrospectivamente, se encontró que 11 de estos pacientes (8,6%), recibieron qiuimioterapia tras regorafenib, con una mediana de SLP de 2,1 meses (0,5-10,2), pero el estudio no permite extraer conclusiones relevantes en este tipo de pacientes18.
Como reflejan las guías de la ESMO19, el regorafenib, puede suponer una alternativa en tercera línea de CCR. No obstante, debe tenerse en cuenta la toxicidad que conlleva y el estado general del paciente, no debiendo iniciarse en pacientes frágiles.
En la misma línea la guía de la SEOM20 posiciona al regorafenib en tercera o cuarta línea de tratamiento al nivel de la participación de los pacientes en ensayos clínicos o en cuidados paliativos, lo que nos confirma la necesidad de una selección rigurosa de los pacientes subsidiarios del fármaco.
El coste estimado aproximado, en nuestra muestra con una mediana de SG de 4,6 meses, fue de 8.561€/paciente. Un análisis sobre el coste-efectividad del tratamiento con regorafenib se ha evaluado en el estudio recientemente publicado de Goldstein y cols.21. En este estudio, partiendo del estudio pivotal que incrementa la supervivencia global 6 semanas, concluye que regorafenib produce un beneficio mínimo con un incremento muy elevado en el coste de los años de vida ajustados por calidad, por lo que se deberían establecer nuevas líneas estratégicas seleccionando adecuadamente los pacientes o estableciendo diferentes políticas de precios.
En esta misma línea, el trabajo de Graziano y cols.22, enfatiza la necesidad de establecer nuevas medidas para valorar el coste-efectividad de nuevos fármacos oncológicos con unos beneficios limitados.
CONCLUSIÓN
Los perfiles de seguridad y eficacia obtenidos del regorafenib, en la práctica clínica habitual, fueron similares a los de sus ensayos pivotales.
Respecto a la SLP (3,8 meses), fue mayor a la registrada en los ensayos pivotales; mientras que la SG (4,6 meses), fueron inferiores a los del ensayo CORRECT (6,4 meses), aunque más cercanos a los resultados obtenidos en la serie de pacientes del estudio REBECCA (5,6 meses). Esta diferencia deber ser contrastada en otras series de pacientes en los que se utilice el fármaco dentro de la práctica clínica habitual.
Se requieren futuros esfuerzos para tratar de reconocer aquellos subgrupos de pacientes que obtendrían, mayores beneficios de la terapia, teniendo en cuenta el elevado número de RA, en un 84,4% de los pacientes, pudiendo afectar a su calidad de vida. También es crucial, la selección de la dosis adecuada, ya que muchos pacientes requirieron reducción de la misma.
La aprobación de nuevos fármacos, para patologías oncológicas, hace necesario que se establezcan unos criterios estrictos que nos permitan valorar el fármaco en la práctica clínica, así como tener en cuenta el coste-efectividad de la utilización del nuevo fármaco con la información disponible.
Conocer los datos de eficacia y seguridad en series de pacientes fuera del ensayo clínico nos permite conocer el potencial real del nuevo fármaco.
Conflicto de intereses: Los autores declaran no tener conflicto de intereses.
BIBLIOGRAFÍA
1. Informe de posicionamiento terapéutico de regorafenib (stivarga®) en cáncer colorrectal. March 2015.
2. Globocan 2012. International Agency for Research on Cancer. World Health Organization. http://globocan. iarc.fr/.
3. Ferlay J, Steliarova-Foucher E, Lortet-Tieulent J, Rosso S, Coebergh JW, Comber H, et al. Cancer incidence and mortality patterns in Europe: estimates for 40 countries in 2012. Eur J Cancer. 2013 Apr;49(6):1374-403.
4. Schmoll HJ, Van Cutsem E, Stein A, Valentini V, Glimelius B, Haustermans K, et al. ESMO Consensus Guidelines for management of patients with colon and rectal cancer. a personalized approach to clinical decision making. Ann Oncol. 2012 Oct;23(10):2479-516.
5. Jimeno A, Messersmith WA, Hirsch FR, Franklin WA, Eckhardt SG. KRAS mutations and sensitivity to Epidermal Growth Factor Receptor Inhibitor in Colorectal Cancer. Practical Application of Patient Selection. J Clin Oncol. 2009;27(7):1130-1136
6. Van Cutsem E, Nordlinger B &. Cervantes A. Advanced colorectal cancer: ESMO CLINICAL Practice Guidelines for treatment. Ann Oncol. 2010 21 (supple 5): v93-v97.
7. Ficha técnica de Stivarga®.
8. Informe público de evaluación de Stivarga. http:// www.ema.europa.eu/docs/en_GB/document_library/EPAR_-_Public_assessment_report/human/ 002573/WC500149166.pdf.
9. Riechelmann R, & Grothey A. (2015). The role of regorafenib in metastatic colorectal cancer. Lancet Oncology, 16(6), 596-597. doi:http://dx.doi.org/10.1016/S1470-2045(15)70191-9.
10. Grothey A, Van Cutsem E, Sobrero A, et al. Regorafenib monotherapy for previously treated metastatic colorectal cancer (CORRECT): an international, multicentre, randomised, placebo-controlled, phase 3 trial (2013). Lancet. 381,303-12.
11. Li J, Qin S, Xu R, et al. Regorafenib monotherapy in Asian patients with previously treated metastatic colorectal cancer (CONCUR): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol. 2015; 16:619-629.
12. García-Alfonso P, Feliú J, García-Carbonero R, et al. Clin Transl Oncol (2016). doi:10.1007/s12094-016-1499-8.
13. Belum VR, Wu S, Lacouture ME. Risk if hand-foot skin reaction with the novel multikinase inhibitor regorafenib: a meta-analysis. Invest New Drugs. 2013;31:1078-1086.
14. Tougeron D, Desseigne F, Etienne PL, Dourthe LM, Mineur L, Paule B, Hollebecque A, Tresch E, Spaeth D, Michel P, Dauba J, Laplaige P, Borg C, Bechade D, Clisant S, Phelip J, Fouchardiere CDL, André T, Adenis A (2014) REBECCA: a large cohort study of regorafenib (REG) in the real-life setting in patients (PTS) previously treated for metastatic colorectal cancer (mCRC). Ann Oncol. 25(Suppl 4):205-206.
15. Adenis A, de la Fouchardiere C, Paule B, et al. Survival, safety, and prognostic factors for outcome with Regorafenib in patients with metastatic colorectal cancer refractory to standard therapies: results from a multicenter study (REBACCA) nested within a compassionate use program. BMC Cancer. 2016;16:412. doi:10.1186/s12885-016-2440-9.
16. Vera R, Alonso V, Gállego J, González E, Guillén-Ponce C, Pericay C, Valladares-Ayerbes M. (2015). Current controversies in the management of metastatic colorectal cancer. Cancer Chemotherapy and Pharmacology, 76(4),659-677. doi:http://dx.doi.org/10.1007/ s00280-015-2808-6.
17. Majithia MDa & Axel Grothey MDb. Regorafenib in the treatment of colorectal cancer 0.1517/14656566. 2016.1118054Neil pages 137-145 Expert Opin Pharmacother. 2016,17(1):137-145.
18. Bertocchi P, Aroldi F, Prochilo T, Meriggi F, Beretta GD, & Zaniboni A. (2016). Chemotherapy rechallenge after regorafenib treatment in metastatic colorectal cancer: still hope after the last hope? Journal of Chemotherapy. 1-4.
19. E Van Cutsem, A Cervantes, R Adam, et al. “ESMO consensus guidelines for the management of patients with metastatic colorectal cancer,” Annals of Oncology, vol. 27, no. 8, pp. 1386-1422, 2016.
20. Aranda E, Aparicio J, Alonso V, Garcia-Albeniz X, García-Alfonso P, Salazar R, et al. SEOM clinical guidelines for diagnosis and treatment of metastatic colorectal cancer 2015. Clinical & translational oncology : official publication of the Federation of Spanish Oncology Societies and of the National Cancer Institute of Mexico. 2015;17(12):972-81
21. Goldstein DA, Ahmad BB, Chen Q, et al. (2015) Cost-effectiveness analysis of regorafenib for metastatic colorectal cancer. J Clin Oncol. 33:3727-3732.
22. Graziano et al. Needed-To-Treat for pricing costly anti-cancer drugs. The example of Regorafenib in metastatic colorectal cancer. Ann Oncol. 2016, doci: 10.1093/ annoc/mdw024.
____
Descargar artículo en PDF: Evaluación de la efectividad y seguridad de regorafenib en la práctica clínica habitual
