Emilio Jesús Alegre del Rey
Servicio de Farmacia. Hospital Universitario Puerto Real. Cádiz, España.
Correspondencia: emilioj.alegre.sspa@juntadeandalucia.es
Fecha de recepción: 19 de octubre de 2023 – Fecha de aceptación: 19 de octubre de 2023
___
Por razones clínicas y económicas, la forma en que se incorporan los nuevos medicamentos a la terapéutica es un punto clave para los sistemas sanitarios. Para un sistema sanitario público de calidad, resulta muy difícilmente aceptable dejar de financiar nuevos fármacos que presentan un beneficio relevante. En consecuencia, la industria farmacéutica puede elevar sus precios, exprimiendo toda la disponibilidad a pagar del financiador público1. Esta tensión amenaza el acceso de los pacientes a los medicamentos, daña la sostenibilidad del sistema y excluye a los sistemas sanitarios de muchos países de renta media y baja2 –tal como sucede en muchos estados de Hispanoamérica, África, Asia y Europa oriental3–, así como a muchos pacientes en países de elevada renta sin sistemas sanitarios públicos de alta calidad y amplia cobertura, como Estados Unidos.
Por eso, una gestión adecuada precisa conocer el lugar que pueden ocupar los nuevos fármacos en terapéutica frente a las demás opciones. Debe basarse en una evaluación y gestión adecuada, más que criterios promocionales, que influyen de forma relevante en su uso4. Los sistemas sanitarios públicos han venido creando instituciones o comisiones multidisciplinares independientes de evaluación y posicionamiento post-regulatorio, que guían y ayudan a gestionar la incorporación de los nuevos fármacos en la terapéutica a nivel local –las comisiones de farmacia5-, regional o nacional. Para disminuir la variabilidad en las decisiones, se creó en España una estructura estatal evaluadora, contando con la propia agencia regulatoria española y la participación de representantes de todas las Comunidades Autónomas, en gran parte expertos en evaluación. Este sistema produjo los “Informes de Posicionamiento Terapéutico”, desde unos inicios modestos en 2013. En 2020, el procedimiento incorporó la revisión del informe inicial por nodos multidisciplinares para grupos de patologías6. Además, se empezaron a añadir y publicar algunas evaluaciones económicas y análisis de impacto presupuestario.
Tras 10 años de actividad, con la publicación de 515 informes de nuevos fármacos entre 2013 y 20237 (el 54%, de oncohematología), este sistema acaba de ser desmantelado. El detonante ha sido la sentencia de la Audiencia Nacional, en julio de 2023, favorable a un recurso de la asociación de compañías farmacéuticas (Farmaindustria), considerando que REvalMed carecía de la base jurídica necesaria y que las evaluaciones económicas no procedían dentro de los informes científicos exigidos por la ley para estudiar la financiación de nuevos medicamentos8 -argumento este último de difícil encaje-. En otros países, el National Institute for Health and Care Excellence (NICE) de Inglaterra y Gales ha soportado grandes presiones y sigue adelante con esta labor; la Haute Autorité de Santé (HAS) francesa y el Scottish Medicines Consortium (SMC, Escocia) continúan realizando oficialmente este tipo de evaluaciones, aunque con importantes diferencias entre ellos. El Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) alemán publica valoraciones del beneficio clínico incluyendo “subindicaciones”.
REvalMed ha conseguido importantes logros y nos ha dejado enseñanzas para la evaluación post-regulatoria. La primera es el propio procedimiento, que constaba de dos secciones6; una primera evaluación “farmacoclínica”, independiente del coste, en la que se establece el escenario de utilidad del fármaco: dentro de su indicación aprobada, hay situaciones o subpoblaciones en las que el fármaco puede ofrecer mayor, menor o nula ventaja terapéutica frente a sus alternativas, y también puede presentar mayor o menor incertidumbre de su beneficio.
La segunda sección incluye la evaluación económica y el análisis de impacto presupuestario, partiendo del escenario de utilidad clínica. Esta parte estaba en pilotaje y solo algunos IPT la incluyeron. Con esta información, se procede a la negociación de precio y financiación, tras la cual se realiza el posicionamiento final, teniendo en cuenta los condicionantes de coste.
Si los recursos fueran ilimitados o los precios asumibles, el posicionamiento terapéutico post-financiación sería idéntico al escenario de utilidad clínica considerado en la primera fase, pero precios muy elevados pueden conllevar una negativa de financiación, especialmente en medicamentos con beneficio limitado o de elevada incertidumbre, o una restricción, usándolos solo en los pacientes que obtienen un beneficio más relevante o que presentan más certeza en cuanto al mismo. Las situaciones de incertidumbre en el beneficio pueden tener una solución parcial en los acuerdos innovadores de precio basado en resultados.
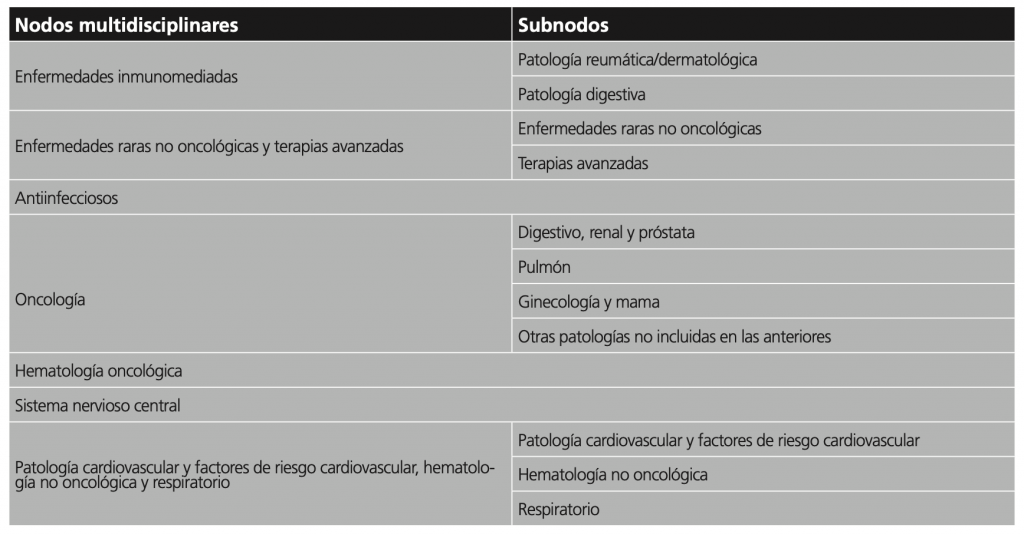
Una segunda enseñanza viene dada por cómo se incorporó en REvalMed la evaluación multidisciplinar. El borrador inicial del informe era realizado generalmente por un evaluador o equipo experto, de acuerdo con un plantilla que cubría todos los aspectos destacables, incluida la valoración del beneficio clínico9. Este borrador se remitía a un nodo multidisciplinar de evaluadores y clínicos que lo revisaban conjuntamente y proponían modificaciones. La incorporación de estas propuestas era luego tratada entre los coordinadores del nodo y el equipo redactor del borrador inicial. Trece nodos y subnodos cubrían grandes áreas de medicamentos (ver tabla 1). Tras consensuar el borrador, la revisión externa se encomendaba a las sociedades científicas implicadas, asociaciones de pacientes e industria.
Tabla 1. Nodos y subnodos de REvalMed. Cada nodo tiene un coordinador, y cada subnodo, un co-coordinador. Los nodos proponen modificaciones sobre el borrador inicial de evaluación. Tras consensuar los cambios con el redactor, el borrador pasa a revisión externa.
La tercera enseñanza es el trabajo por consenso dentro de estas revisiones, y no por mayoría o por votaciones. Entre profesionales con experiencia y buena formación científica sin intereses espurios, el consenso es posible profundizando en la evidencia y matizando las afirmaciones, para que sean aceptables por las distintas perspectivas posibles. Para alcanzar una simbiosis, clínicos y evaluadores han de compartir un lenguaje y objetivos comunes. Los clínicos han de tener una sólida formación metodológica, y los evaluadores han de contar con experiencia de selección de medicamentos en el ámbito clínico. Ambos deben ser elegidos por una manifiesta independencia y compartir el objetivo de una incorporación razonable, basada en la evidencia, de los nuevos fármacos a la terapéutica.
Aunque los IPT no adoptaron una clasificación de los fármacos evaluados tras sus conclusiones, en la práctica manejaron categorías como “preferente” cuando un fármaco presentaba un beneficio clínico adicional relevante sobre el estándar, “alternativas” de similar beneficio clínico cuando no había evidencia para preferir uno sobre otro -lo cual favorece la competencia en descuentos-, “opciones” especificando otras situaciones -por ejemplo, condicionadas al uso previo del estándar-, y en algunos casos no se encontró un lugar en terapéutica para el nuevo fármaco con la evidencia disponible.
Es importante que la evaluación farmacoclínica se realice de forma ajena a cuestiones económicas, que se valorarán posteriormente en otras instancias. El Comité asesor para la financiación de la prestación farmacéutica en el SNS (CAPF), que consideró REvalMed como un paso adelante en la dirección correcta y propuso algunas mejoras y reformas, abogó además por la independencia entre los autores de las evaluaciones farmacoclínica/farmacoeconómica, y las instancias políticas10. Asimismo, es importante diferenciar el campo regulatorio, que asegura el balance beneficio/riesgo en la indicación solicitada, de la evaluación comparativa y posicionamiento relativo de los fármacos en la terapéutica.
Como problemas que necesitaban aún ser resueltos, si bien es importante que los evaluadores y clínicos sigan implicados en la práctica asistencial, se les debería liberar de alguna parte de su carga de trabajo y profesionalizar más su colaboración, sobre todo para conseguir una mayor participación e implicación, así como una mejora en los tiempos de respuesta.
Realizar una evaluación post-regulatoria que especifique el verdadero escenario de utilidad de cada nuevo fármaco es necesario para orientar su incorporación razonable en terapéutica y como base para la evaluación económica/análisis de impacto presupuestario. La experiencia de REvalMed y los IPT ha supuesto un aprendizaje y una experiencia muy valiosos en esta tarea.
BIBLIOGRAFÍA
- WHO. Pricing of cancer medicines and its impact. 2019. [citado 18/19/2023]. Disponible en: https://iris.who.int/bitstream/handle/10665/277190/9789241515115-eng.pdf?isAllowed=y&sequence=1
- Barber S, Lorenzani L, Ong P. Price setting and price regulation in health coverage. WHO & OECD 2019 [citado 18/10/2023]. Disponible en: https://www.oecd.org/health/health-systems/OECD-WHO-Price-Setting-Summary-Report.pdf
- European Parliament. Directorate General for Internal Policies. Environment, public health and scientific policy. EU options for improving Access to medicines [citado 18/10/2023]. Disponible en: https://w/ww.europarl.europa.eu/RegData/etudes/STUD/2016/587304/IPOL_STU(2016)587304_EN.pdf/
- Jacob NT. Drug promotion practices: A review. Br J Clin Pharmacol. 2018;84(8):1659-67.
- Puigventós Latorre F, Santos-Ramos B, Ortega Eslava A, Durán-García ME; Grupo de Evaluación de Novedades, Estandarización e Investigación en Selección de Medicamentos (GENESIS) de la Sociedad Española de Farmacia Hospitalaria (SEFH). Variabilidad en la actividad y los resultados de la evaluación de nuevos medicamentos por las comisiones de farmacia y terapéutica de los hospitales en España. Farm Hosp. 2011;35(6):305-14.
- Ministerio de Sanidad. REvalMed SNS, 2020. Plan para la consolidación de los informes de posicionamiento terapéutico de medicamentos en el Sistema Nacional de Salud [citado 18/10/2023]. Disponible en: https://www.sanidad.gob.es/profesionales/farmacia/IPT/docs/20200708.Plan_de_accion_para_la_consolidacion_de_los_IPT.actCPF8Julio.pdf
- Ministerio de Sanidad. Informes de posicionamiento terapéutico[citado 2023]. Disponible en: https://www.aemps.gob.es/medicamentos-de-uso-humano/informes-de-posicionamiento-terapeutico/
- Audiencia Nacional. Sala de lo Contencioso-Administrativo, sección octava. Recurso Nº: 0000123/2021 [citado 18/10/2023]. Disponible en: https://www.farmaindustria.es/web/wp-content/uploads/sites/2/2023/07/Sentencia-de-la-AN-sobre-Plan-Consolidacion-IPT.pdf
- Procedimiento normalizado de trabajo de evaluación clínica, evaluación económica y posicionamiento para la redacción de Informes de Posicionamiento Terapéutico de medicamentos en el Sistema Nacional de Salud, 2020 [citado 18/10/2023]. Disponible en: https://www.sanidad.gob.es/profesionales/farmacia/IPT/docs/20200708.PNT_elaboracion_IPT_CPF8Julio.pdf
- Comité Asesor para la Financiación de la Prestación Farmacéutica en el SNS. Ministerio de Sanidad, Consumo y Bienestar Social, 2021. Recomendaciones sobre los Informes de Posicionamiento Terapéutico de los Medicamentos en el Sistema Nacional de Salud [citado 18/10/2023]. Disponible en: https://www.sanidad.gob.es/profesionales/farmacia/pdf/CAPF_RECOMENDACIONES_IPT_2021_11_25.pdf
____
