Medina Guerrero A1, Montero Hernández M1, Gil Borrás R2, Bellver Albertos M1, Soler Company E1
1 Servicio de Farmacia
2 Servicio de Digestivo
Hospital Arnau de Vilanova-Lliria. Valencia (España)
Fecha de recepción: 17/10/2018 – Fecha de aceptación: 08/11/2018
Correspondencia: Álvaro Medina Guerrero – Hospital Arnau de Vilanova-Lliria (Servicio de Farmacia. Edificio Consultas externas) – C/San Clemente, 12 – 46015 Valencia (España)
medina_alv@gva.es
____
Resumen
El síndrome de intestino corto (SIC) es una enfermedad provocada por pérdida física de porciones intestinales debido a diferentes causas. Por este motivo es preciso el aporte de nutrientes y fluidoterapia por vía parenteral para mantener un adecuado estado nutricional de los pacientes afectados. Se presenta un caso clínico de un paciente diagnosticado de síndrome de intestino corto, en tratamiento con teduglutida (primera alternativa no sintomática indicada para esta patología), y su evolución a lo largo de 15 meses.
Palabras clave: Síndrome de intestino corto, teduglutida, nutrición parenteral.
Clinical evolution of a patient with short intestine syndrome in treatment with teduglutida
Summary
Short bowel syndrome is a disease caused by the resection of segments of small intestine due to different causes. For this reason, it is necessary to provide nutrients and parenteral fluid therapy to maintain an adequate nutritional status of patients. We present a clinical report of a patient diagnosed with short bowel syndrome, in treatment with teduglutide (first non-symptomatic alternative indicated for this pathology), and its evolution over 15 months.
Key Words: Short bowel syndrome, teduglutide, parenteral nutrition.
____
Introducción
El síndrome de intestino corto es la causa más frecuente de fallo intestinal (FI) crónico, representando un 50% de población pediátrica y un 75% adulta en las series europeas de nutrición parenteral domiciliaria (NPD)1. Se produce como resultado de la pérdida física de porciones intestinales por resecciones quirúrgicas extensas debido a isquemia, traumatismo, tumores o alteraciones congénitas. Aproximadamente, del 50% de los pacientes cuya longitud intestinal es inferior a 2 metros, un 41% son candidatos a soporte con NPD y un 12% a fluidoterapia y electrolitos1,2.
Durante los meses posteriores a la resección intestinal tienen lugar varios procesos de adaptación entre los que destacan el aumento de la superficie absortiva y la ralentización del tránsito3,4. Los síntomas característicos de pacientes con SIC son diarrea, esteatorrea, dolor abdominal, alteraciones electrolíticas, deshidratación, desnutrición y pérdida de peso. Además se puede acompañar de pérdidas de abundante líquido por estomas4. En este contexto, el soporte nutricional por vía oral es importante. A pesar de ello, normalmente es insuficiente para cubrir los requerimientos de los pacientes, motivo por el cual requieren aporte externo de nutrición parenteral (NP) y fluidoterapia para mantener un estado nutricional e hidratación adecuados. Estos tratamientos a largo plazo presentan complicaciones como infecciones, trombosis de catéter y alteraciones metabólicas, además de interferir de manera importante en la calidad de vida de los pacientes3-5.
El principal objetivo del tratamiento en el SIC es potenciar la capacidad de absorción del tracto gastrointestinal remanente para reducir la dependencia de soporte parenteral manteniendo una adecuada nutrición e hidratación6.
Recientemente se ha incorporado teduglutida, un análogo del péptido 2 similar a glucagón endógeno que aumenta su semivida de 7 minutos a 2 horas7. La dosis recomendada en adultos es 0,05 mg/kg peso una vez al día administrada por vía subcutánea1,7. Ejerce un efecto intestinotrófico reduciendo los requerimientos de NP y fluidoterapia8,9.
Caso clínico
Hombre adulto de 37 años con SIC secundario a un fallo intestinal por trombosis de la arteria mesentérica superior. En diciembre 2014 se realizó intervención quirúrgica (IQ) por una isquemia masiva de intestino delgado con resección desde 50 cm del ángulo de Treitz hasta íleon terminal a 10 cm de válvula ileocecal dejando yeyunostomía en vacío izquierdo y fístula mucosa ileal en fosa iliaca derecha. En el postoperatorio precisó de reintervención por necrosis de tramo distal del íleon con resección del mismo y nueva ileostomía. Se procedió a la colocación de un reservorio subcutáneo para NP de forma crónica. Ecocardiograma normal. Inició anticoagulación y antiagregación a causa de trombofilia. Durante 2 años el paciente llevó NP 1.590 ml y fluidoterapia con fisiológico 2.000 ml diarios. Su tratamiento farmacológico constaba de omeprazol, lorazepam nocturno, loperamida, enoxaparina y ácido acetil salicílico. Seguía una dieta libre con 2 suplementos hipercalóricos e hiperproteicos diarios de consistencia pudin. Fue descartada por cirugía la intervención de unión del colón por su previsible mala calidad de vida y mal pronóstico. El paciente presentaba hiperfagia compensadora, factor predictor de buen pronóstico en el proceso de adaptación intestinal y de suspensión del soporte NPD, especialmente los dos primeros años tras la resección intestinal2.
En junio 2016, posteriormente a una colonoscopia con extirpación de tres adenomas tubulares, se inició tratamiento con teduglutida 3,6 mg diarios.
En enero de 2017, tras 6 meses de tratamiento, dada su buena evolución se realizó reconstrucción del tránsito intestinal con anastomosis termino-terminal yeyuno-ileal manual junto con colecistectomía de forma programada. Se suspendió teduglutida desde tres días antes de la IQ hasta dos días después del inicio de la dieta oral.
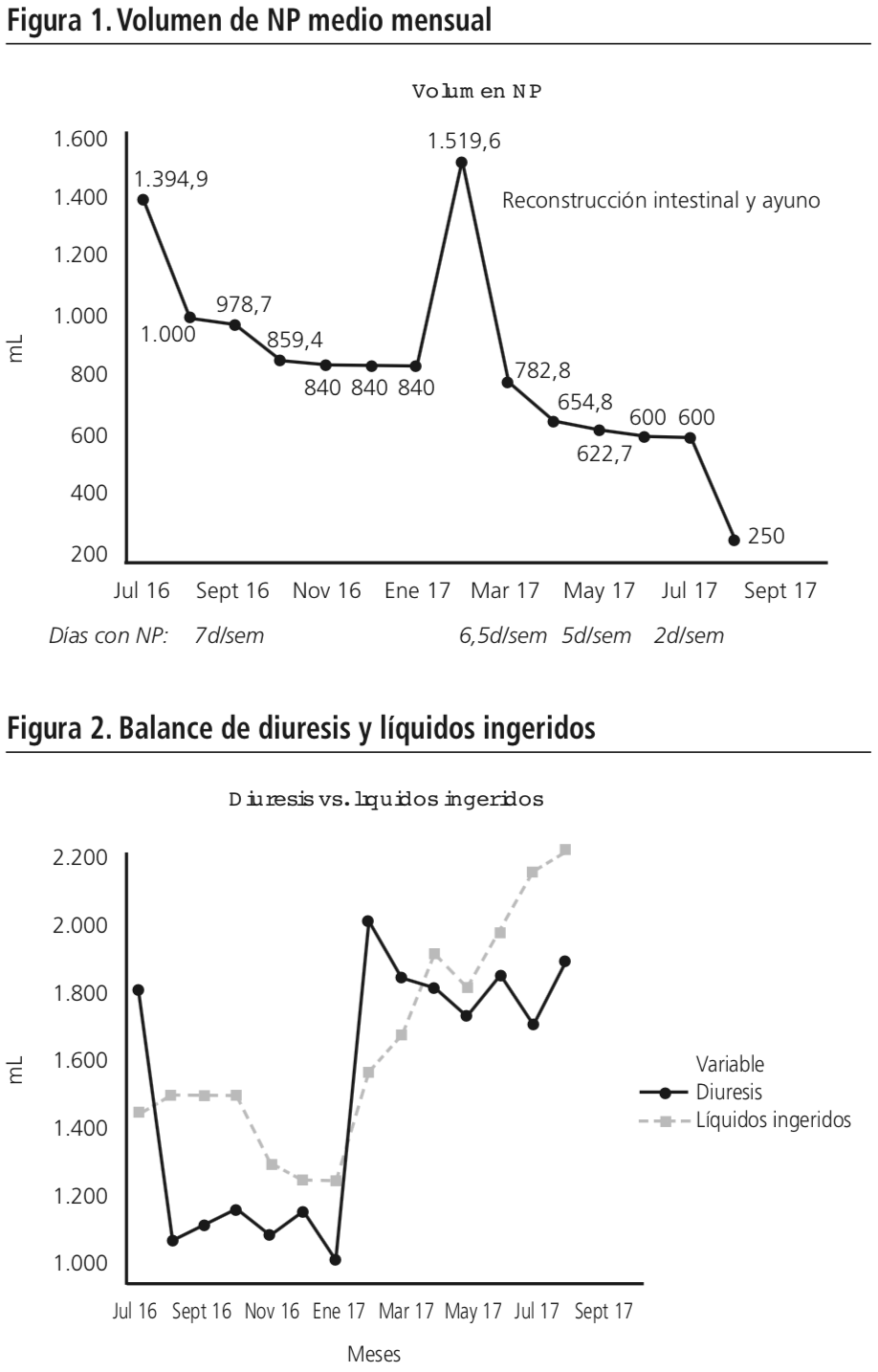
Tras 15 meses de tratamiento con teduglutida y especialmente durante los últimos 8 desde la IQ, se produjo un descenso de sus requerimientos diarios de NPD (Figura 1) y fluidos en volumen y tiempo. La cantidad de la NP se redujo progresivamente en un 100%, desde 1.590 ml diarios iniciales a no precisar nada. El volumen de fluidos de soporte se disminuyó en un 100% desde 2.000 ml diarios iniciales hasta no necesitar aporte intravenoso. El tiempo de nutrición parenteral pasó de 15 horas al día los 7 días de la semana, a poder cubrir los requerimientos mediante dieta oral con 500 ml de suplemento enteral rico en fibra soluble, polimérico, hipercalórico-hiperproteico.
El paciente mantuvo peso durante el tratamiento, sin embargo, como consecuencia de la IQ de enero de 2017, y de una infección de catéter en julio de 2017, presentó dos descensos marcados que rompieron la tendencia.
Los parámetros de laboratorio oscilaron dentro de registros de normalidad, prácticamente constantes en valores medios de: albúmina 4,2 g/dl, prealbúmina 38,3 mg/dl y linfocitos 2,8 x109/l. Las pérdidas por ostomía durante los 6 primeros meses de estudio fueron estables, mientras que la evolución post-quirúrgica del número de deposiciones decreció a lo largo de 60 días: desde las 22 deposiciones en el postoperatorio hasta alcanzar cifras estables de 1 o 2 diarias.
La relación diuresis-volumen de líquido ingerido presentó un balance positivo, con dos puntos críticos del seguimiento: el inicio de tratamiento con teduglutida y la reconstrucción del tránsito intestinal ileo-cólico (Figura 2). Se realizó una revisión periódica del tratamiento farmacológico.
Los ajustes en los aportes de NP y fluidos se realizaron de acuerdo a valores de diuresis, pérdidas por ostomía, peso y requerimientos nutricionales según parámetros analíticos periódicos y evolución clínica.
En cuanto al perfil de seguridad, teduglutida ha sido bien tolerado. El paciente solo refirió en las primeras semanas un dolor abdominal leve que no requirió tratamiento. La calidad de vida se evaluó a través del cuestionario de calidad de vida SF-36, de carácter general y el cuestionario GiQLI, específico de patologías gastrointestinales10. Se demostró una evolución positiva en capacidad para realizar actividades, sensaciones y su calidad de vida mejoró a los 15 meses de forma drástica con la suspensión de la NP y la fluidoterapia externa.
Discusión
La NP y la fluidoterapia están indicados en aquellos pacientes con resección intestinal incapaces de mantener un adecuado aporte calórico, proteico, de fluidos, electrolitos y micronutrientes por vía gastrointestinal4. Hasta ahora el arsenal terapéutico era escaso y limitado. Las guías ESPEN recomiendan el uso de antagonistas H2 o inhibidores de la bomba de protones para reducir las pérdidas fecales. También sugieren el uso de octreótido en pacientes con yeyunostomías de alto débito. Respecto a fármacos que inhiben la motilidad intestinal, ESPEN señala el uso de loperamida oral (menos adictiva y sedante que otros opiáceos) para reducir pérdidas fecales de líquidos y sodio en pacientes con ostomía1. La presencia de complicaciones limitantes del uso de NP y fluidoterapia hacía obligatorio valorar el trasplante intestinal en determinados pacientes.
La aprobación de teduglutida ha supuesto una opción en el tratamiento de esta patología. Aumenta la capacidad de absorción del tracto gastrointestinal remanente y reduce la dependencia y del aporte nutricional externo. En los ensayos pivotales (STEPs) el 63% de los pacientes redujo en un 20-30% el aporte de volúmenes de NP y fluidoterapia a las 24 semanas. En este mismo periodo de estudio en un 54% de los pacientes se prescindió de 1 o más días de NP8. En nuestro caso alcanzamos los mismos objetivos propuestos por los ensayos clínicos con una reducción de 53% en aporte de NP y 38% en fluidoterapia durante sus primeras 24 semanas. Si bien es cierto que la mejoría más significativa de nuestro paciente se produjo tras la cirugía de reconstrucción intestinal, la progresión inicial propiciada por teduglutida fue determinante a la hora de plantear la IQ.
Un aspecto controvertido acerca de la utilización de teduglutida son los costes elevados que se generan al Sistema Sanitario. En España todavía no hay datos de coste anual debido a su reciente comercialización, sin embargo, se estima que en EE.UU. este valor por paciente y año ronda los 300.000 dólares. Frente a este alto coste directo, se tendrían que tener en cuenta los costes directos anuales evitados por paciente con NPD, que ascienden a 8.393 euros en patología benigna, costes indirectos evitados, así como la incorporación de nuestro paciente al ámbito laboral1.
El estado nutricional del paciente se mantuvo constante según los parámetros nutricionales. El rápido efecto de teduglutida en las primeras semanas de tratamiento, el escaso conocimiento del manejo del fármaco y la incertidumbre de cómo podía reaccionar el paciente a la cirugía, nos hizo ir ligeramente por detrás de su efecto a la hora de reducir fluidos, hecho que se manifiesta en el incremento de peso durante los 6 primeros meses. Sin embargo contamos con ventajas importantes como el hecho de tratarse de un paciente joven, que realiza control diario de todas sus constantes, cumplidor y colaborador con el equipo interdisciplinar para conseguir el mayor beneficio posible. La buena tolerancia al tratamiento con teduglutida y el éxito en la intervención de reconstrucción del tránsito intestinal han supuesto una desconexión de nuestro paciente del soporte parenteral. Su independencia es total, y el aumento de la calidad de vida notorio.
Conflicto de intereses: Los primeros seis meses de seguimiento han sido aceptados para su publicación en otra revista.
BIBLIOGRAFÍA
1. Burgos Peláez, Rosa, Cuerda Compés, MC, Demchyshyn, L, García Ortí, L, García Peris, P, Loinaz Segurola, C, et al. Manejo farmacológico del sindrome de intestino corto: teduglutida. Majadahonda Madrid: CYESAN; 2017.
2. Burgos Peláez R, Cuerda Compes C, et al. Teduglutide: revisión de su uso en el síndrome de intestino corto. Nutrición Hospitalaria. 2016;33:969-977.
3. Palle B, Jeppesen P.B, et al. Teduglutide reduces need for parenteral support among patients with short bowel syndrome with intestinal failure. Gastroenterology. 2012;143:1473-1481.
4. Pomar B, D M, Vidal Casariego A. Síndrome de intestino corto: definición, causas adaptación intestinal y sobrecrecimiento bacteriano. Nutrición Hospitalaria. 2007;22:74-85.
5. Lam K, Schwartz L, Batisti J, Iyer KR. Single Center Experience with the Use of teduglutide in Adult Patients with short bowel syndrome. Journel of Parenteral and Enteral Nutrition. 2018 Jan 1;42(1):225-30.
6. Billiauws L, Bataille J, Boehm V, Corcos O, Joly F. Teduglutide for treatment of adult patients with short bowel syndrome. Expert Opinion on Biological Therapy. 2017 May 4 ;17(5):623-32.
7. AEMPS: Agencia Española de Medicamentos y Productos Sanitarios. CIM (centro de información de medicamentos). Ficha técnica Revestive 5 mg de polvo y disolvente para solución inyectable®. España: Agencia Española de Medicamentos y Productos sanitarios.
8. Jeppesen P.B, Gilroy R, et al. R placebo-controlled trial of teduglutide in reducing parenteral nutrition and/or intravenous fluid requirements in patients with short bowel syndrome. Gut. 2011; 60:902-914.
9. Stephen J.D, O´Keefe, et al. S and efficacy of teduglutide after 52 weeks of treatment in patients with short bowel syndrome intestinal failure. Clinical Gastroenterology and Hepatology 2013;11: 815-823.
10. Berghöfer P, Fragoso K.C, et al. Development and validation of the disease-specific short bowel syndrome-quality of life (SBS-Q scale. Clinical Nutrition. 2013;32:789-796.
____
