Fecha de recepción: 22/01/2018 – Fecha de aceptación: 25/04/2018
Pascual-Marmaneu O1, Montañés-Pauls B1, Bellés-Medall MD1, Álvarez-Arroyo L2, Serrano Picazo L3, Ferrando-Piqueres R1
1 Servicio de Farmacia Hospitalaria. Hospital General Universitario de Castellón. Castellón (España)
2 Servicio de Farmacia Hospitalaria. Hospital Universitario de la Plana. Villarreal (España)
3 Servicio de Hematología. Hospital General Universitario de Castellón. Castellón (España)
____
Correspondencia:
Óscar Pascual Marmaneu
Avda. Hermanos Bou, 13 6º A
12003 Castellón
Correo electrónico: oscar_pas69@hotmail.com
____
RESUMEN
Objetivo: Analizar la eficacia y seguridad de carfilzomib en el tratamiento del mieloma múltiple refractario y/o en recaída (MMRR), y evaluar los resultados en función del esquema terapéutico y dosis de carfilzomib utilizada.
Métodos: Análisis retrospectivo que incluyó pacientes en tratamiento con carfilzomib desde diciembre de 2015 hasta agosto de 2017. Se analizaron variables demográficas, de la enfermedad, analíticas, de respuesta y toxicidad.
Resultados: Se incluyeron 13 pacientes (85% varones), de 67 años (rango intercuartílico (IQR: 57-70), con un tiempo de evolución de la enfermedad de 33 meses (IQR: 12-53) y en estadio 3 en el 69% de los sujetos. La tasa de respuesta global fue del 46%, el tiempo hasta respuesta de 1,5 meses (IQR: 1-3) y la duración de la respuesta de 6,5 meses (IQR: 4,8-11,5). La mediana de supervivencia libre de progresión fue de 3,2 meses (IC 95%: 2,1-no estimable) y la supervivencia global de 8,1 meses (IC 95%: 2,5-no estimable). No se observaron diferencias significativas en la progresión ni mortalidad según esquema y dosis de carfilzomib utilizada. La trombocitopenia y la anemia fueron los efectos adversos más frecuentes, apareciendo en el 38,5% y 30,8% de los pacientes.
Conclusiones: La eficacia de carfilzomib fue baja en esta serie, donde carfilzomib se utilizó en pacientes de elevada complejidad en líneas de tratamiento avanzadas. En este sentido, los criterios de utilización de este fármaco en la práctica clínica difieren de los descritos en los ensayos clínicos. Por tanto, son necesarios estudios más amplios para posicionar a carfilzomib en el tratamiento del MMRR en la práctica clínica.
Palabras clave: Carfilzomib, mieloma múltiple, recaída, resistencia, inhibidores del proteosoma, análisis de supervivencia.
____
INTRODUCCION Y ANTECEDENTES
El mieloma múltiple (MM) es una neoplasia hematológica que produce una proliferación aberrante y descontrolada de células plasmáticas que se originan tras la maduración y selección antigénica de los linfocitos B1. Actualmente, el MM es aún considerado incurable, representando alrededor del 1%2 del total de los carcinomas, suponiendo la segunda neoplasia hematológica más común (12%)3.
Sin embargo, en la última década la aparición de múltiples avances, tanto en el conocimiento de la enfermedad, como en su tratamiento, han abierto una puerta a la mejor evolución de los pacientes afectados por esta patología. En este sentido, la mejora del conocimiento de los factores moleculares y celulares predictores de la progresión de la enfermedad, unida a la irrupción de nuevos fármacos, ha supuesto un beneficio clínico que ha incrementado la supervivencia de los pacientes con MM en la última década4, con una tasa de supervivencia relativa a 5 años del 49%5. La inclusión del bortezomib, primer inhibidor de proteosoma, así como de fármacos inmunomoduladores tales como, la lenalidomida, talidomida y pomalidomida, unida a la reciente aparición de los anticuerpos monoclonales daratumumab y elotuzumab ha ampliado considerablemente el arsenal terapéutico disponible. No obstante, los pacientes con MM refractario y/o en recaída (MMRR) continúan siendo un reto terapéutico ante los resultados poco satisfactorios en términos de calidad y duración de la respuesta en estas poblaciones6.
Carfilzomib (CFZ) es un inhibidor del proteosoma de segunda generación que en combinación con lenalidomida y dexametasona (Cld) o dexametasona en monoterapia (Cd) fue autorizado en noviembre de 2015 por la Agencia Europea del Medicamento (EMA) para el tratamiento del MMRR en pacientes que habían recibido ≥1 líneas previas7. El objetivo de este estudio es analizar la eficacia y seguridad de CFZ, y evaluar los resultados en función del esquema terapéutico y dosis de CFZ utilizada.
MATERIAL Y MÉTODOS
Se diseñó un estudio observacional retrospectivo, promovido en dos hospitales de segundo y tercer nivel, respectivamente. El ámbito del estudio se circunscribe a pacientes con MMRR en tratamiento con Cld o Cd, que acudieron a Hospital Día para la administración del fármaco desde diciembre de 2015 hasta agosto de 2017. No hubo criterios de exclusión y se incluyó toda la población en el ámbito del estudio tratada con CFZ.
CFZ se adquirió a través de medicamentos no autorizados en España, mediante la plataforma de gestión de medicamentos en situaciones especiales de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS), hasta enero de 2017, que se autorizó su comercialización como producto nacional. Los esquemas de tratamiento utilizados fueron Cd y Cld, en función del tipo de paciente y comorbilidades. Siguiendo las recomendaciones descritas en ficha técnica7, se administró CFZ por infusión intravenosa durante 10-30 min. los días 1, 2, 8, 9, 15 y 16 en ciclos de 28 días. La dosis de CFZ fue de 20 mg/m2 los días 1 y 2 del ciclo 1, que se incrementó en las administraciones posteriores a 27-56 mg/m2, siempre que la dosis anterior fuera bien tolerada.
Los datos recogidos se obtuvieron mediante la consulta del aplicativo de prescripción de citostáticos Oncofarm® (versión 2013.0.26.2) y de los programas informáticos de historia clínica Abucasis® (SIA versión 22.02.03) y Orion Clinic® (versión 10).
Se analizaron variables demográficas (edad y sexo), características de la enfermedad previas a la administración de CFZ (tiempo de evolución, estadio, tipo de MM, y anomalías citogenéticas), analíticas (calcemia, hemoglobina, plaquetas, albúmina, aclaramiento de creatinina), clínicas (afectación ósea), tratamientos previos (número de líneas y tipo de esquemas de quimioterapia anteriores a CFZ), respuesta a los esquemas con CFZ y efectos adversos (EA).
La valoración del estadiaje del MM se basó en el índice pronóstico internacional (ISS) publicado por el International Myeloma Working Group (IMWG)8, que clasifica a los pacientes en 3 estadios en función de los valores de beta2-microglobulina y albúmina sérica.
La respuesta al tratamiento con CFZ se clasificó siguiendo los criterios del IMWG9 en: respuesta completa (RC), muy buena respuesta parcial (MBRP), respuesta parcial (RP), respuesta mínima (RM) y enfermedad estable (EE). Como variables de respuesta se evaluaron: la tasa de respuesta global (TRG) definida como respuesta parcial o superior, la mediana del tiempo hasta respuesta (TTR), la duración de la respuesta (DR), la supervivencia libre de progresión (SLP) y la supervivencia global (SG).
Los EA asociados a los regímenes que contenían CFZ se clasificaron de acuerdo a los Criterios de Terminología Comunes para Eventos Adversos (NCI-CTCAE) del Instituto Nacional del Cáncer (NCI)10.
Las características de los pacientes se resumieron descriptivamente como mediana y rango intercuartílico (IQR) para variables cuantitativas y frecuencias para variables cualitativas. El estudio estadístico se realizó mediante la prueba de chi cuadrado de Pearson para variables cualitativas y las curvas de supervivencia se estimaron mediante el método de Kaplan-Meier con el test de Log-Rank. Se compararon los resultados de SLP y SG según esquema y dosis de CFZ empleada, a través del modelo de regresión de riesgos proporcionales de Cox para estimar los Hazard ratio (HR) y los intervalos de confianza (IC) del 95%. Se consideró estadísticamente significativo un valor p<0,05. El estudio estadístico se realizó mediante el programa informático STATA/IC-14.1.
RESULTADOS
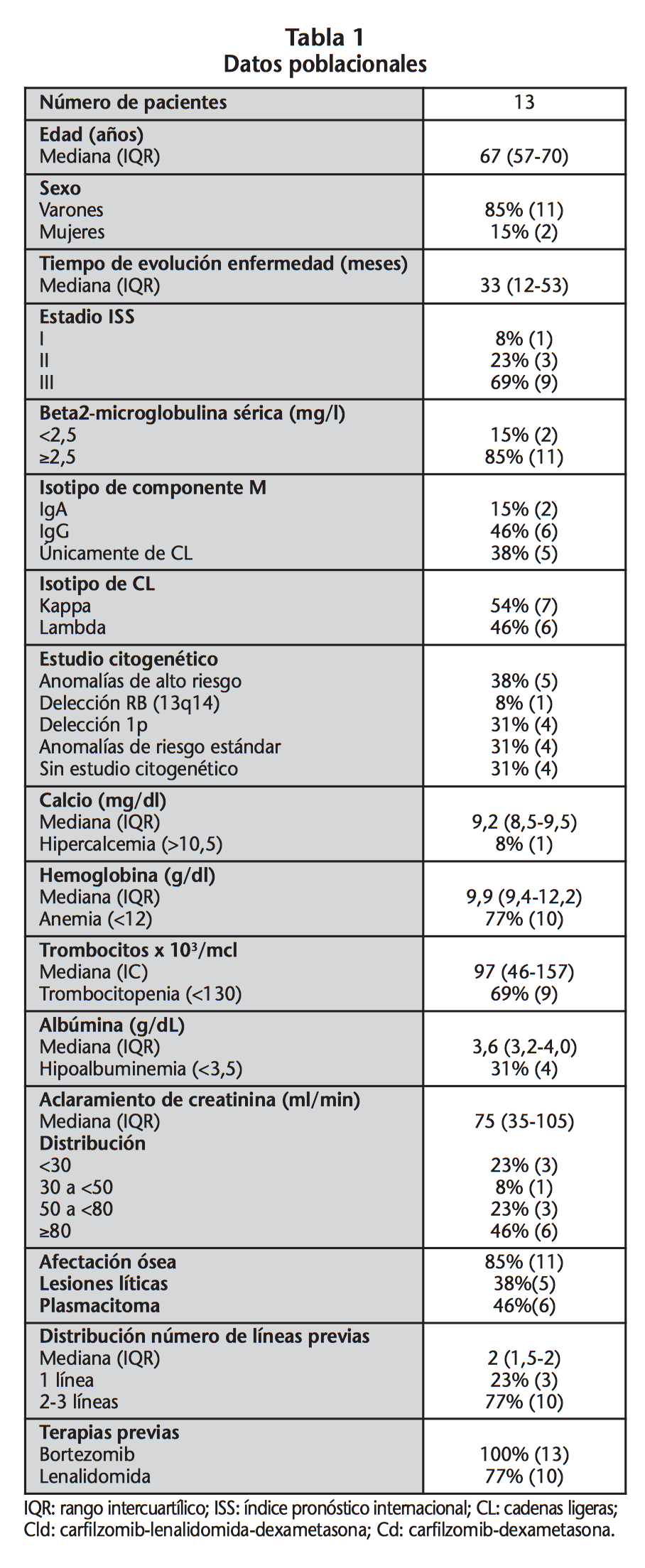 Se incluyeron 13 pacientes con MMRR con una mediana de edad de 67 años (IQR: 57-70), que recibieron en algún momento de la evolución de su enfermedad tratamiento con carfilzomib, de los cuales el 85% eran varones. En el inicio del tratamiento con carfilzomib, el 69% de los pacientes presentaron un estadio III (ISS). El estudio citogénetico se realizó en 9 pacientes hallando anomalías de alto riesgo en 5 de ellos, mientras que el resto presentó citogenética de riesgo estándar. El 77% de los pacientes habían recibido 2 o 3 líneas de tratamiento, y el 46% habían sido sometidos a trasplante autólogo de células madre previamente al tratamiento con CFZ. El 100% y el 77%, de los pacientes tuvieron exposición a bortezomib y lenalidomida, respectivamente, antes de la instauración del tratamiento con CFZ. La última línea de tratamiento más común fue la que contenía lenalidomida, administrada en el 54% de los pacientes. En la tabla 1 se describen las características poblacionales de los pacientes incluidos en el estudio.
Se incluyeron 13 pacientes con MMRR con una mediana de edad de 67 años (IQR: 57-70), que recibieron en algún momento de la evolución de su enfermedad tratamiento con carfilzomib, de los cuales el 85% eran varones. En el inicio del tratamiento con carfilzomib, el 69% de los pacientes presentaron un estadio III (ISS). El estudio citogénetico se realizó en 9 pacientes hallando anomalías de alto riesgo en 5 de ellos, mientras que el resto presentó citogenética de riesgo estándar. El 77% de los pacientes habían recibido 2 o 3 líneas de tratamiento, y el 46% habían sido sometidos a trasplante autólogo de células madre previamente al tratamiento con CFZ. El 100% y el 77%, de los pacientes tuvieron exposición a bortezomib y lenalidomida, respectivamente, antes de la instauración del tratamiento con CFZ. La última línea de tratamiento más común fue la que contenía lenalidomida, administrada en el 54% de los pacientes. En la tabla 1 se describen las características poblacionales de los pacientes incluidos en el estudio.
El número de ciclos administrados de CFZ fue 2 (IQR: 1-6). La mayoría de los pacientes (62%) recibieron CFZ según el esquema de dosis de 20/27 mg/m2, mientras que el resto (38%) recibieron la dosis de 20/56 mg/m2. En el 62% de los pacientes, CFZ se administró en el esquema Cd y en el 38% como parte del protocolo Cld.
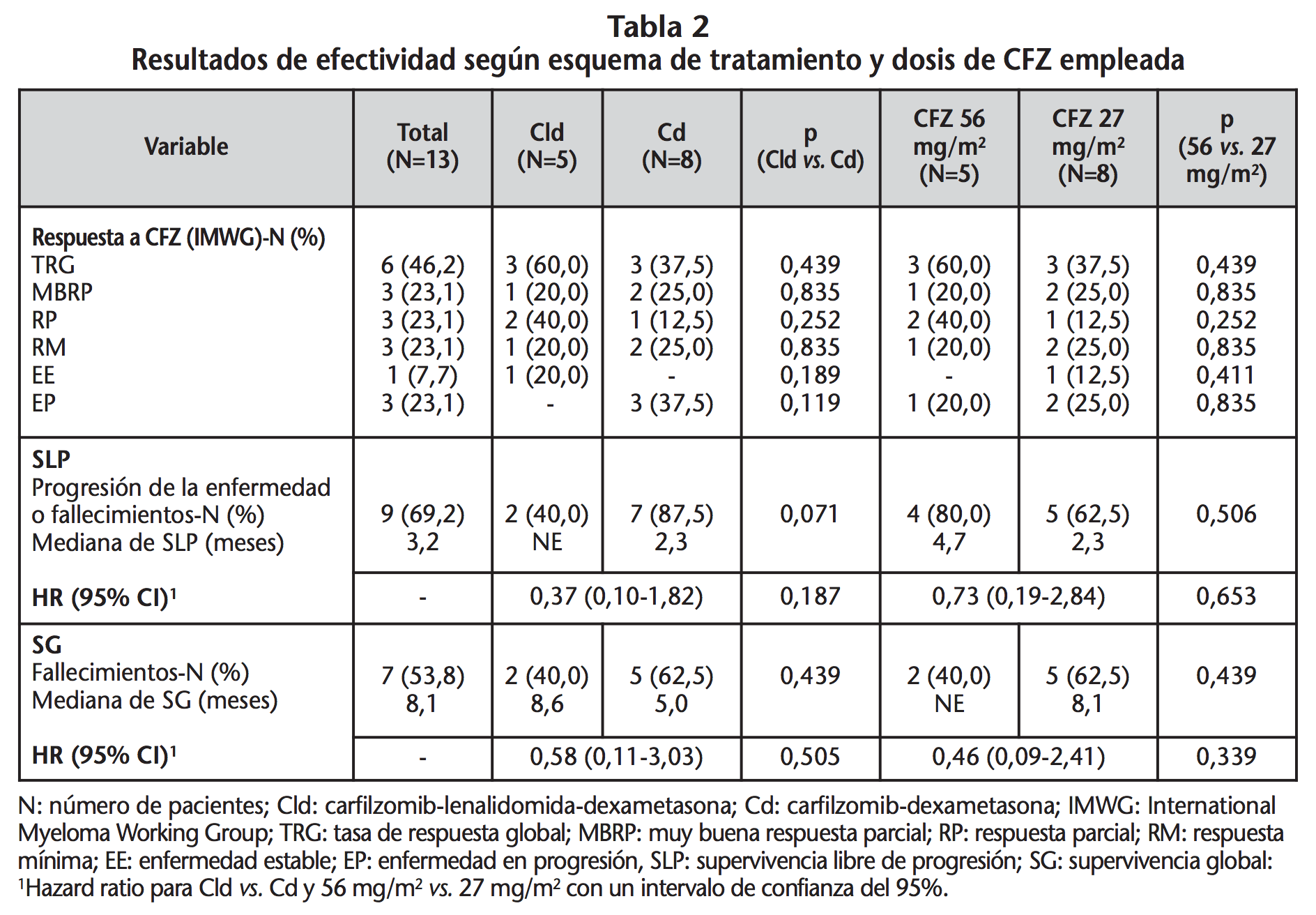
La mediana del tiempo de seguimiento fue de 5 meses (IQR: 3,0-9,5), con una mediana del tiempo hasta respuesta (TTR) de 1,5 meses (IQR: 1-3), y la duración de la respuesta (DR) fue de 6,5 meses (IQR: 4,8-11,5). La TRG fue del 46%, la SLP fue de 3,2 meses (IC 95%: 2,1-no estimable) y la SG fue de 8,1 meses (IC 95%: 2,5-no estimable). Se observó mayor TRG, SLP y SG, con el esquema Cld y con la dosis de CFZ de 56 mg/m2, aunque sin significación estadística. En la tabla 2 se muestran los resultados de efectividad de CFZ según esquema terapéutico y dosis de CFZ empleada.
Los efectos adversos más frecuentes que marcan el análisis de seguridad del fármaco durante los tratamientos instaurados, se muestran en la tabla 3. Las reacciones adversas en los esquemas que incluían CFZ ocurrieron en el 100%. Los trastornos hematológicos fueron los más frecuentes, destacando la trombocitopenia que ocurrió en 5 pacientes (38,5%) y la anemia que apareció en 4 pacientes (30,8%). Tres pacientes (23%) requirieron una reducción de dosis de carfilzomib, debido a la anemia en dos casos y a la aparición de edemas en un sujeto. En 3 pacientes fue necesaria la retirada de CFZ, ante un episodio de hiponatremia grave, un proceso neumónico y a la edematización de miembros inferiores en un paciente con insuficiencia cardíaca. Se objetivó mayor porcentaje de trombocitopenia con el esquema Cld que con Cd. (80% frente a 12,5%, p=0,015).
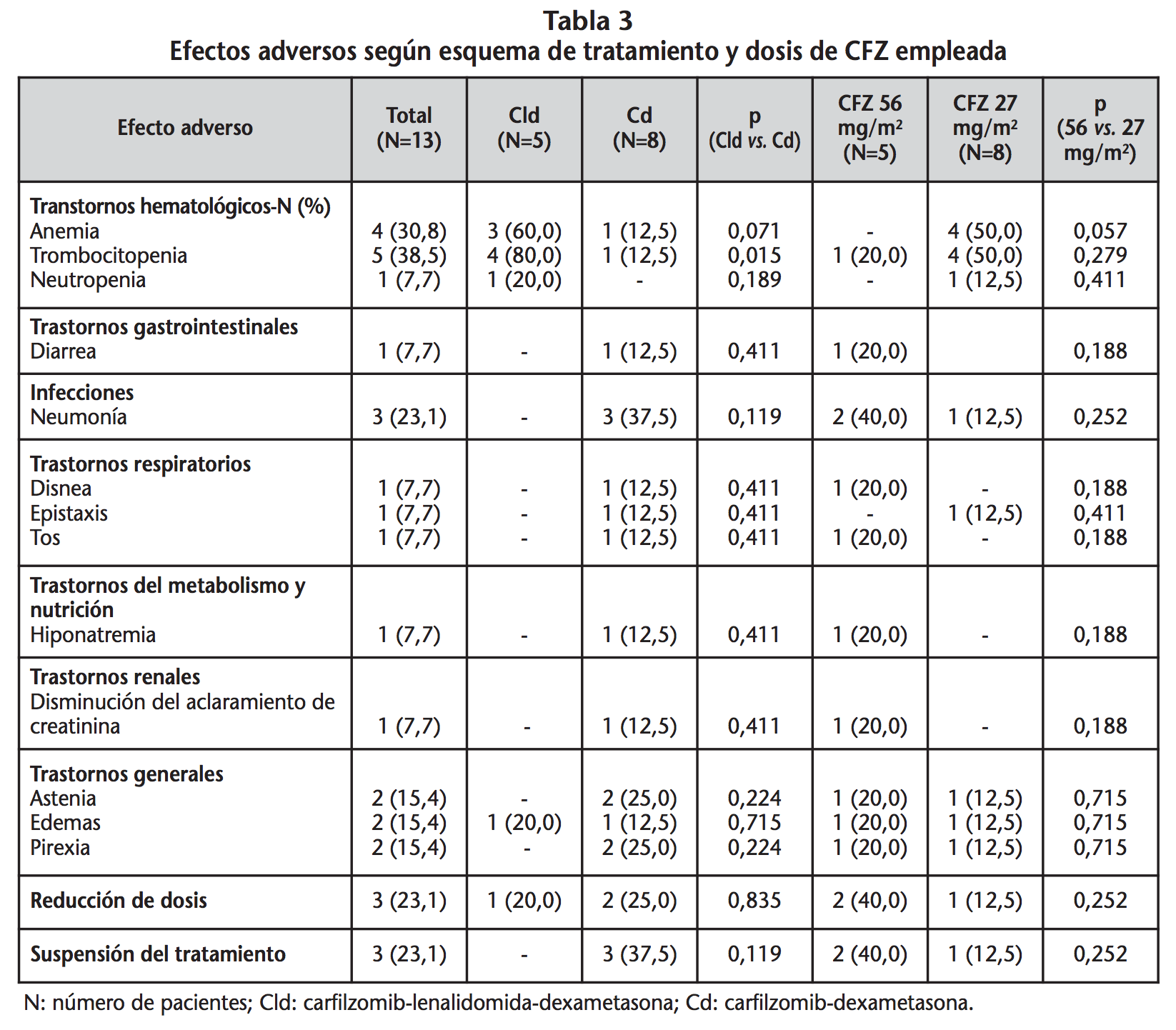
No se observaron diferencias significativas en cuanto al resto de reacciones adversas, necesidad de reducción de dosis ni retirada del tratamiento según esquema y dosis de CFZ instaurada. No obstante, Cld frente a Cd, mostró mayor tendencia de otros trastornos hematológicos tales como anemia (60% frente a 12,5%) y neutropenia (20% frente a 0%). Mientras que se observó mayor porcentaje de neumonía (37,5%), astenia (25%) y pirexia (25%) con Cd que con Cld donde no se produjo en ningún caso. La reducción de dosis de CFZ debido a los efectos adversos fue superior con las dosis de 56 mg/m2 que con 27 mg/m2 con un 40% y 12,5%, respectivamente. Asimismo, la suspensión del tratamiento con CFZ fue mayor con Cd (37,5%) que con Cld, donde no se requirió en ningún caso.
DISCUSIÓN
Los resultados de supervivencia y de duración de la respuesta fueron modestos en comparación con los ensayos pivotales ASPIRE11 (SLP=26,3 meses; SG=no estimable; DR=28,6 meses) y ENDEAVOR12 (SLP=18,7 meses y SG=no estimable; DR:21,3 meses). Una posible explicación a estos resultados es que a diferencia de los ensayos pivotales, CFZ se utilizó como segunda y tercera línea de tratamiento en un mayor porcentaje de pacientes, 77% frente a un 53% en el estudio ASPIRE y un 50% en ENDEAVOR. En este sentido, los pacientes incluidos en nuestro estudio presentan estadios de la enfermedad más avanzados, de modo que el 92% tenían una evolución de la enfermedad en estadio 2-3, mientras que en el ensayo ENDEAVOR el porcentaje fue del 56%. Asimismo, respecto al estudio citogenético, el 38% de los pacientes presenta anomalías de alto riesgo mientras que en los estudio ASPIRE y ENDEAVOR el porcentaje de pacientes con citogenética de alto riesgo fue del 12% y 21%, respectivamente. Del mismo modo, los pacientes incluidos en esta serie eran más mayores, con una mediana de edad de 67 años, mientras que en el ensayo ASPIRE y ENDEAVOR la mediana de edad era de 64 y 65 años, respectivamente.
Los criterios de selección de pacientes en el ensayo ASPIRE excluyeron aquellos con progresión de la enfermedad durante el tratamiento con cualquier régimen con bortezomib, o con progresión durante los 3 primeros meses al iniciar el tratamiento con lenalidomida y dexametasona. Asimismo, cabe destacar que en el ensayo ENDEAVOR no hubo superioridad en cuanto a SG de CFZ en los pacientes refractarios a bortezomib en líneas previas, e igualmente sucedió con los refractarios a lenalidomida. En este sentido, la disminución de la eficacia y duración de la respuesta a CFZ en la población de nuestro estudio, puede deberse a que el 100% de los pacientes habían sido pretratados con bortezomib y el 77% con lenalidomida, de modo que la utilización de CFZ no se correspondió con la de los ensayos clínicos, donde el porcentaje de pacientes pretratados con estos dos fármacos fue mucho menor.
En un estudio retrospectivo multicéntrico de Muchtar et al. 201613, en práctica clínica con 135 pacientes sin criterios de exclusión, los resultados de efectividad fueron modestos (TRG=47,2%; DR=8,4; SLP=4,9; SG=12,2 meses) aunque superiores a los de nuestro estudio. La mediana de edad de los pacientes incluidos en este estudio fue de 67 (rango: 35-91) años, con una mediana de líneas previas de tratamiento de 3 (rango: 1-7), y fueron pretratados con bortezomib y lenalidomida, en el 100% y el 93,3% de los casos. En este sentido, los pacientes incluidos en nuestro estudio presentan estadios de evolución de la enfermedad más avanzados, ya que en el estudio de Muchtar el porcentaje de pacientes con estadio ISS 2-3 fue del 57%, inferior al de nuestra serie. Asimismo, la mediana del tiempo de seguimiento fue de 6,8 meses, superior a la de nuestro estudio que fue de 5 meses.
Respecto a la eficacia de CFZ en función del esquema utilizado, se observan mejores resultados con el régimen Cld que Cd. Hay que reseñar que la toxicidad es una limitación importante de las combinaciones de tres fármacos. En este sentido, la triterapia con Cld se suele reservar a pacientes más jóvenes y con menores comorbilidades, hecho que se observó en el presente estudio, donde la mediana de edad fue superior (p=0,04) en el esquema de Cd que con Cld, con valores de 69 (IQR: 65-71) y de 60 años (IQR: 50-65), respectivamente. El hecho de que los pacientes fueran más longevos en el esquema Cd pudo influir en que los resultados de SLP y SG fueran inferiores que con Cld, donde los pacientes fueron significativamente más jóvenes.
En cuanto a la SLP y SG en función de la dosis de CFZ se observaron mejores resultados con las dosis de 56 mg/m2 que con 27 mg/m2. La dosis de CFZ recomendada según ficha técnica es de 27 mg/m2 en el esquema Cld y de 56 mg/m2 en la biterapia Cd. Sin embargo, en nuestro estudio, tres pacientes con Cd recibieron dosis de CFZ de 27 mg/m2, utilizándose el fármaco fuera de las recomendaciones de la ficha técnica. La causa de la infradosificación, fue que estos pacientes fueron tratados con CFZ previamente a que la EMA aprobara el tratamiento en combinación únicamente con dexametasona, de modo que se utilizaron las dosis de CFZ de 27 mg/m2 propias del esquema Cld.
El reducido periodo de seguimiento, la pequeña muestra del estudio, combinándose datos de dos esquemas diferentes unido a que la dosis de CFZ en el esquema Cd fue inferior en algunos pacientes a la utilizada en el estudio pivotal, son importantes limitaciones del estudio. Por ello, a partir de estos datos preliminares, son necesarios estudios más amplios, que confirmen estos resultados.
El perfil de toxicidad observado es muy similar al descrito en los ensayos clínicos. No obstante se aprecia un mayor porcentaje de pacientes con anemia y trombocitopenia, dado que los sujetos incluidos presentan en su estado basal mayor progresión de la enfermedad. Según esquema terapéutico, el porcentaje de efectos adversos fue superior en Cd que con Cld, a excepción de los trastornos hematológicos donde fue superior en la triterapia con Cld. El hecho de que los pacientes asociados al esquema Cd en el estudio presentaran edades superiores pudo ser el causante del incremento de la toxicidad en la biterapia, y del mayor porcentaje de reducción de dosis y de retirada del tratamiento que con Cld.
CONCLUSIONES
La eficacia de carfilzomib fue baja en esta serie, no obstante, los pacientes tratados con este fármaco, en el presente estudio presentaban elevada comorbilidad y complejidad, donde CFZ se utilizó en líneas de tratamiento avanzadas. En este sentido, los criterios de utilización de CFZ en la práctica clínica difieren a los descritos en los ensayos clínicos. Por lo tanto, y tras estos datos preliminares, son necesarios estudios más amplios para posicionar al CFZ en el tratamiento del MMRR en la práctica clínica.
Agradecimientos: Nuestro agradecimiento al Servicio de Hematología del Hospital General Universitario de Castellón y al Servicio de Farmacia Hospitalaria del Hospital de la Plana por la colaboración en el diseño del estudio.
Conflicto de intereses: Los autores declaran no tener conflicto de intereses.
BIBLIOGRAFÍA
1. Kazandjian D, Mailankody S, Korde N, Landgren O. Smoldering multiple myeloma: pathophysiologic in sights, novel diagnostics, clinical risk models, and treatment strategies. Clin Adv Hematol Oncol. 2014;12(9):578-87.
2. Kazandjian D. Multiple myeloma epidemiology and survival: A unique malignancy. Semin Oncol. 2016;43 (6):676-681.
3. International Agency for Research on Cancer (IARC). GLOBOCAN 2012 [Base de datos en internet]. Lyon (FR): International Agency for Research on Cancer; 2013. [citado 15 diciembre 2017] Disponible en: http://globocan.iarc.fr/Default.aspx.
4. Kumar SK, Rajkumar SV, Dispenzieri A, Lacy MQ, Hayman SR, Buadi FK, et al. Improved survival in multiple myeloma and the impact of novel therapies. Blood 2008;111(5):2516-20.
5. Siegel RL, Miller KD, Jemal A. Cancer statistics, 2016. CA Cancer J Clin. 2016;66(1):7-30.
6. Blade J, Rosinol L, Fernandez de Larrea C. How I treat relapsed myeloma. Blood. 2015; 125(10):1532-1540.
7. European Medicines Agency. London: The Agency; 1995-2018 [citado 17 septiembre 2017]. Kyprolis EPAR product information. Disponible en: http://www.ema. europa.eu/docs/en_GB/document_library/EPAR_-_Product_Information/human/003790/WC500197692.pdf.
8. Greipp P, San Miguel J, Durie B, Crowley J, Barlogie B, Bladé J, et al. International Staging System for Multiple Myeloma. J Clin Oncol. 2005;23(15):3412-3420.
9. Durie BG, Harousseau JL, Miguel JS, Bladé J, Barlogie B, Anderson K, et al International uniform response criteria for multiple myeloma. Leukemia. 2006;20(9):1467-1473.
10. National Cancer Institute. Maryland: The institute 1995-2018 [citado 15 septiembre 2017]. Cancer therapy evaluating program. Reporting guidelines. Common Terminology Criteria of Adverse Events v3.0. Disponible en: https://ctep.cancer.gov/protocoldevelopment/electronic_applications/ctc.htm#ctc_50.
11. Stewart AK, Rajkumar SV, Dimopoulos MA, Masszi T, Špička I, Oriol A, et al. Carfilzomib, lenalidomide, and dexamethasone for relapsed multiple myeloma. N Engl J Med. 2015;372(2):142-52.
12. Dimopoulos MA, Moreau P, Palumbo A, Joshua D, Pour L, Hájek R, et al. Carfilzomib and dexamethasone versus bortezomib and dexamethasone for patients with relapsed or refractory multiple myeloma (ENDEAVOR): a randomised, phase 3, open-label, multicentre study. Lancet Oncol. 2016;17(1):27-38.
13. Muchtar E, Gatt M, Rouvio O, Ganzel C, Chubar E, Suriu C, et al. Efficacy and safety of salvage therapy using Carfilzomib for relapsed or refractory multiple myeloma patients: a multicentre retrospective observational study. Br J Haematol. 2016;172(1):89-96.
____
Descargar artículo en PDF: Experiencia en práctica clínica de carfilzomib para mieloma múltiple refractario y/o en recaída
