García Martínez T1, Ferrando Piqueres R1, Vicedo Cabrera A2, García Boyero R3, Liñana Granell C1, Ibáñez Benages E1
1 Servicio de Farmacia. Hospital General Universitario de Castellón (España)
2 Fundación para el Fomento de la Investigación Sanitaria y Biomédica de la Comunitat Valenciana (FISABIO)-Salud Pública, València. CIBER de Epidemiología y Salud Pública (CIBERESP) (España)
3 Servicio de Hematología. Hospital General Universitario de Castellón (España)
Resumen
Objetivo: El objetivo de este estudio es evaluar los factores de riesgo para las reacciones infusionales tras la administración de rituximab en pacientes con linfoma no Hodgkin tipo B.
Métodos: Se realizó un análisis retrospectivo de los pacientes con diagnóstico linfoma no Hodgkin tipo B que recibieron una dosis de rituximab durante el año 2013. Se recogieron de todos ellos parámetros de la enfermedad y tratamiento, así como valores analíticos referentes a su primera administración.
Resultados: Se incluyen 51 pacientes con diagnóstico de linfoma no Hodgkin tipo B, se identifican reacción infusional en 8 pacientes (15,7%) tras la primera infusión de rituximab. Existe una tendencia de asociación positiva con el índice de masa corporal, aunque no alcanza significación estadística (5,25 (0,80-34,50), p=0,084). En pacientes con linfoma de manto se observa una tendencia a mayor riesgo de reacción infusional, pero sin llegar a la significación (13,94 (0,75-259,12) p=0,077). En pacientes en estadios avanzados de la enfermedad, estadio 4 (21,51 (2,13-216,87) p=0,009) y linfocitosis (4,16 (1,45-11,98) p=0,008), sí se observa un mayor riesgo de reacción infusional estadísticamente significativo. En el resto de variables analizadas no se obtiene significación estadística.
Conclusiones: El estadio 4 de la enfermedad y la linfocitosis en los pacientes estudiados están asociados con mayor probabilidad de desarrollo de reacción infusional. Existe una tendencia a la asociación de pacientes obesos y diagnóstico de linfoma de manto con aparición de reacción infusional. Los factores de riesgo definidos pueden ayudar a prevenir las reacciones infusionales en aquellos pacientes que los presenten.
Palabras clave: Anticuerpo monoclonal, linfoma, reacciones adversas.
Predictive factors of infusional reaction after rituximab administration
SUMMARY
Objective: The objective of this study is to evaluate the risk factors for infusion reactions following administration of rituximab in patients with non-Hodgkin type B lymphoma.
Methods: A retrospective analysis of patients diagnosed with non-Hodgkin type B lymphoma who received one dose of rituximab during 2013. It collected all parameters of the disease and treatment and analytical values concerning their first administration is performed.
Results: 51 patients were included with a diagnosis of non-Hodgkin type B, infusional reaction was identified in 8 patients (15.7%) after the first infusion of rituximab. There is a trend of positive association with body mass index, although not statistically significant (5.25 (0.80 to 34.50), p=0.084). In patients with mantle lymphoma a tendency to increased risk of infusion reaction is observed, but without reaching significance (13.94 (0.75 to 259.12) p=0.077). In patients with lymphocytosis (4.16 (1.45 to 11.98) p=0.008) and advanced stages of disease (stage 4) (21.51 (2.13 to 216.87) p=0.009) an increased risk of infusional reaction statistically significant is observed. In the other analyzed variables no statistical significance wasobtained.
Conclusions: The stage 4 disease and lymphocytosis in the studied patients are associated with increased infusion reaction development. There is a trend of association of obese patients and patients diagnosed with mantle lymphoma and ocurrence of infusion reaction. The defined risk factors can help prevent infusion reactions in patients who present them.
Key Words: Monoclonal antibodies, lymphoma, adverse drug reactions.
____
Introducción
Rituximab (RTX) es un anticuerpo monoclonal quimérico anti-CD20 usado en el tratamiento de enfermedades linfoproliferativas de la línea B. Este fármaco está indicado en enfermedades hematológicas como linfoma no Hodgkin (LNH) y leucemia linfocítica crónica (LLC), y su empleo junto a los esquemas de quimioterapia clásicos ha mejorado el pronóstico de pacientes con estas patologías1-4. Se administra junto con otros fármacos citostáticos tanto en inducción, como en recaídas o mantenimiento de pacientes que han respondido a la inducción. La dosis varían según indicación y esquema terapéutico entre 375 mg/m2 y 500 mg/m2 por ciclo. Se administra en unidades de hospitalización sin ingreso, ya que la velocidad de infusión es inicialmente lenta y, requiere monitorización para poder ir incrementándola según la tolerancia, no superando en la mayoría de los casos las seis horas totales.
En general, RTX es bien tolerado pero algunos pacientes pueden presentar citopenias transitorias y reacciones infusionales (RI) en su administración, siendo éstas últimas los eventos adversos más frecuentes y peligrosos de este fármaco5. La razón por la que se producen las RI no está clara, podrían estar implicados dos mecanismos, uno relacionado con reacciones alérgicas mediadas por Inmunoglobulinas (Ig) E (hipersensibilidad) y desencadenado por la administración de proteínas extrañas, y el otro, en cambio, un mecanismo no mediado por Ig E y debido a la liberación de citoquinas inflamatorias6. Ambos síndromes son indistinguibles clínicamente y las estrategias terapéuticas a seguir son idénticas: uso de antihistamínicos y/o corticoides, disminución de la velocidad de infusión o interrupción temporal de la administración, seguida de terapia de soporte1,7. Estas reacciones no se deben confundir con el síndrome de lisis tumoral que se produce por la destrucción rápida de células tumorales, donde se libera al torrente circulatorio el contenido intracelular, causando un aumento de ácido úrico, potasio sérico y otros trastornos metabólicos tras las 24 horas de la infusión de la quimio/inmunoterapia8.
La clínica de las RI varía en severidad e incluye diferentes síntomas como hipotensión, broncoespasmo, náuseas, cefalea, fiebre, urticaria, incluso en casos graves compromiso de la función cardiovascular y respiratoria1,9. Generalmente, estos síntomas son reversibles y se resuelven con medidas de soporte e interrupción o disminución de la velocidad de perfusión. Datos sobre su prevalencia indican que estas RI son frecuentes, aparecen en más del 50% de los pacientes10, en la primera administración entre los 30-120 minutos iniciales, reduciéndose significativamente en las siguientes infusiones. La mayoría de RI son de grado medio, mientras que la incidencia de las severas es generalmente baja7,10. Se conocen diversos factores de riesgos asociados al desarrollo de estas reacciones adversas como son linfocitosis8, antecedentes de alergia, alta carga tumoral6, infiltrados pulmonares, pacientes en edad avanzada y diagnóstico de LLC o linfoma de las células del manto11.
Los CD20 situados en la membrana de las células tumorales son expresados en mayor proporción en LLC, por ello se administra una dosis mayor de RTX que, lógicamente, provocará que la depleción de las células B CD20+ sea mayor en estos pacientes tras la infusión del fármaco e incrementará, notablemente, la posibilidad de desarrollar un síndrome de liberación de citoquinas. Para minimizar este riesgo en los pacientes con LLC se suele administrar RTX fraccionando la dosis durante dos días en el primer ciclo y en algún ciclo posterior si existe linfocitosis.
Por todo ello y en busca de la máxima seguridad, en las guías de práctica clínica se recomienda iniciar la primera infusión a una velocidad de 50 mg/h, a los 60 minutos incrementar 50 mg/h, y cada 30 minutos si existe buena tolerancia, hasta un máximo de 400 mg/h, vigilando siempre los signos vitales durante quince minutos, tras cada incremento de velocidad infusional. En los esquemas de administración de RTX se incluye la pauta de premedicación para todos los pacientes en la primera infusión con un analgésico como paracetamol y un antihistamínico, dexclorfeniramina, y sólo en casos de linfocitosis elevada y en LLC, se administra un corticoide. Se recomienda también no administrar antihipertensivos en las doce horas previas a la administración de RTX para prevenir la hipotensión10,12.
La mayor parte de estas reacciones se resuelven con las medidas anteriormente comentadas, pero en algunos casos la mala tolerancia o la necesidad de seguimiento estrecho tras la administración tiene como consecuencia el ingreso de estos pacientes. Este hecho supone una reorganización de la unidad de hospitalización, tratamiento agudo para la RI y un incremento del coste asociado a todo el proceso.
En el actual estudio se evalúan los posibles factores de riesgo de RI por RTX en pacientes con linfoma no Hodgkin de células B (LNH-B), donde se emplea fundamentalmente este fármaco como primera línea de tratamiento, con el fin de identificar a aquellos pacientes con mayor predisposición a desarrollar estas reacciones y poder establecer las medidas necesarias para prevenirlas.
Se plantean los siguientes objetivos: conocer la incidencia de las reacciones infusionales, definir factores de riesgo en los pacientes que han sufrido una reacción infusional a rituximab.
Material y métodos
Estudio observacional restrospectivo, donde se incluyeron pacientes mayores de 18 años que recibieron al menos una dosis de inmunoterapia con RTX para cualquier enfermedad oncohematológica indicada durante el año 2013 en un hospital de tercer nivel. Se excluyeron pacientes incluidos de ensayos clínicos.
Se seleccionaron inicialmente 70 pacientes que recibieron RTX en el año 2013. Con el fin de obtener un grupo lo más homogéneo posible, no se incluyeron los pacientes con diagnóstico de LLC, enfermedad de Waldestrom, Linfoma de Burkitt y Linfoma Hodgkin, debido a su escasa incidencia (19 pacientes) y a que su gran variabilidad en cuanto a las dosis de RTX, esquemas terapéuticos asociados y ciclos de tratamiento de diferente duración dificultarían notablemente su comparación con los grupos de los pacientes con LNH-B. La inclusión de estos pacientes en el análisis sería un factor de confusión en los resultados. Por todo ello, finalmente se decidió la inclusión de 51 pacientes diagnosticados de LNH-B de tipo B, cualquiera que fuera el subtipo, ya que en estos el tratamiento de elección es siempre RTX.
Los datos consultados de las historias clínicas fueron tratados según la Ley Orgánica 15/99 de Protección de datos de carácter personal. Se disoció toda la información clínica y personal de los pacientes en la construcción de la base de datos.
Para cada paciente se recogieron parámetros antropométricos y demográficos (sexo, edad, índice de masa corporal (IMC), superficie corporal), factores relacionados con su enfermedad (diagnóstico, estadio en el momento del diagnóstico, órganos infiltrados, fase evolutiva) y con su tratamiento (esquema terapéutico, dosis, volumen de mezcla administrado), así como pruebas analíticas (leucocitos, linfocitos, neutrófilos, LDH, plaquetas, hemoglobina). Toda la información recogida fue referente a la administración de la primera dosis de RTX.
Los subtipos de LNH-B se agruparon en tres categorías: linfomas de bajo grado (que incluye linfoma folicular, linfoma de célula pequeña, linfoma de la zona marginal y linfoma linfoplasmocítico), linfoma difuso de célula grande y linfoma de células del manto.
El análisis estadístico se realizó con el programa Stata versión 11 (Stata Corp LP, College Station, Texas).
En el análisis descriptivo de los datos en el caso de las variables continuas se calculó la media (X), la desviación estándar (DS) y el rango. En las variables discretas se calculó la mediana (Med) y frecuencia (%). Algunas variables continuas se transformaron a categóricas para observar de manera más clara las diferencias. Para las variables continuas normales se realizó el Test T-Student. En el caso de las variables categóricas en contexto normal se debería realizar el Test de Chi cuadrado, pero se debe tener en cuenta que éste, cuando el valor de n es bajo no es correcto, como ocurre en este estudio, por lo que se realizó el Test Exacto de Fisher para obtener el p valor.
En el caso de los valores analíticos, a excepción de la hemoglobina, no siguen una distribución normal tras realizar el test de la normalidad, por lo que se utiliza la mediana y el rango. Se realizó en este caso un test no paramétrico, el test de U Mann Whitney.
Para definir los factores de riesgo relacionados con RI se realiza una regresión logística binomial en la que la variable categórica es presentar RI o no RI. En las variables categóricas se toma una de ellas como referencia para la comparación, mientras en las variables continuas se calcula el incremento de riesgo por cada unidad de medida (o múltiplos). Se calcula el Odds Ratio crudo (ORc) como medida de asociación (no de causalidad) para todas las variable y el Odds Ratio ajustado (ORa) en algunas de ellas. Los modelos se ajustaron por sexo, edad e IMC del paciente, con el fin de tener en cuenta la posible heterogeneidad en las características basales (o individuales) de la muestra. En una segunda fase, se incluyeron en el modelo el resto de variables individuales, sin embargo dado que no mejoraba la bondad de ajuste, se decidió reportar los resultados del análisis del ajuste inicial. Un p valor <0,05 se considera estadísticamente significativo.
Resultados
En base a la hipótesis y los objetivos del presente trabajo, se realizó el análisis de los datos demográficos clasificando a los pacientes en dos grupos: pacientes que no presentaron RI y pacientes que presentaron RI. En el periodo de estudio de 51 pacientes con tratamiento RTX se produjeron RI en 8 de ellos (15,7%).
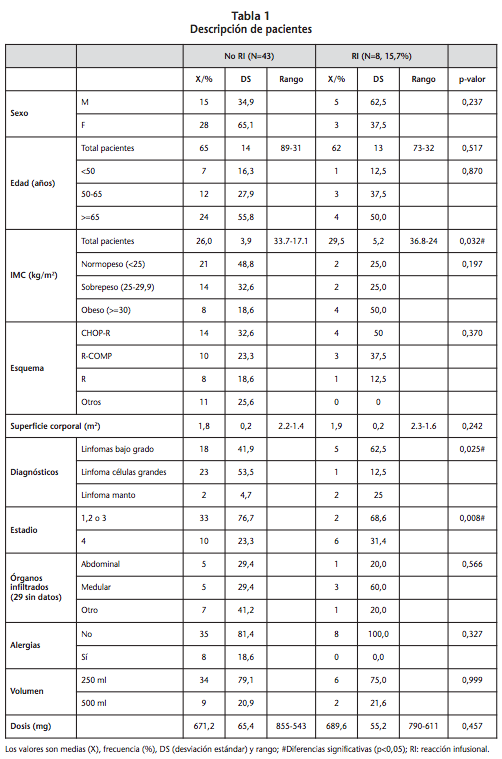
En primer lugar se hizo un análisis descriptivo de los datos de los pacientes que se muestra en la tabla 1. En los resultados obtenidos no existen diferencias significativas en cuanto a los dos grupos en la mayoría de las características comparadas, con excepción del IMC y el tipo de linfoma y estadio.
Para la variable del IMC se observa que existe una mayor aparición de RI en pacientes con mayor IMC, según el test T Student (p=0,0032) (Figura 1).
En linfomas de bajo grado se observa un mayor número de pacientes que presentaron RI de manera estadísticamente significativa (p=0,025), al igual que ocurre en pacientes con estadio 4 de la enfermedad (p=0,008). En ambos casos se realizó el Test exacto de Fisher.
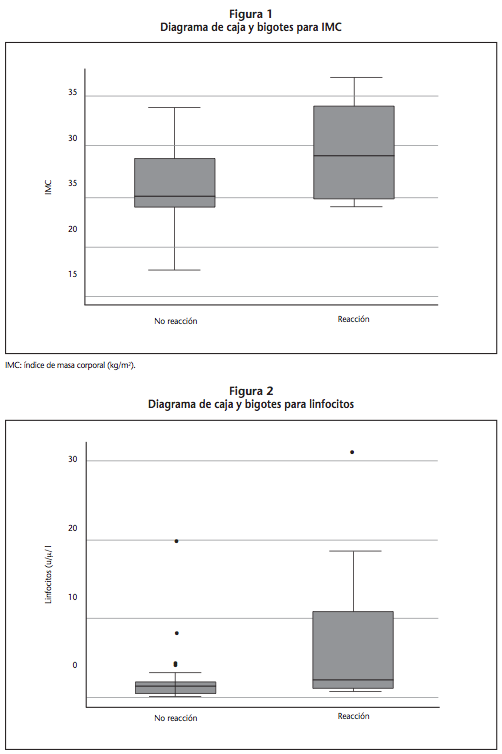
En la tabla 2 se describen los valores analíticos de los pacientes, se realizó el Test no paramétrico de U Mann Whitney en todos los parámetros a excepción de hemoglobina que se trató como variable continua normal. Se observa que no existen diferencias significativas entre los parámetros de los dos grupos, aunque se aprecia una tendencia a la significación en los linfocitos, sin embargo, debido a la elevada dispersión de los datos no se obtiene significación estadística (Figura 2).
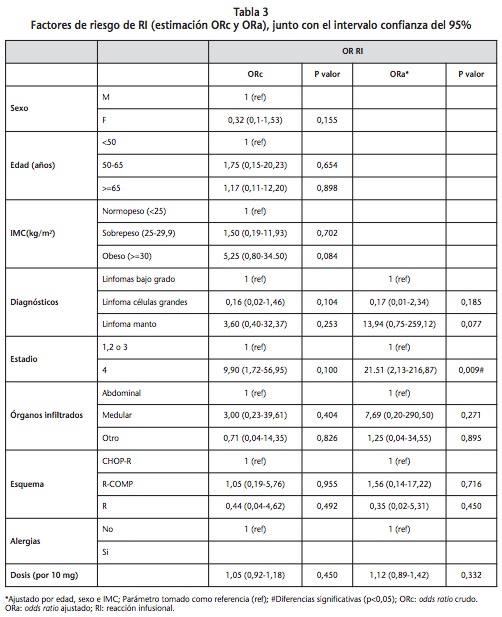
Los resultados de la regresión logística binomial se muestran en la tabla 3. Se observa que los pacientes obesos están cinco veces más relacionados con RI que los pacientes con normopeso, por lo que hay una tendencia de asociación positiva con IMC aunque no alcanza significación estadística (5,25 (0,80-34,50), p=0,084).
Con el fin de que los dos grupos de pacientes sean similares en cuanto a sus características basales de edad, sexo e IMC se calcula el Odds Ratio ajustado (ORa), de esta manera se corrige la posible influencia de éstos en los resultados.
En pacientes con linfoma de manto se observa una tendencia a mayor riesgo de RI pero sin llegar a la significación (13,94 (0,75-259,12) p=0,077). En cambio, en estadios avanzados de la enfermedad, estadio 4, sí se observa un mayor riesgo de RI estadísticamente significativo (21,51 (2,13-216,87) p=0,009). En el resto de variables analizadas no se obtiene significación estadística, probablemente debido al bajo tamaño muestral.
En el caso de alergias no ha sido posible establecer una asociación, ya que no existen casos.
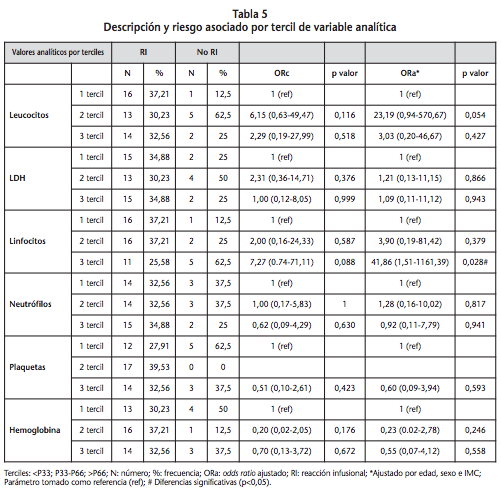
Como se ha comentado anteriormente en las variables analíticas continuas se calcula el riesgo por cada unidad (o múltiplo) que aumenta. Los resultados se muestran en la tabla 4, donde se observa que se alcanza significación estadística en valores analíticos de linfocitos en los dos casos (ORc y ORa), así se incrementa el riesgo de RI por cada 5 u/μl.103.
Los parámetros analíticos son variables no normales y los resultados del análisis pueden estar influenciados por los valores extremos, por lo que se dividen en terciles para evaluar mejor estas variables continuas (Tabla 5), ya que de la otra manera se asume que el riesgo incrementa de forma lineal. Se calcula el riesgo respecto a la categoría más baja, y así, se obtiene que valores elevados de linfocitos (tercer tercil) se asocian con mayor riesgo de RI de forma estadísticamente significativa (4,16 (1,45-11,98) p=0,008).
Discusión
La incidencia de RI en el entorno del estudio en la primera dosis de RTX es de 15,7% (8 de 51 pacientes). No se dispone de información detallada de la gravedad de las RI en las historias clínicas, por lo que se asume que en los ocho pacientes se trata de RI debidas a liberación de citoquinas (“Cytokine release síndrome/acute infusión reactions”)13. Es difícil establecer con exactitud el grado de toxicidad en estos pacientes, según los clínicos todos los casos fueron grado 2-313, ya que se resolvieron con disminución o interrupción de la infusión de RTX, tratamiento de los síntomas e ingreso para finalización de la infusión con posterior alta en menos de 48 horas. El dato del 15,7% es inferior al observado en la bibliografía científica. Esta diferencia está motivada por las características y diseño del estudio, donde la información se recoge de las historias clínicas de los pacientes en la práctica clínica habitual, por ello en este escenario la mayoría de RI leves que se resuelven durante la administración (leve descenso de la velocidad de infusión) en el propio Hospital de Día, no quedan registradas. Así pues, la incidencia del 15,7% hace referencia a las RI moderadas o graves. La causalidad fue establecida usando el Algoritmo de Naranjo14 y se consideraron los ocho casos como probables.
En el presente estudio se establece una asociación con las RI con significación estadística, en los pacientes en estadio 4 de la enfermedad, así como con linfocitosis. Ambas asociaciones, ya descritos en la literatura6,8,15, están relacionadas con un alto grado de enfermedad y una alta carga tumoral, por lo que se podría esperar gran liberación de citoquinas y desarrollo de RI. El diagnóstico más frecuentemente asociado con RI fue linfoma de manto aunque sin obtener significación estadística. En los pacientes con IMC elevado (obesidad) se observa una tendencia a la significación pero sin ser concluyente, por lo que este dato podría constituir una nueva línea de investigación para tratar de dar respuesta de forma concluyente a esta tendencia observada. En otros parámetros estudiados como son el esquema terapéutico utilizado o la dosis no se obtiene asociación.
Otros autores asocian la RI con afectación de la médula ósea1, parámetro no evaluable en este estudio, ya que no se disponían de los datos de todos los pacientes. Aunque la asociación con linfocitosis pudiera ser un dato indirecto de afectación medular, ya que en caso de estar en rango patológico sugiere daño de la medula ósea y salida a sangre periférica, por tanto indicador de estadio 4.
La historia de alergias medicamentosas o atopias se han asociado con reacciones adversas cuando se ha utilizado otro anticuerpo monoclonal6, no se puede establecer dicha relación en este caso. No obstante para prevenir las reacciones adversas secundarias a RTX es necesario recoger la historia de alergias medicamentosas del paciente así como una adecuada premedicación.
La premedicación está incluida en los protocolos de administración de anticuerpos monoclonales, como es el caso del RTX, con el fin de minimizar el riesgo de RI. Se administra la misma premedicación en todos los pacientes en la primera dosis por lo que no es un factor comparador a tener en cuenta. La premedicación se administra en todas las dosis de RTX aunque el valor de la premedicación en la segunda y siguientes dosis pierde su valor, ya que existe menor riesgo.
La terapia de mantenimiento con RTX ofrece un tratamiento continuo a los pacientes después de la inducción con el fin de retrasar las recaídas, muy frecuentes en linfomas foliculares, y reduce el riesgo de progresión sin aumentar los efectos adversos derivados del tratamiento16. Algunos autores demuestran la buena tolerancia de las infusiones rápidas de 60-90 minutos de RTX en algunos pacientes seleccionados con baja incidencia de RI y mejora de la eficiencia del centro hospitalario9,11,17-18. Si se conocen los factores de riesgo que determinan la tolerancia a partir de la segunda dosis se podría incluir en un protocolo de infusión rápida aquellos pacientes que pudieran beneficiarse.
El tamaño muestral es bajo por lo que los resultados no pueden extrapolarse, pero pueden servir de utilidad en la práctica clínica diaria, ya que en aquellos pacientes con riesgo (IMC elevado, linfoma de bajo grado, estadio 4 y linfocitosis) se deberá actuar con mayor precaución con el fin de disminuir la aparición de RI.
Se debe realizar un seguimiento a los pacientes con nuevos tratamiento con RTX con el fin de observar si la actuación derivada de estos factores de riesgo tiene implicación en una disminución de la aparición de RI.
Conclusiones
Con los resultados obtenidos en este trabajo se puede concluir que las reacciones infusionales tras la primera dosis de rituximab de gravedad moderada-grave son frecuentes en los pacientes analizados. El estadio 4 de la enfermedad y la linfocitosis están asociados con reacciones infusionales en los pacientes estudiados. Existe una tendencia a la asociación de pacientes obesos y diagnóstico de linfoma de manto con reacciones infusionales. Los factores de riesgo definidos pueden ayudar a prevenir reacciones infusionales en aquellos pacientes que los presenten.
Conflicto de intereses: Los autores declaran no tener conflictos de intereses.
Bibliografía
- Hong J, Kim JY, Ahn HK, Lee SM, Sym SJ, Park J, et al. Bone marrow involvement is predictive of infusion-related reaction during rituximab administration in patients with B cell lymphoma. Support Care Cancer. 2013;21(4):1145-52.
- National Comprehensive Cancer Network. Clinical Practice guidelines in Oncology: Non-Hodgkins lymphomas. Version 2.2014. Publicado 27 marzo 2014. Disponible en: www.nccn.org. Consultado: 3 noviembre 2014.
- Freedman AS. CME Information: folicular lymphoma: 2014 update on diagnosis and management. Am J Hematol. 2014;89(4):429-36.
- Tilly H, Vitolo U, Walewski J, da Silva MG, Shpilberg O, André M, Pfreundschuh M, Dreyling M. ESMO Guidelines Working Group. Diffuse large B-cell lymphoma (DLBCL): ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2012;23(7):78-82.
- Keating G.M. Rituximab. A Review of its Use in Chronic Lymphocytic Leukaemia, Low-Grade or Follicular Lymphoma and Diffuse Large B-Cell Lymphoma. Drugs. 2010;70(11):1445-76.
- Arredondo-Garza T, Majluf-Cruz A,Vela-Ojeda J, Mariscal-Ramirez I, Solis-Anaya L, Lopez-Gutierrez JR, et al. Peri-infusional adverse reactions to rituximab in patients with non-Hodgkin´s lymphoma. Arch Med Res. 2013;44:549-54.
- Vogel WH. Infusion reactions: diagnosis, assessment and management. Clin J Oncol Nurs. 2010,14 (2):E10-E21.
- Chung CH. Managing premedications and the risk for reactions to infusional monoclonal antibody therapy. Oncologist. 2008;13:725-32.
- Patel J, Ho M, Ho V, Bello C, Djulbegovic B, Sokol L, et al. Rapid infusión rituximab for maintenance therapy: is it feasible? Leuk Res Treatment. 2013;2013:629283. (Epub 2013 Oct 31).
- Centro on line de medicamentos de la AEMPS [internet]. Madrid: Agencia Española de Medicamentos y productos sanitarios; 1997. Ficha técnica Mabthera®. Disponible en: http://www.aemps.gob.es/cima/fichasTecnicas. Consultado: 13 octubre 2014.
- Atmar J. Review of the safety and feasibility of rapid infusión of rituximab. J Oncol Pract. 2010,6(2):91-3.
- Hegele V, Stoll P, Wüst D, Ehrenbrink G, Grazziotin LR, Prohonoski J, et al. Pharma ceutical follow-up for patients on rituximab therapy for non-Hodgkin lymphoma: what is the evidence? Int J Clin Pharm. 2013;35:513-9.
- U.S. Department of health and human services. National Institutes of health, National Cancer Institute. Common terminology criteria for adverse events (CTCAE). V4.03. Publicado 14 Junio 2010. Disponible en http://evs.nci.nih.gov/ftp1/CTCAE Consultado: 14 de octubre de 2014.
- Naranjo CA, Busto U, Sellers EM, Sandor P, Ruiz I, Roberts A, et al. A method for estimating the probability of adverse drug reactions. Clin Pharmacol Ther. 1981;30:239-45.
- Byrd JC, Waselenko JK, Maneatis TJ, Murphy T, Ward FT, Monahan BP, et al. Rituximab therapy in hematologic malignancy patients with circulating blood tumor cells: association with increased infusion-related side effects and rapid blood tumor clearance. J Clin Oncol. 1999;17(3):791-5.
- Zhou X, Wang J, Zhang J, Copley-Merriman C,Torigoe Y, Reyes C. Symptoms and toxicity of rituximab maintenance relative to observation following immunochemotherapy in patients with folicular lymphoma. Hematology July 2014. (Epub ahead of print).
- Chiang J, Chan A, Shih V, Wan Hee S, Tao M, Lim ST. A prospective study to evaluate the feasibility and economic benefits of rapid infusión rituximab at an Asian cáncer center. Int J Hematol. 2010;91:826-30.
- Tuthill M, Crook T, Corbet T, King J, Webb A. Rapid infusión of rituximab over 60 min. Eur J Haematol. 2009;82:322-5.
____
Descargar artículo en PDF: Factores predictores de reacción infusional tras administración de rituximab
Artículo dentro del número: VOL. 25 – Nº3 – 2015
____