Albanell-Fernández M*, Escolà Rodríguez A*, López-Cabezas C
Hospital Clínic de Barcelona. Servicio de Farmacia. Área del Medicament. Barcelona (España)
*Ambas autoras contribuyeron por igual
Fecha de recepción: 07/06/2022 – Fecha de aceptación: 27/06/2022
Correspondencia: Marta Albanell-Fernández – Calle Villaroel, 170 – 08030 Barcelona (España)
malbanell@clinic.cat – aescola@clinic.cat
____
Resumen
Introducción: Los excipientes son componentes inertes de formas farmacéuticas, empleados para mejorar características farmacodinámicas y organolépticas. La frecuencia de reacciones de hipersensibilidad a excipientes es generalmente baja, aunque en los últimos años ha cobrado más relevancia; especialmente por excipientes presentes en fármacos antineoplásicos y recientemente, con las vacunas contra SARS-CoV-2.
Objetivos: Generar una herramienta de consulta útil para un adecuado manejo de reacciones de alergia e hipersensibilidad a excipientes presentes en medicamentos y vacunas, revisando la información más relevante publicada respecto a la epidemiología, mecanismos de acción, sistemas de identificación y posibles alternativas disponibles.
Métodos: Se realizó una búsqueda sistemática en PubMed/ Medline para recopilar la información disponible en estudios publicados en los últimos 25 años en inglés y español. Se consultaron páginas web de organismos oficiales: EMA, AEMPS y Institute for Vaccine Safety; John Hopkins. De cada excipiente se recogió: uso, características fisicoquímicas, medicamentos que los contienen, tipo de alergia con la que se les ha relacionado y descripción de casos reportados.
Resultados: La revisión sistemática incluyó 89 artículos: casos clínicos, artículos originales y revisiones bibliográficas; el 69,6% de ellos publicados en la última década. Este trabajo recoge un total de 16 excipientes, 9 incluidos en medicamentos, 4 contenidos en vacunas y 3 presentes tanto en medicamentos como en vacunas.
Conclusiones: Esta revisión proporciona un resumen actualizado de los principales excipientes relacionados con reacciones de hipersensibilidad aportando información actualizada y detallada a profesionales sanitarios involucrados en el manejo de estas reacciones, contribuyendo así a la administración segura de medicamentos.
Palabras clave: Excipientes, hipersensibilidad, alergia, vacunas, medicamentos.
Hypersensitivity to drug and vaccine excipients: literature review
Summary
Introduction: Excipients are inert components of pharmaceutical forms, used to improve pharmacodynamic and organoleptic characteristics. The frequency of hypersensitivity reactions to excipients is generally low, although in recent years it has become more relevant, especially due to excipients present in antineoplastic drugs and recently with vaccines against SARS-CoV-2.
Objectives: To generate a useful reference tool for an adequate management of allergy and hypersensitivity reactions to excipients present in drugs and vaccines, reviewing the most relevant information published regarding epidemiology, mechanisms of action, identification systems and possible alternatives available.
Methods: A systematic search was carried out in PubMed/Medline to compile the information available in studies published in the last 25 years in English and Spanish. Websites of official organizations were consulted: EMA, AEMPS and Institute for Vaccine Safety; John Hopkins. The following information was collected for each excipient: use, physicochemical characteristics, drugs containing them, type of allergy to which they have been related and description of reported cases.
Results: The systematic review included 89 articles: clinical cases, original articles and bibliographical reviews; 69.6% were published in the last decade. This work includes a total of 16 excipients, 9 included in drugs, 4 contained in vaccines and 3 present in both drugs and vaccines.
Conclusions: This review provides an updated summary of the main excipients related to hypersensitivity reactions, providing up-to-date and detailed information to healthcare professionals involved in the management of these reactions, thus contributing to the safe administration of drugs.
Key words: Excipients, hypersensitivity, allergy, vaccine, drug.
____
Introducción
Los excipientes son componentes inertes de una forma farmacéutica, diferentes del principio activo y del material de acondicionamiento, carentes de actividad farmacológica, que se emplean para mejorar la estabilidad, propiedades organolépticas, influir en la palatabilidad, modificar la solubilidad o mejorar la cinética de absorción de los medicamentos que los contienen. Entre ellos destacan los conservantes, disgregantes, colorantes, estabilizadores, emulsionantes, solubilizantes y aromatizantes, entre otros1.
La frecuencia de reacciones de hipersensibilidad o alergia a este tipo de compuestos es baja; sin embargo, en los últimos años hemos asistido a un creciente interés en este tema, debido especialmente al incremento de reacciones de hipersensibilidad a los excipientes contenidos en ciertos fármacos biológicos y antineoplásicos, y más recientemente, con la aparición de las vacunas contra el SARS-CoV-2.
Por otra parte, el elevado número de excipientes presentes en los medicamentos y la baja especificidad de las manifestaciones que producen, hacen que el diagnóstico resulte complejo, dando lugar a falsos positivos de alergia al principio activo del medicamento que los contiene2. Por este motivo, es importante conocer aquellos excipientes más relacionados con reacciones de hipersensibilidad, así como el manejo y alternativas disponibles en cada caso.
El objetivo de este trabajo es recopilar información publicada sobre alergia e hipersensibilidad a los principales excipientes contenidos en medicamentos y en vacunas, generando una herramienta de consulta útil para el adecuado manejo de estos casos. Se revisa la información más relevante publicada respecto a la epidemiología, mecanismos de acción, métodos de identificación y posibles alternativas disponibles, en caso de que las haya.
MÉTODOS
Se realizó una revisión exhaustiva de la literatura científica publicada sobre el tema siguiendo las siguientes premisas3:
Criterios de eligibilidad: se incluyeron artículos originales, revisiones y casos clínicos sobre reacciones de hipersensibilidad causadas por excipientes presentes en medicamentos y vacunas. Los años de publicación de los estudios abarcaron desde el 1996 hasta el 2021 y los idiomas incluidos fueron el inglés y el español. Se excluyeron los artículos de los que no se disponía de acceso al texto completo.
Fuentes de información: base de datos PubMed/MEDLINE. También se consultaron páginas web de organismos oficiales4-6: Agencia Europea del Medicamento (EMA) y Agencia Española del Medicamento y Productos Sanitarios (AEMPS) para la revisión de fichas técnicas, y la del Institute for Vaccine Safety; John Hopkins, para consultar información relacionada con vacunas. En la bibliografía se incluyen las fechas de consulta.
Estrategia de búsqueda: Los términos elegidos para la búsqueda fueron: “allergy”, “hypersensitivity”, “drug reaction”, “vaccine”, además de los nombres y sinónimos de los excipientes conocidos, combinados con los operadores booleanos “AND” y “OR”. El proceso de búsqueda bibliográfica para cada excipiente fue realizado por dos investigadores de forma paralela; seguidamente se revisaron los artículos identificados y posteriormente se eliminaron los duplicados.
Se estableció un límite de 5 o más casos de hipersensibilidad identificados en la literatura, según los criterios de búsqueda establecidos, para aquellos excipientes con un apartado propio en la revisión, mientras que el resto se citan en el apartado “Otros”. En los excipientes contenidos en medicamentos se ha incluido algún artículo en el que la molécula se ha empleado como principio activo en vez de como excipiente, debido a la relevancia clínica de la información que aportaban.
En el caso de los excipientes contenidos en vacunas, se seleccionaron aquellos con mayor número de casos descritos en vacunas comercializadas en Europa y EE. UU., haciendo especial mención a los excipientes contenidos en vacunas para el SARS-CoV-2, por el especial interés que han suscitado.
Variables: de cada excipiente se recogió información respecto al uso, características fisicoquímicas, medicamentos que los contienen, tipo de alergia o hipersensibilidad con la que se les ha relacionado, descripción de casos clínicos y alternativas disponibles en caso de que hubiera.
RESULTADOS
Se revisaron 116 referencias bibliográficas, de las que se seleccionaron 89 referencias que cumplían los criterios de elegibilidad, entre los cuales se incluyeron 43 casos clínicos, 28 artículos originales y 10 revisiones bibliográficas (figura 1). De los trabajos seleccionados, 62 de 89 (69,6%) estaban publicados en la última década, y el 58,4% estaban publicados en los últimos 5 años.
Finalmente, se seleccionaron un total de 16 excipientes, 9 excipientes contenidos en medicamentos, 4 contenidos en vacunas y 3 presentes tanto en medicamentos como en vacunas.
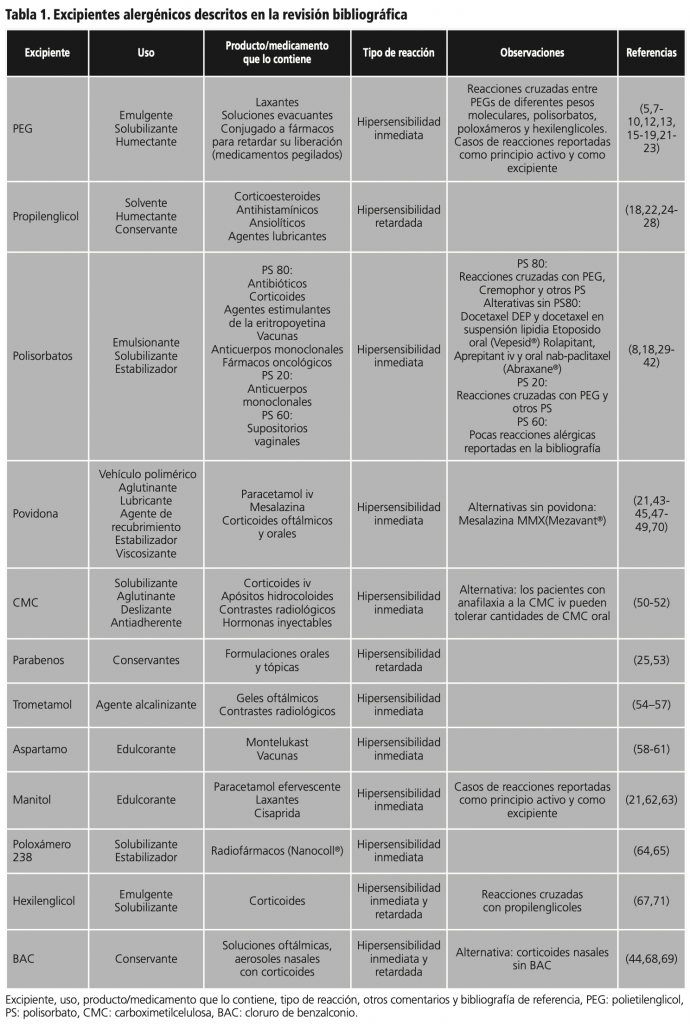
Los excipientes contenidos en medicamentos con mayor número de casos reportados (≥5 casos por excipiente) fueron: polietilenglicol, propilenglicol, polisorbatos, povidona, carboximetilcelulosa, parabenos, trometamol y aspartamo. Los excipientes con menor número de casos reportados (≤4 casos) fueron: manitol, poloxámero 238, hexilenglicol y cloruro de benzalconio. En el apartado “Excipientes en vacunas” se incluyeron 7 excipientes, de los cuales 3 de ellos también están incluidos en el apartado de excipientes presentes en medicamentos.
A continuación, se detalla la información de cada excipiente y los casos descritos:
1. Polietilenglicoles (PEG)
Estos compuestos, también denominados macrogoles, se caracterizan estructuralmente por sus grupos poliéter. Constituyen una familia de polímeros hidrófilos de óxido de etileno, y a menudo se denominan con un valor numérico, que indica el número promedio de unidades de óxido de etileno contenidos en cada molécula7.
Son ampliamente usados en el ámbito médico y comercial. Se utilizan principalmente como agente emulgente, solubilizante y humectante. La principal diferencia entre ellos y lo que les otorga diferentes usos es su peso molecular, el cual varia de 200 a 35.000 g/mol8. Actualmente, su posible potencial alergénico ha despertado gran interés por su uso en algunas de las vacunas para el SARS-CoV-29-11.
Los PEG de alto peso molecular son usados habitualmente como excipientes, en medicamentos por vía oral, tanto sólidos como líquidos. Aunque es más habitual encontrarlos como excipientes que como principio activo8, las reacciones más habituales de hipersensibilidad se dan en pacientes que ingieren preparados intestinales que contienen PEG como principio activo y tras la administración de agentes pegilados12. PEG 3350 es usado como principio activo en laxantes y formulaciones para la preparación de colonoscopias (Moviprep®, Molaxole®, Movicol®, Pleinvue® y Atolaxant®), al igual que PEG 4000 (Casenglicol®, Casenlax®, Femlax®, Clensia®, Omnilax®, Solución evacuantes de Bohm® y Evacuante Lainco®)5.
PEG también se encuentra conjugado a medicamentos para modificar sus características farmacocinéticas, lograr una liberación controlada y mejorar la biodisponibilidad7. Este es el caso de PEG-asparraginasa (Oncaspar®), PEG-adenosina diaminasa (Adagen®), PEG-G-CSF (Neulasta®), PEG-interferon β1A (Plegridy®), PEG-interferon α2a (Pegasys®) y PEG-liposomal/doxorubicina (Doxil®/Caelyx®)13.
Los mecanismos de reacciones de hipersensibilidad a PEG no están claramente establecidos, aunque la mayoría de estudios sugieren un mecanismo mediado por IgE7,8,12,14-16. Las reacciones alérgicas inmediatas, incluyendo anafilaxis, son raras17, siendo más habituales las dermatitis de contacto18.
Los compuestos de PEG de mayor peso molecular son los que presentan mayor carácter alergénico. Aunque lo habitual es que los pacientes que se someten a pruebas cutáneas de PEGs de diferentes pesos moleculares muestren resultados positivos a todos ellos14, existen algunos casos descritos con resultados de pruebas cutáneas positivas a los PEG de alto peso molecular y negativos a los de bajo peso molecular, dato que también se corroboró con pruebas de provocación oral8.
En muchos casos se han descrito reacciones cruzadas entre PEGs de diferentes pesos moleculares4, así como con polímeros con estructura similar, como son los polisorbatos y poloxámeros8,9,16,18-22, aunque no con la carboximetilcelulosa17.
En la actualidad, la exposición generalizada a productos que contienen PEG ha llevado a la formación inevitable de anticuerpos anti-PEG en la población general12. El estudio de Garay RP et al., mostró una incidencia de anticuerpos anti-PEG del 22-25% en donantes de sangre sanos, en comparación con la incidencia del 0,2% hallada dos décadas antes. Estos resultados apoyan la conveniencia de hacer screenings previos a la administración de productos pegilados, y explican el aumento en la incidencia de reacciones de hipersensibilidad a este tipo de compuestos13. Una alternativa que se baraja es el uso de derivados de hidroxi-PEG (OH-PEG), que en comparación con los productos pegilados usados en la actualidad han demostrado tener menor inmunogenicidad en los estudios llevados a cabo en animales23.
El uso de PEG en las vacunas COVID-19 puede haber supuesto un aumento en el número de reacciones reportadas a este tipo de compuestos. PEG2000 se encuentra en las vacunas de Pfizer® y Moderna®, aunque a diferente concentración. La vacuna de Pfizer – BioNTech® contiene 0,05 mg/dosis de PEG2000, mientras que la Moderna contiene 1,93 mg/dosis, por lo que cabría esperar mayor reactividad de esta última en personas alérgicas o con hipersensibilidad a PEG6.
2. Propilenglicol
El propilenglicol (PG) es un agente inodoro, incoloro y viscoso. Se trata de un alcohol alifático comúnmente utilizado por sus cualidades humectantes y conservantes24.
Las reacciones alérgicas al PG incluyen principalmente reacciones de hipersensibilidad retardada25. Se ha descrito que concentraciones de PG por encima del 30% pueden causar reacciones de irritación, con resultados positivos en las pruebas epicutáneas26,27. En ocasiones resulta difícil interpretar los resultados de las pruebas epicutáneas ya que es un agente irritante y débil sensibilizante22.
En un estudio llevado a cabo en EE. UU. con 166 productos farmacéuticos tópicos con corticoides, el PG fue el excipiente más frecuente (presente en el 64% de los productos analizados). Algunas preparaciones tópicas contenían más de un 50% de PG26,27. Otros medicamentos que contienen PG son los antihistamínicos orales (Cetirizina Sandoz® gotas orales, Alerlisin® gotas orales, Cetirizina Almus®, Cetirizina Teva®, Atarax® jarabe…) en los que principalmente se han descrito reacciones de hipersensibilidad retardada, entre 48 y 96h tras la exposición. En la mayoría de los casos, tras resultados positivos en las pruebas epicutáneas, se optó por cambiar a antihistamínicos de otras marcas que no contuvieran PG18,28.
En pacientes con alergias conocidas y/o con hipersensibilidad a PG, es muy importante hacer una revisión exhaustiva de todos los excipientes que contiene su medicación habitual, ya que suele haber más de un producto implicado18,28.
3. Polisorbatos
Los polisorbatos (PS), también conocidos como Tween®, son agentes tensioactivos no iónicos ampliamente utilizados en la formulación de fármacos como emulsionantes, solubilizantes y agentes estabilizadores29-31.
Polisorbato 80
El polisorbato 80 está presente en la composición de una gran cantidad de medicamentos, como antibióticos, corticoides, agentes estimulantes de la eritropoyetina, vacunas, vitamina K, anticuerpos monoclonales y fármacos oncológicos, además de encontrarse en cosméticos y alimentos21,30,32,33.
Entre los fármacos oncológicos formulados con PS80 cabe destacar el etopósido, el docetaxel, antieméticos como el fosaprepitant, y agentes estimulantes de la eritopoyetina, epoetina alfa y darbepoetina alfa. Para todos ellos se han descrito reacciones de hipersensibilidad causadas por el PS8030,31,34,35. Como consecuencia, algunos de ellos se han reformulado evitando dicho excipiente o se han desarrollado nuevas alternativas30,33.
En el caso concreto del docetaxel, se están estudiando nuevas formulaciones sin PS80: el dendrímero de docetaxel (DEP® Docetaxel), actualmente en ensayo clínico de fase 2 y el docetaxel en suspensión lipídica (NDLS), ya aprobado en algunos países30,36. Estas presentaciones permitirían reducir las reacciones de hipersensibilidad y la necesidad de premedicación con corticoides.
El etopósido también puede ser formulado como fosfato de etopósido (Etopophos®, Bristol-Myers Squibb), profármaco hidrosoluble que no incluye el PS8034,35. Sin embargo, este fármaco no está comercializado en España. Por otra parte, el etopósido oral (Vepesid®), comercializado en España, no contiene PS8033.
Respecto a las alternativas al fosaprepitant en aquellos pacientes con hipersensibilidad al PS80, en España está disponible el aprepitant oral, que no contiene PS8037. En la actualidad se investiga HTX-019 (aprepitant IV libre de PS80), como una alternativa segura y con menos reacciones adversas infusionales que fosaprepitant38.
Se ha comprobado la existencia de reacciones cruzadas entre PEG y PS a través de un mecanismo de hipersensibilidad tipo I8,22,32. De la misma manera, se han descrito reacciones cruzadas entre PS y Cremophor®22,39, también presente en fármacos como paclitaxel. Por este motivo, puede existir reactividad cruzada entre medicamentos como docetaxel y paclitaxel que contienen estos excipientes. En estos casos, una posible alternativa, disponible en nuestro país, sería la administración de nab-paclitaxel (paclitaxel unido a albumina, Abraxane®), que no contiene PS80 ni Cremophor®39.
Polisorbato 20
El PS20 está presente en algunos anticuerpos monoclonales como son el brodalumab y el omalizumab, ya que se agrega a las soluciones de proteínas como estabilizador. En otros, como el infliximab, adalimumab, ustekinumab y secukinumab, se emplea el PS8040.
Se han descrito algunos casos de hipersensibilidad inmediata tras la administración de anticuerpos monoclonales con PS20. En todos los casos, las pruebas cutáneas fueron también positivas para PS8040.
Se han reportado varios casos de reacción anafiláctica tras la administración de omalizumab32,41. En algunos casos las pruebas cutáneas fueron positivas para el PS20, así como para otros anticuerpos monoclonales que contienen PS80 y PEG en su composición32.
Polisorbato 60
El PS60 es menos frecuente en las preparaciones farmacéuticas que el resto de PS. Existen pocas reacciones alérgicas a dicho excipiente reportadas en la bibliografía. No obstante, se ha descrito un caso de reacción de hipersensibilidad grave de tipo inmediato tras la administración de un supositorio vaginal que contenía en su formulación PS6042.
4. Povidona
La povidona, o polivinilpirrolidona (PVP) es un componente empleado como vehículo polimérico, aglutinante, lubricante, agente de recubrimiento, estabilizador y viscosizante, utilizado en la formulación de comprimidos y soluciones oftálmicas, aunque es más conocida por su uso en soluciones antisépticas a base de yodo, como Betadine®43-45.
La povidona causa principalmente reacciones de hipersensibilidad inmediata46-48. Se ha descrito una reacción anafiláctica postoperatoria tras la administración i.v de una formulación de paracetamol (paracetamol BNM®) que contenía povidona como excipiente, en un paciente que había presentado anteriormente hipersensibilidad a la povidona iodada (Betadine®)43.
También se ha hallado un caso de anafilaxia tras la administración oral de paracetamol/clorhidrato de fenilefrina (Doregrippin®), no comercializado en España; en este caso, las pruebas cutáneas fueron positivas para PVP, y además, se encontraron IgE específicas contra PVP49.
También se ha reportado un caso de intolerancia a la mesalazina, en el que se pudo demostrar mediante la prueba de estimulación de linfocitos inducida por fármacos (DLST) que la alergia a la povidona era la responsable de la intolerancia al fármaco. Únicamente mesalazina multimatrix system (MMX), presentación de liberación prologada, disponible en España (Mezavant®), sin povidona, fue bien tolerada en este paciente, por lo que se cambió a esta formulación ante la necesidad de continuar el tratamiento48.
Este excipiente también se encuentra en una solución oral de prednisolona (Estilsona®). Se han reportado casos de asma y rinitis tras la administración de dicho fármaco, con pruebas cutáneas y de provocación oral positivas para PVP21.
5. Carboximetilcelulosa
La carboximetilcelulosa (CMC) es un biopolímero aniónico derivado de la celulosa. Se usa principalmente como solubilizante en preparaciones intravenosas y como aglutinante, deslizante y antiadherente en comprimidos50.
Su uso está cada vez más extendido en formulaciones farmacéuticas como apósitos para heridas, hormonas inyectables, comprimidos, principios activos hidrofóbicos (corticoides entre otros) de administración parenteral y en contrastes radiológicos, así como en la industria alimentaria y cosmética50,51.
Se han publicado tres casos de reacción anafiláctica tras la administración parenteral de corticoesteroides. Las pruebas intradérmicas fueron positivas para la CMC. Sin embargo, la prueba de provocación oral con dosis de CMC similares a las encontradas en alimentos o comprimidos fue negativa en todos los pacientes, sugiriendo que la vía oral es mejor tolerada que la vía parenteral. En consecuencia, los pacientes con anafilaxia a la CMC administrada por vía intravenosa podrían tolerar determinadas cantidades de este componente por vía oral50.
También se han descrito casos de anafilaxia causada por este excipiente tras la administración de apósitos hidrocoloides y de contrastes radiológicos, como la suspensión de sulfato de bario52.
6. Parabenos
Los parabenos se han utilizado como conservantes en la industria cosmética, alimentaria y farmacéutica. Metilparabeno y propilparabeno son los más comunes en formulaciones orales25. Estos conservantes se encuentran principalmente en productos de cosmética, aunque también podemos encontrarlos en medicamentos25,53.
Al metabolizarse, los parabenos dan lugar a hidroxiparabenzoico, que tiene una estructura química similar al ácido acetilsalicílico. Aunque la concentración de parabenos en la mayoría de medicamentos es baja (rara vez supera el 1%), en individuos susceptibles (por ejemplo, aquellos con intolerancia a los salicilatos), puede precipitar una reacción anafiláctica25.
7. Trometamol
El trometamol, tris-buffer o THAM, es un aminoalcohol biológicamente inerte de baja toxicidad. Se utiliza en cosmética, como solución tampón y en medicina como agente alcalinizante54. La sal de trometamol ha sido ampliamente utilizada para mejorar la absorción de medicamentos, tales como fosfomicina trometamol y dexketoprofeno trometamol55,56.
En la bibliografía se ha descrito el caso de una paciente que desarrolló picor, lagrimeo y enrojecimiento del globo ocular, tras el uso de un gel oftálmico (Oculotect®) durante varios meses. Las pruebas cutáneas mostraron una reacción positiva a trometamol54.
Este agente también se encuentra en agentes de contraste con galio. Se ha descrito un caso de hipersensibilidad inmediata a este excipiente en una paciente a la que se administró gadoteridol (Prohance®). La paciente desarrolló opresión respiratoria, náuseas, vómitos, y edema facial. La alergia a trometamol fue demostrada en las pruebas cutáneas57.
El trometamol también se cuenta entre los excipientes de la vacuna COVID-19 de Moderna® a una concentración de 0,31 mg/dosis, aunque hasta el momento no se conocen casos reportados de alergia6.
8. Aspartamo
El aspartamo es un dipéptido sintético usado como edulcorante artificial en alimentos, medicamentos y bebidas. Es un excipiente de declaración obligatoria, ya que es una fuente de fenilalanina, contraindicada en pacientes con fenilcetonuria. El aspartamo en nuestro organismo se metaboliza a formaldehido, por lo que en personas alérgicas a este compuesto puede suponer un grave problema58-60. Se ha estudiado que el consumo de dosis altas de aspartamo (>40 mg/kg/día), puede resultar tóxico para el SNC61.
En la bibliografía se describe el caso de un niño con dermatitis atópica leve y asma, que experimentó un brote severo de dermatitis atópica después del uso de comprimidos masticables de montelukast (Singulair®), que contienen aspartamo. El estudio alergológico fue positivo para formaldehído. Se suspendió la ingesta de todo tipo de bebidas y alimentos que contenían aspartamo y los comprimidos de montelukast masticable fueron reemplazados por una preparación de montelukast que no contenía aspartamo58.
Este excipiente también está presente en muchas vacunas6. Un varón de 48 años desarrolló un brote de dermatitis en brazos y pecho tras la inyección de una vacuna antigripal (Agriflu®, Novartis) que contenía aspartamo. Posteriormente, las pruebas cutáneas resultaron positivas para este excipiente y otros conservantes que liberaban formaldehído. La vacuna antigripal intranasal viva atenuada FluMist® (AstraZeneca) no contiene formaldehído, por lo que podría utilizarse con seguridad en este tipo de pacientes6,60.
9. Otros
Manitol
El manitol es un poliol ampliamente utilizado en la industria alimentaria y en la formulación de fármacos como edulcorante natural de bajo metabolismo y sin índice glucémico62. Su absorción es independiente de la insulina, y por este motivo se utiliza en productos para diabéticos63.
Se han descrito reacciones de hipersensibilidad inespecífica tras la administración de manitol i.v21. Estas manifestaciones se atribuyen a sus propiedades hiperosmolares, que pueden desencadenar la degranulación inespecífica de basófilos y mastocitos, reacciones consideradas no inmunológicas21,63. También se han reportado reacciones de hipersensibilidad inmediata tras la ingesta oral de este excipiente, presente en formulaciones de fármacos analgésicos como el paracetamol efervescente, algunos laxantes y cisaprida21,63.
Poloxámero 238
Los poloxámeros son excipientes farmacéuticos que pueden usarse en forma micelar para aumentar tanto la solubilidad como la estabilidad de los fármacos64.
Se ha descrito un caso de anafilaxia tras la administración de Nanocoll®, un radiofármaco con Tc99m. El estudio alergológico atribuyó la responsabilidad de la reacción al excipiente65.
Hexilenglicol
El hexilenglicol es un excipiente muy utilizado como emulgente y solubilizante en cosméticos, alimentos y en la formulación de fármacos tópicos y sistémicos, como los corticoides66,67.
Las reacciones más habituales causadas por este excipiente son de hipersensibilidad retardada. Se ha descrito reactividad cruzada entre PG y hexilenglicol67.
Cloruro de benzalconio
El cloruro de benzalconio (BAC) es un tensioactivo ampliamente utilizado como conservante bactericida en soluciones oftálmicas, tópicas, aerosoles nasales, agentes de limpieza y productos de cuidado personal68,69.
Además de actuar como alérgeno, el BAC es un conocido irritante69, pudiendo causar reacciones de hipersensibilidad inmediata y retardada68. Las manifestaciones más comunes son broncoconstricción (en el caso de soluciones nebulizadas) y toxicidad ocular (tras la administración de soluciones oftálmicas)44.
Lechien JR et al., describieron tres casos de reacción de hipersensibilidad retardada a BAC tras la administración de mometasona en aerosol nasal. Cabe destacar que existen corticoides nasales que no contienen BAC en su formulación, como Flixonase® (fluticasona nasal), comercializado en España, que suponen una alternativa para estos pacientes68.
En la tabla 1 se resumen los excipientes alergénicos anteriormente descritos.
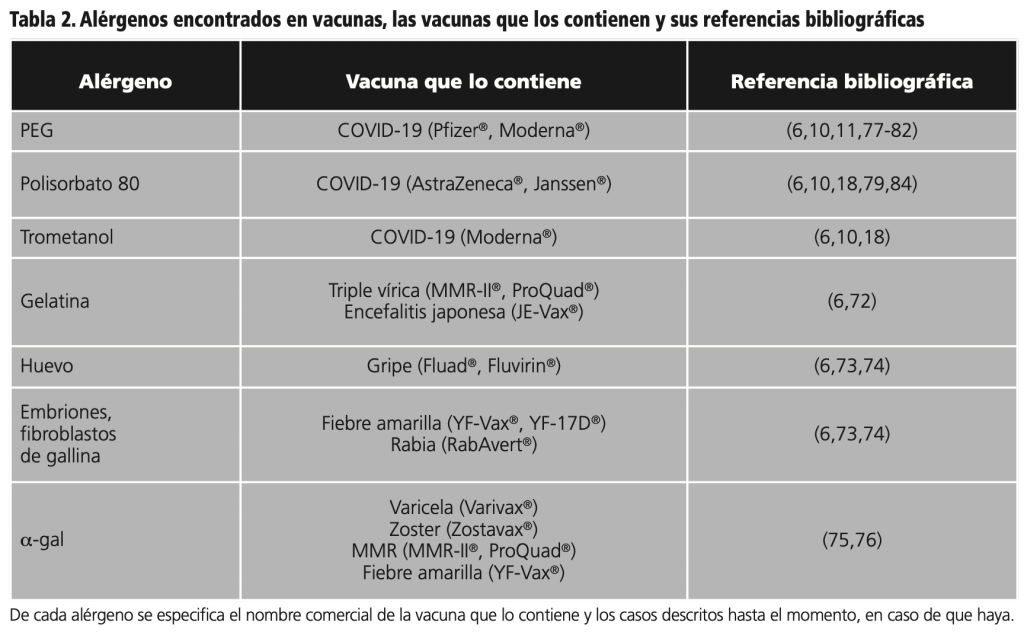
10. Excipientes en vacunas
Las vacunas contienen numerosos excipientes usados como estabilizadores, conservantes, antimicrobianos, adyuvantes, diluyentes, buffers, etc. El Institute for Vaccine Safety de la Universidad John Hopkins, proporciona información actualizada de los excipientes y sus cantidades en todas las vacunas aprobadas hasta la fecha en EE.UU.6
La gelatina es una de las moléculas que más reacciones alérgicas y/o de hipersensibilidad ha provocado desde que se emplea como excipiente. Los pacientes con alergia a la carne de ternera o cerdo corren el riesgo de desarrollar reacciones de hipersensibilidad inmediata a la gelatina contenida en las vacunas. En un estudio en pacientes que habían sufrido reacciones anafilácticas a diversas vacunas, se demostró que 16 de los 20 (80%) pacientes que tuvieron reacciones alérgicas a las vacunas tenían alergia a la proteína de la leche o a la carne de vacuno/cerdo. En todos los casos las reacciones se manifestaron como hipersensibilidad de tipo inmediato72.
Algunas vacunas, como la del sarampión, la gripe estacional, la fiebre amarilla, la rabia, la encefalitis y algunas vacunas contra la gripe A H1N1, se fabrican con embriones, fibroblastos o contenido de huevos de gallinas6,73,74. En pacientes con reacciones anafilácticas graves (asma o shock anafiláctico) a las proteínas del huevo, algunos investigadores han propuesto realizar la vacunación a través de un protocolo de 2 pasos bajo supervisión hospitalaria: una primera inyección del 10% de la dosis, y 30 minutos después, si existe buena tolerancia, una segunda inyección con el 90% restante73,74.
Otro agente contenido en vacunas es el epítopo α-gal, el cual se expresa abundantemente en los glucoconjugados de no primates (incluidas proteínas alergénicas de la carne de vacuno, cerdo, cordero y gato). Este producto se usa en vacunas como la de la gripe, varicela zoster y la triple vírica (sarampión, parotiditis y rubéola), siendo las dos últimas las que presentan mayor contenido de α-gal75.
Este compuesto no únicamente se encuentra en vacunas. Se ha descrito el caso de una paciente que había tenido 6 episodios de anafilaxia en los últimos dos años tras comer carne de ternera y cerdo. Las pruebas epicutáneas fueron positivas para α-gal, por lo que se restringió la carne de su dieta. Tras el uso de unas cápsulas vaginales de fenticonazol, la paciente presentó de nuevo síntomas de anafilaxia debido a que la cubierta de la cápsula vaginal contenía colágeno y por tanto, estaba involucrada la proteína α-gal76.
La aprobación de las vacunas SARS-CoV-2, ha puesto en el punto de mira los excipientes como posibles causantes de reacciones alérgicas tras su administración. Sin embargo, los datos actuales muestran que los casos han sido anecdóticos77-82. Las vacunas aprobadas frente a SARS-CoV-2 contienen como excipientes PEG 2000, polisorbato 80 y trometamol, entre otros10,11,83,84. En caso de sospecha de alergia a alguno de estos excipientes se han desarrollado algoritmos sobre cómo actuar85. Se han descrito algunos casos de reacciones alérgicas, principalmente al PEG77-82, aunque la mayoría de los individuos con una reacción alérgica a la primera dosis de las vacunas COVID-19 de ARNm, independientemente del resultado de la prueba cutánea, recibieron la segunda dosis con seguridad79.
En la tabla 2 se resumen los excipientes alergénicos de las vacunas de los casos descritos.
DISCUSIÓN
Aunque a priori los excipientes son componentes inertes de las formas farmacéuticas, no están exentos de riesgo desde el punto de vista de las reacciones de hipersensibilidad. La gran variedad de excipientes, así como las diversas manifestaciones clínicas que pueden producir, dificultan la identificación de reacciones de hipersensibilidad y alergia a estos compuestos. Además, estas reacciones pueden ser relacionadas erróneamente con el principio activo, por lo que es probable que la verdadera prevalencia esté infraestimada.
En los últimos años, ha aumentado el conocimiento y la concienciación sobre este problema entre los profesionales sanitarios. Para prevenir posibles reacciones indeseadas, el primer paso es disponer de una clara identificación de los excipientes en los productos que los contienen, ya que medicamentos o vacunas que contienen el mismo principio activo pueden tener diferentes excipientes. En este sentido, la AEMPS proporciona en la ficha técnica de los fármacos información detallada sobre el contenido de excipientes en los medicamentos comercializados en España. Igualmente, el Institute for Vaccine Safety, de la Universidad John Hopkins, proporciona con detalle los tipos y cantidades de excipientes presentes en diferentes vacunas.
Un etiquetado claro y una nomenclatura estandarizada puede facilitar el diagnóstico de alergias y prevenir que se repitan reacciones de hipersensibilidad, con el severo impacto que tienen en la vida de los pacientes. Por este motivo, cabe destacar la necesidad de que todos los excipientes contenidos en la formulación de un medicamento aparezcan en el prospecto y la ficha técnica de dicho fármaco, para informar a los profesionales sanitarios y a los pacientes.
Por parte de los profesionales sanitarios, es importante insistir en realizar una adecuada educación sobre el etiquetado de medicamentos, para lograr que el paciente se involucre en revisar los componentes y sean conscientes del cuidado de su salud.
Otro elemento clave para la prevención es un adecuado diagnóstico. En los últimos años se ha incrementado mucho la inclusión de excipientes en las pruebas cutáneas. Se debe tener en cuenta que en muchas ocasiones existe reactividad cruzada entre diferentes excipientes debido a su semejante estructura química, por lo que, en la mayoría de las ocasiones, las pruebas diagnósticas deben incluir no solo el excipiente del que se sospecha, sino también aquellos con los que se han descrito casos de reactividad cruzada.
En la mayoría de casos de alergia confirmada a un determinado excipiente, es posible ofrecer al paciente una alternativa terapéutica exenta del alérgeno en cuestión; sin embargo, esto no siempre es posible. En algunas ocasiones, especialmente en aquellos casos confirmados de hipersensibilidad tipo I, es posible realizar una desensibilización al excipiente, buscando la tolerancia temporal al alérgeno que permita administrar el tratamiento. Esta estrategia es muy utilizada en los tratamientos oncológicos34,86,87.
En cualquier caso, el abordaje de estos pacientes siempre debe ser desde un punto de vista multidisciplinar, en el que el farmacéutico, en colaboración con el equipo clínico, tiene un papel destacado. Por ejemplo, participa en la preparación de pruebas diagnósticas (epicutáneas e intradérmicas), en las que se deben ajustar las concentraciones ensayadas al contenido del excipiente en el producto88. También colabora en la búsqueda de alternativas terapéuticas ya comercializadas libres de excipientes y en caso de no disponer de alterativas comercializadas, el farmacéutico tiene un papel clave en la investigación de nuevas opciones a través de la formulación magistral, que permite formular el principio activo con otros excipientes no alergénicos, ofreciendo una alternativa segura al paciente.
Por otra parte, cabe recordar que algunos excipientes pueden estar contraindicados en determinados grupos de pacientes por otros motivos, como es el caso de las personas intolerantes a la lactosa y a la fructosa; o el etanol, benzoatos y alcohol bencílico, excipientes no recomendados en la población pediátrica88.
La pandemia causada por el COVID-19 y la vacunación masiva ha despertado aún más el interés sobre el contenido de excipientes en productos farmacéuticos. Con la vacunación masiva se esperaba que aumentara el número de casos de alergia a excipientes contenidos en vacunas frente a SARS-CoV-2. Se han desarrollado algoritmos a seguir en caso de sospecha de alergia a algún excipiente contenido en las vacunas. En el caso del PEG, se recomienda que las pruebas de alergia se realicen en centros especializados empleando diluciones iniciales de 1:1000 a 1:10 de PEG y un período de observación de 30 minutos después de cada prueba con dosis creciente, para minimizar el riesgo de una reacción sistémica85. En el caso de sospecha de alergia a trometamol también se recomiendan pruebas intradérmicas con diluciones, desde 1:1000 a 1:1085,89.
Esta revisión proporciona una actualización de la evidencia disponible sobre las reacciones de alergia e hipersensibilidad a 16 excipientes contenidos en medicamentos. Esto no excluye que otros excipientes que no aparecen en esta revisión sean también susceptibles de causar reacciones alérgicas: por ejemplo, no se incluyeron los sulfitos y el maltitol, dado que en la mayoría de reacciones de hipersensibilidad secundarias a estos excipientes descritas en la literatura, estos componentes se encuentran contenidos en alimentos y no en medicamentos.
En conclusión, esta revisión aporta información contrastada y actualizada sobre los principales excipientes relacionados con reacciones de alergia e hipersensibilidad, manifestaciones clínicas, posibles reacciones cruzadas entre excipientes, métodos diagnósticos y alternativas disponibles en el caso de alergia a alguno de sus excipientes. Esta información puede ser de utilidad a los profesionales sanitarios implicados en el manejo de alergias y contribuir a la administración segura de los medicamentos.
Conflicto de intereses: Las autoras declaran no tener conflicto de intereses.
BIBLIOGRAFÍA
1. European Medicines Agency (EMA). Guideline on Excipients in the Dossier for Application for Marketing Authorisation of a Medicinal Product. Emea. 2008;(June):1-12.
2. Barbaud A. Place of excipients in systemic drug allergy. Immunol Allergy Clin North Am. 2014;34(3):671-9.
3. Urrutia G, Bonfill X. Declaración PRISMA: una propuesta para mejorar la publicación de revisiones sistemáticas y metaanálisis. Med Clin (Barc) [Internet]. 2010;135(11):507-11. Disponible en: http://es.cochrane.org/sites/es.cochrane. org/files/public/uploads/PRISMA_Spanish.pdf.
4. Science Medicines Health. European Medicines Agency [Internet]. 2021 [cited 2021 Oct 14]. Disponible en: https://www.ema.europa.eu/en.
5. CIMA AEMPS. Agencia española de medicamentos y productos sanitarios [Internet]. 2021 [cited 2021 Sep 13]. Disponible en: https://cima.aemps.es/ cima/publico/home.html.
6. Institute for Vaccine Safety, Hopkins J. Vaccine Excipients [Internet]. John Hopkins. 2021 [cited 2021 Aug 30]. Disponible en: https://www.vaccinesafety. edu/components-Excipients.htm.
7. Giavina-Bianchi P, Kalil J. Polyethylene Glycol Is a Cause of IgE-Mediated Anaphylaxis. J Allergy Clin Immunol Pract [Internet]. 2019;7(6):1874-5. Disponible en: https://doi.org/10.1016/j.jaip.2019.05.001.
8. Stone CA, Liu Y, Relling M V., Krantz MS, Pratt AL, Abreo A, et al. Immediate Hypersensitivity to Polyethylene Glycols and Polysorbates: More Common Than We Have Recognized. J Allergy Clin Immunol Pract [Internet]. 2019;7(5):1533-1540.e8. Disponible en: https://doi.org/10.1016/j.jaip.2018.12.003.
9. Bruusgaard-Mouritsen MA, Johansen JD, Garvey LH. Clinical manifestations and impact on daily life of allergy to polyethylene glycol (PEG) in ten patients. Clin Exp Allergy. 2021;(August 2020):1-8.
10. Ortega Rodríguez N, Audícana Berasategui M, de la Hoz Caballer B, Valero Santiago A. The century of mRNA vaccines: COVID-19 vaccines and allergy. J Investig Allergol Clin Immunol. 2021;31(1):1-7.
11. Caballero ML, Quirce S. Excipients as Potential Agents of Anaphylaxis in Vaccines: Analyzing the Formulations of Currently Authorized COVID-19 Vaccines. J Investig Allergol Clin Immunol. 2021;31:92-3.
12. Calogiuri G, Foti C, Nettis E, Di Leo E, Macchia L, Vacca A. Polyethylene glycols and polysorbates: Two still neglected ingredients causing true IgE-mediated reactions. J Allergy Clin Immunol Pract [Internet]. 2019;7(7):2509-10. Disponible en: https://doi.org/10.1016/j.jaip.2019.05.058.
13. Garay RP, El-Gewely R, Armstrong JK, Garratty G, Richette P. Antibodies against polyethylene glycol in healthy subjects and in patients treated with PEG-conjugated agents. Expert Opin Drug Deliv. 2012;9(11):1319-23.
14. Cerdá VJ, Pacheco RR, Witek JD, De La Calle FMM, De La Sen Fernández ML. Immediate hypersensitivity to polyethylene glycols in unrelated products: When standardization in the nomenclature of the components of drugs, cosmetics, and food becomes necessary. Allergy, Asthma Clin Immunol [Internet]. 2019;15(1):1-5. Disponible en: https://doi.org/10.1186/s13223-019-0327-4.
15. Caballero ML, Lluch-Bernal M, Vilà-Nadal G, Lluncor M QS. IgE-Mediated Anaphylaxis Induced by Macrogol 6000. J Investig Allergol Clin Immunol. 2016;26(6):398-400.
16. Wylon K, Dölle S, Worm M. Polyethylene glycol as a cause of anaphylaxis. Allergy, Asthma Clin Immunol. 2016;12(1):10-2.
17. Pascale D, Mouton-Faivre C. Anaphylaxis to macrogol 4000 after a parenteral corticoid injection. Allergy Eur J Allergy Clin Immunol. 2005;60(5):705.
18. Caballero ML, Quirce S. Delayed hypersensitivity reactions caused by drug excipients: A literature review. J Investig Allergol Clin Immunol. 2020;30(6):400-8.
19. Schwede K, Simon JC TR. A case of severe immediate type reaction to macrogol and polysorbate 60 after intravaginal drug application. Eur J Dermatol. 2019;29(3):329-31.
20. Wenande E, Garvey LH. Immediate-type hypersensitivity to polyethylene glycols: a review. Clin Exp Allergy. 2016;46(7):907-22.
21. Caballero ML, Quirce S. Immediate hypersensitivity reactions caused by drug excipients: A literature review. J Investig Allergol Clin Immunol. 2020;30(2):86-100.
22. Caballero ML, Krantz MS, Quirce S, Phillips EJ, Stone CA. Hidden Dangers: Recognizing Excipients as Potential Causes of Drug and Vaccine Hypersensitivity Reactions. J Allergy Clin Immunol Pract [Internet]. 2021;9(8):2968-82. Disponible en: https://doi.org/10.1016/j.jaip.2021.03.002
23. Sherman MR, Williams LD, Sobczyk MA, Michaels SJ, Saifer MGP. Role of the methoxy group in immune responses to mpeg-protein conjugates. Bioconjug Chem. 2012;23(3):485-99.
24. Jacob SE, Scheman A, McGowan MA. Propylene Glycol. Dermatitis. 2018;29(1):3-5.
25. Farber MK, Angelo TE, Castells M, Tsen LC. Anesthetic management of a patient with an allergy to propylene glycol and parabens. Anesth Analg. 2010;110(3):839-42.
26. Lessmann H, Schnuch A, Geier J, Uter W. Skin-sensitizing and irritant properties of propylene glycol. Contact Dermatitis. 2005;53(5):247-59.
27. Coloe J, Zirwas MJ. Allergens in corticosteroid vehicles. Dermatitis. 2008;19(1):38-42.
28. Tocci EM, Robinson A, Belazarian L, Foley E, Wiss K, Silvestri DL. Excipients in Oral Antihistamines Can Perpetuate Allergic Contact Dermatitis. Pediatr Dermatol. 2015;32(6):e242-4.
29. Coors EA, Seybold H, Merk HF, Mahler V. Polysorbate 80 in medical products and nonimmunologic anaphylactoid reactions. Ann Allergy, Asthma Immunol. 2005 Dec;95(6):593-9.
30. Schwartzberg LS, Navari RM. Safety of Polysorbate 80 in the Oncology Setting. Adv Ther. 2018 Jun;35(6):754-67.
31. Palacios Castaño MI, Venturini Díaz M, Lobera Labairu T, González Mahave I, Del Pozo Gil MD, Blasco Sarramián A. Anaphylaxis due to the excipient polysorbate 80. J Investig Allergol Clin Immunol. 2016;26(6):394-6.
32. Perino E, Freymond N, Devouassoux G, Nicolas JF, Berard F. Xolair-induced recurrent anaphylaxis through sensitization to the excipient polysorbate. Ann Allergy, Asthma Immunol [Internet]. 2018;120(6):664-6. Disponible en: https://doi.org/10.1016/j.anai.2018.02.018.
33. Pantín C, Letellez J, Calzas J, Mohedano E. Indirect identification of hypersensitivity reaction to etoposide mediated by polysorbate 80. Farm Hosp. 2018;42(1):27-8.
34. Mullera MM, Riba Solé M, Fernández de Gamarra Martínez E, Mangues Bafalluy M. A. Reacción de hipersensibilidad a etopósido: a propósito de un caso. Farm Hosp [Internet]. 2014;38(3):255-6.
35. Bernstein BJ, Troner MB. Successful rechallenge with etoposide phosphate after an acute hypersensitivity reaction to etoposide. Pharmacotherapy. 1999;19(8):989-91.
36. Mckeage K. Nanosomal Docetaxel Lipid Suspension: A Guide to Its Use in Cancer. 2017;37:405-10.
37. Emend (aprepitant) cápsulas para uso oral. Ficha técnica. [Internet]. Agencia Europea de Medicamentos (AEMPS). Merck & Co. 2014. p. 1-33. Disponible en: ec.europa.eu/health/documents/community…/anx_130850_es.pdf.
38. Ottoboni T, Lauw M, Keller MR, Cravets M, Manhard K, Clendeninn N, et al. Safety of HTX-019 (intravenous aprepitant) and fosaprepitant in healthy subjects. Futur Oncol. 2018;14(27):2849-59.
39. Bibera MAT, Lo KMK, Steele A. Potential cross-reactivity of polysorbate 80 and cremophor: A case report. J Oncol Pharm Pract. 2020;26(5):1279-81.
40. Kato M, Oiso N, Uchida S, Yanagihara S, Sano H, Tohda Y, et al. Biologic-induced urticaria due to polysorbate 20. J Dermatol. 2019;46(7):e230-2.
41. Price KS, Hamilton RG. Anaphylactoid reactions in two patients after omalizumab administration after successful long-term therapy. Allergy Asthma Proc. 2007;28(3):313-9.
42. Schwede K, Simon JC, Treudler R. A case of severe immediate type reaction to macrogol and polysorbate 60 after intravaginal drug application. Eur J Dermatology. 2019 May;29(3):329-31.
43. Preuss JF, Goddard CE, Clarke RC, Platt PR, Sadleir PHM. Anaphylaxis to intravenous paracetamol containing povidone. A case report and narrative review of excipient allergy related to anaesthesia. Anaesth Intensive Care. 2020;48(5):404-8.
44. Haywood A, Glass BD. Pharmaceutical excipients – where do we begin? Aust Prescr. 2011;34(4):112-4.
45. Liccioli G, Mori F, Barni S, Pucci N, Novembre E. Anaphylaxis to polyvinylpyrrolidone in eye drops administered to an adolescent. J Investig Allergol Clin Immunol. 2018;28(4):263-5.
46. Pedrosa C, Costa H, Oliveira G, Romariz J, Praça F. Anaphylaxis to povidone in a child. Pediatr Allergy Immunol. 2005;16(4):361-2.
47. Gonzalo Garijo M, Durán Quintana J, Bobadilla González P, Máiquez Asuero P. Anaphylactic shock following povidone. Ann Pharmacother. 1996;30(1):37-40.
48. Arai Y, Ogawa M, Yamane F, Sumiyoshi N, Arimoto R, Ando Y, et al. Mesalazine formulation intolerance due to suspected excipient allergy in the treatment of ulcerative colitis: a case report. Clin J Gastroenterol. 2020;13(6).
49. Rönnau AC, Wulferink M, Gleichmann E, Unver E, Ruzicka T, Krutmann J, et al. Anaphylaxis to polyvinylpyrrolidone in an analgesic preparation. Br J Dermatol. 2000;143(5):1055-8.
50. Bigliardi PL, Izakovic J, Weber JM, Bircher AJ. Anaphylaxis to the carbohydrate carboxymethylcellulose in parenteral corticosteroid preparations. Dermatology. 2003;207(1):100-3.
51. Ohnishi A, Hashimoto K, Ozono E, Sasaki M, Sakamoto A, Tashiro K, et al. Anaphylaxis to carboxymethylcellulose: Add food additives to the list of elicitors. Pediatrics. 2019 Mar;143(3).
52. Muroi N, Nishibori M, Fujii T, Yamagata M, Hosoi S, Nakaya N, et al. Anaphylaxis from the Carboxymethylcellulose Component of Barium Sulfate Suspension. N Engl J Med. 1997 Oct;337(18):1275-7.
53. Fransway AF, Fransway PJ, Belsito D V., Warshaw EM, Sasseville D, Fowler JF, et al. Parabens. Dermatitis. 2019;30(1):3-31.
54. Bohn, S., Hurni, M., & Bircher AJ. Contact allergy to trometamol. Contact Dermatitis. 2001;44(5):319.
55. Reeves D. Fosfomycin trometamol. J Antimicrob Chemother. 1994;34(6): 853-8.
56. Hanna M, Moon JY. A review of dexketoprofen trometamol in acute pain. Curr Med Res Opin [Internet]. 2019;35(2):189-202. Disponible en: https://doi.org/10.1080/03007995.2018.1457016.
57. Lukawska J, Mandaliya D, Chan AWE, Foggitt A, Bidder T, Harvey J, et al. Anaphylaxis to trometamol excipient in gadolinium-based contrast agents for clinical imaging. J Allergy Clin Immunol Pract [Internet]. 2019;7(3):1086-7. Disponible en: https://doi.org/10.1016/j.jaip.2018.08.035.
58. Castanedo-Tardan MP, González ME, Connelly EA, Giordano K, Jacob SE. Systematized contact dermatitis and montelukast in an atopic boy. Pediatr Dermatol. 2009;26(6):739-43.
59. Hill A, Belsito D. Systemic contact dermatitis of the eyelids caused by formaldehyde derived from aspartame? Contact Dermatitis. 2003;49(5):258-9.
60. Kuritzky LA, Pratt M. Systemic allergic contact dermatitis after formaldehyde-containing influenza vaccination. J Cutan Med Surg. 2015;19(5):504-6.
61. Choudhary AK, Pretorius E. Revisiting the safety of aspartame. Nutr Rev. 2017;75(9):718-30.
62. Chen M, Zhang W, Wu H, Guang C, Mu W. Mannitol: physiological functionalities, determination methods, biotechnological production, and applications. Appl Microbiol Biotechnol. 2020 Aug;104(16):6941-51.
63. Calogiuri G, Muratore L, Nettis E, Casto A, Di Leo E, Vacca A. Immediate-type hypersensitivity reaction to Mannitol as drug excipient (E421): a case report. Eur Ann Allergy Clin Immunol. 2015;47(3):99-102.
64. Kabanov AV AV. Pluronic block copolymers in drug delivery: From micellar nanocontainers to biological response modifiers. Crit Rev Ther Drug Carr Syst. 2002;19:1-72.
65. Carbonell A, Escudero Pastor AI, Miralles JC, González A, Navarro C, Cardona P, et al. Anaphylaxis due to poloxamer 238. J Investig Allergol Clin Immunol. 2018;28(6):419-20.
66. Hexylene Glycol [MAK Value Documentation, 2001]. MAK‐Collection Occup Heal Saf. 2002;234-46.
67. Spoerl D, Scherer K, Bircher AJ. Contact urticaria with systemic symptoms due to hexylene glycol in a topical corticosteroid: Case report and review of hypersensitivity to glycols. Dermatology. 2010;220(3):238-42.
68. Lechien JR, de Araujo PC, De Marrez LG, Halloy JL, Khalife M, Saussez S. Contact allergy to benzalkonium chloride in patients using a steroid nasal spray: A report of 3 cases. Ear, Nose Throat J. 2018 Jan;97(1-2).
69. Isaac J, Scheinman PL. Benzalkonium Chloride: An Irritant and Sensitizer. Dermatitis. 2017 Nov;28(6):346-52.
70. Pedrosa C, Costa H, Oliveira G, Romariz J, Praça F. Anaphylaxis to povidone in a child. Pediatr Allergy Immunol. 2005;16(4):361-2.
71. Kinnunen T, Hannuksela M. Skin reactions to hexylene glycol. Contact Dermatitis. 1989;21(3):154-8.
72. de Silva R, Dasanayake WMDK, Wickramasinhe GD, Karunatilake C, Weerasinghe N, Gunasekera P, et al. Sensitization to bovine serum albumin as a possible cause of allergic reactions to vaccines. Vaccine [Internet]. 2017;35(11):1494-500. Disponible en: http://dx.doi.org/10.1016/j.vaccine.2017.02.009
73. Barbaud A, Deschildre A, Waton J, Raison-Peyron N, Tréchot P. Hypersensitivity and vaccines: An update. Eur J Dermatology. 2013;23(2):135-41.
74. Roukens AH, Vossen AC, van Dissel JT, Visser LG. Reduced intradermal test dose of yellow fever vaccine induces protective immunity in individuals with egg allergy. Vaccine. 2009;27(18):2408-9.
75. Stone CA, Hemler JA, Commins SP, Schuyler AJ, Phillips EJ, Peebles RS, et al. Anaphylaxis after zoster vaccine: Implicating alpha-gal allergy as a possible mechanism. J Allergy Clin Immunol. 2017;139(5):1710-1713.e2.
76. Vidal C, Méndez-Brea P, López-Freire S, González-Vidal T. Vaginal Capsules: An Unsuspected Probable Source of Exposure to α-Gal. J Investig Allergol Clin Immunol. 2016;26(6):388-9.
77. Sellaturay P, Nasser S, Islam S, Gurugama P, Ewan PW. Polyethylene glycol (PEG) is a cause of anaphylaxis to the Pfizer/BioNTech mRNA COVID-19 vaccine. Clin Exp Allergy. 2021;51(6):861-3.
78. Pickert J, Hennighausen I, Mühlenbein S, Möbs C, Pfützner W. Immediate-Type Hypersensitivity to Polyethylene Glycol (PEG) Including a PEG-containing COVID-19 Vaccine Revealed by Intradermal Testing. J Investig Allergol Clin Immunol. 2021;31(6):2-7.
79. Wolfson AR, Robinson LB, Li L, McMahon AE, Cogan AS, Fu X, et al. First Dose mRNA COVID-19 Vaccine Allergic Reactions: Limited Role for Excipient Skin Testing. J Allergy Clin Immunol Pract [Internet]. 2021;9(9):3308-3320.e3. Disponible en: https://doi.org/10.1016/j.jaip.2021.06.010.
80. Troelnikov A, Perkins G, Yuson C, Ahamdie A, Balouch S, Plinio R Hurtado, et al. Basophil reactivity to BNT162b2 is mediated by PEGylated lipid nanoparticles in PEG allergic patients. J Allergy Clin Immunol [Internet]. 2021;148(1):91-5. Disponible en: https://doi.org/10.1016/j.jaci.2021.04.032.
81. Restivo V, Candore G, Barrale M, Caravello E, Graziano G, Onida R, et al. Allergy to polyethilenglicole of anti-sars cov2 vaccine recipient: A case report of young adult recipient and the management of future exposure to sars-cov2. Vaccines. 2021;9(5):1-7.
82. Cox F, Khalib K, Conlon N. PEG That Reaction: A Case Series of Allergy to Polyethylene Glycol. J Clin Pharmacol. 2021;61(6):832-5.
83. Garvey LH, Nasser S. Anaphylaxis to the first COVID-19 vaccine: is polyethylene glycol (PEG) the culprit? Br J Anaesth [Internet]. 2021;126(3):e106-8. Disponible en: https://doi.org/10.1016/j.bja.2020.12.020.
84. AEMPS. COVID-19 Vaccine Janssen. Agencia Eur Medicam [Internet]. 2021;1–41. Disponible en: ec.europa.eu/health/documents/community…/anx_ 130850_es.pdf.
85. Klimek L, Novak N, Cabanillas B, Jutel M, Bousquet J, Akdis CA. Allergenic components of the mRNA-1273 vaccine for COVID-19: possible involvement of polyethylene glycol and IgG-mediated complement activation. Allergy [Internet]. 2021;0-2. Disponible en: http://www.ncbi.nlm.nih.gov/pubmed/33657648.
86. Castells Guitart MC. Rapid drug desensitization for hypersensitivity reactions to chemotherapy and monoclonal antibodies in the 21st century. J Investig Allergol Clin Immunol. 2014;24(2):72-9.
87. Castells MC, Tennant NM, Sloane DE, Ida Hsu F, Barrett NA, Hong DI, et al. Hypersensitivity reactions to chemotherapy: Outcomes and safety of rapid desensitization in 413 cases. J Allergy Clin Immunol. 2008;122(3):574-80.
88. Martínez Ramos B, Cortizas Feal B, García Queiruga M. Pruebas de alergia y desensibilizaciones. En: Grupo de Farmacotecnia de la Sociedad Española de Farmacia Hospitalaria (SEFH), editores. Boletín farmacotecnia. 1era Ed. Madrid. 2021.
89. Brockow K, Garvey LH, Aberer W, Atanaskovic-Markovic M, Barbaud A, Bilo MB, et al. Skin test concentrations for systemically administered drugs – An ENDA/EAACI Drug Allergy Interest Group position paper. Allergy Eur J Allergy Clin Immunol. 2013;68(6):702-12.
____
