Cidoncha Muñoz I1, Ibáñez Zurriaga A2, Alañón Plaza E2, Pérez Abánades M2, Ramírez Herráiz E2, Morell Baladrón A3
1 Residente 2º año en Farmacia Hospitalaria
2 Especialistas en Farmacia Hospitalaria. Facultativos Especialistas de Área
3 Especialista en Farmacia Hospitalaria. Jefe de Servicio
Servicio de Farmacia. Hospital Universitario de La Princesa. Madrid (España)
____
Rev. OFIL 2017, 27;1:19-22
Fecha de recepción: 21/03/2016 – Fecha de aceptación: 21/04/2016
____
Correspondencia:
Isabel Cidoncha Muñoz
Diego de León, 62
28006 Madrid
Correo electrónico: isabel.cidoncha@salud.madrid.org
____
Resumen
Introducción: En diciembre de 2014 la Agencia Española de Medicamentos y Productos Sanitarios emitió una nota informativa en la que exponía que micofenolato de mofetilo (MMF) en combinación con otros inmunosupresores podía causar hipogammaglobulinemia y bronquiectasias.
Objetivo: Analizar la evolución de los niveles séricos de inmunoglobulinas y aparición de episodios de infección respiratoria y bronquiectasias en pacientes tratados con MMF en condiciones diferentes a las autorizadas en ficha técnica.
Material y método: Estudio observacional retrospectivo de pacientes que iniciaron tratamiento con MMF en condiciones diferentes a las autorizadas en ficha técnica (off-label) entre enero de 2010 y enero de 2015. Se revisaron los informes clínicos y analíticas recogiendo datos demográficos, clínicos y analíticos.
Resultados: Se incluyeron 39 pacientes en tratamiento con MMF y en tratamiento concomitante con otro fármaco inmunosupresor. De ellos, 20 (51%) sufrieron hipogammaglobulinemia, con una mediana de tiempo de aparición de 7 (IQR 3,3-8,8) meses. De estos pacientes con hipogammaglobulinemia, 14 (70%) tomaban una dosis diaria de ≥2000 mg. Se disminuyó la dosis a 12 (60%) y, de ellos, 7 (58%) experimentaron mejoría analítica. 10 pacientes (50%) con hipogammaglobulinemia sufrieron algún episodio de infección respiratoria, y en 4 (40%) evolucionó a bronquiectasia. La totalidad de ellos recibió tratamiento antibiótico.
Conclusiones: La hipogammaglobulinemia se presenta en un elevado porcentaje de pacientes (51%) y está relacionada directamente con la dosis. Los pacientes con hipogammaglobulinemia desarrollaron una alta tasa de infecciones, que evolucionaron a bronquiectasias. La monitorización podría evitar estos efectos adversos.
Palabras clave: Hipogamaglobulinemia, bronquiectasia, inmunosupresión, micofenolato de mofetilo.
____
Introducción
Micofenolato de mofetilo (MMF) es un inmunosupresor relativamente nuevo que ha supuesto un gran impacto en los trasplantes de órganos sólidos y en el tratamiento de enfermedades autoinmunes. En combinación con ciclosporina y corticoides, está indicado para la profilaxis del rechazo agudo de trasplante en pacientes sometidos a trasplante alogénico renal, cardiaco o hepático1.
En el ámbito hospitalario, el MMF se prescribe frecuentemente en condiciones diferentes a las autorizadas en ficha técnica para el tratamiento de otras enfermedades autoinmunes, tales como artritis reumatoide, lupus eritematoso sistémico, glomerulonefritis, pénfigo, esclerodermia, entre otras. Esta situación se encuentra regulada por el Real Decreto 1015/2009, de 19 de junio2, por el que se regula la disponibilidad de medicamentos en situaciones especiales.
MMF es un éster del ácido micofenólico (MPA), ácido orgánico débil y liposoluble producido por el hongo Penicillium stoloniferum3. En el hígado es convertido, por hidrólisis de ésteres, en su metabolito activo, el MPA4, que inhibe de manera reversible y no competitiva la actividad del enzima inosina monofosfato deshidrogenasa (IMPDH) durante la síntesis de ADN en la fase S del ciclo de división celular. Este enzima juega un papel importante en la síntesis de novo de nucleótidos de guanosina. Así, la inhibición de este enzima produce una disminución de nucleótidos de guanosina y un incremento de nucleótidos de adenosina, lo cual, finalmente, resulta en una inhibición de la síntesis de ADN y de la proliferación celular. Otra alternativa para la síntesis de purinas es la vía de salvamento, la cual lleva a la producción de nucleótidos de guanosina a partir de guanina y es catalizada por los enzimas hipoxantina guanina fosforribosil transferasa y fosforribosil pirofosfato sintetasa. En los linfocitos, esta vía de salvamento es menos activa que la síntesis de novo, por lo que el MPA tiene unos efectos citostáticos más potentes en los linfocitos que en otras células, siendo éste el principal mecanismo mediante el cual ejerce acciones inmunosupresoras5,6.
Existen dos isoformas de IMPDH: tipo 1 o constitutiva7, que se expresa en linfocitos en reposo8, y tipo 2 o inducible7, que se expresa en linfocitos activados8. La isoforma tipo 2 es cinco veces más sensible a la inhibición ejercida por el MPA que la isoforma tipo 1, la cual se expresa en la mayoría de los tipos celulares5.
Existen otros dos mecanismos que pueden contribuir a la eficacia de MMF. El primero es la inducción de apoptosis de linfocitos T activados policlonalmente, lo cual elimina clones de células que responden a estimulación antigénica9. Otro mecanismo es la inhibición de la glicosilación y expresión de moléculas de adhesión, por lo que disminuye el reclutamiento de linfocitos y monocitos en sitios de inflamación10.
Asimismo, MMF tiene efectos antiproliferativos y antifibróticos, ya que al inhibir el reclutamiento de monocitos y macrófagos en órganos y tejidos disminuye la producción de TNF e IL-1, las cuales reclutan y estimulan la proliferación de fibroblastos11. Evidencias recientes sugieren que MMF también es capaz de inhibir la proliferación de células no inmunes como las células del músculo liso, las de los túbulos renales y las mesangiales12.
En comparación con otros fármacos inmunosupresores, MMF presenta la ventaja de bloquear las respuestas secundarias de los anticuerpos moduladas por las células B de memoria13. Además, a diferencia de azatioprina y metotrexato, que tienen un efecto selectivo sobre la síntesis del ADN en todo tipo de células, MMF actúa solamente sobre la proliferación de los linfocitos, no se incorpora al ADN y, por tanto, no causa la rotura de los cromosomas. A diferencia de los inhibidores de calcineurina, MMF no produce nefrotoxicidad14.
En diciembre de 2014 la Agencia Española de Medicamentos y Productos Sanitarios emitió una nota informativa en la que exponía que MMF en combinación con otros fármacos inmunosupresores podía causar hipogammaglobulinemia y bronquiectasias, basándose en una revisión reciente llevada a cabo por el Comité para la Evaluación de Riesgos en Farmacovigilancia europeo (PRAC), de los casos notificados y de los estudios publicados hasta el momento. En base a esto, nos propusimos analizar la evolución de los niveles séricos de inmunoglobulinas y aparición de episodios de infección respiratoria y bronquiectasias en pacientes tratados con MMF en condiciones diferentes a las autorizadas en ficha técnica.
La hipogammaglobulinemia es una inmunodeficiencia primaria o secundaria debida a la falta total o parcial de la capacidad de producir inmunoglobulinas. Este defecto predispone a padecer infecciones recurrentes provocadas por microorganismos específicos (Streptococcus pneumoniae, Haemophilus influenzae), principalmente localizadas en las vías respiratorias, lo que finalmente da lugar a la aparición de bronquiectasias, consistentes en una dilatación permanente de las paredes bronquiales y destrucción de las mismas, así como producción de esputo abundante, provocando la pérdida progresiva de función pulmonar y de la calidad de vida de los pacientes que las padecen, llevándoles a una mortalidad precoz15.
Material y método
Se realizó un estudio observacional retrospectivo en el que se incluyeron pacientes que iniciaron tratamiento con MMF en condiciones off-label entre enero de 2010 y enero de 2015. Se revisaron los informes clínicos y analíticas utilizando el sistema de información clínica “Hygeia” y el Programa informático de dispensación a pacientes externos (Dominion®), y se elaboró una hoja de recogida de datos con los siguientes ítems: edad, sexo, diagnóstico, servicio médico, concentraciones séricas de inmunoglobulinas antes y después de iniciar tratamiento, dosis de MMF, tratamiento concomitante con otros fármacos inmunosupresores (corticoides y citostáticos), aparición de episodios de hipogammaglobulinemia y bronquiectasias desde el inicio del tratamiento, así como el tiempo que tardaron en manifestarse, y actuación frente a esas situaciones. Se definió la hipogammaglobulinemia como un valor de IgG menor de 800 mg/dL y/o de IgA menor de 100 mg/dL y/o un valor de IgM menor de 80 mg/dL16. Todos los datos fueron analizados según el programa estadístico informático SPSS versión 15.0.
Resultados
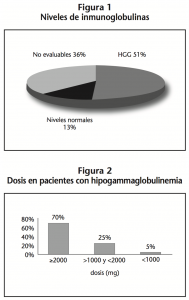 Se incluyeron 39 pacientes en tratamiento con MMF: 32 (82%) mujeres y 7 (18%) hombres, con una media de edad de 53,9±17,1 años. De ellos, 23 (59%) pertenecían al Servicio de Reumatología y 16 (41%) al Servicio de Nefrología. 11 (28%) pacientes estaban diagnosticados de Lupus Eritematoso Sistémico, 10 (26%) de Síndrome Nefrótico, 7 (18%) de Glomerulonefritis, 5 (13%) de Vasculitis Sistémica, 4 (10%) de Esclerodermia anti SCL-70 y 2 (5%) de Síndrome de Sjögren. La mediana de dosis recibida fue 2000 (IQR 1000-2000) mg/día. Todos estaban recibiendo tratamiento concomitante con otro fármaco inmunosupresor, principalmente corticoides (mayoritariamente prednisona) y citostáticos (mayoritariamente metotrexato). En 5 (13%) pacientes los niveles séricos de inmunoglobulinas se mantuvieron dentro de los límites de normalidad, en 14 (36%) no fueron evaluables por falta de datos y en 20 (51%) se presentó hipogammaglobulinemia, con una mediana de tiempo de aparición de 7 (IQR 3,3-8,8) meses (Figura 1). La inmunoglobulina más afectada fue IgG, presentando valores por debajo de la normalidad 10 (50%) pacientes. De estos pacientes con hipogammaglobulinemia, 14 (70%) tomaban una dosis mayor o igual a 2000 mg, 5 (25%) llevaban prescritos más de 1000 y menos de 2000 mg y 1 (5%) tomaba menos de 1000 mg (Figura 2). De ellos, se procedió a suspender el tratamiento a 2 (10%), se disminuyó la dosis a 12 (60%) y se mantuvo la dosis a 6 (30%). De los 12 pacientes a los que se les modificó la dosis, 7 (58%) experimentaron mejoría analítica, un aumento de los niveles de las inmunoglobulinas afectadas. 10 (50%) pacientes con hipogammaglobulinemia sufrieron algún episodio de infección respiratoria, y en 4 (40%) evolucionó a bronquiectasia. La totalidad de ellos recibió tratamiento antibiótico, siendo los más prescritos levofloxacino, ciprofloxacino y amoxicilina-clavulánico.
Se incluyeron 39 pacientes en tratamiento con MMF: 32 (82%) mujeres y 7 (18%) hombres, con una media de edad de 53,9±17,1 años. De ellos, 23 (59%) pertenecían al Servicio de Reumatología y 16 (41%) al Servicio de Nefrología. 11 (28%) pacientes estaban diagnosticados de Lupus Eritematoso Sistémico, 10 (26%) de Síndrome Nefrótico, 7 (18%) de Glomerulonefritis, 5 (13%) de Vasculitis Sistémica, 4 (10%) de Esclerodermia anti SCL-70 y 2 (5%) de Síndrome de Sjögren. La mediana de dosis recibida fue 2000 (IQR 1000-2000) mg/día. Todos estaban recibiendo tratamiento concomitante con otro fármaco inmunosupresor, principalmente corticoides (mayoritariamente prednisona) y citostáticos (mayoritariamente metotrexato). En 5 (13%) pacientes los niveles séricos de inmunoglobulinas se mantuvieron dentro de los límites de normalidad, en 14 (36%) no fueron evaluables por falta de datos y en 20 (51%) se presentó hipogammaglobulinemia, con una mediana de tiempo de aparición de 7 (IQR 3,3-8,8) meses (Figura 1). La inmunoglobulina más afectada fue IgG, presentando valores por debajo de la normalidad 10 (50%) pacientes. De estos pacientes con hipogammaglobulinemia, 14 (70%) tomaban una dosis mayor o igual a 2000 mg, 5 (25%) llevaban prescritos más de 1000 y menos de 2000 mg y 1 (5%) tomaba menos de 1000 mg (Figura 2). De ellos, se procedió a suspender el tratamiento a 2 (10%), se disminuyó la dosis a 12 (60%) y se mantuvo la dosis a 6 (30%). De los 12 pacientes a los que se les modificó la dosis, 7 (58%) experimentaron mejoría analítica, un aumento de los niveles de las inmunoglobulinas afectadas. 10 (50%) pacientes con hipogammaglobulinemia sufrieron algún episodio de infección respiratoria, y en 4 (40%) evolucionó a bronquiectasia. La totalidad de ellos recibió tratamiento antibiótico, siendo los más prescritos levofloxacino, ciprofloxacino y amoxicilina-clavulánico.
Discusión
MMF, piedra angular de los tratamientos inmunosupresores de baja toxicidad, comenzó a administrarse en 1995, y está incluido en protocolos internacionales de inmunosupresión desde hace más de 10 años. Generalmente es un fármaco bien tolerado, pudiendo provocar efectos adversos restringidos al tracto gastrointestinal, tales como náuseas, vómitos y diarrea, los cuales se minimizan al reducir la dosis o fraccionarla en más tomas. También se han reportado trastornos genitourinarios como disuria, hematuria y síntomas neurológicos, como cansancio, cefalea y alteraciones del sueño. Entre los efectos adversos metabólicos se informan hiperglucemia, hipofosfatemia, alteraciones de la concentración del potasio y aumento del colesterol. Con menor frecuencia se describen disnea, dolor precordial, tos, palpitaciones e hipertensión. El efecto adverso más importante es hematológico –leucopenia (0,5 a 2,0%)– por lo que tras 1 a 2 semanas de tratamiento se requiere examen hematológico completo y monitorización mensual. No obstante, la supresión de médula ósea es menos frecuente que la observada con azatioprina. El uso intravenoso incrementa el riesgo de tromboflebitis y trombosis.
El perfil de seguridad de MMF se compara favorablemente con el de otros inmunosupresores ya que la toxicidad neurológica, renal, hipertensión, hiperglucemia e infertilidad son infrecuentes. MMF no produce efectos tóxicos renales ni hepáticos clínicamente significativos; no obstante, se han descrito aumentos de transaminasas séricas que se normalizaron al suspender el fármaco14,17,18.
Algunos de estos efectos adversos se han producido fundamentalmente en pacientes trasplantados, lo cual podría atribuirse a la condición médica per se o a la mayor cantidad de pacientes tratados en estas condiciones. MMF tiene una solubilidad mayor a la del MPA en los jugos gástricos por las características de su estructura química, lo que repercute en una mejor biodisponibilidad y menos efectos adversos asociados.
Es conocido que el descenso de las inmunoglobulinas incrementa la probabilidad de desarrollar infecciones recurrentes, al tiempo que se asocia con una menor esperanza de vida y un mayor riesgo de sufrir rechazo agudo del trasplante. La acción inhibitoria que MMF ejerce sobre los linfocitos se ha postulado como el mecanismo causal de la hipogammaglobulinemia de estos pacientes. En nuestro estudio, la hipogammaglobulinemia se presenta en un elevado porcentaje de pacientes (51%) y está relacionada directamente con la dosis. Los pacientes con hipogammaglobulinemia desarrollaron una alta tasa de infecciones, que evolucionaron a bronquiectasias (estos pacientes no tenían enfermedad pulmonar previa al inicio del tratamiento), hecho que concuerda con los resultados obtenidos en el estudio realizado por Boddana et al.19. En ese mismo estudio se describe, además, que la mediana de tiempo de aparición de episodios de bronquiectasia es de 9 meses, siendo de 7 meses en nuestro caso. La principal limitación es que, al tratarse de un estudio transversal llevado a cabo en un hospital en el que no se realizan trasplantes de órganos sólidos, el número de pacientes incluidos no ha sido alto; por ello, todos los pacientes llevaban prescrito MMF en condiciones diferentes a las autorizadas en ficha técnica, a diferencia de los estudios realizados por Boddana et al.19, Cransberg et al.20 y Rook et al.21, en los que todos los pacientes incluidos son trasplantados renales. Estos hechos podrían influir en las leves diferencias apreciadas en cuanto a resultados obtenidos. Estos casos deberían repercutir en la práctica clínica habitual, de tal forma que todos los pacientes en tratamiento con MMF que desarrollen infecciones recurrentes o síntomas pulmonares persistentes como tos y disnea deberían ser monitorizados. En caso de hipogammaglobulinemia sostenida clínicamente relevante se deberá considerar la acción clínica más apropiada. En un número elevado de los pacientes analizados en el presente estudio, la disminución de la dosis de MMF dio lugar a la normalización de los niveles de inmunoglobulinas en suero, y en algunos de los casos confirmados de bronquiectasias, la disminución de la dosis de MMF condujo a una mejora de los síntomas respiratorios de los pacientes.
Conclusiones
La hipogammaglobulinemia se presenta en un elevado porcentaje de pacientes (51%) y está relacionada directamente con la dosis. Los pacientes con hipogammaglobulinemia desarrollaron una alta tasa de infecciones, que evolucionaron a bronquiectasias. Realizar una monitorización lo más precoz posible podría evitar estos efectos adversos.
Conflicto de intereses: Los autores declaran no tener conflictos de intereses.
Bibliografía
1. Ficha técnica de Cellcept®. (Acceso Febrero 2016). Disponible en: http://www.ema.europa.eu/docs/es_ES/ document_library/EPAR_Product_Information/human/000082/WC500021864.pdf.
2. Boletín Oficial del Estado. Real Decreto 1015/2009, de 19 de junio, por el que se regula la disponibilidad de medicamentos en situaciones especiales. BOE núm 174 de 20/07/2009.
3. Allison AC, Almquist SJ, Muller CD, Eugui EM. In vitro immunosuppressive effects of mycophenolic acid an ester produg, RS-61443. Transplant Proc. 1991;23 (Suppl. 2):10-14.
4. Platz KP, Sollinger HW, Hullett DA, Eckhoff DE, Eugui EM, Allison AC. RS-61443 A new, potent immunosuppressive agent. Transplantation 1991;51:27-31.
5. Allison AC, Eugui EM. Mycophenolate mofetil and its mechanisms of action. Immunopharmacology 2000; 47:85-118.
6. Allison AC. Mechanisms of action of mycophenolate mofetil. Lupus 2005; 14 (Suppl 1):s2-s8.
7. Natsumeda Y, Ohno S, Kawasaki H, Konno Y, Weber G, Suzuki K. Two distinct cDNAs for human IMP dehydrogenase. J Biol Chem. 1990;25(265): 5292-5295.
8. Konno Y, Natsumeda Y, Nagai M, Yamaji Y, Ohno S, Suzuki K, et al. Expression of human IMP dehydrogenase types I and II in Escherichia coli and distribution in human normal lymphocytes and leukemic cell lines. J Biol Chem. 1991;266:506-509.
9. Cohn RG, Mirkovich A, Dunlap B, Burton P, Chiu SH, Eugui E, et al. Mycophenolic acid increases apoptosis, lysosomes and lipid droplets in human lymphoid and monocytic cell lines. Transplantation 1999;68:411-418.
10. Allison AC, Kowalski WJ, Muller CJ, Waters RV, Eugui EM. Mycophenolic acid and brequinar, inhibitors of purine and pyrimidine synthesis, block the glycosylation of adhesion molecules. Transplant Proc. 1993;25 (Suppl 2):67-70.
11. Morath C, Schwenger V, Beimler J, Mehrabi A, Schmidt J, Zeier M, et al. Antifibrotic actions of mycophenolic acid. Clin Transplant. 2006; 20(Suppl 17):25-29.
12. Morath C, Zeier M. Review of the antiproliferative properties of mycophenolate mofetil in non-immune cells. Int J Clin Pharmacol Ther. 2003;41(10):465-9
13. Sievers T, Rossi S, Ghobrial R, et al. Mycophenolate mofetil. Pharmacotherapy 1997;17:1178-97.
14. Keven K, Sahin M, Kutlay S, et al. Inmunoglobulin deficiency in kidney allograft recipients: comparative effects of mycophenolate mofetil and azathioprine. Transpl Infect Dis. 2003:5:181.
15. Keistinen T, Säynäjäkangas O,Tuuponen T, Kivelä SL. Bronchiectasis: an orphan disease with a poorly-understood prognosis. Eur Respir J, 10 (1997), pp. 2784-2787.
16. Devlin, T. M. 2004. Bioquímica, 4ª edición. Reverté, Barcelona. ISBN 84-291-7208-4.
17. Edge J, Outland J.D y col. Mycophenolate Mofetil as an Effective Corticosteroid Sparing Therapy for Recalcitrant Dermatomiositis. Arch Dermatol. 2006;142:65-69.
18. Hantash B, Fiorentino D. Liver Enzyme Abnormalities in Patients With Atopic Dermatitis Treated With Mycophenolate Mofetil. Arch Dermatol. 2006;142:109-110.
19. Boddana P, H. Weeb L, Unsworth J, Brealey M, Bingham C, J. Harper S. Hypogammaglobulinemia and bronchiectasis in mycophenolate mofetil-treated renal transplant recipients: an emerging clinical phenomenon? Clin Transplant. 2011:25:417-419.
20. Cransberg K, Cornelissen EA, Davin JC, Van Hoeck K, Lilien M, Stijnen T, et al. Improved outcome of pediatric kidney transplantations in the Netherlands – effect of introduction of mycophenolate mofetil. Pediatr Transplant. 2005:9:104.
21. Rook M, Postma DS, Van der Jagt EJ, Van Minnen CA, Van der Heide J, Ploeg R, et al. Mycophenolate mofetil and bronchiectasis in kidney transplant patients: a possible relationship. Transplantation 2006:81:287.
___
Descargar artículo en PDF: Hipogammaglobulinemia y bronquiectasias en pacientes tratados con micofenolato de mofetilo. A propósito de una alerta
