Fecha de recepción: 20/09/2017 – Fecha de aceptación: 22/11/2017
Lázaro Cebas A, Cortijo Cascajares S, Goyache Goñi MP, Ferrari Piquero JM
Servicio de Farmacia. Hospital Universitario 12 de Octubre. Madrid (España)
____
Correspondencia:
Andrea Lázaro Cebas
Hospital Universitario 12 de Octubre
(Servicio de Farmacia)
Avda. Córdoba, s/n
28041 Madrid
Correo electrónico: andrealazarocebas@gmail.com
____
Resumen
Objetivos: Determinar los costes derivados del uso de las formulaciones intravenosa (iv) y subcutánea (sc) de trastuzumab y realizar un análisis de costes en 3 escenarios diferentes: antes de la introducción de trastuzumab sc, actualmente con un empleo de la formulación sc del 70% y por último en un escenario en el que se aumentase el uso de la formulación sc hasta el 90%.
Métodos: Estudio de corte transversal realizado durante 2016. Se recogieron variables demográficas y terapéuticas. Para el análisis de costes se consideraron costes directos (farmacológicos, material fungible y personal sanitario) e indirectos (pérdida de productividad laboral). Para el cálculo del coste farmacológico de la administración iv, se consideró un “vial sharing” del 90%.
Resultados: 153 pacientes (110 con cáncer de mama precoz (CMp) y 43 con cáncer de mama metastásico (CMm)) fueron tratadas con trastuzumab en 2016. La media de ciclos recibidos fue de 7,37±4,06 en CMp, 8,32±5,44 en CMm en primera línea y 6,21±5,89 en CMm en líneas sucesivas. Partiendo del escenario inicial en el que el 100% de los pacientes eran tratados con trastuzumab iv el empleo de la formulación sc ha supuesto un ahorro de 128.583,00 € anuales. El ahorro anual que se podría conseguir aumentando el uso de la formulación sc hasta el 90% sería de 36.738,00 €.
Conclusiones: El uso de trastuzumab sc ha supuesto un ahorro considerable dado los costes directos e indirectos. El ahorro se podría incrementar con el aumento del uso de la formulación sc respecto a la iv.
Palabras clave: Subcutáneo, trastuzumab, cáncer de mama, uso de recursos.
____
INTRODUCCIÓN
El cáncer de mama es la neoplasia maligna más frecuente en las mujeres en todo el mundo1, suponiendo en España el 29% de todos los cánceres en las mujeres2. El 15-20% de este tipo de cánceres sobreexpresan el receptor HER2, diana de acción del trastuzumab3. El trastuzumab se comercializó por primera vez en España en el año 2000 con el nombre de Herceptin®. Desde entonces se ha administrado vía intravenosa (iv), con una primera dosis de carga de 8 mg/kg seguida de dosis de 6 mg/kg administradas cada 21 días4. En septiembre de 2013 la nueva formulación de administración subcutánea (sc) de trastuzumab fue autorizada por la Agencia Europea del Medicamento (EMA), estando disponible en España desde diciembre de 2014. Esta nueva formulación es administrada también cada 21 días pero a diferencia de la administración intravenosa, ésta se realiza a dosis fija de 600 mg sin ser necesaria una dosis de carga4.
El vial de Herceptin® iv es un liofilizado que contiene una dosis de 150 mg. Para la preparación los viales deben reconstituirse con 7,2 mL de agua para inyectable y posteriormente la dosis prescrita debe diluirse en un suero fisiológico de 250 mL. Este proceso de preparación tiene una duración de 10 minutos aproximadamente. Herceptin® sc es un vial que contiene 600 mg de trastuzumab y hialuronidasa recombinante humana (rHuPH20) en un volumen de 5 mL listo para ser administrado. La preparación se realiza cargando el contenido del vial en una jeringa mediante un sistema cerrado de trasferencia de fármacos citostáticos, siendo el tiempo de preparación de unos 2 minutos. Los tiempos de administración para la formulación iv son de 90 minutos para la primera dosis y de 30 minutos para las sucesivas; en el caso de la formulación sc la administración se realiza en 5 minutos4.
Distintos estudios se han realizado durante el desarrollo de la formulación subcutánea de trastuzumab. Estudios farmacocinéticos, en los que se determinó la dosis de trastuzumab sc equivalente a la dosis iv y se demostró una exposición equivalente a trastuzumab en el organismo con ambas formulaciones5-7. El estudio Hannah, estudio pivotal de fase III con el que se obtuvo la aprobación de la formulación sc por parte de la EMA al demostrar la no inferioridad frente a la formulación iv8,9. Posteriormente, tras la aprobación, se han realizado estudios como el PrefHer y el MetaspHer en los que pacientes tanto en tratamiento adyuvante como en enfermedad metastásica han indicado una elevada preferencia por la formulación subcutánea10,11. Paralelamente al estudio PrefHER se realizó un estudio de minimización de costes en el que se observó que con el empleo de la formulación subcutánea se conseguía un ahorro de tiempo de 55 minutos en la sala de tratamiento y de 17 minutos por parte del personal de elaboración y de administración por cada dosis de trastuzumab12. En el subgrupo de hospitales españoles también se observó esta tendencia y teniendo en cuenta costes directos e indirectos se estimó un ahorro 1.132,43 € por cada tratamiento adyuante completo (18 ciclos) empleando la formulación subcutánea13.
En un estudio previo realizado también en el Hospital Universitario 12 de Octubre, se analizó el ahorro derivado del uso de la formulación subcutánea considerando tanto costes directos de adquisición del fármaco como de material fungible. El ahorro estimado durante un año fue de 69.747 €, sin embargo no se pudieron considerar en el cálculo ni los costes del personal sanitario ni los costes indirectos14. Por este motivo realizamos un estudio cuyo objetivo fue cuantificar tanto los costes directos como los indirectos derivados del uso de las formulaciones intravenosa y subcutánea y realizar un análisis de costes en 3 escenarios diferentes: el primero antes de la introducción de trastuzumab sc, el segundo actualmente con el empleo de un 70% de trastuzumab sc respecto al total de trastuzumab y el tercero un escenario potencial en el que se aumentase el uso de la formulación sc hasta el 90%.
MATERIAL Y MÉTODOS
Se llevó a cabo un estudio observacional, descriptivo y transversal durante el año 2016 en el que se incluyeron todos los pacientes en tratamiento con trastuzumab intravenoso y subcutáneo. La identificación de pacientes y la recogida de variables se realizó con el programa de prescripción electrónica Oncofarm®.
Se recogieron las siguientes variables de los pacientes: demográficas (edad, sexo y peso) y terapéuticas (indicación del tratamiento: cáncer de mama precoz HER2 positivo o cáncer de mama metastásico HER2 positivo (primera línea o sucesivas)).
Para el análisis de costes se consideraron tanto los costes directos (farmacológicos, de material fungible y costes del personal sanitario) como indirectos (pérdida de productividad laboral).
Costes farmacológicos: se consideraron los costes de ambas formulaciones expresados en PVL financiado (507,04 € trastuzumab 150 mg iv y 1.275,00 € trastuzumab 600 mg sc). Para el cálculo del coste farmacológico de la administración intravenosa, se consideró un aprovechamiento máximo de los viales (vial sharing 90%). El cálculo de la dosis de trastuzumab iv en función del peso se realizó empleando el peso medio de las mujeres de nuestra población.
Costes de material fungible: el consumo de material fungible y sus costes se obtuvieron del estudio “Time and Motion” de López-Vivanco y colaboradores, de la base de datos del Consejo General de Colegios Oficiales de Farmacéuticos (CGCOF) y de estudios de costes13.
Costes de los profesionales sanitarios: se calcularon teniendo en cuenta el salario bruto de los profesionales sanitarios implicados en las actividades analizadas (farmacéuticos, enfermeros y auxiliares de enfermería)15,16 y los tiempos empleados por los distintos profesionales para la preparación y administración de trastuzumab (27,1 minutos para la formulación iv y 13,2 minutos para la sc)13.
Costes asociados a la pérdida de productividad laboral (costes indirectos): el cálculo se realizó mediante el método del capital humano, a partir del tiempo de los pacientes en el hospital (205 minutos en el caso de la asministración iv y 105 minutos en el caso de la sc)13 y del salario medio. Para trasladar el tiempo en el hospital en “coste por pérdida de productividad”, se consideró un salario medio de 21.023,57 €, y una tasa de paro del 21,39%.
En análisis de costes se emplearon 3 escenarios; el escenario inicial (antes de la introducción de la formulación subcutánea), el escenario actual (uso de la formulación subcutánea del 70%) y un escenario potencial (uso de la formulación subcutánea del 90%).
El análisis estadístico de los datos se realizó con la calculadora de costes de trastuzumab intravenoso y subcutáneo de Roche® y la aplicación informática Microsoft Excel 2010®.
RESULTADOS
Durante el año 2016, 153 pacientes (100% mujeres) con diagnóstico de cáncer de mama HER2 positivo fueron tratadas con trastuzumab. La edad media de las pacientes fue de 59,88±14,76 años y el peso medio 66,27±12,29 kg. El 71,90% (n=110) presentaba cáncer de mama precoz. El 28,10% restante presentaba enfermedad metastásica (19 en tratamiento de primera línea y 24 en líneas sucesivas). La media de ciclos recibidos fue de 7,37±4,06 en pacientes con cáncer de mama precoz (tratamiento adyuvante), 8,32±5,44 en pacientes con enfermedad metastásica en primera línea y 6,21±5,89 para pacientes con enfermedad metastásica en líneas posteriores de tratamiento. La media de ciclos por paciente recibidos durante 2016 fue de 7,31±4,57.
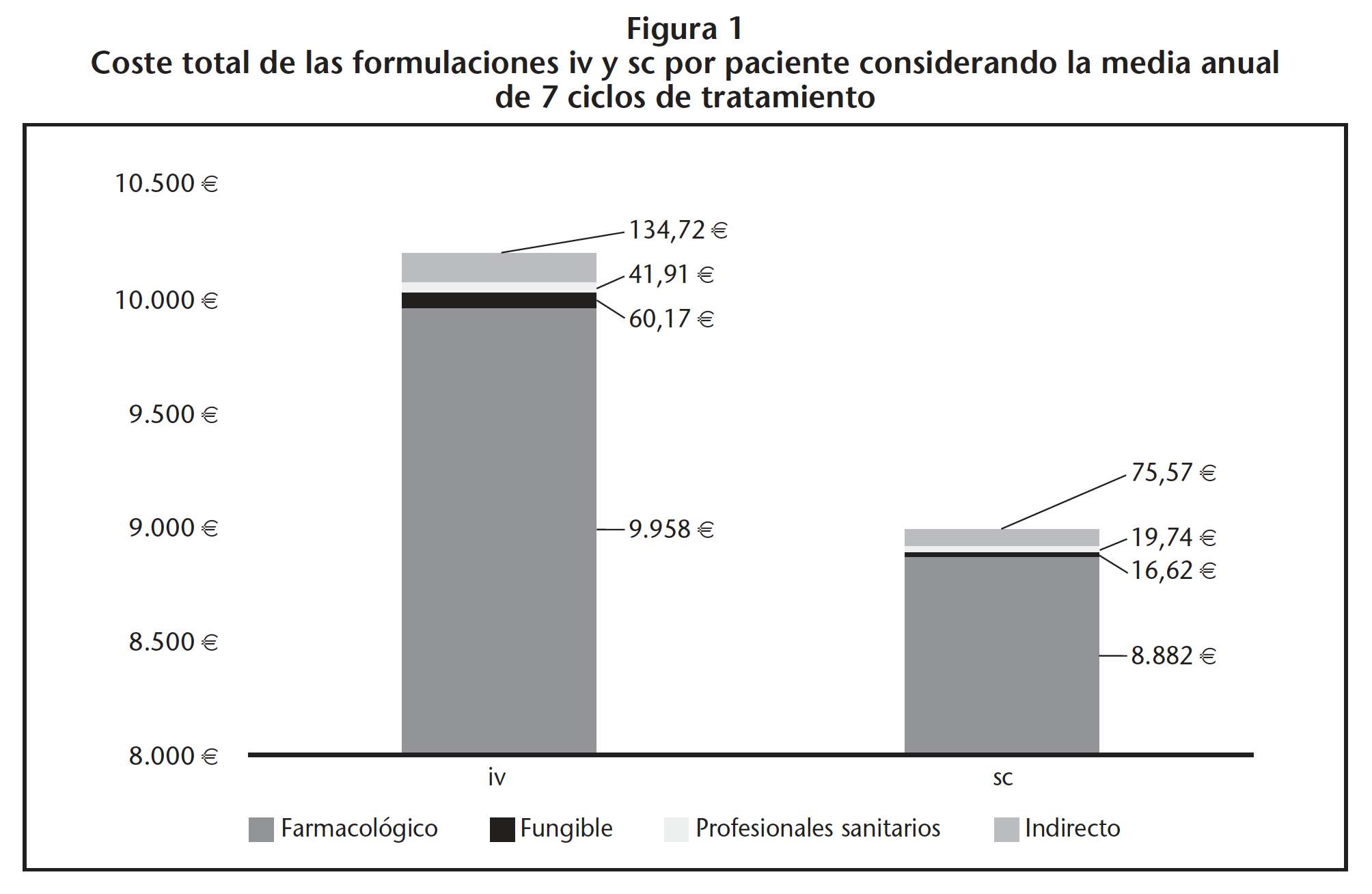
El coste farmacológico anual por paciente considerando 7 ciclos de tratamiento fue de 9.957,73 € para la formulación iv y de 8.882,00 € para la sc. El coste total del tiempo empleado por los distintos profesionales sanitarios (farmacéutico, enfermero, auxiliar de enfermería) para la preparación y administración de 1 ciclo de trastuzumab fue de 6,02 € en el caso del iv y de 2,83 € en el del sc. El coste para la media anual de 7 ciclos por paciente fue de 42,14 € para el iv y de 19,81 € para el sc. El coste completo de material fungible para 7 ciclos de tratamiento fue de 60,17 € para la administración iv y 16,62 € para la sc.
Los costes asociados a la pérdida de productividad para la media de 7 ciclos anuales por paciente fueron 134,72 € en el caso de trastuzumab iv y 75,57 € en el caso del sc.
En la figura 1 se muestra el resultado por paciente de los distintos tipos de costes agregados para las distintas formulaciones considerando una media anual de 7 ciclos.
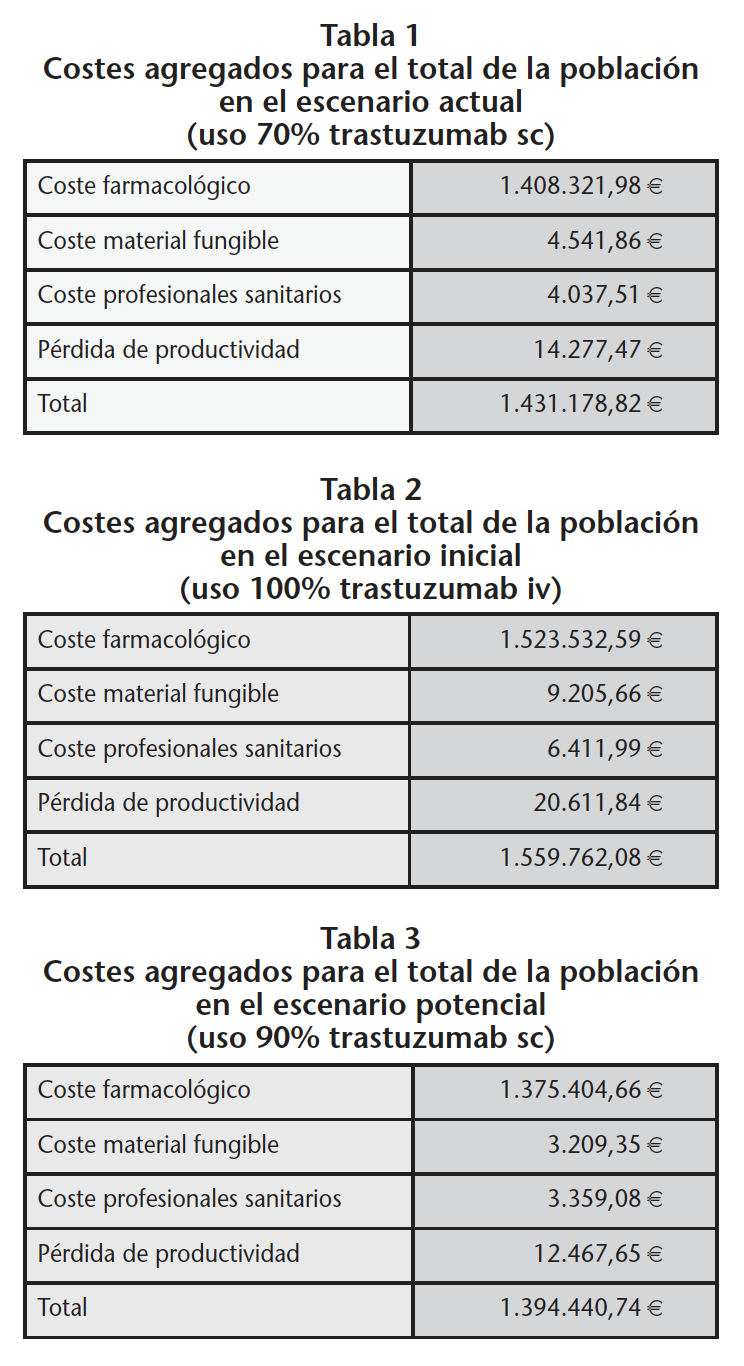
Los costes totales agregados para el total de nuestra población de 153 pacientes considerando que actualmente el uso de trastuzumab sc frente al total de trastuzumab es del 70% se muestran en la tabla 1. Considerando el escenario inicial en el que el 100% de los pacientes eran tratados con trastuzumab iv el empleo de la formulación sc ha supuesto un ahorro de 128.583,00 € anuales (Tabla 2). El ahorro anual que se podría conseguir aumentando el uso de la formulación sc del 70% actual hasta el 90% serían 36.738,00 € adicionales (Tabla 3).
DISCUSIÓN
Con la introducción de la formulación sc de trastuzumab y con un uso actual del 70% respecto al total del trastuzumab administrado en el hospital se ha conseguido un ahorro de 128.583,00 € durante el año 2016 considerando costes directos e indirectos. El ahorro considerando únicamente los costes directos farmacológicos fue de 115.211,00 €. En un estudio de utilización de recursos realizado en Italia en pacientes con cáncer de mama precoz en el que se proyectaron también 3 escenarios de uso de trastuzumab (100% uso iv, 100% uso sc y uso de iv junto a quimioterapia seguido de sc en monoterapia), no se consiguió ahorro considerando únicamente los costes farmacológicos. Esto, podría explicarse además de por las diferencias entre países en los costes de adquisición del fármaco, a que el peso medio de su población fue 3 kg inferior a la media de peso en nuestra población y al dosificarse por peso la formulación iv el ahorro con la formulación sc es mayor a mayor peso de las pacientes17. En otro estudio de este tipo realizado en Suecia en el que se consideraron tanto costes directos como indirectos se obtuvo un ahorro con el empleo de la formulación sc de 897 € por primer ciclo y de 117 € por cada uno de los ciclos sucesivos. El ahorro se observó también considerando sólo los costes directos de adquisición del fármaco18.
En nuestro estudio los tiempos empleados por los distintos profesionales para la preparación y administración de trastuzumab así como los tiempos que permanecieron las pacientes en el Hospital de Día para la administración de las distintas formulaciones se extrapolaron del estudio de López-Vivanco y colaboradores. En este estudio se analizaron los datos obtenidos en los 4 hospitales españoles en los que se realizó el estudio de minimización de costes paralelo al estudio PrefHer, calculándose una reducción en el tiempo de ocupación de las sillas de Hospital de Día del 80% y un ahorro de tiempo empleado por los distintos profesionales sanitarios del 50% con la formulación sc respecto a la iv13. En el análisis global de los datos de todos los centros participantes se obtuvo una reducción menor en el tiempo de ocupación de las sillas de Hospital de Día respecto al subgrupo de hospitales españoles (71%) y un ahorro de tiempo similar de los profesionales sanitarios, 53,5%12. En otro estudio realizado en Nueva Zelanda se obtuvo un ahorro medio de 36,95 minutos en la ocupación de la silla en la sala de tratamiento y de 20,45 minutos en el tiempo del farmacéutico cuando se emplea la formulación sc19. En Reino Unido también se realizó un estudio en el que se analizó el coste que supone el ahorro de tiempo del personal con la formulación subcutánea obteniéndose un ahorro de 100,06 £ por cada ciclo de tratamiento20.
La elección de todo tratamiento médico debe basarse en dos principios fundamentales que son la eficacia y la seguridad. Pero sí disponemos en el mercado de dos formulaciones con distinta vía de administración equivalentes en cuanto a eficacia y seguridad, como es el caso del trastuzumab, la decisión sobre cuál es la formulación más adecuada debe basarse en criterios de eficiencia y en la preferencia de los pacientes. Actualmente trastuzumab sc ha demostrado, tanto en nuestro estudio como en los anteriormente citados, ser una alternativa más eficiente que la formulación iv, pudiéndose optimizar tiempos de preparación, administración y ocupación de sillas de Hospital de Día con el aumento del uso de la formulación sc. Además, ha demostrado ser la formulación preferida por las pacientes en distintos ensayos clínicos y en otros estudios realizados en Alemania, Suecia y España con preferencias de las pacientes entre el 60 y el 89% por la formulación sc10,11,14,21.
A pesar de que actualmente la formulación de trastuzumab sc es la alternativa más eficiente, análisis posteriores deberán realizarse cuando se produzca la salida al mercado de los biosimilares de trastuzumab. Actualmente se ha publicado el ensayo clínico fase III que demuestra la equivalencia de CT-P6 frente a trastuzumab de referencia y otras 2 moléculas están en estudio22. Los ahorros asociados a la introducción de los biosimilares dependen de diferentes factores como los precios asignados en los diferentes países, pero en un estudio realizado en Europa se estimaron descuentos en torno al 15% en el precio de la molécula biosimilar respecto a la de referencia23. Por otro lado, en un modelo de efecto presupuestario realizado en Croacia se ha calculado un ahorro anual de 0,69 millones de € con la introducción de trastuzumab biosimilar24.
La limitación principal de nuestro estudio ha sido extrapolar los datos de estancia en Hospital de Día y de preparación de trastuzumab del estudio de López-Vivanco. Sin embargo, hemos considerado sus resultados extrapolables por ser un subestudio del ensayo clínico PrefHer, de tipo multicéntrico, y realizado en hospitales españoles.
En conclusión, este estudio muestra que trastuzumab subcutáneo es actualmente una alternativa más eficiente que la iv. El uso de trastuzumab sc ha supuesto un ahorro importante considerando tanto costes directos como indirectos, y el ahorro podría crecer con el aumento del uso de la formulación sc respecto a la iv. Sin embargo, con el lanzamiento de las moléculas biosimilares de trastuzumab análisis posteriores deberán realizarse para continuar garantizando el uso más eficiente de los recursos.
Conflicto de intereses: Los autores declaran no tener conflicto de intereses
BIBLIOGRAFÍA
1. Fact Sheets by Cancer. [citado 14 de septiembre de 2017]. Disponible en: http://globocan.iarc.fr/Pages/ fact_sheets_cancer.aspx.
2. Cáncer de mama. [citado 14 de septiembre de 2017]. Disponible en: http://www.seom.org/es/info-sobre-el-cancer/cancer-de-mama?start=2#content.
3. Wolff AC, Hammond MEH, Hicks DG, Dowsett M, McShane LM, Allison KH, et al. Recommendations for human epidermal growth factor receptor 2 testing in breast cancer: American Society of Clinical Oncology/College of American Pathologists clinical practice guideline update. Arch Pathol Lab Med. 2013;138(2):241-256.
4. Ficha técnica trastuzumab (Herceptin®) intravenoso/ subcutáneo.pdf. [citado 14 de septiembre de 2017]. Disponible en: http://www.ema.europa.eu/docs/es_ ES/document_library/EPAR_-_Product_Information/ human/000278/WC500074922.pdf.
5. Wynne C, Harvey V, Schwabe C, Waaka D, McIntyre C, Bittner B. Comparison of Subcutaneous and Intravenous Administration of Trastuzumab: A Phase I/Ib Trial in Healthy Male Volunteers and Patients With HER2-Positive Breast Cancer. J Clin Pharmacol. 2013;53(2):192-201.
6. Wynne CJ, Ellis-Pegler RB, Waaka DS, Schwabe C, Lehle M, Heinzmann D, et al. Comparative pharmacokinetics of subcutaneous trastuzumab administered via handheld syringe or proprietary single-use injection device in healthy males. Cancer Chemother Pharmacol. 2013;72(5):1079-87.
7. Quartino AL, Hillenbach C, Li J, Li H, Wada RD, Visich J, et al. Population pharmacokinetic and exposure–response analysis for trastuzumab administered using a subcutaneous “manual syringe” injection or intravenously in women with HER2-positive early breast cancer. Cancer Chemother Pharmacol. 2016;77(1):77-88.
8. Ismael G, Hegg R, Muehlbauer S, Heinzmann D, Lum B, Kim S-B, et al. Subcutaneous versus intravenous administration of (neo)adjuvant trastuzumab in patients with HER2-positive, clinical stage I–III breast cancer (HannaH study): a phase 3, open-label, multicentre, randomised trial. Lancet Oncol. 2012;13(9):869-78.
9. Jackisch C, Kim S-B, Semiglazov V, Melichar B, Pivot X, Hillenbach C, et al. Subcutaneous versus intravenous formulation of trastuzumab for HER2-positive early breast cancer: updated results from the phase III HannaH study. Ann Oncol Off J Eur Soc Med Oncol. 2015;26(2):320-5.
10. Pivot X, Gligorov J, Muller V, Curigliano G, Knoop A, Verma S, et al. Patients’ preferences for subcutaneous trastuzumab versus conventional intravenous infusion for the adjuvant treatment of HER2-positive early breast cancer: final analysis of 488 patients in the international, randomized, two-cohort PrefHer study. Ann Oncol. 2014;25(10):1979-87.
11. Pivot X, Spano JP, Espie M, Cottu P, Jouannaud C, Pottier V, et al. Patients’ preference of trastuzumab administration (subcutaneous versus intravenous) in HER2-positive metastatic breast cancer: Results of the randomised MetaspHer study. Eur J Cancer. 2017; 82:230-6.
12. De Cock E, Pivot X, Hauser N, Verma S, Kritikou P, Millar D, et al. A time and motion study of subcutaneous versus intravenous trastuzumab in patients with HER2-positive early breast cancer. Cancer Med. 2016;5(3):389-97.
13. Lopez-Vivanco G, Salvador J, Diez R, López D, De Salas-Cansado M, Navarro B, et al. Cost minimization analysis of treatment with intravenous or subcutaneous trastuzumab in patients with HER2-positive breast cancer in Spain. Clin Transl Oncol. 2 de junio de 2017 [citado 23 de julio de 2017]; Disponible en: http://link. springer.com/10.1007/s12094-017-1684-4.
14. Cebas AL, Cascajares SC, Bravo SP, Del Puy M, Goñi G, Monterrubio GG, et al. Subcutaneous versus intravenous administration of trastuzumab: preference of HER2+ breast cancer patients and financial impact of its use. [citado 23 de julio de 2017]; Disponible en: http://www.jbuon.com/pdfs/334-339.pdf.
15. Retribuciones correspondientes al año 2012 de la Agencia Valenciana de Salud.pdf. [citado 14 de septiembre de 2017]. Disponible en: http://www.san.gva. es/documents/153662/6405222/Tabla_01.pdf.
16. Retribuciones correspondientes al año 2011 del personal del Servicio Aragonés de Salud al que resulta de aplicación el sistema retributivo establecido en la ley 55/2003, del estatuto marco del personal estatutario de los servicios de salud.pdf. [citado 14 de septiembre de 2017]. Disponible en: https://www.cesmaragon. org/servicios-cesm-aragon/documentos-cesm-aragon-sindicato-medico/category/5-retribuciones?download=31:tablas-de-retribuciones-de-personal-estatutario-para-2011.
17. Farolfi A, Silimbani P, Gallegati D, Petracci E, Schirone A, Altini M, et al. Resource utilization and cost saving analysis of subcutaneous versus intravenous trastuzumab in early breast cancer patients. Oncotarget. [citado 14 de septiembre de 2017]; Disponible en: http://www.oncotarget.com/fulltext/18527.
18. Olofsson S, Norrlid H, Karlsson E, Wilking U, Ragnarson Tennvall G. Societal cost of subcutaneous and intravenous trastuzumab for HER2-positive breast cancer – An observational study prospectively recording resource utilization in a Swedish healthcare setting. The Breast. 2016;29:140-6.
19. Ryan S, North R, Harvey V, Cox L. Medical resource utilization for administration of trastuzumab in a New Zealand oncology outpatient setting: a time and motion study. Clin Outcomes Res. 2015;423.
20. Burcombe R, Chan S, Simcock R, Samanta K, Percival F, Barrett-Lee P. Subcutaneous Trastuzumab (Herceptin®): A UK Time and Motion Study in Comparison with Intravenous Formulation for the Treatment of Patients with HER2-Positive Early Breast Cancer. Adv Breast Cancer Res. 2013;02(04):133-40.
21. Jackisch C, Müller V, Dall P, Neumeister R, Park-Simon T-W, Ruf-Dördelmann A, et al. Subcutaneous Trastuzumab for HER2-positive Breast Cancer – Evidence and Practical Experience in 7 German Centers. Geburtshilfe Frauenheilkd. 2015;75(6):566-73.
22. Stebbing J, Baranau Y, Baryash V, Manikhas A, Moiseyenko V, Dzagnidze G, et al. CT-P6 compared with reference trastuzumab for HER2-positive breast cancer: a randomised, double-blind, active-controlled, phase 3 equivalence trial. Lancet Oncol. 2017 [citado 14 de septiembre de 2017]; Disponible en: http://www. sciencedirect.com/science/article/pii/S1470204517304345.
23. Rémuzat C, Dorey J, Cristeau O, Ionescu D, Radière G, Toumi M. Key drivers for market penetration of biosimilars in Europe. J Mark Access Health Policy. 2017;5(1):1272308.
24. Cesarec A, Likić R. Budget Impact Analysis of Biosimilar Trastuzumab for the Treatment of Breast Cancer in Croatia. Appl Health Econ Health Policy. 2017;15(2):277-86.
____
Descargar artículo en PDF: Impacto económico de la utilización de trastuzumab subcutáneo en un hospital de tercer nivel
