Mañes Sevilla M1, Labrador Andújar N2, Arias Moya MA3, Prats Oliván P4, Gutiérrez Ortega C5,
Montenegro Álvarez de Tejera P4
1 Servicio de Farmacia. Hospital General Universitario Gregorio Marañón. Madrid (España)
2 Servicio de Farmacia. Hospital Virgen de la Salud. Madrid (España)
3 Servicio de Farmacia. Hospital Fundación Jiménez Díaz. Madrid (España)
4 Servicio de Farmacia. Hospital Central de la Defensa Gómez Ulla. Madrid (España)
5 Servicio de Medicina Preventiva. Hospital Central de la Defensa Gómez Ulla. Madrid (España)
____
Resumen
Objetivo: La vancomicina es un fármaco susceptible de monitorizar con el objetivo de aumentar su efectividad, limitando los efectos adversos. Entre estos efectos adversos se encuentra la nefrotoxicidad, relacionada entre otros factores con concentraciones plasmáticas valle mayores a 15 mg/l y tratamientos superiores a 7 días. El objetivo del estudio es conocer la incidencia de nefrotoxicidad hallada en pacientes en tratamiento con vancomicina y conocer si existe una relación entre las concentraciones séricas valle de vancomicina y la nefrotoxicidad.
Metodología: Se realizó un estudio transversal, retrospectivo, observacional y descriptivo. Se incluyeron 40 pacientes adultos tratados con vancomicina durante el año 2013, con al menos una determinación de concentraciones plasmáticas. La nefrotoxicidad se determinó en base a las concentraciones séricas de creatinina.
Resultados: La incidencia de nefrotoxicidad fue de un 22,5%. Los pacientes con concentraciones séricas de vancomicina superiores a 20 mg/l presentaron 2,4 veces más riesgo de sufrir nefrotoxicidad (IC 95%: 1,1-5,6) que los que presentaron una concentración plasmática inferior a 20 mg/l. La aceptación por parte de los clínicos de las recomendaciones realizadas en base a los datos analíticos facilitadas por el Servicio de Farmacia fue del 85%.
Conclusiones: La vancomicina continúa siendo una opción adecuada en el manejo de los pacientes con infecciones graves que requieren alcanzar concentraciones plasmáticas valle en torno a 15-20 mg/l e incluso hasta 25 mg/l, siempre y cuando se monitoricen las concentraciones plasmáticas de vancomicina y la función renal, así como otros factores de riesgo que puedan estar asociados a nefrotoxicidad, ajustando la dosis a la situación fisiopatológica de cada paciente. El seguimiento de los informes farmacocinéticos, por parte de los clínicos, fue satisfactorio.
Palabras clave: Vancomicina, nefrotoxicidad, monitorización.
____
Incidence of nephrotoxicity in patients monitored on treatment with vancomicina
SUMMARY
Objective: The vancomycin is a glycopeptide antibiotic subject to be monitored with the goal of increase its efectivity, restricting the adverse effects. One of this adverse effect is the nephrotoxicity, relationed among other factors with a plasma level up to 15 mg/l and treatments with a duration higher to 7 days. The objective of the study is knowing the impact of nephrotoxicity associated with the use of vancomycin.
Methods: A cross, retrospective, observational and descriptive study was carried out. 40 pacients treated with vancomycin throughout 2013 were included in our study, with at least a determination of plasma levels. Nephrotoxicity was determined according to serum concentration of creatinine.
Results: The incidence of nephrotoxicity was 22.5%. The pacients with serum concentratios of vancomycin higher than 20 mg/l had 2.4 times more risk in suffering nephrotoxicity (IC 95%: 1.1-5.6) compared with those who had plasma levels lower than 20mg/l. The acceptance by the clinicians about the recommendations issued based on the analytical data provided by the Pharmacy Service was 85%.
Conclusions: The vancomycin continues being an appropiate option in management of the patients with severe infections that requires to reach plasma levels around 15-20 mg/l or even up to 25 mg/l. The plasma levels of vancomycin and renal function, as well as another risk factors that may be associated with nephrotoxicity, must be monitored adjusting the dose to the pathophysiologic condition of each patient. The acceptance of the pharmacokinetic reports by the clinicians was satisfactory.
Key Words: Vancomycin, nephrotoxicity, monitorization.
____
Introducción
La vancomicina es un antibiótico glucopeptídico tricíclico perteneciente al grupo farmacoterapéutico J01XA01 de la clasificación anatómico-farmacoterapéutica1,2. Actúa inhibiendo la síntesis de péptido glucano en un paso metabólico diferente y previo al de los β-lactámicos; además, altera la permeabilidad de la membrana citoplasmática e inhibe la síntesis de RNA3. Está indicada para el tratamiento de infecciones severas producidas por microorganismos grampositivos, como Staphylococcus aureus meticilin resistente (SARM), Staphylococcus coagulasa negativos (incluido Staphylococcus epidermidis) y Enterococcus spp,4,5 que son resistentes a los antibióticos β lactámicos o en pacientes con historia de alergia grave a penicilina6. Puede emplearse de forma empírica cuando se sospecha que existe infección por alguno de estos microorganismos antes de conocerse el resultado del antibiograma1. La dosis recomendada según ficha técnica1 para adultos con una función renal normal es de 2 g, administrada como 500 mg cada 6 horas o 1 g cada 12 horas6. Normalmente se observa una mejora entre las 48 y 72 horas. La duración total de la administración está determinada por el tipo y gravedad de la infección y la respuesta clínica del paciente. Para la endocarditis bacteriana, el régimen generalmente aceptado es de 1 g de vancomicina por vía intravenosa cada 12 horas durante 4 semanas, ya sea sola o en combinación con otros antibióticos. En función del patógeno involucrado, puede ser necesario un tratamiento más largo de hasta 6 semanas. Para la profilaxis preoperatoria frente a la endocarditis bacteriana antes de la cirugía, a los adultos se les administra por vía intravenosa 1 g de vancomicina y dependiendo del tiempo y tipo de cirugía, puede administrarse una dosis de 1 g 12 horas después de la cirugía. En los pacientes con insuficiencia renal, debe ajustarse la dosis para evitar concentraciones tóxicas en suero y deben controlarse de forma periódica las concentraciones de vancomicina en suero1. Otras fuentes recomiendan dosis de vancomicina entre 15-20 mg/kg cada 8-12 horas siendo necesario un ajuste de dosis según la función renal7,8.
En relación a sus características farmacocinéticas, la vancomicina no sigue un modelo monocompartimental sino que se ajusta a un modelo farmacocinético más complejo compuesto por uno, dos e incluso tres compartimentos8. Presenta una baja biodisponibilidad oral9 y por ello para el tratamiento de infecciones sistémicas debe administrarse por vía intravenosa (iv). Debido a la producción de reacciones locales e histamínicas, la vía intramuscular (im) debe evitarse3,10. La vancomicina penetra en la mayoría de los espacios corporales aunque las concentraciones que alcanza son variables y un tanto dependientes del grado de inflamación9. En los adultos, una dosis intravenosa única de 1 g da lugar a concentraciones plasmáticas de 15 a 30 miligramo por litro (mg/l) 1 hora después de una perfusión de 1 a 2 horas. El volumen de distribución es de 0,4-1 l/kg de peso y se une entre un 10% y un 50% a proteínas plasmáticas. Los factores que afectan a la actividad general de la vancomicina incluyen su distribución en los tejidos, tamaño del inóculo y los efectos de unión a las proteínas1,9. La vancomicina se metaboliza solamente en una pequeña proporción. Después de la administración parenteral, se elimina casi completamente a través de filtración glomerular9. La semivida de eliminación es de aproximadamente 4-6 horas en adultos con una función renal normal, en pacientes con insuficiencia renal, la semivida de eliminación en el suero puede estar considerablemente aumentada (hasta 7,5 días)1.
La monitorización de concentraciones plasmáticas de los antimicrobianos tiene como objetivo aumentar su efectividad, limitando los efectos adversos11. Está indicada en aquellos fármacos con un margen terapéutico estrecho, donde el intervalo entre la concentración eficaz y la tóxica es pequeño12. La vancomicina se incluye dentro de este grupo de fármacos que deberían de ser monitorizados. La posibilidad de ajustar la dosis a partir de la determinación de sus concentraciones en plasma ha constituido un avance muy importante, siendo una herramienta útil para la optimización de la terapia13. En el tratamiento con vancomicina existe controversia sobre cuál es el índice Farmacocinético/Farmacodinámico (PK/PD) que mejor predice el resultado terapéutico, ya que algunos autores consideran que es el cociente entre el área bajo la curva (ABC) y la concentración mínima inhibitoria (CMI)6,12, mientras que otros clasifican este antibiótico como “tiempo dependiente”1,13.
Las reacciones adversas más frecuentes son flebitis y reacciones pseudoalérgicas relacionadas con una administración de la vancomicina intravenosa demasiado rápida, ototoxicidad y nefrotoxicidad1,6-9,11,14.
Por ello, además de la monitorización de las determinaciones de concentración plasmática de fármaco valle o antes de la siguiente dosis, se deberían obtener también los datos de concentración sérica de creatinina antes, durante y al finalizar la terapia con vancomicina con el fin de controlar la evolución de la función renal y detectar una posible nefrotoxicidad15,16.
Es importante recalcar que las concentraciones de vancomicina consideradas fuera de un contexto clínico no permiten predecir el éxito o fracaso terapéutico, es necesario interpretarlas en relación con la fisiopatología y otros síntomas y signos de eficacia y toxicidad13.
A pesar de su uso generalizado, hay una creciente preocupación acerca el futuro papel de la vancomicina, en particular entre los pacientes con infecciones graves por SARM con CMI mayor a 1 mg/l7. Aunque el lugar de infección y los factores relacionados con el patógeno están relacionados con la eficacia del tratamiento17,18, una posible explicación del fracaso terapéutico en estos pacientes puede deberse a una dosificación sub-óptima16,19,20. Para la optimización del tratamiento en pacientes que presentan infecciones graves, como endocarditis, infecciones del aparato respiratorio inferior (p.ej. neumonía), infecciones intraabdominales (p. ej. peritonitis), infecciones de la piel y de los tejidos blandos (p.ej. úlceras en el pie diabético), infecciones del tracto urinario y septicemia, se recomienda una dosificación intensiva alcanzando unas concentraciones plasmáticas valle entre 15 y 20 mg/l7 e incluso hasta 25 mg/l en infecciones óseas y articulares (p.ej. osteomielitis) dada la mala penetración de la vancomicina en el hueso13 y una relación AUC/CMI superior a 4008,9. Por otro lado, esta intensificación de las dosis se ha relacionado con un aumento de la nefrotoxicidad inducida por vancomicina11,16,19,20. Sin embargo esa incidencia es variable de unos estudios a otros y se relaciona con otros factores de riesgo.
En base a lo expuesto, se ha planteado estudiar la incidencia de nefrotoxicidad asociada al tratamiento con vancomicina en los pacientes en los que se han monitorizado las concentraciones plasmáticas de fármaco. Para lo cual, se va a determinar si existe una correlación entre las concentraciones plasmáticas y la diferencia de concentración de creatinina sérica final e inicial. Así mismo se planteó conocer el grado de aceptación por parte del clínico de las recomendaciones farmacocinéticas realizadas en base a las concentraciones plasmáticas de fármaco y de creatinina sérica del paciente.
MATERIAL Y MÉTODOS
Se realizó un estudio transversal, retrospectivo, observacional y descriptivo. Se llevó a cabo en el área de Farmacocinética del Servicio de Farmacia y Productos Sanitarios del Hospital Central de la Defensa Gómez Ulla de Madrid. Se incluyeron los pacientes tratados con vancomicina durante el año 2013 con al menos una determinación de las concentraciones plasmáticas de fármaco. Se excluyeron aquellos pacientes con tratamiento inferior a 3 días, que hubiesen estado sometidos a hemodiálisis, sin datos de concentración sérica de creatinina o a los que se les hubiese extraído o analizado la muestra de manera incorrecta. Se consideró una muestra adecuada, la extraída inmediatamente antes de la administración de la dosis10,13,15. Los datos demográficos y clínicos de los pacientes se obtuvieron a través de la historia clínica electrónica mediante el programa HP-HIS® y se completaron mediante la revisión de la historia clínica en formato papel. Los datos analíticos de concentraciones plasmáticas de vancomicina y concentraciones séricas de creatinina el día de la determinación de las concentraciones plasmáticas, se obtuvieron con el analizador Cobas Integra 400 plus (Roche®).
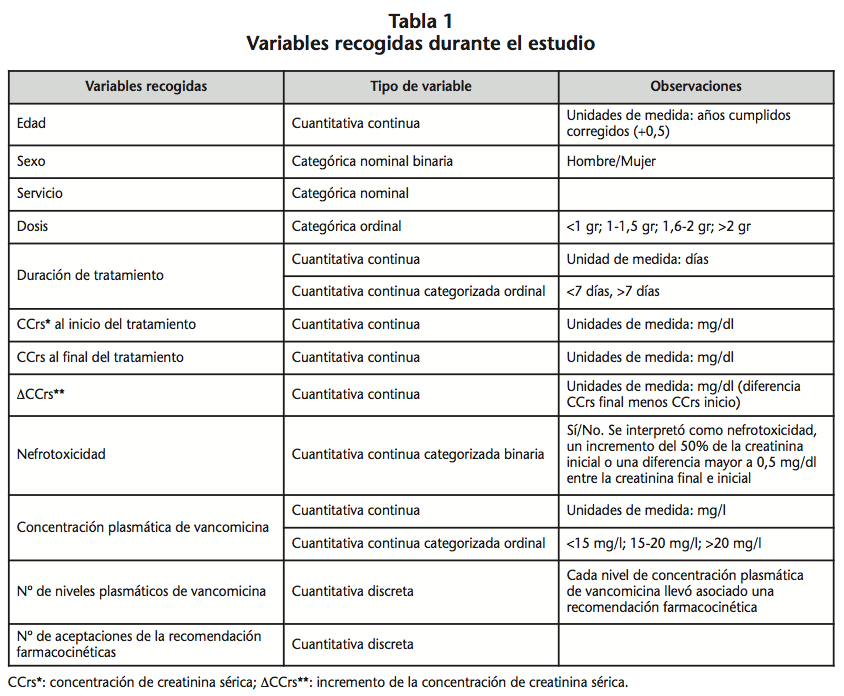
Las variables recogidas en el estudio se reflejan en la tabla 1.
 Método estadístico empleado: Como índices de la tendencia central y de la dispersión de las variables cuantitativas se empleó la mediana y el rango intercuartílico (IQR) una vez comprobada la ausencia de normalidad mediante el test de Kolmogorof-Smirnov (K-S). Para las variables categóricas se emplearon las frecuencias absolutas y relativas porcentuales. Para ver la asociación entre las concentraciones plasmáticas de vancomicina y nefrotoxicidad se empleó el test χ2 de Pearson. La valoración del efecto se realizó mediante la estimación de la razón de prevalencia (RP). Para conocer la correlación entre las concentraciones plasmáticas del fármaco y el incremento de concentración de creatinina sérica se empleó la prueba estadística Rho de Spearman. Todos los datos se analizaron con el programa SPSS versión 15.0. Se consideró que había diferencias estadísticamente significativas cuando la p fue inferior a 0,05.
Método estadístico empleado: Como índices de la tendencia central y de la dispersión de las variables cuantitativas se empleó la mediana y el rango intercuartílico (IQR) una vez comprobada la ausencia de normalidad mediante el test de Kolmogorof-Smirnov (K-S). Para las variables categóricas se emplearon las frecuencias absolutas y relativas porcentuales. Para ver la asociación entre las concentraciones plasmáticas de vancomicina y nefrotoxicidad se empleó el test χ2 de Pearson. La valoración del efecto se realizó mediante la estimación de la razón de prevalencia (RP). Para conocer la correlación entre las concentraciones plasmáticas del fármaco y el incremento de concentración de creatinina sérica se empleó la prueba estadística Rho de Spearman. Todos los datos se analizaron con el programa SPSS versión 15.0. Se consideró que había diferencias estadísticamente significativas cuando la p fue inferior a 0,05.
RESULTADOS
Durante el período de estudio 46 pacientes requirieron determinaciones de concentración plasmática de vancomicina. Se excluyeron 6 pacientes por no cumplir los criterios de inclusión: 2 pacientes por encontrarse en hemodiálisis, 3 por presentar una muestra mal extraída y 1 por una duración de tratamiento inferior a tres días. La mediana de edad fue 77,5 años (66-84); 52,5% mujeres y 47,5% hombres. Los servicios que solicitaron determinar las concentraciones plasmáticas de vancomicina fueron, Medicina Interna (37,5%), Unidad de Cuidados Intensivos (12,5%), Neumología (12,5%), Cirugía (10%), Onco-Hematología (7,5%) y en el 20% restante de los pacientes otros servicios que incluían Nefrología, Radioterapia, Traumatología, Digestivo, Urología, Unidad de media-corta estancia. En la tabla 2 se reflejan las características de todos los pacientes incluidos en el estudio en función de si presentaron nefrotoxicidad a lo largo del tratamiento con vancomicina.
La incidencia de nefrotoxicidad en el estudio fue de 9 pacientes (22,5%).
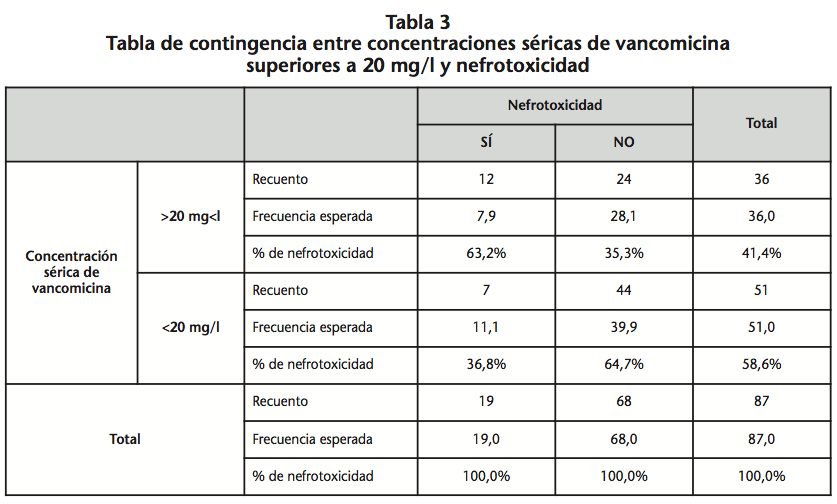
Al hacer una estimación del riesgo de presentar nefrotoxicidad en función de las concentraciones plasmáticas de vancomicina, observamos que los pacientes con concentraciones séricas valle de vancomicina superiores a 20 mg/l presentaron 2,4 veces más riesgo de sufrir nefrotoxicidad (IC 95%: 1,1-5,6) que los que presentaron una concentración plasmática inferior a 20 mg/l. Ver tabla 3.
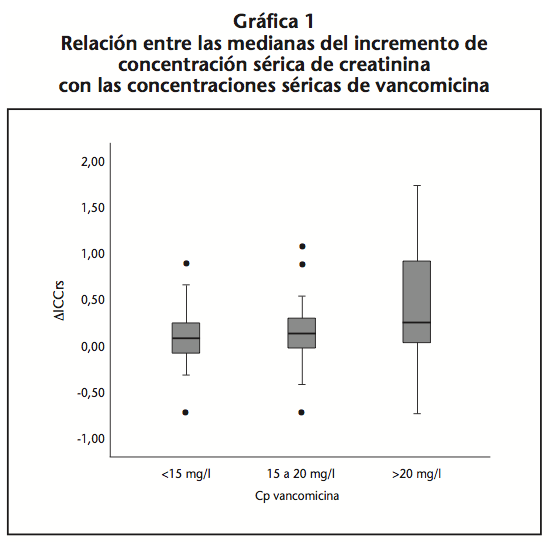
Sin embargo al relacionar las medianas del incremento de concentración sérica de creatinina en los diferentes rangos de concentraciones séricas de vancomicina, tal como se muestra en la gráfica 1, no se observaron diferencias significativas.
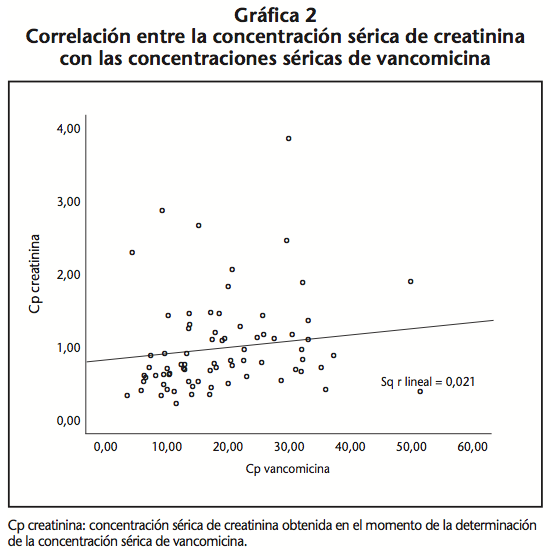
Se obtuvo una correlación estadísticamente significativa (p<0,05) entre las concentraciones plasmáticas de vancomicina y la concentración sérica de creatinina obtenida en cada uno de los niveles solicitados (Gráfica 2).
En total se obtuvieron 87 determinaciones de concentración plasmática valle de vancomicina durante el año de estudio. Las recomendaciones se basaron en las concentraciones plasmáticas de fármaco obtenidas, el tipo de infección y las características fisiopatológicas del paciente y se consideraron como niveles superiores a los requeridos en un 48,3% de las determinaciones solicitadas, en el 78,6% de los casos se aceptó la recomendación procediendo a un cambio para adecuar la posología. En un 12,6% se encontraron unas concentraciones plasmáticas de vancomicina inferiores al rango terapéutico, se les recomendó un incremento de dosis para obtener concentraciones plasmáticas en rango terapéutico y tuvo una aceptación del 81,8%. En un 39,1% de los pacientes las concentraciones plasmáticas se consideraron dentro del rango terapéutico recomendándose una continuación de tratamiento a igual pauta posológica que se llevo a cabo en el 94,1%.
DISCUSIÓN
La incidencia de nefrotoxicidad encontrada en este estudio es de un 22,5%. Este dato se encuentra dentro del intervalo reflejado en un metanálisis16 reciente que abarca todos los estudios publicados hasta la fecha relacionado con la utilización de vancomicina y la incidencia de nefrotoxicidad. En dicho metanálisis se encuentra una correlación entre dosis diarias mayores de 4G al día4,7, concentraciones plasmáticas valle de vancomicina superiores a 15 mg/l y duración de tratamiento superior a 7 días, con un incremento de nefrotoxicidad4,11, sin embargo los resultados de los diferentes estudios incluidos en este metanálisis son variables y la incidencia de nefrotoxicidad oscila de un 5%-43%16.
Al analizar los principales factores implicados en la aparición de este efecto adverso en este estudio, se observó que solo 2 pacientes de los que presentaron nefrotoxicidad tenían unas concentraciones plasmáticas de vancomicina inferiores a 15 mg/l y 3 pacientes habían presentado una duración de tratamiento inferior a 7 días.
En este estudio hemos observado que con una concentración plasmática valle de vancomicina superior a 20 mg/l existe un incremento de 2,4 veces en el riesgo de nefrotoxicidad. No obstante el intervalo de confianza del 95% es amplio (1,1-5,6), lo que no permite obtener resultados concluyentes siendo necesario incrementar el tamaño muestral.
Al comparar la mediana del incremento de creatinina en función de las concentraciones séricas de vancomicina no se han encontrado diferencias estadísticamente significativas, pero sí se encuentra una gran dispersión en los incrementos de creatinina a concentraciones superiores a 20 mg/l.
La recta resultante de la correlación de las concentraciones plasmáticas de vancomicina con las concentraciones séricas de creatinina medidas en ese mismo instante no permite explicar más que un 27% (r2=0,277) de la variabilidad de las concentraciones de creatinina, probablemente debido a la existencia de otros factores de riesgo de nefrotoxicidad que no se han tenido en cuenta en este estudio, tales como medicación concomitante (aminoglucosidos, anfotericina B, inhibidores de la enzima convertidora de angiotensina (IECAS), bloqueantes de los receptores de la angiotensina II (ARA2) y agentes de contraste intravenoso) o fenómenos patológicos del paciente (diabetes, insuficiencia cardiaca I-IV, hipertensión, EPOC, insuficiencia hepática y/o renal, VIH, cirugía previa) que se han relacionado también con la incidencia de este evento adverso7,17,19,20.
De todo lo expuesto anteriormente se deduce que es difícil determinar el potencial nefrotóxico de la vancomicina. A pesar de que los pacientes con concentraciones plasmáticas superiores a 20 mg/l y una duración de tratamiento mayor a 7 días son más propensos a sufrir nefrotoxicidad, posiblemente también influyan otros factores de riesgo que potencian la aparición de este efecto adverso4,7. Estos datos coinciden con un ensayo clínico donde comparan ceftarolina fosamil con vancomicina en pacientes con infección de piel y partes blandas. La incidencia de nefrotoxidad asociada a vancomicina en estos pacientes fue de 1,3% (tan solo 0,9% mayor que en el grupo de ceftarolina). Esta baja incidencia de nefrotoxicidad la atribuyen a que los pacientes del ensayo raramente se encontraban en UCI, generalmente presentaban concentraciones plasmáticas valle de vancomicina menores de 10 mg/l y la duración del tratamiento fue menor de 10 días en la mayoría de los casos21. Algunos autores concluyen que la probabilidad de presentar nefrotoxicidad sin esos factores de riesgo adicionales es mínima11,20, lo que coincide con los resultados obtenidos en este estudio. Al igual que consideran otros autores11, la vancomicina continúa siendo una opción adecuada en el manejo de los pacientes con infecciones graves que requieren alcanzar concentraciones plasmáticas en torno a 15-20 mg/l e incluso hasta 25 mg/l, siempre y cuando se monitoricen las concentraciones plasmáticas de vancomicina y la función renal, así como otros factores de riesgo que puedan estar asociados a nefrotoxicidad, ajustando la dosis a la situación fisiopatológica de cada paciente.
Es satisfactorio encontrar un alto grado (85%) de aceptación por parte de los clínicos de las recomendaciones realizadas en base a los datos analíticos facilitadas por el Servicio de Farmacia. En el estudio publicado por Darko W. et al. consideran la monitorización de vancomicina y el ajuste posológico coste-efectivo, en concreto en pacientes que reciben otros fármacos nefrotóxicos y en el subgrupo de pacientes ingresados en UCI22.
Los resultados sugieren nuevas vías de investigación ya que éstos no son concluyentes debido a las limitaciones del estudio tanto en el tamaño muestral como en la no identificación de factores de riesgo de nefrotoxicidad descritos anteriormente.
Conflicto de intereses: Los autores declaran no tener conflictos de intereses.
Bibliografía
Spanish Agency for Medicines and Health Products. Vancomicina Actvis® Data Sheet [internet]. Madrid. AEMPS. c2012Jul [Update 2012 Dec, cited 2014 Feb] Available from: http://www. aemps.gob.
WHOCC- ATC/DDD Index [Internet]. [cited 2014 feb 28]; Available from: http://www.whocc.no/atc_ ddd_index/.
Mensa J, Gatell JM, García-Sánchez JE, Letang E, López-Suñé E, Marco F. Guía de terapéutica antimicrobiana 2011;182-3.
Elyasi S, Khalili H, Dashti-Khavidaki S, Mohammadpour A. Vancomycin-induced nephrotoxicity: mechanism, incidence, risk factors and special populations. A literature review. Eur J Clin Pharmacol. 2012;68:1243-55.
Cataldo ML, Tacconelli E,Grilli E, Pea F, Petrosillo N. Continuous versus intermittent infusion of vancomycin for the treatment of Gram-positive infections: systematic review. Journal of Antimicrobial Chemotherapy. 2012;67:17-24.
Cohen E, Dadashev A, Drucker M, Samra Z, Rubinstein E, Garty M. Once-daily versus twice-daily intravenous administration of vancomycin for infections in hospitalized patients. J. Antimicrob. Chemother. 2002;49:155-60.
Lodise TP, Lomaestro B, Graves J, Drusano GL. Larger vancomycin doses (at least four grams per day) are associated with an increased incidence of nephrotoxicity. Antimicrob. Agents Chemother. 2008;52(4):1330-6.
Rybak M, Lomaestro B, Rotschafer JC, Moellering R, JR, Craig W, Billeter M, Dalovisio JR, Levine DP. Therapeutic monitoring of vancomycin in adult patients: a consensus review of the American Society of Health-System Pharmacists, the Infectious Diseases Society of America, and the Society of Infectious Diseases Pharmacists. Am. J. Health Syst. Pharm. 2009;66:82-98.
- Rybak MJ. The pharmacokinetic and pharmacodynamic properties of vancomycin. Clin. Infect. Dis. 2006; 42(Suppl 1):S35-S39.
- Winter ME. Vancomycin. In: Basic Clinical Pharmacokinetics. Fifth Edition. Philadelphia. Baltimore: Lyppincott Willians & Wilkins; 2010. P.459-487.
- Hazlewood KA, Brouse SD, Pitcher WD, Hall RG. Vancomycin-associated nephrotoxicity: grave concern or death by character assassination? Am J Med. 2010; 123:182.
- Álvarez-Lerma F, Grau S, Marín Casino M, Olaechea P, Sánchez M, Martín E, et al. Monitorización de concentraciones plasmáticas de antibióticos en hospitales españoles. Enferm Infecc Microbiol Clin. 2006;24 (1):14-19.
- Álvarez-Lerma F, Olaechea P, Grau S, Marín M, Domínguez A, Martínez-Lanao J, et al. Recomendaciones para la monitorización de antibióticos en pacientes críticos ingresados en UCI. Enferm Infecc Microbiol Clin. 2008;26(4):230-9.
- Uptodate. Drew, RH. Vancomycin dosing and serum concentration monitoring in adults (Internet). North Carolina (EEUU). Uptodate Waltham [updated 2014 Feb 21, cited 2013 Ene 10]. Available from: http:// www.uptodate.com/.
- Bauer LA. Vancomycin. In: Applied Clinical Pharmacokinetics. Second Edition. United States of America: McGraw-Hill Companies; 2008. P. 207-298.
- Van Hal SJ, Paterson DL, Lodise TP. Systematic Review and Meta-Analysis of Vancomycin-Induced Nephrotoxicity Associated with Dosing Schedules That Maintain Troughs between 15 and 20 Milligrams per Liter. Antimicrob. Agents Chemother. 2013;57(2):734-44.
- Minejima E, Choi J, Beringer P, Lou M, Tse E, Wong-Beringer A. Applying new diagnostic criteria for acute kidney injury to facilitate early identification of nephrotoxicity in vancomycin-treated patients. Antimicrob. Agents Chemother. 2011;55:3278-83.
- Lodise TP, Patel N, Lomaestro BM, Rodvold KA, Drusano GL. Relationship between initial vancomycin concentration-time profile and nephrotoxicity among hospitalized patients. Clin. Infect. Dis. 2009;.49:507-14.
- Bosso JA, Nappi J, Rudisill C, Wellein M, Bookstaver PB, Swindler J, et al. Relationship between vancomycin trough concentrations and nephrotoxicity: a prospective multicenter trial. Antimicrob. Agents Chemother. 2011;55:5475-9.
- Pritchard L, Baker C, Leggett J, Sehdev P, Brown A, Bayley B. Increasing vancomycin serum trough concentrations and incidence of neprhotoxicity. Am J Med. 2010;123(12):1143-9.
- Corrado ML. Integrated safety summary of CANVAS 1 and 2 trials: phase III, randomized, double-blind studies evaluating ceftaroline fosamil for the treatment of patients with complicated skin and skin structure infections. J. Antimicrob. Chemother. 2010. 65(Suppl 4):iv67–iv71.
- Elting LS, Rubenstein EB, Kurtin D, Rolston KV, Fangtang J, Martin CG, Raad II, Whimbey EE, Manzullo E, Bodey GP. Mississippi mud in the 1990s: risks and outcomes of vancomycin-associated toxicity in general oncology practice. Cancer. 1998;83:2597-607.
____