Díaz Madriz J1, Garro Zamora L2
1 Farmacéutico Clínico
2 Farmacéutico
Hospital Clínica Bíblica. San José (Costa Rica)
____
Rev. OFIL 2016, 26;4:314-321
Fecha de recepción: 27/09/2015 – Fecha de aceptación: 08/08/2016
____
Correspondencia:
José Díaz Madriz
Hospital Clínica Bíblica
San José, Central, entre calle central y primera, avenida 14 y 16
1307-1 San José (Costa Rica)
Correo electrónico: jp.diazm27@gmail.com
____
Resumen
Introducción: La falta de desarrollo de nuevos antibióticos y el alarmante incremento de la resistencia bacteriana ha obligado a la búsqueda de nuevas estrategias terapéuticas con los agentes utilizados tradicionalmente, principalmente en pacientes críticos. La infusión extendida de antibióticos, es una alternativa que ha sido ampliamente analizada en la última década. Los estudios se han enfocado en antibióticos β-lactámicos y en la vancomicina debido a sus características farmacocinéticas y farmacodinámicas.
Métodos: Esta revisión contiene publicaciones obtenidas de bases de datos como PUBMED, IDIS y ScienceDirect, con el fin de mostrar la información más relevante y actualizada, necesaria para la toma de decisiones relacionadas a este tema.
Resultados: A través de estudios clínicos no ha sido posible demostrar un beneficio absoluto del uso de infusiones extendidas de betalactámicos y vancomicina, sin embargo, la evidencia muestra una tendencia al alcance de parámetros de efectividad farmacodinámicos y farmacocinéticos en algunos grupos de pacientes críticos con infecciones nosocomiales causadas por bacterias multidroga-resistentes.
Conclusión: Según la evidencia de los estudios analizados y el hecho de que las infusiones extendidas son al menos tan efectivas como las infusiones intermitentes, el uso de este tipo de estrategias en pacientes críticos podría ser beneficioso. Idealmente, estas prácticas deben de desarrollarse bajo la supervisión de los Programas de Optimización de Antimicrobianos (Antimicrobial Stewardship Programs). Además, es necesario que se lleve a cabo mayor investigación en este tema.
Palabras clave: Antibióticos, infusión extendida, infusión continua, infusión prolongada, β-lactámicos, vancomicina, Antimicrobial Stewardship Programs.
____
INTRODUCCIÓN
Los antibióticos de amplio espectro están indicados en el tratamiento de infecciones severas. Sin embargo, el alto grado de resistencia a antibióticos por parte de microorganismos, en conjunto con la escasa investigación de nuevas moléculas, ha provocado la búsqueda de nuevas estrategias terapéuticas para mejorar tanto su eficacia clínica como la tolerabilidad1-5.
Para ello, se buscó optimizar los parámetros y metas farmacocinéticas y farmacodinámicas a través de la modificación de la dosificación, así como el método de administración con el fin de adaptarse tanto al paciente como al patógeno, maximizar los resultados, minimizar toxicidad y desarrollo de resistencia1,3-5.
Los antibióticos se han clasificado farmacodinámicamente según su efecto para provocar muerte bacteriana y según su efecto post antibiótico. En relación a la muerte bacteriana se dividen en: antibióticos tiempo-dependientes y antibióticos concentración-dependientes3. En los tiempo-dependientes, la eficacia depende del tiempo en que el porcentaje acumulativo del fármaco esté por encima de la concentración mínima inhibitoria (MIC) del microorganismo en un periodo de 24 horas, de forma abreviada se conoce como T>MIC4.
Estudios preclínicos y clínicos han demostrado que el tiempo en el cual la fracción no unida a proteína del antibiótico está por encima de la MIC, (fT>MIC) es el mejor indicador de efecto bactericida de los antibióticos tiempo-dependientes (p.ej, betalactámicos). La fT>MIC requerida para obtener el máximo efecto bactericida cambia según el tipo del fármaco1,2,6.
Para alcanzar de manera adecuada concentraciones plasmáticas (Cp) por encima de la MIC, la frecuencia de dosificación tiene un papel importante. La infusión intermitente (II) alcanza concentraciones pico altas y concentraciones valle bajas, lo cual puede llevar al riesgo de que las Cp estén debajo de la MIC, situación que fomenta el recrecimiento bacteriano durante el intervalo de dosificación (ver Figura 1)6,7.
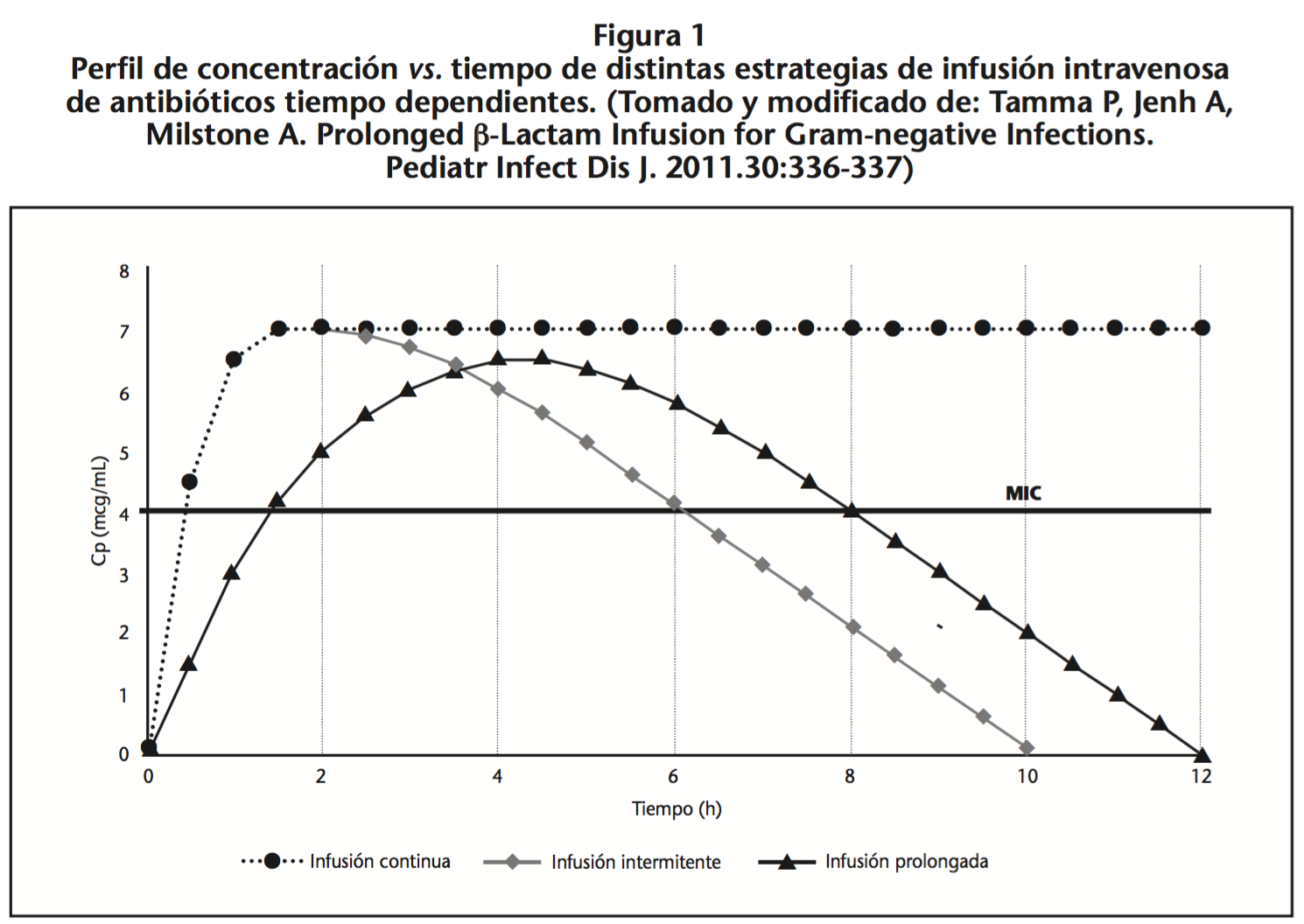
Análisis de farmacocinética clínica han mostrado cómo las infusiones extendidas (IE) definidas como infusiones prolongadas (IP) e infusiones continuas (IC) de antibióticos beta-lactámicos incrementan la posibilidad de mantener las Cp por encima de la MIC por más tiempo dentro de un periodo de 24 horas4. De ahí que algunos estudios prospectivos y retrospectivos han demostrado una mejoría en los índices de cura clínica, tiempo de hospitalización y mortalidad, versus II. Sin embargo, esta evidencia se ha reflejado principalmente en subgrupos de pacientes críticos, en Unidad de Cuidados Intensivos (UCI) o con infecciones por patógenos multirresistentes8. Con tal de unificar los términos de infusiones y sus objetivos terapéuticos, se define:
– Concentración Pico: la concentración más alta alcanzada o estimado en el compartimiento de referencia10.
– Concentración Valle: se refiere a la concentración plasmática más baja alcanzada por el antibiótico, generalmente se obtiene previo a la dosis siguiente a administrar10.
– Efecto post-antibiótico: período de supresión del crecimiento bacteriano después de la exposición corta de los organismos frente a un antibiótico10.
– Infusión intermitente (II): solución a infundir en un periodo de 15 a 120 minutos2.
– Infusión continua (IC): se utiliza un período de tiempo de 12 a 24 horas2,9.
– Infusión prolongada (IP): es la administración del antibiótico que se realiza en un periodo de tiempo más largo de lo habitual (2 a 4 horas), con el fin de emular los niveles séricos de una IC. Esta forma de administración disminuye las fluctuaciones propias de la administración “en bolo” o de la infusión intermitente1-5.
– % fT>MIC: es el porcentaje de tiempo en el cual antibiótico no unido a proteína está por encima de la MIC1,10.
– “Probability of target attainment” (PTA): es el valor de la probabilidad de unión al blanco específico alcanzado a cierta MIC (por ejemplo, 30% fT>MIC; fAUC/MIC de 100), se determina mediante un modelo farmacocinético de poblaciones (estudio teórico) conocido como “simulaciones de Monte Carlo”1,10.
– Simulaciones de Monte Carlo: son modelos estadísticos usados para aproximar expresiones matemáticas complejas, que si acoplan datos farmacocinéticos y farmacodinámicos (FC/FD) de antibióticos, permiten establecer mediante valores de probabilidad, una relación entre los parámetros farmacocinéticos del antibiótico en el paciente y su respectiva susceptibilidad al patógeno6,10.
La razón de administrar los antibióticos por IP o IC es mantener sus Cp de manera constante y sostenida por encima de la MIC. Esta administración podría obtener resultados esperanzadores en antibióticos tiempo-dependientes, siempre que no implique una mayor aparición de efectos adversos y se dé un manejo apropiado, según las respectivas propiedades farmacocinéticas de estas soluciones3,5.
Metodología
Se recopilaron las publicaciones de los años 1995-2015 de las bases de datos PUBMED, IDIS y ScienceDirect, de acuerdo a las palabras clave: antibiotics, extended infusion, continuous infusion, prolonged infusion, beta-lactams, vancomycin, Antimicrobial Stewardship Programs.
Resultados
Antibióticos beta-lactámicos
Los antibióticos beta-lactámicos son “tiempo-dependientes”. La eficacia de los beta-lactámicos no depende de sus Cmax, sino del tiempo en el cual su Cp supere la MIC entre dos administraciones sucesivas (T>MIC). Por ende, una concentración mantenida en el tiempo mediante una IC sería la idónea para optimizar su eficacia1,4,5.
Para la mayoría de infecciones severas, las cefalosporinas y penicilinas requieren amplias razones de fT>MIC (>50%) para exhibir efecto bactericida, aunque en algunos casos se ha recomendado alcanzar incluso fT>MIC (∼100%). Por ello es razonable administrar cefepime, ceftazidima y piperacilina/tazobactam por IC o IP. Sin embargo, los carbapenémicos por su corta estabilidad a temperatura ambiente, solamente se recomiendan en infusiones prolongadas (<4 horas)2.
Cefepime
Cefepime es una cefalosporina de cuarta generación con actividad contra gram-positivos y gram-negativos como Pseudomonas aeruginosa y Acinetobacter baumanni. El mismo es recomendado en el tratamiento empírico de infecciones severas en UCI11,12.
La evidencia clínica es limitada en relación a IP, por lo que esto representa una restricción para la implementación de esta estrategia terapéutica. Se conoce que la utilización de IP de cefepime aumenta la posibilidad de alcanzar la PTA. Un estudio realizado con bacterias gram-negativas con MIC de 8 µg/mL, describió que dosis de 1-2 g cada 8 horas en IP durante 4 horas podría requerirse para proveer la exposición farmacodinámica ideal, definido con una PTA o CFR mayor o igual al 60%4,11,12. También se han realizado modelos de simulación de Monte Carlo comparando los resultados de regímenes de II versus IP utilizando información referente a MIC de pacientes de diversas poblaciones (incluyendo, hospitalizados, críticos y/o paciente con neumonía asociada a ventilador –NAVM–). Los resultados de estos estudios reportan de manera consistente que las IP maximizan la probabilidad de alcanzar la PTA11.
Nicasio y colaboradores evaluaron la reducción en el tiempo de tratamiento utilizando IP de 3 horas de cefepime en dosis de 2 g cada 8 horas más vancomicina y tobramicina (ambos en infusión estándar) respectivamente, como parte de un protocolo para NAVM en UCI. Al compararlo con pacientes que recibieron el tratamiento en II se obtuvo una reducción estadísticamente significativa en el tiempo de tratamiento (24 vs. 11 días, p<0,001). Sin embargo, se analizó un posible sesgo en la interpretación de los resultados, ya que además de aumentar el tiempo de infusión se estandarizó la manera de tratar a los pacientes para esta infección, por lo que no fue posible afirmar que la reducción se deba solo al efecto de la IP11.
Bauer et al. realizaron un estudio unicéntrico, retrospectivo que comparó la IP de cefepime versus II en pacientes con bacteremia o neumonía con cultivo positivo en sangre o en vías respiratorias para P. aeruginosa; el mismo demostró con significancia estadística que la mortalidad global para el grupo que utilizó IP versus II fue menor (3% vs. 20%, p=0,03) así como la estancia en UCI de los pacientes utilizando IP (8 días vs. 18,5 días, p=0,04)13. En síntesis, las IP de cefepime maximizan la probabilidad de alcanzar la PTA solamente en pacientes con Clcr mayor a 50 mL/min y para patógenos con una MIC para cefepime de 4-32 µg/mL4.
En el caso de las IC, estudios recientes sugieren que la IC de cefepime obtiene mejores resultados clínicos de pacientes críticos con infecciones graves que requieren tratamientos antibióticos de 4 días o más. Datos de un meta-análisis encontraron una menor tasa de fracaso clínico en los pacientes que recibieron antibióticos por IC en comparación con los que recibieron II del mismo antibiótico14.
Huang y colaboradores elaboraron un estudio retrospectivo, no aleatorizado, que comparó 68 pacientes con infecciones intracraneales post- neurocirugía tratados con 4 g/día de cefepime en IC (con dosis de carga 0,5 g en 30 minutos) versus 2 g cada 12 horas en II durante 30 minutos (en el estudio no se especifica razón para definir esta frecuencia de administración), arrojando resultados favorables a IC respecto al control de la infección (6,6±1,9 días vs. 7,8±2,6 días; p=0,036). Respecto a la farmacocinética, la media calculada de AUC24 para el grupo de IC fue mayor que en el grupo de II (220,56±13,59 µg h/mL vs. 86,34±5,69 µg h/mL; p=0,003). Por lo tanto, el cefepime en IC mejoró significativamente el efecto antibacteriano y redujo la duración del tratamiento en los pacientes15.
Ceftazidima
Esta cefalosporina de tercera generación, es comúnmente utilizada como tratamiento empírico en infecciones causadas por aerobios gram-negativos (p.ej, P. aeruginosa, Enterobacter cloacae, Escherichia coli, Haemophilus influenzae, Klebsiella pneumoniae) tales como tracto respiratorio inferior, piel, tracto urinario, hueso, articulaciones, intraabdominal y del sistema nervioso central6. Resultados de estudios recientes sugieren que la IC de ceftazidima beneficia las poblaciones de pacientes críticos con infecciones graves que requieren cursos de antibióticos mayor o igual a 4 días3.
En el caso de población pediátrica, se documenta un estudio de 14 pacientes diagnosticados con fibrosis quística (edad promedio=12,6 años) infectados por Pseudomona aeruginosa utilizando una combinación fija con amikacina (20 mg/kg/día). El estudio comparó la II de ceftazidima de 200 mg/kg en 3 dosis divididas, versus IC a dosis de 100 mg/kg/día; como conclusión no se encontró ningún beneficio clínico estadísticamente significativo entre ambos tipos de infusión, sin embargo los autores mencionan que la utilización podría tener beneficios coste-efectivos, así como en calidad de vida, de pacientes tratados en el hogar6.
Desde el punto de vista farmacoeconómico se ha puesto en evidencia a la ceftazidima como una buena alternativa coste-efectiva en el tratamiento de neumonías nosocomiales en UCI, referente a los costes asociados a su uso; siendo por tanto una opción válida ante la equivalencia clínica que presenta la IC de este antibiótico respecto a la II16,17.
Prueba de ello fue el análisis realizado por Nicolau y colaboradores, quienes en un estudio (n=41) abierto, prospectivo, aleatorizado compararon la eficacia clínica y microbiológica de la IC (3 g diarios) versus la II (2 g cada 8 horas), de la ceftazidima, más una dosis diaria de tobramicina, en neumonía nosocomiales en UCI. Se obtuvieron resultados de eficacia clínica similares, [IC 16/17 (94 %), II 15/18 (83%)] y microbiológica [IC 10/13 (76%), II 12/15 (80)] sin arrojar diferencias estadísticamente significativas17.
Carbapenémicos
Meropenem
Este carbapenémico es de los que se cuenta con mayor experiencia clínica. Se ha logrado demostrar mediante modelos farmacocinéticos que las IP mejoran la probabilidad de alcanzar valores superiores de PTA en pacientes críticos con distintas condiciones renales18. Crandon y colaboradores demostraron que a MICs de hasta 8 mg/L, la probabilidad de alcanzar el 40% fT=MIC fue mayor para IP de 3 horas (96, 90 y 61% respectivamente), en el caso de II, la PTA fue de 75, 65 y 44%. Estos valores fueron respectivos a la dosis administrada (2 g cada 8 horas, 1 g cada 8 horas y 1 g cada 12 horas). El esquema de dosificación fue ajustado según la función renal de los pacientes (ClCr=50 mL/min, 30-49 mL/min y 10-29 mL/min, respectivamente)19.
Se han realizado otros estudios farmacocinéticos basándose en estudios clínicos que incluyeron pacientes con infecciones intraabdominales, neumonía adquirida en la comunidad y NAVM, en los que se encontraron que a MICs de 4 mg/mL, prolongar el tiempo de infusión de 30 min a 3 horas para 1 gramo de meropenem incrementa la PTA (40% fT=MIC) de un 64% a un 90%14.
La infusión de 3 horas también demostró ser superior que el bolo intravenoso (IV). En un estudio de dosis única de meropenem en sujetos sanos una infusión de 3 horas de 1 g o 500 mg de meropenem alcanzaron mayores rangos de %T=MIC (rango 47-86%) para MICs de 1-4 mg/L, que un bolo de 1 g de meropenem (rango 43%-67%)19.
En 2009 se evaluó la farmacocinética de meropenem en 38 neonatos (23 a pretérmino, 15 a término) utilizando simulaciones de Monte Carlo. Los parámetros de cada grupo de estudio se utilizaron para examinar diversas dosis (20 y 40 mg/kg), los intervalos de dosificación (8 y 12 horas), y los tiempos de infusión (0,5 y 4 horas); el objetivo en esta simulación era alcanzar el 40% de T>MIC. El mejor efecto bactericida fue alcanzado por el uso de IP (4 horas) en comparación con II. Tanto en niños prematuros como a término, la utilización de IP de 4 horas (40 mg/kg) fue más efectiva, especialmente para los microorganismos más resistentes6.
Respecto al actual peligro referente a resistencia antibiótica causadas por Enterobacteriaceae productoras de carbapenemasas, se ha sugerido que en infecciones causadas por Klebsiella pneumoniae productora de carbapenemasas con un MIC hasta 4 mg/L todavía se puede tratar con antibióticos carbapenémicos si se dan en una IP y un mayor régimen de dosificación5.
Imipenem-cilastatina
A la fecha existen pocos estudios y datos relacionados con la administración por IP de imipenem debido a que es relativamente inestable a temperatura ambiente (25°C). Se describe que un 10% de la solución de imipenem se degrada después de 4 horas, lo cual puede conducir a una baja Cp20.
La IP de imipenem obtiene mayor beneficio terapéutico y optimiza la exposición al patógeno en pacientes con MIC cercanas a 4 μg/mL22. Los datos de estudios clínicos disponibles tanto en voluntarios sanos como en los pacientes con NAVM que recibieron 2h de IC con el régimen de 1g cada 6h resultó en un mejor fT>MIC (51,6±5,4%)4. Similares resultados obtuvieron Sakka y colaboradores en un estudio controlado aleatorizado de pacientes con neumonía nosocomial admitidos en UCI que comparó una IC a dosis bajas de imipenem versus II; en ambos brazos se alcanzó la PTA en un 100% por lo cual no se puede concluir diferencia significativa en términos de eficacia21.
Lee y colaboradores realizaron un estudio de fase 4, aleatorizado, cruzado (n=18) en el cual compararon mediante simulaciones de Monte Carlo la PTA alcanzada mediante IP o II de imipenem-cilastatina y meropenem, se demostró que la IP de ambos carbapenémicos aumenta la PTA sobre varios microorganismos incluyendo E. coli, Klebsiella sp y P. aeruginosa18.
Penicilinas
Piperacilina-tazobactam
Piperacilina-tazobactam es una combinación antibiótica de amplio espectro utilizada para tratar infecciones graves en UCI22. Datos recientes han mostrado que la IP es al menos equivalente a las estrategias de II. Además en pacientes críticos (APACHE II=17) con infección con P. aeruginosa se ha visto disminuida la mortalidad a 14 días (12,2 vs. 31,6%, p=0,04) y el tiempo medio de hospitalización (21 días vs. 38 días, p=0,02)23.
En un meta-análisis realizado en 2012, el cual recopiló los datos de 14 estudios (1.229 pacientes en total), se determinó que la mortalidad fue menor en pacientes que recibieron tanto IP (3 horas) o IC (24 horas) de carbapenémicos y piperacilina-tazobactam versus II, (RR=0,59; IC 95%, 0,41-0,83). Además pacientes que sufrieron neumonía obtuvieron una menor mortalidad al recibir IC e IP versus la II. (RR=0,50; IC 95%, 0,26-0,96). Sin embargo no demostró diferencia estadísticamente significativa de mejoría clínica total respecto a la utilización de IP o IC versus II RR = 1,11 ( IC 95%, 0,95-1,31), ni en presentación de efectos adversos3.
En un estudio controlado, multicéntrico, doble ciego, aleatorizado (n=60) comparó las diferencias clínicas entre meropenem y piperacilina-tazobactam, demostró que el grupo de IC se benefició con una curación clínica más rápida que en II (70 vs. 43%; p=0,037), sin embargo la estancia en UCI no fue menor en términos significativos alcanzando ciertamente mayores Cp24.
Finalmente una revisión sistemática realizada por Yusuf et al., determinó que los estudios de farmacocinética y farmacodinamia (FC/FD) de piperacilina-tazobactam proporcionan un nivel de evidencia positivo y moderado de los resultados clínicos en los pacientes críticos en IP por encima de la II, por tanto recomiendan preferir la IP en pacientes en estado crítico. Esta conclusión se basa en los resultados de un estudio aleatorizado controlado y 4 estudios de cohorte22.
Implicaciones clínicas beta-lactámicos
Según el meta-análisis realizado por Shiu y colaboradores para la base de datos Cochrane, la evidencia clínica disponible en pacientes en estado crítico no muestra un beneficio concluyente y significativa a favor de la IC e IP, referente a disminuir mortalidad (n=1,241 RR=0,89 [0,67-1,20]), recurrencia de la infección (n=398 RR=1,22 [0,35-4,19]) o cura clínica (n=975, RR 1,04 [0,95 a 1,13])9.
Se plantea que esto se debe al hecho de que la IC e IP sólo se dirige a subpoblaciones de pacientes para los que II es incapaz de lograr una adecuada T>MIC. Estas subpoblaciones son de pacientes con infecciones causadas por organismos con poca susceptibilidad a antibióticos, con alteraciones en la eliminación del medicamento o con un aumento en el volumen de distribución, y posiblemente en pacientes inmunodeprimidos. Las mismas son difíciles de incluir homogéneamente en los estudios, así como las patologías subyacentes y antibióticos concomitantes que pueden causar sesgo en los estudios5.
Vancomicina
La vancomicina, como los β-lactámicos, posee un ligero efecto bactericida tiempo-dependiente en experimentos in vitro. Sin embargo a diferencia de este grupo de fármacos, posee un moderado efecto post-antibiótico; por ello es importante para la efectividad clínica que la concentración sérica esté por encima sobre la MIC todo el tiempo5,25.
Otra diferencia respecto a los beta-lactámicos es parámetro de eficacia; con la vancomicina se prefiere utilizar la razón AUC24/MIC, en la infusión continua, la AUC24 es simplemente el producto de la concentración sérica por 24. Lo anterior se basa en estudios sobre la relación AUC24/MIC requerida, esto significa que se debe mantener un nivel plasmático estable de 14 a 18 veces el MIC para conseguir una eficacia óptima26.
Estudios clínicos de IC de vancomicina
En un estudio prospectivo aleatorizado que evaluó 119 pacientes con infección severa por Staphylococcus no observó mejora del resultado terapéutico en los pacientes que recibieron IC de vancomicina. También, se comparó la seguridad y el coste de IC frente a la II de vancomicina, el resultado fue similar entre los dos regímenes, sin embargo se alcanzaron Cp más rápidamente que en II, hubo una menor variabilidad de los valores AUC24, y los costes fueron menores con la IC27.
Otro estudio observacional, retrospectivo de tipo cohorte (n=129), reportó menores tasas de mortalidad en pacientes con NAVM al recibir vancomicina en IC (25% vs. 55%). Además se confirmó con un análisis de regresión múltiple de los datos que la administración por IC se asoció con una mejor supervivencia. Desafortunadamente, ese estudio no fue diseñado primordialmente para comparar la IC de la II, ya que sus objetivos eran determinar la incidencia y factores de riesgo en desarrollar fallo renal agudo durante la IC de vancomicina25.
La nefrotoxicidad es de vital importancia en la toma de decisión respecto al régimen de vancomicina; estudios sugieren que la IC puede enlentecer la aparición de nefrotoxicidad; datos de un meta-análisis reciente mostró que al comparar la IC del régimen convencional (II), la IC se asocia significativamente un menor riesgo en la nefrotoxicidad28-30.
Los datos actuales no muestran diferencias en los resultados clínicos entre los regímenes de IC e II, sin embargo para la vancomicina, en contraste con las beta-lactámicos, se ha visto que AUC24/MIC es el mejor parámetro FC/FD predictivo de la eficacia clínica ya que sólo depende del total de dosis administrada por día y de la función renal5. En comparación con la terapia convencional de II, el empleo del régimen de IC de vancomicina no promueve la mejoría clínica en el paciente. (Nivel de evidencia II, grado de recomendación A)9,24.
Lo anterior genera una pregunta, ¿cuáles son las razones de la elección de un régimen de IC? Wysocki et al. sugieren que la IC es más barata, logísticamente más conveniente para administrar y a la vez obtener niveles plasmáticos de vancomicina, alcanza concentraciones objetivo más rápido, y resulta en una menor variabilidad de la AUC24 respecto a la II5,26.
Utilización de dosis de carga asociado a infusiones extendidas
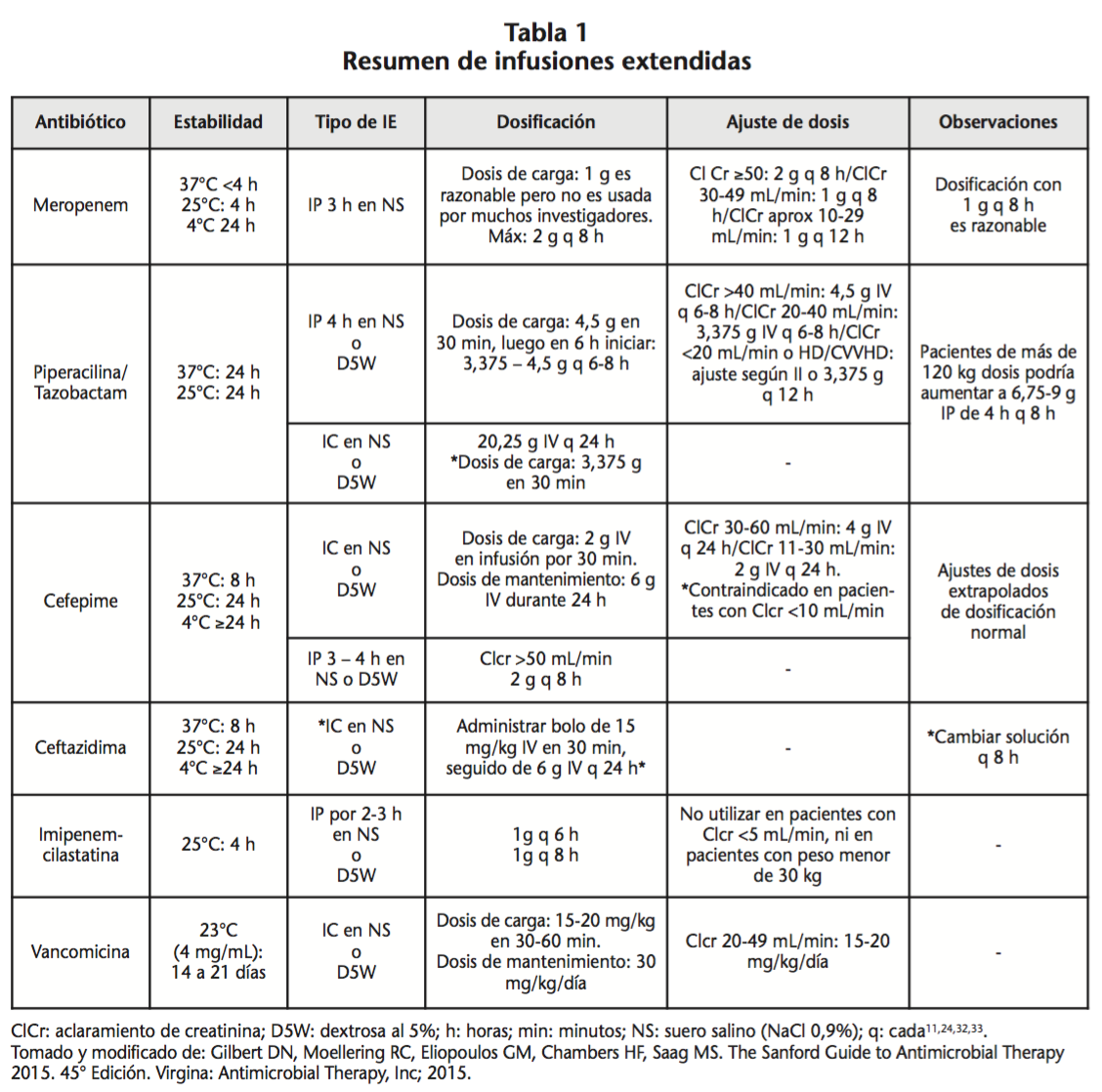
Utilizar la dosis de carga en un antibiótico busca alcanzar rápidamente las concentraciones plasmáticas del fármaco. En el contexto de este tema, la dosis de carga en IP e IC se utiliza para compensar el aumento del volumen de distribución tisular de los fármacos en los pacientes críticos30. En el caso de la vancomicina estudios demostraron la vital importancia de administrar la dosis de carga lo más rápido posible para obtener valores plasmáticos adecuados de manera más rápida y eficaz. De igual manera algunos β-lactámicos requieren este tipo de dosis (ver Tabla 1) para alcanzar los objetivos terapéuticos de manera más rápida31.
Desventajas de IC e IP
Uno de los mayores inconvenientes de la IC está relacionado con la estabilidad del antibiótico administrado, especialmente para los carbapenémicos, y las incompatibilidades con otros fármacos. En el caso de los carbapenémicos, se limita a su uso como IP (3-4 h), a menos que las soluciones se reemplacen regularmente o se mantengan las soluciones a temperatura de 4°C. Respecto a la ceftazidima, los problemas de inestabilidad serán importantes si la temperatura ambiente supera los 25°C, por lo que se requiere reemplazo frecuente (cada 8 h) de la solución, lo cual limita su uso1,5.
Un aspecto a tomar en cuenta es en el caso de utilizar bombas de infusión, se debe procurar la administración total de la solución, ya que en ocasiones puede sobrar líquido en el “espacio muerto” del dispositivo de infusión de hasta 22 mL en caso de soluciones de poco volumen (<100 mL). Asimismo, se recomienda realizar un lavado de la línea de infusión después de finalizado para evitar pérdidas de dosis del antibiótico31.
En la UCI, el problema de incompatibilidad (física o química) con otros fármacos se puede solucionar en parte a través del uso frecuente de catéteres venosos centrales con múltiples luces, utilizando uno exclusivo para la infusión del antibiótico31. Sin embargo, en una unidad de enfermería en que la mayoría de los pacientes tienen catéteres venosos periféricos estándar, puede convertirse en un problema. Como buena práctica de seguridad en el uso de medicamentos, Van Herendael et al. indican que los médicos deben ser advertidos previamente (idealmente por parte del Servicio de Farmacia o del Antimicrobial Stewardship) para evitar así posibles incompatibilidades antes de iniciar una IP o IC, con el fin de analizar las posibles alternativas a tomar en cuenta5.
Otra sugerencia refiere específicamente a los beta-lactámicos, que es el riesgo de toxicidad neurológica (p. ej, encefalopatía, convulsiones). Los beta-lactámicos son conocidos por causar tales efectos adversos, pero los estudios realizados en IC y diversos meta-análisis no han establecido una diferencia significativa en aparición de efectos adversos (n=575, RR 1,02 [0,94-1,12]) o en efectos adversos graves (n=871, RR 1,36 [0,80-2,30]). Sin embargo, el médico debe ser consciente de este riesgo, sobre todo si busca alcanzar altos niveles plasmáticos, debido a la presencia de un organismo con una MIC alta9.
Implicaciones de un Programa de optimización de antimicrobianos en IC e IP
En el año 2007, la Sociedad Americana de Enfermedades Infecciosas (IDSA, por sus siglas en inglés) y la Sociedad para la Salud Epidemiológica de América (SHEA, por sus siglas en inglés), publicaron las guías para el desarrollo institucional de los llamados “Antimicrobial Stewardship Programs” (Programas de optimización de antimicrobianos), los cuales abogan por el correcto uso de los antimicrobianos con el fin de lograr alcanzar los objetivos terapéuticos y a la vez reducir la resistencia, los costes y los efectos adversos asociados a estos medicamentos. Dentro de las actividades específicas a desarrollar que se recomiendan para estos programas está la optimización de dosis, donde se recomienda tomar en cuenta las características FC/FD del antibiótico, las características del paciente, el lugar de infección y el organismo patógeno. El desarrollo de protocolos donde se utilicen IP e IC de antibióticos, se monitorice la estabilidad de las soluciones, se ajuste dosis de acuerdo a aclaramiento renal y hepático, así como charlas educativas a los profesionales de salud son un claro ejemplo de una actividad importante a implementar4,34.
Conclusiones
La búsqueda de ventajas clínicas de las IP e IC seguirá en discusión. A pesar que los metaanálisis más recientes no favorecen su uso respecto a los resultados de beneficio clínico, ha sido posible evidenciar que al menos son tan efectivas como las II. Además existe evidencia a partir de estudios FC/FD que la administración por IC o IP de algunos antibióticos beta-lactámicos (p.ej, meropenem, piperacilina-tazobactam y cefepime) y vancomicina es superior a II para el logro de los objetivos FC/FD9,24.
Los programas de optimización de antimicrobianos se presentan como una opción adecuada para el asesoramiento y vigilancia de este tipo de regímenes de administración con el fin de obtener los mejores resultados clínicos y la menor incidencia de problemas asociados a la medicación del paciente.
Finalmente para obtener conclusiones más robustas y concretas; estudios futuros deben incluir poblaciones homogéneas como las II y además, un análisis FC/FD (incluyendo las MIC de los patógenos responsables y niveles plasmáticos de antibiótico) para saber qué pacientes alcanzan la PTA y cómo esto está relacionado con los regímenes de infusión y sus respectivos resultados. Se debe analizar más de cerca los resultados adicionales, como la duración de la estancia hospitalaria, curación clínica y mortalidad. Existen otras ventajas en favor de IC, por ejemplo, respecto a los costes económicos, los cuales se consideran menores en comparación con la II, ahora bien se requieren estudios farmacoeconómicos adicionales a futuro que permitan confirmar si existen otras razones para apoyar el uso de IC e IP9,10,27.
Conflicto de intereses: Los autores declaran no tener conflictos de intereses.
BIBLIOGRAFÍA
1. Vinks A, Derendor H, Mouton J, editors. Fundamentals of Antimicrobial Pharmacokinetics and Pharmacodynamics [Internet]. 1st ed. New York: Springer-Verlag New York; 2014. 1-467 p. Available from: http://www. springer.com/us/book/9780387756127#aboutBook.
2. The John Hopkins Antimicrobial Stewardship Program. Continuous Infusion of Antibiotics [Internet]. 2010 [cited 2014 Mar 20]. p. 1-3. Available from: http:// www.hopkinsmedicine.org/amp/includes/Continuous_and_Extended_Infusion_Beta_lactams.pdf.
3. Falagas ME, Tansarli GS, Ikawa K, Vardakas KZ. Clinical outcomes with extended or continuous versus short-term intravenous infusion of carbapenems and piperacillin/tazobactam: A systematic review and meta-analysis. Clin Infect Dis. 2013;56(2):272-82.
4. George JM, Towne TG, Rodvold K a. Prolonged infusions of β-Lactam antibiotics: Implication for antimicrobial stewardship. Pharmacotherapy. 2012;32(8):707-21.
5. Van Herendael B, Jeurissen A, Tulkens PM, Vlieghe E, Verbrugghe W, Jorens PG, et al. Continuous infusion of antibiotics in the critically ill: The new holy grail for beta-lactams and vancomycin? Ann Intensive Care [Internet]. Annals of Intensive Care; 2012;2(1):22. Available from: Annals of Intensive Care.
6. Walker MC, Man Lam W, Manasco KB. Continuous and Extended Infusions of -Lactam Antibiotics in the Pediatric Population (November). Ann Pharmacother. 2012;46:1537-46.
7. Tamma PD, Jenh AM, Milstone AM. Prolonged β-lactam infusion for Gram-negative Infections. Pediatr Infect Dis J. 2011;30(4):336-7.
8. Roberts J, Abdul-Aziz MH, Lipman J, Mouton JW, Vinks AA, Felton TW, et al. Individualised antibiotic dosing for patients who are critically ill: Challenges and potential solutions. Lancet Infect Dis. 2014;14(6):498-509.
9. Shiu J, Wang E, Tejani AM, Wasdell M. Continuous versus intermittent infusions of antibiotics for the treatment of severe acute infections. Cochrane database Syst Rev [Internet]. 2013;3(3):CD008481. Available from: http:// www.ncbi.nlm.nih.gov/pubmed/23543565.
10. Mouton JW, Dudley MN, Cars O, Derendorf H, Drusano GL. Standardization of pharmacokinetic/pharmacodynamic (FC/FD) terminology for anti-infective drugs: An update. J Antimicrob Chemother. 2005;55(5):601-7.
11. Nicasio AM, Ariano RE, Zelenitsky S a., Kim A, Crandon JL, Kuti JL, et al. Population pharmacokinetics of high-dose, prolonged-infusion cefepime in adult critically 111 patients with ventilator-associated pneumonia. Antimicrob Agents Chemother. 2009;53(4):1476-81.
12. Ham V, Arnold L, Ben L, George D. Integration of population pharmacokinetics, a pharmacodynamic target, and Microbiologic Surveillance Data to generate a rational empiriric dosing strategy for cefepine against P. aeruginosa. 2003. p. 291-5.
13. Karri B, Jessica W, James O´b, Debra G. Extended-Infusion Cefepime reduces mortality in patients with Pseudomona aeruginosa infections. Antimicrob Agents Chemother. 2013;57(7):2907-12.
14. Roberts JA, Paratz J, Paratz E, Krueger WA, Lipman J. Continuous infusion of beta-lactam antibiotics in severe infections: a review of its role. Int J Antimicrob Agents. 2007;30(1):11-8.
15. Huang H, Huang S, Zhu P, Xi X. Continuous versus intermittent infusion of cefepime in neurosurgical patients with post-operative intracranial infections. Int J Antimicrob Agents [Internet]. Elsevier B.V.; 2014;43(1):68-72. Available from: http://dx.doi.org/ 10.1016/j.ijantimicag.2013.08.019.
16. Aguilar L, Giménez MJ, Martín JE, Prieto J. Optimización farmacodinámica de la administración de ceftazidima frente a Pseudomonas aeruginosa: ¿Infusión continua o administración intermitente? Rev Esp Quimioter. 2005;18(1):21-5.
17. Nicolau DP, McNabb J, Lacy MK, Quintiliani R, Nightingale CH. Continuous versus intermittent administration of ceftazidime in intensive care unit patients with nosocomial pneumonia. Int J Antimicrob Agents. 2001;17(6):497-504.
18. Lee LS, Kinzig-Schippers M, Nafziger AN, Ma L, Sörgel F, Jones RN, et al. Comparison of 30-min and 3-h infusion regimens for imipenem/cilastatin and for meropenem evaluated by Monte Carlo simulation. Diagn Microbiol Infect Dis [Internet]. Elsevier Inc.; 2010;68(3):251-8. Available from: http://dx.doi.org/10.1016/j.diagmicrobio.2010.06.012.
19. Crandon JL, Ariano RE, Zelenitsky S a., Nicasio AM, Kuti JL, Nicolau DP. Optimization of meropenem dosage in the critically ill population based on renal function. Intensive Care Med. 2011;37(4):632-8.
20. Viaene E, Chanteux H, Servais H, Mingeot-Leclercq MP, Tulkens PM. Comparative stability studies of antipseudomonal β-lactams for potential administration through portable elastomeric pumps (home therapy for cystic fibrosis patients) and motor-operated syringes (intensive care units). Antimicrob Agents Chemother. 2002;46(8):2327-32.
21. Sakka SG, Glauner AK, Bulitta JB, Kinzig-Schippers M, Pfister W, Drusano GL, et al. Population pharmacokinetics and pharmacodynamics of continuous versus short-term infusion of imipenem-cilastatin in critically ill patients in a randomized, controlled trial. Antimicrob Agents Chemother. 2007;51(9):3304-10.
22. Yusuf E, Spapen H, Piérard D. Prolonged vs intermittent infusion of piperacillin/tazobactam in critically ill patients: A narrative and systematic review. J Crit Care [Internet]. Elsevier Inc.; 2014;29(6):1089-95. Available from: http://ac.els-cdn.com.sci-hub.org/ S088394411 4003220/1-s2.0-S0883944114003220-main. pdf?_tid=20c3704a-3537-11e4-b01e-00000aab 0f6c&acdnat=1409947341_ a9ab2acc69a5852c30c 337a5e7523d01.
23. Lodise TP, Lomaestro B, Drusano GL. Piperacillin-tazobactam for Pseudomonas aeruginosa infection: clinical implications of an extended-infusion dosing strategy. Clin Infect Dis. 2007;44(3):357-63.
24. Dulhunty JM, Roberts JA, Davis JS, Webb SA, Bellomo R, Gomersall C, et al. Continuous infusion of beta-lactam antibiotics in severe sepsis: A multicenter double-blind, randomized controlled trial. Clin Infect Dis. 2013;56(2):236-44.
25. Spapen HD, Janssen van Doorn K, Diltoer M, Verbrugghe W, Jacobs R, Dobbeleir N, et al. Retrospective evaluation of possible renal toxicity associated with continuous infusion of vancomycin in critically ill patients. Ann Intensive Care [Internet]. Springer Open Ltd; 2011;1(1):26. Available from: http://www.annalsofintensivecare.com/content/1/1/26.
26. James JK, Palmer SM, Levine DP, Rybak MJ. Comparison of conventional dosing versus continuous-infusion vancomycin therapy for patients with suspected or documented gram-positive infections. Antimicrob Agents Chemother. 1996;40(3):696-700.
27. Wysocki M, Delatour F, Faurisson F, Rauss A, Pean Y, Misset B, et al. Continuous versus intermittent infusion of vancomycin in severe staphylococcal infections: prospective multicenter randomized study. Antimicrob Agents Chemother [Internet]. 2001;45(9):2460-7. Available from: http://aac.asm.org/content/45/9/2460.short.
28. Di Filippo a., De Gaudio a. R, Novelli a., Paternostro E, Pelagatti C, Livi P, et al. Continuous infusion of vancomycin in methicillin-resistant staphylococcus infection. Chemotherapy. 1998;44(1):63-8.
29. Cataldo MA, Tacconelli E, Grilli E, Pea F, Petrosillo N. Continuous versus intermittent infusion of vancomycin for the treatment of gram-positive infections: Systematic review and meta-analysis. J Antimicrob Chemother. 2012;67(1):17-24.
30. Ingram PR, Lye DC, Fisher DA, Goh WP, Tam VH. Nephrotoxicity of continuous versus intermittent infusion of vancomycin in outpatient parenteral antimicrobial therapy. Int J Antimicrob Agents. 2009;34(6):570-4.
31. De Waele JJ, Lipman J, Carlier M, Roberts J a. Subtleties in practical application of prolonged infusion of β-lactam antibiotics. Int J Antimicrob Agents [Internet]. Elsevier B.V.; 2015;45(5):461-3. Available from: http:// linkinghub.elsevier.com/retrieve/pii/S0924857915000588.
32. Gilbert DN, Moellering RC, Eliopoulos GM, Chambers HF, Saag MS. The Sanford Guide to Antimicrobial Therapy 2015. 45° Edición. Virgina: Antimicrobial Therapy, Inc; 2015.
33. Lexi-Comp, Inc. (Lexi Drugs®). Lexi Comp; Septiembre 20, 2015.
34. Kaki R, Elligsen M, Walker S, Simor A, Palmay L, Daneman N. Impact of antimicrobial stewardship in critical care: A systematic review. J Antimicrob Chemother. 2011;66(6):1223-30.
____
Descargar artículo en PDF: Infusiones extendidas de antibióticos
