Rev. O.F.I.L. 2016, 26;1
Fecha de recepción: 25/01/2015 – Fecha de aceptación: 16/09/2015
Bustos-Morell C1, Ruiz-Gutiérrez J2, Olivan-Prats P3
1 Servicio de Farmacia. Hospital Virgen de la Salud. Toledo (España)
2 Servicio de Farmacia. Hospital Puerta de Hierro Majadahonda. Madrid (España)
3 Servicio de Farmacia. Hospital Central de la Defensa Gómez Ulla. Madrid (España)
Palabras clave: Ácido valproico, meropenem, farmacocinética, interacciones.
_____
Correspondencia:
María Pilar Prats Olivan
Glorieta del Ejército, s/n
28047 Madrid
Correo electrónico: bubierka@gmail.com
____
INTRODUCCIÓN
La utilización conjunta de ácido valproico (VPA) y carbapenemes da lugar a una disminución significativa de concentraciones séricas de VPA que ha sido ampliamente descrita1,2. Se presenta un caso de dicha interacción en el que se observó una alta proporción de VPA libre.
DESCRIPCIÓN DEL CASO
Paciente varón de 62 años (180 cm y 100 Kg) que acudió a Urgencias por presentar un cuadro de dolor periorbicular derecho en el contexto de una pansinusitis. Como antecedentes de interés destacaban: hipertensión arterial, poliquistosis renal familiar con insuficiencia renal crónica asociada y dislipemia.
Se decidió su ingreso con el diagnóstico de celulitis orbital derecha y sospecha de meningitis, para lo que inició tratamiento antibiótico intravenoso con linezolid y meropenem. El segundo día, presentó convulsiones tónico-clónicas generalizadas que motivaron su traslado a la unidad de Cuidados Intensivos, donde se inició tratamiento con levetiracetam. El cuarto día precisó diazepam intravenoso para controlar una crisis clónica y durante la ventana de sedación sufrió varias crisis convulsivas generalizadas, por lo que se añadió VPA intravenoso (dosis de carga de 400 mg seguido de una perfusión continua de 2.400 mg/24 horas). Al día siguiente, ante la persistencia de convulsiones, se añadió fenitoína intravenosa (dosis de carga de 150 mg el primer día seguido de 150 mg/8 h). Ese día se obtuvieron niveles subterapéuticos de VPA, con una fracción libre normal pero muy elevada en relación al VPA total. Consciente de la posible interacción entre VPA y meropenem, el Servicio de Farmacia emitió un informe recomendando el cambio de agente antiepiléptico a fenitoína o carbamazepina, dada la dificultad para predecir las concentraciones séricas de VPA y la imposibilidad de encontrar un modelo que permitiera ajustar la pauta posológica. Ante la persistencia de convulsiones se había añadido FNT intravenosa al tratamiento (dosis de carga de 150 mg el primer día seguido de 150 mg/8 h). Tras las recomendaciones efectuadas, se detuvo la perfusión de VPA y se aumentó la dosis de levetiracetam.
Durante el octavo día de ingreso presentó nuevas crisis convulsivas, por lo que se solicitaron niveles de FNT y se añadió al tratamiento lacosamida intravenosa. Tres días después el paciente padeció una nueva crisis de focalidad que requirió tratamiento con midazolam, propofol y una dosis extra de FNT intravenosa. Durante los días posteriores se sucedieron nuevas crisis comiciales, por lo que se decidió suspender todos los tratamientos antiepilépticos e inducir el coma barbitúrico con tiopental. El paciente requirió la administración de nutrición parenteral. Tras permanecer dos días en esta situación, se revirtió el coma y se reinició el tratamiento antiepiléptico con FNT intravenosa en monoterapia.
La evolución clínica del paciente fue buena, por lo que fue trasladado a la planta de Neurología, donde la mejoría clínica fue evidente. No volvió a presentar crisis comiciales y fue dado de alta con levetiracetam profiláctico.
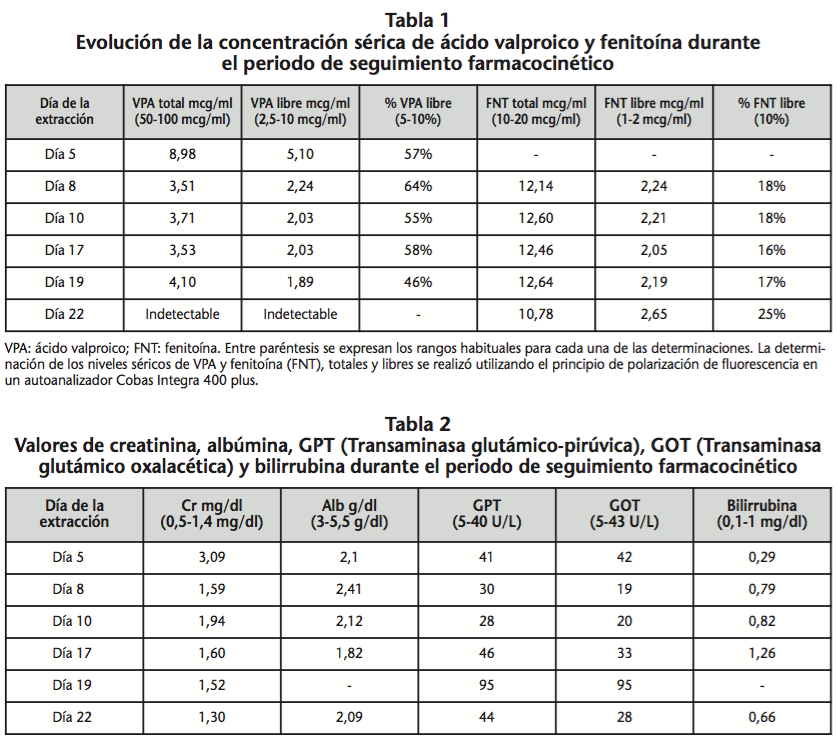
En la tabla 1 se muestra la evolución de las concentraciones séricas de VPA y fenitoína (total y libre) y el porcentaje de fracción libre VPA y fenitoína y en la tabla 2 los valores de creatinina, albúmina, GPT (Transaminasa glutámico-pirúvica), GOT (Transaminasa glutámico oxalacética) durante el periodo de seguimiento.
DISCUSIÓN
El paciente presentó un nivel subterapéutico de VPA total tras el tratamiento concomitante con meropenem, coincidiendo con lo descrito en la literatura1-5. Sin embargo, el porcentaje de fracción libre de VPA en este paciente, alrededor del 60%, se encuentra muy por encima del 5-10% que se considera normal. Esta elevación puede explicarse por la hipoalbuminemia que presentaba el paciente, ya que el VPA es un fármaco con una elevada unión a proteínas plasmáticas y por tanto, niveles bajos de albúmina producen una elevación de la fracción libre6,7. Otra posible causa del incremento de la fracción libre es la insuficiencia renal, que da lugar a la formación de metabolitos endógenos que competirían con el VPA por los sitios de unión a la albúmina, provocando un desplazamiento del VPA8,9. La bilirrubina es otra sustancia endógena que puede producir este desplazamiento, aunque solo se considera relevante para bilirrubinemias mayores de 2 mg/dl8 y el paciente no alcanzó ese valor. Así mismo, concentraciones elevadas de ácidos grasos libres pueden afectar a la unión del VPA con las proteínas plasmáticas10. Dado que nuestro paciente presentaba dislipemia y se le administró propofol y nutrición parenteral, que contienen lípidos, es posible que el aumento de la fracción libre de VPA se debiera, al menos en parte, a esta condición. Por último, el desplazamiento del VPA de su unión a proteínas plasmáticas puede ocurrir también por un mecanismo de competición con compuestos exógenos, como algunos medicamentos que se unen fuertemente a la albúmina. Sin embargo, no hay descrita ninguna interacción farmacológica entre el VPA y los fármacos que recibió el paciente que pueda explicar el aumento de la fracción libre de VPA.
Las causas que podrían explicar el aumento de la fracción libre de VPA (hipoalbuminemia, insuficiencia renal, y desplazamiento por sustancias endógenas y exógenas) podrían servir para explicar también el aumento de la fracción libre de FNT que presentaba el paciente.
Además de una fracción libre de VPA anormalmente elevada, el paciente siguió presentando niveles plasmáticos de VPA dos semanas después de suspender el tratamiento. Una explicación a esta situación podría ser la existencia de alguna interacción medicamentosa que produjese una inhibición del metabolismo del VPA impidiendo su eliminación, pero no hay descrita ninguna interacción entre VPA y los fármacos que recibió el paciente. Esta persistencia también podría explicarse por una interferencia analítica, sin embargo, no hay descrita en la literatura ningún tipo de interferencia con la técnica utilizada.
En el caso descrito, la monitorización farmacocinética del VPA permitió detectar de manera precoz la interacción entre VPA y meropenem, que a pesar de estar ampliamente descrita, aún no es del todo conocida por los clínicos. Gracias a la intervención del Servicio de Farmacia se modificó el tratamiento antiepiléptico para evitar que la interacción tuviera consecuencias clínicas.
Asimismo, cabe destacar la importancia de la determinación de la concentración de valproico libre, que no se realiza de forma rutinaria en muchos centros, debido principalmente a dificultades técnicas de estandarización analítica. Sin embargo este dato ofrece información sobre el porcentaje de fármaco que es farmacológicamente activo y puede ser muy útil en determinadas situaciones, como la hipoalbuminemia o la insuficiencia renal.
Conflicto de intereses: Los autores declaran no tener conflictos de intereses.
Bibliografía
- Haroutiunian S, Ratz Y, Rabinovich B, Adam M, Hoffman A. Valproic acid plasma concentration decreases in a dose-independent manner following administration of meropenem: a retrospective study. J Clin Pharmacol. 2009;49:1363-9.
- Spriet I, Goyens J, Meersseman W, Wilmer A,Willems L, Van Paesschen W. Ann Interaction Between Valproate and Meropenem: A Retrospective Study. Pharmacother. 2007;41:1130-6.
- Llinares-Tello F, Bosacoma-Ros N, Hernandez-Prats C, Climent-Grana E, Selva-Otaolaurruchi J, Ordovas-Baines JP. Interacción farmacocinética entre ácido valproico y antibióticos carbapenémicos: descripción de tres casos. Farm Hosp. 2003;27:258-63.
- Mancl EE, Gidal BE. The effect of carbapenem antibiotics on plasma concentrations of valproic acid. Ann Pharmacother. 2009;43:2082-7.
- Mori H, Takahashi K, Mizutani T. Interaction between valproic acid and carbapenem antibiotics. Drug Metab Rev. 2007;39:647-57.
- De Maat MMR, van Leeuwen HJ, Edelbroek PM. High unbound fraction of valproic acid in a hypoalbuminemic critically ill patient on renal replacement therapy. Ann Pharmacother. 2011;45:e18.
- Haroldson JA, Kramer LE, Wolff DL, Lake KD. Elevated free fractions of valproic acid in a heart transplant. Ann Pharmacother. 2000;34:183-7.
- Bauer L. Applied clinical pharmacokinetics. 2ª ed. Seattle (Estados Unidos): Mac Graw Hill Medical; 2008.
- Reidenberg MM, Drayer DE. Alteration of drug-protein binding in renal disease. Clin Pharmacokinet. 1984;9 Supl 1:18-26.
- Dasgupta A, Crossey MJ. Elevated Free Fatty Acid Concentrations in Lipemic Sera Reduce Protein Binding of Valproic Acid Significantly More Than Phenytoin. Am J Med Sci. 1997;313:75-9.
____
Descargar PDF: Interacción entre ácido valproico y meropenem, relevancia de la determinación de niveles de valproico libre
Artículo dentro del número: VOL. 26 – Nº1 – 2016
